化学人教版(2019)选择性必修2 3.4配合物与超分子(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.4配合物与超分子(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-25 20:52:25 | ||
图片预览








文档简介
(共20张PPT)
人教版选择性必修2《物质结构与性质》
第四节 配合物和超分子
第三章 晶 体 结 构 与 性 质
无水硫酸铜
五水硫酸铜
天蓝色 天蓝色 天蓝色
无色
无色
无色
SO42-
Na+
Cl-
K+
Br-
固体颜色
溶液颜色
无色离子:
CuSO4
CuCl2
CuBr2
NaCl
K2SO4
KBr
白色
白色
白色
白色
绿色
深褐色
什么离子呈天蓝色:
Cu2+ 和 H2O
【实验 3-2】 P 95
[Cu(H2O)4]2+
配位键
空轨道接受孤电子对
提供孤电子对
电子对给予体
电子对接受体
Cu2+
H2O
Cu
OH2
H2O
H2O
2+
OH2
问题1:依据电子式,讨论H2O与H+是如何形成H3O+的?
问题2:类比H3O+,推测[Cu(H2O)4]2+的形成。
配合物
[Cu(N H 3)4 ] S O 4
内界(配离子)
配合物
外界
配位体
配位数
配位原子
中心离子
空轨道
孤电子对
构成
思考:NH4Cl是配合物吗?
不是,
含有配位键的化合物不一定是配合物;配合物一定含有配位键。
如:
X-
OH-CN-SCN-H2O
NH3
CO
金属原子或离子
配合物
配合物 内界 外界 中心原子(离子) 配位体 配位数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]4-
K+
Fe2+
CN-
6
6
[AlF6]3-
Na+
Al3+
F-
Ni(CO)4
无
Ni
CO
4
[Co(NH3)5Cl]2+
Cl-
Co3+
Cl- NH3
6
注意:有时配位体数并不一定等于配位数
固态时属于哪种晶体?
离子晶体
配合物
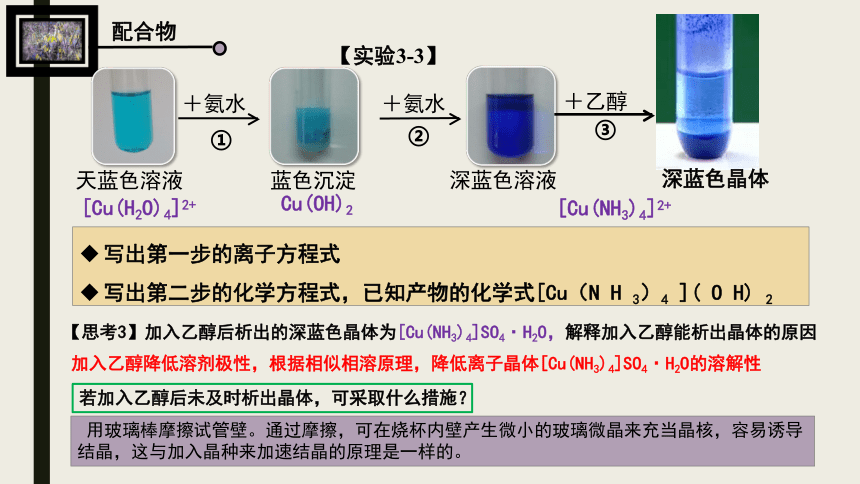
天蓝色溶液
蓝色沉淀
深蓝色溶液
+氨水
+氨水
+乙醇
深蓝色晶体
①
②
③
写出第一步的离子方程式
写出第二步的化学方程式,已知产物的化学式[Cu(N H 3)4 ]( O H) 2
【思考1】向硫酸铜溶液中滴加氨水,为什么[Cu(H2O)4]2+转化为[Cu(NH3)4]2+呢?
配位键的强度有大小,有的配合物很稳定,有的很不稳定。许多过渡金属元素的离子对多种配体有很强的结合力
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
【实验3-3】
配合物
天蓝色溶液
蓝色沉淀
深蓝色溶液
+氨水
+氨水
+乙醇
深蓝色晶体
①
②
③
写出第一步的离子方程式
写出第二步的化学方程式,已知产物的化学式[Cu(N H 3)4 ]( O H) 2
【思考2】结合沉淀溶解平衡,从微观的角度解释为什么Cu(OH)2沉淀会溶解氨水中?
观察实验3-5,写出反应的化学方程式并解释为什么AgCl会溶解在氨水中?
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
【实验3-3】
配合物
天蓝色溶液
蓝色沉淀
深蓝色溶液
+氨水
+氨水
+乙醇
深蓝色晶体
①
②
③
写出第一步的离子方程式
写出第二步的化学方程式,已知产物的化学式[Cu(N H 3)4 ]( O H) 2
【思考3】加入乙醇后析出的深蓝色晶体为[Cu(NH3)4]SO4·H2O,解释加入乙醇能析出晶体的原因
加入乙醇降低溶剂极性,根据相似相溶原理,降低离子晶体[Cu(NH3)4]SO4·H2O的溶解性
用玻璃棒摩擦试管壁。通过摩擦,可在烧杯内壁产生微小的玻璃微晶来充当晶核,容易诱导结晶,这与加入晶种来加速结晶的原理是一样的。
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
若加入乙醇后未及时析出晶体,可采取什么措施?
【实验3-3】
配合物
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 c(SCN-) 大小而异)
【知识回顾】检验Fe3+的方法
【演示实验】课本104页实验2简单离子和配离子的区别
实验步骤 实验现象 解释
溶液变为
红色
生成 [Fe(SCN)n]3-n
(n = 1~6)
无明显现象
[Fe(CN)6]3-
很难电离出 Fe3+
两滴
FeCl3(aq)
少量水
两滴
KSCN(aq)
两滴
K3[Fe(CN)6](aq)
少量水
两滴
KSCN(aq)
在一定条件下, 配位键比较稳定,配离子不易发生电离。
【动笔】写出K3[Fe(CN)6]的电离方程式
配合物
[①Cr(H2O)6]Cl3 ② [Cr(H2O)5Cl]Cl2
思考:观察下面两种配合物的组成,分析其异同点
+3
+3
若各取含1mol上述溶质的溶液,加入足量硝酸银溶液,分别产生多少molAgCl沉淀。
配合物
【小结】实验3-3、3-4、3-5中出现的配合物
配离子 [Cu(H2O)4]2+ [Cu(NH3)4]2+ [Fe(SCN)]2+ [Ag(NH3)2]+
颜色 天蓝色 深蓝色 血红色 无色
水溶性 溶 溶 溶 溶
生成方法 —— 硫酸铜溶液加氨水至沉淀消失 Fe3+和SCN-混合 硝酸银溶液中加氨水至沉淀消失
中心离子 Cu2+ Cu2+ Fe3+ Ag+
配体 H2O NH3 SCN- NH3
配位数 4 4 1 2
结构式 —— [H3N—Ag—NH3]+
配合物
叶绿素
血红素
维生素 B12
在生命体中的应用
应用
叶绿素
固氮酶
血红蛋白
维生素B12
电镀
王水溶金
照相技术定影
助熔剂
抗癌药物
——顺铂
污水处理
汽车尾气净化
激光材料
超导材料
在生命体
中的应用
在生产生活
中的应用
其他
领域
在医药中
的应用
配合物
应用
两种或两种以上的分子(包括离子)通过分子间相互作用形成的分子聚集体。
2. 微粒间作用力—非共价键
主要是静电作用、范德华力和氢键等
1. 概念
超分子
3. 大小
有的是有限的 有的是无限伸展的
超分子
---分子识别:
4. 重要特征及其应用
a. 分离 C60 和 C70
b. 冠醚识别碱金属离子
C60
C70
超分子
---分子识别:
4. 重要特征及其应用
a. 分离 C60 和 C70
b. 冠醚识别碱金属离子
冠醚环的大小与金属离子匹配,才能识别
超分子
15-冠-5 12-冠-4
15-冠-5 12-冠-4
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
超分子
冠醚识别碱金属离子的应用
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
超分子
---分子识别:
4. 重要特征及其应用
a. 分离 C60 和 C70
b. 冠醚识别碱金属离子
细胞和细胞器的双分子膜
---自组装:
一般认为晶体从液相或气相中的生长有三个阶段:
①介质达到过饱和、过冷却阶段;
②成核阶段;
③生长阶段。
明矾晶体的制备
明矾的化学式:
明矾的生长阶段:
得到规则的大晶体的关键:
KAl(SO4)2·12H2O
控制生长速率,结晶速率越慢,越容易得到大颗粒的晶体
人教版选择性必修2《物质结构与性质》
第四节 配合物和超分子
第三章 晶 体 结 构 与 性 质
无水硫酸铜
五水硫酸铜
天蓝色 天蓝色 天蓝色
无色
无色
无色
SO42-
Na+
Cl-
K+
Br-
固体颜色
溶液颜色
无色离子:
CuSO4
CuCl2
CuBr2
NaCl
K2SO4
KBr
白色
白色
白色
白色
绿色
深褐色
什么离子呈天蓝色:
Cu2+ 和 H2O
【实验 3-2】 P 95
[Cu(H2O)4]2+
配位键
空轨道接受孤电子对
提供孤电子对
电子对给予体
电子对接受体
Cu2+
H2O
Cu
OH2
H2O
H2O
2+
OH2
问题1:依据电子式,讨论H2O与H+是如何形成H3O+的?
问题2:类比H3O+,推测[Cu(H2O)4]2+的形成。
配合物
[Cu(N H 3)4 ] S O 4
内界(配离子)
配合物
外界
配位体
配位数
配位原子
中心离子
空轨道
孤电子对
构成
思考:NH4Cl是配合物吗?
不是,
含有配位键的化合物不一定是配合物;配合物一定含有配位键。
如:
X-
OH-CN-SCN-H2O
NH3
CO
金属原子或离子
配合物
配合物 内界 外界 中心原子(离子) 配位体 配位数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]4-
K+
Fe2+
CN-
6
6
[AlF6]3-
Na+
Al3+
F-
Ni(CO)4
无
Ni
CO
4
[Co(NH3)5Cl]2+
Cl-
Co3+
Cl- NH3
6
注意:有时配位体数并不一定等于配位数
固态时属于哪种晶体?
离子晶体
配合物
天蓝色溶液
蓝色沉淀
深蓝色溶液
+氨水
+氨水
+乙醇
深蓝色晶体
①
②
③
写出第一步的离子方程式
写出第二步的化学方程式,已知产物的化学式[Cu(N H 3)4 ]( O H) 2
【思考1】向硫酸铜溶液中滴加氨水,为什么[Cu(H2O)4]2+转化为[Cu(NH3)4]2+呢?
配位键的强度有大小,有的配合物很稳定,有的很不稳定。许多过渡金属元素的离子对多种配体有很强的结合力
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
【实验3-3】
配合物
天蓝色溶液
蓝色沉淀
深蓝色溶液
+氨水
+氨水
+乙醇
深蓝色晶体
①
②
③
写出第一步的离子方程式
写出第二步的化学方程式,已知产物的化学式[Cu(N H 3)4 ]( O H) 2
【思考2】结合沉淀溶解平衡,从微观的角度解释为什么Cu(OH)2沉淀会溶解氨水中?
观察实验3-5,写出反应的化学方程式并解释为什么AgCl会溶解在氨水中?
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
【实验3-3】
配合物
天蓝色溶液
蓝色沉淀
深蓝色溶液
+氨水
+氨水
+乙醇
深蓝色晶体
①
②
③
写出第一步的离子方程式
写出第二步的化学方程式,已知产物的化学式[Cu(N H 3)4 ]( O H) 2
【思考3】加入乙醇后析出的深蓝色晶体为[Cu(NH3)4]SO4·H2O,解释加入乙醇能析出晶体的原因
加入乙醇降低溶剂极性,根据相似相溶原理,降低离子晶体[Cu(NH3)4]SO4·H2O的溶解性
用玻璃棒摩擦试管壁。通过摩擦,可在烧杯内壁产生微小的玻璃微晶来充当晶核,容易诱导结晶,这与加入晶种来加速结晶的原理是一样的。
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
若加入乙醇后未及时析出晶体,可采取什么措施?
【实验3-3】
配合物
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 c(SCN-) 大小而异)
【知识回顾】检验Fe3+的方法
【演示实验】课本104页实验2简单离子和配离子的区别
实验步骤 实验现象 解释
溶液变为
红色
生成 [Fe(SCN)n]3-n
(n = 1~6)
无明显现象
[Fe(CN)6]3-
很难电离出 Fe3+
两滴
FeCl3(aq)
少量水
两滴
KSCN(aq)
两滴
K3[Fe(CN)6](aq)
少量水
两滴
KSCN(aq)
在一定条件下, 配位键比较稳定,配离子不易发生电离。
【动笔】写出K3[Fe(CN)6]的电离方程式
配合物
[①Cr(H2O)6]Cl3 ② [Cr(H2O)5Cl]Cl2
思考:观察下面两种配合物的组成,分析其异同点
+3
+3
若各取含1mol上述溶质的溶液,加入足量硝酸银溶液,分别产生多少molAgCl沉淀。
配合物
【小结】实验3-3、3-4、3-5中出现的配合物
配离子 [Cu(H2O)4]2+ [Cu(NH3)4]2+ [Fe(SCN)]2+ [Ag(NH3)2]+
颜色 天蓝色 深蓝色 血红色 无色
水溶性 溶 溶 溶 溶
生成方法 —— 硫酸铜溶液加氨水至沉淀消失 Fe3+和SCN-混合 硝酸银溶液中加氨水至沉淀消失
中心离子 Cu2+ Cu2+ Fe3+ Ag+
配体 H2O NH3 SCN- NH3
配位数 4 4 1 2
结构式 —— [H3N—Ag—NH3]+
配合物
叶绿素
血红素
维生素 B12
在生命体中的应用
应用
叶绿素
固氮酶
血红蛋白
维生素B12
电镀
王水溶金
照相技术定影
助熔剂
抗癌药物
——顺铂
污水处理
汽车尾气净化
激光材料
超导材料
在生命体
中的应用
在生产生活
中的应用
其他
领域
在医药中
的应用
配合物
应用
两种或两种以上的分子(包括离子)通过分子间相互作用形成的分子聚集体。
2. 微粒间作用力—非共价键
主要是静电作用、范德华力和氢键等
1. 概念
超分子
3. 大小
有的是有限的 有的是无限伸展的
超分子
---分子识别:
4. 重要特征及其应用
a. 分离 C60 和 C70
b. 冠醚识别碱金属离子
C60
C70
超分子
---分子识别:
4. 重要特征及其应用
a. 分离 C60 和 C70
b. 冠醚识别碱金属离子
冠醚环的大小与金属离子匹配,才能识别
超分子
15-冠-5 12-冠-4
15-冠-5 12-冠-4
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
超分子
冠醚识别碱金属离子的应用
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
超分子
---分子识别:
4. 重要特征及其应用
a. 分离 C60 和 C70
b. 冠醚识别碱金属离子
细胞和细胞器的双分子膜
---自组装:
一般认为晶体从液相或气相中的生长有三个阶段:
①介质达到过饱和、过冷却阶段;
②成核阶段;
③生长阶段。
明矾晶体的制备
明矾的化学式:
明矾的生长阶段:
得到规则的大晶体的关键:
KAl(SO4)2·12H2O
控制生长速率,结晶速率越慢,越容易得到大颗粒的晶体
