北京课改版九下化学 第12章 第1节 几种常见的盐 同步测试(word版 含答案)
文档属性
| 名称 | 北京课改版九下化学 第12章 第1节 几种常见的盐 同步测试(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 204.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-23 00:00:00 | ||
图片预览


文档简介
北京课改版九下化学 第12章 第1节 几种常见的盐 模拟
一、单项选择题(共7小题;共14分)
1. 下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A. B. C. D.
2. 化学就在我们身边,生活中处处有化学。根据你所学过的知识,下列说法错误的是
A. “请往菜里加点盐”中的“盐”特指食盐——
B. 体温表中的水银不是银,是金属汞
C. 食品工业中,发酵粉的主要成份是小苏打——
D. 生活中常用的铁制品都是铁的合金
3. 下列物质的化学式不正确的是
A. 干冰—— B. 消石灰——
C. 纯碱—— D. 小苏打——
4. 【 密云一模 】下列关于物质用途的描述不正确的是
A. 食盐可用作调味品 B. 熟石灰可用于治疗胃酸过多
C. 氧气可用于炼钢 D. 活性炭可用于冰箱除臭
5. 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发量溶液中的下列各量变化正确的是
A. B.
C. D.
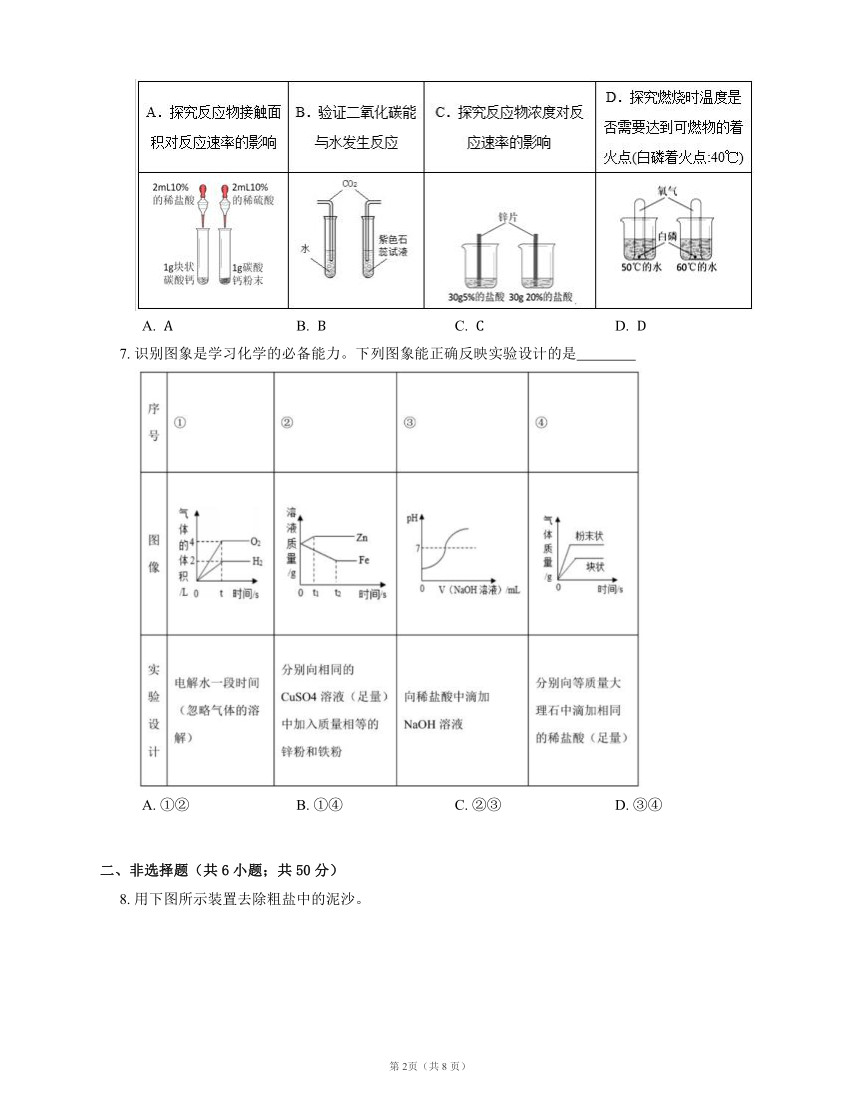
6. 下列能达到实验目的的方案是
A. B. C. D.
7. 识别图象是学习化学的必备能力。下列图象能正确反映实验设计的是
A. ①② B. ①④ C. ②③ D. ③④
二、非选择题(共6小题;共50分)
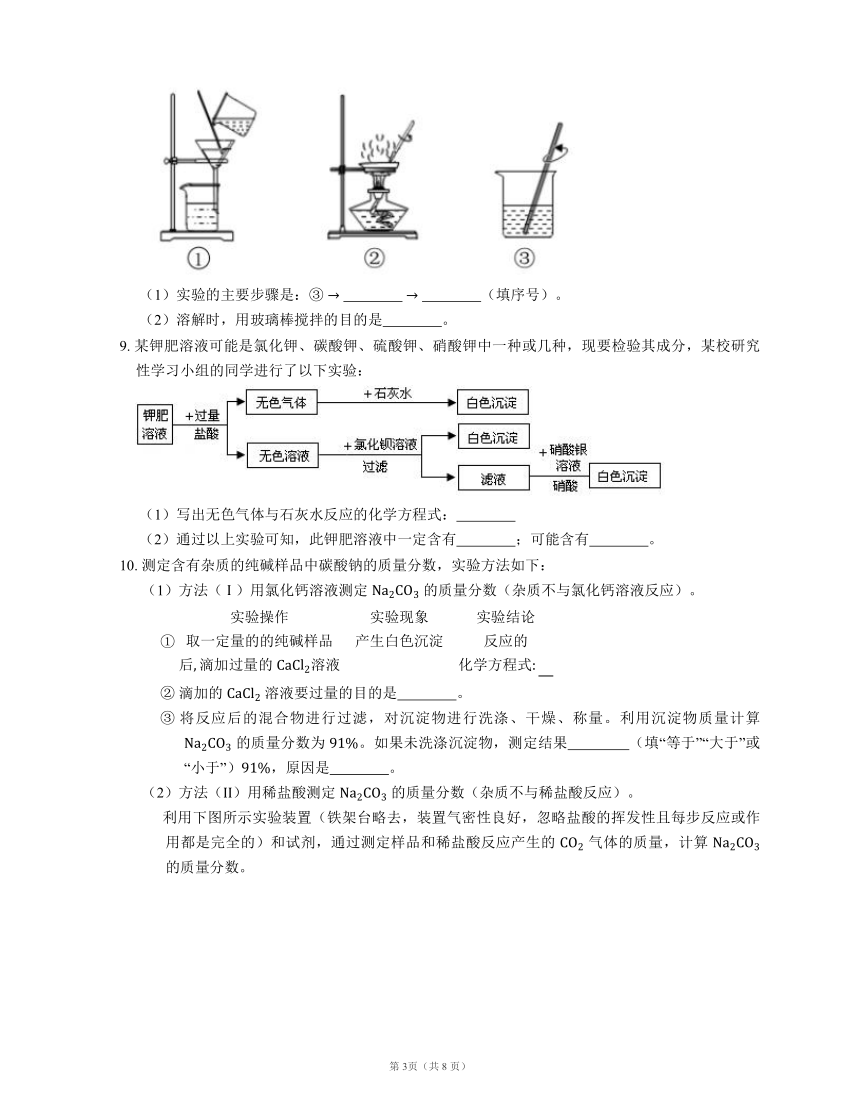
8. 用下图所示装置去除粗盐中的泥沙。
(1)实验的主要步骤是:③ (填序号)。
(2)溶解时,用玻璃棒搅拌的目的是 。
9. 某钾肥溶液可能是氯化钾、碳酸钾、硫酸钾、硝酸钾中一种或几种,现要检验其成分,某校研究性学习小组的同学进行了以下实验:
(1)写出无色气体与石灰水反应的化学方程式:
(2)通过以上实验可知,此钾肥溶液中一定含有 ;可能含有 。
10. 测定含有杂质的纯碱样品中碳酸钠的质量分数,实验方法如下:
(1)方法( )用氯化钙溶液测定 的质量分数(杂质不与氯化钙溶液反应)。
①
② 滴加的 溶液要过量的目的是 。
③ 将反应后的混合物进行过滤,对沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算 的质量分数为 。如果未洗涤沉淀物,测定结果 (填“等于”“大于”或“小于”),原因是 。
(2)方法()用稀盐酸测定 的质量分数(杂质不与稀盐酸反应)。
利用下图所示实验装置(铁架台略去,装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)和试剂,通过测定样品和稀盐酸反应产生的 气体的质量,计算 的质量分数。
① 打开弹簧夹 ,先通入已除去 的空气一会儿,目的是排尽各装置中含有的 。
② 关闭弹簧夹 ,加入足量的稀盐酸。反应结束后,用焰色反应检验装置 中的溶质,其火焰呈 色;装置 中可观察到的现象是 。
③ 待装置 中的反应结束后,再一次打开弹簧夹 ,继续往装置中通入已除去 的空气一会儿。根据装置 (填标号)在反应前后的质量差就可得到产生 的质量,由此计算出该样品中 的质量分数。
11. 有一包固体,可能含有 、 、 、 、 、 中的一种或几种。根据下列实验回答问题:
取少量固体与熟石灰研磨,无氨味。
另取少量固体进行如下图的实验:
已知:实验 中无沉淀产生,实验 中无气体产生。
(1)由实验 、实验 判断:原固体中一定含有 ,一定不含
(2)为进一步探究原固体的组成,取无色溶液 ,向其中通入 ,产生白色沉淀。由此判断:原固体中一定还含有
(3)根据上述判断,可推知 中实验 所得滤液 中的溶质有 、 、
12. 某化学兴趣小组同学对家用普通干电池中含有的物质产生了浓厚的兴趣。他们剥开电池时闻到氨味且发现有黑色物质。
【提出问题】为什么有氨味 黑色物质的成分是什么
【猜想假设】能闻到氨味说明含有铵盐(如 );黑色固体可能有铁粉、氧化铜或二氧化锰。
(1)【实验探究】同学们分别设计实验进行探究。
实验 .小聪取适量黑色物质与 混合置于研钵内研磨,嗅到强烈氨味,再用湿润的红色石蕊试纸检测,观察到试纸变蓝,证明黑色物质中含有铵盐。
实验 .小敏将黑色物质加入适量的水中搅拌溶解,静置后 ,取不溶物进行实验。
(2)【交流讨论】步骤 中发生反应的化学方程式为 。
13. 有一包粉末,已知由 、 、 、 、 、 中的几种组成,为确定其组成,现进行以下实验(各步骤均充分反应):
①取一定质量的粉末,加水搅拌后过滤,得到沉淀和无色溶液A;
②向①步得到的沉淀中加入足量稀硝酸,得到无色气体和蓝色溶液;
③将①步得到的无色溶液A进行如图所示的实验:
回答下列问题:
(1) 的化学式是 。
(2) 中一定存在的溶质的化学式是 。
(3)生成白色沉淀 的化学方程式是 。
(4)这包粉末中可能含有的物质的化学式是 。
答案
第一部分
1. C
2. C
【解析】A、食盐具有咸味,是常用的调味品,故A正确;
B、体温计中的金属是液态汞,故B正确;
C、发酵粉的主要成分是小苏打碳酸氢钠,故C错误;
D、生活中的铁制品都是铁的合金,故D正确,
故选C。
3. C
【解析】干冰是二氧化碳固体,化学式为 ;消石灰是氢氧化钙的俗称,化学式为 ;纯碱是碳酸钠的俗称,化学式为 ,而氢氧化钠()的俗称是火碱、烧碱、苛性钠;小苏打是碳酸氢钠的俗称,化学式为 。故C不正确。
4. B
【解析】A、食盐是常用的调味品,A正确;
B、熟石灰具有腐蚀性,不能用于治疗胃酸过多,B不正确;
C、氧气具有支持燃烧的性质,可用于炼钢,C正确;
D、活性炭具有吸附性,可用于冰箱除臭,D正确。
5. C
【解析】A、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,由于温度不变,所得溶液仍为该温度下的饱和溶液,溶解度不变,故选项错误。
B、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,溶质质量减少,故选项错误。
C、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,由于温度不变,所得溶液仍为该温度下的饱和溶液,溶质质量分数不变,故选项正确。
D、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,溶液质量减少,故选项错误。
故选:C。
6. C
7. C
【解析】①在电解水实验中,“正氧负氢”,生成氢气和氧气的体积比约为 ,不符合题意;
②锌和硫酸铜反应:, 份的锌置换出 份的铜,固体质量减小,溶液质量增加,待完全反应后,不再变化,铁与硫酸铜反应:, 份的铁置换出 份的铜,固体质量增加,溶液质量减小,待完全反应后,不再变化,锌的活动性比铁强,完全反应所需时间短,符合题意;
③向稀盐酸中滴加 溶液,一开始 小于 ,随着反应的进行,氢氧化钠和稀盐酸反应生成氯化钠和水, 逐渐增大,待恰好完全反应时,,后氢氧化钠过量,,符合题意;
④分别向等质量大理石中滴加相同的稀盐酸(足量),接触面积越大,反应速率越快,故粉末状的反应速率快,但是最后生成二氧化碳的质量相同,不符合题意。
故②③正确。
故选C。
第二部分
8. (1) ①;②
(2) 加快溶解速率
9. (1)
【解析】加入盐酸生成无色气体则该气体是二氧化碳,原混合物中一定会有碳酸钾。二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为 。
(2) 、 ; 、
【解析】因为碳酸钾在第一步中已完全反应,则加入氯化钡有白色沉淀则是说明存在硫酸根,化肥中一定含有硫酸钾,则此化肥一定含有 、 ,可能含有 、 。
10. (1) ①
② 与碳酸钠充分反应
③ 大于;不洗涤,碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大
(2) ① 二氧化碳(空气)
② 黄;白色固体变蓝色
③
11. (1) ; 、
【解析】硝酸铜溶于水显蓝色,硝酸铵和碱混合研磨会生成有刺激性气味的氨气,氯离子和银离子会生成氯化银沉淀,碳酸根离子和钡离子会生成碳酸钡沉淀。少量固体与熟石灰研磨,无氨味,说明原固体中不含 ;固体样品溶于水且溶液呈无色,硝酸铜溶于水显蓝色,说明该固体一定不含 ,且 和 最多只能含一种,实验 中加入稀硝酸无气体产生,说明该固体一定不含 ;加入 产生白色沉淀,说明该固体中一定含有氯化钠;溶液 通入 产生白色沉淀说明该固体中一定含 和 , 和 反应生成 ,碳酸钠再与 生成 沉淀;实验 中加入的是过量的硝酸银,所以反应后的滤液中含有硝酸银,硝酸银和氯化钠会生成氯化银沉淀和硝酸钠,所以滤液 中也含有硝酸钠,则实验 所得滤液 中的溶质有 、 、 、 。 通过推导可知,取少量固体与熟石灰研磨,无氨味。由此判断:原固体中一定不含 ; 通过实验 、 判断:原固体中一定含有 ,一定不含 、 。
(2) 、
【解析】氢氧化钠和二氧化碳反应生成碳酸钠,碳酸钠和硝酸钡会生成碳酸钡沉淀和硝酸钠,所以取无色溶液 ,向其中通入 ,产生白色沉淀。由此判断:原固体中一定还含有 、 。
(3) 、
【解析】通过分析可知,实验 中加入的是过量的硝酸银,所以反应后的滤液中含有硝酸银,硝酸银和氯化钠会生成氯化银沉淀和硝酸钠,所以滤液 中也含有硝酸钠,则实验 所得滤液 中的溶质有 、 、 、 。
12. (1) 熟石灰(合理即可);过滤;黑色粉末中一定不含铁粉或氧化铜;(或过氧化氢);木条复燃
【解析】铵盐与碱性物质混合研磨会放出氨气,所以取适量黑色物质与熟石灰混合置于研钵内研磨,嗅到氨味,再用湿润的红色石蕊试纸检测,试纸变蓝,证明黑色物质中含有铵盐。小敏将黑色物质加入适量的水中搅拌溶解,静置后过滤,取不溶物进行实验。取适量黑色滤渣装入试管中,再加入过量稀盐酸,无气泡生成,溶液不变色,说明黑色粉末中一定不含铁粉或氧化铜。取适量黑色滤渣装入另一支试管中,再加入 溶液,向该试管中伸入带火星的小木条,木条复燃,说明有氧气生成,则黑色粉末中含有二氧化锰。
(2)
【解析】二氧化锰催化过氧化氢分解生成水和氧气,化学方程式为 。
13. (1)
(2) 、
(3)
(4) 、
第1页(共1 页)
一、单项选择题(共7小题;共14分)
1. 下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A. B. C. D.
2. 化学就在我们身边,生活中处处有化学。根据你所学过的知识,下列说法错误的是
A. “请往菜里加点盐”中的“盐”特指食盐——
B. 体温表中的水银不是银,是金属汞
C. 食品工业中,发酵粉的主要成份是小苏打——
D. 生活中常用的铁制品都是铁的合金
3. 下列物质的化学式不正确的是
A. 干冰—— B. 消石灰——
C. 纯碱—— D. 小苏打——
4. 【 密云一模 】下列关于物质用途的描述不正确的是
A. 食盐可用作调味品 B. 熟石灰可用于治疗胃酸过多
C. 氧气可用于炼钢 D. 活性炭可用于冰箱除臭
5. 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发量溶液中的下列各量变化正确的是
A. B.
C. D.
6. 下列能达到实验目的的方案是
A. B. C. D.
7. 识别图象是学习化学的必备能力。下列图象能正确反映实验设计的是
A. ①② B. ①④ C. ②③ D. ③④
二、非选择题(共6小题;共50分)
8. 用下图所示装置去除粗盐中的泥沙。
(1)实验的主要步骤是:③ (填序号)。
(2)溶解时,用玻璃棒搅拌的目的是 。
9. 某钾肥溶液可能是氯化钾、碳酸钾、硫酸钾、硝酸钾中一种或几种,现要检验其成分,某校研究性学习小组的同学进行了以下实验:
(1)写出无色气体与石灰水反应的化学方程式:
(2)通过以上实验可知,此钾肥溶液中一定含有 ;可能含有 。
10. 测定含有杂质的纯碱样品中碳酸钠的质量分数,实验方法如下:
(1)方法( )用氯化钙溶液测定 的质量分数(杂质不与氯化钙溶液反应)。
①
② 滴加的 溶液要过量的目的是 。
③ 将反应后的混合物进行过滤,对沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算 的质量分数为 。如果未洗涤沉淀物,测定结果 (填“等于”“大于”或“小于”),原因是 。
(2)方法()用稀盐酸测定 的质量分数(杂质不与稀盐酸反应)。
利用下图所示实验装置(铁架台略去,装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)和试剂,通过测定样品和稀盐酸反应产生的 气体的质量,计算 的质量分数。
① 打开弹簧夹 ,先通入已除去 的空气一会儿,目的是排尽各装置中含有的 。
② 关闭弹簧夹 ,加入足量的稀盐酸。反应结束后,用焰色反应检验装置 中的溶质,其火焰呈 色;装置 中可观察到的现象是 。
③ 待装置 中的反应结束后,再一次打开弹簧夹 ,继续往装置中通入已除去 的空气一会儿。根据装置 (填标号)在反应前后的质量差就可得到产生 的质量,由此计算出该样品中 的质量分数。
11. 有一包固体,可能含有 、 、 、 、 、 中的一种或几种。根据下列实验回答问题:
取少量固体与熟石灰研磨,无氨味。
另取少量固体进行如下图的实验:
已知:实验 中无沉淀产生,实验 中无气体产生。
(1)由实验 、实验 判断:原固体中一定含有 ,一定不含
(2)为进一步探究原固体的组成,取无色溶液 ,向其中通入 ,产生白色沉淀。由此判断:原固体中一定还含有
(3)根据上述判断,可推知 中实验 所得滤液 中的溶质有 、 、
12. 某化学兴趣小组同学对家用普通干电池中含有的物质产生了浓厚的兴趣。他们剥开电池时闻到氨味且发现有黑色物质。
【提出问题】为什么有氨味 黑色物质的成分是什么
【猜想假设】能闻到氨味说明含有铵盐(如 );黑色固体可能有铁粉、氧化铜或二氧化锰。
(1)【实验探究】同学们分别设计实验进行探究。
实验 .小聪取适量黑色物质与 混合置于研钵内研磨,嗅到强烈氨味,再用湿润的红色石蕊试纸检测,观察到试纸变蓝,证明黑色物质中含有铵盐。
实验 .小敏将黑色物质加入适量的水中搅拌溶解,静置后 ,取不溶物进行实验。
(2)【交流讨论】步骤 中发生反应的化学方程式为 。
13. 有一包粉末,已知由 、 、 、 、 、 中的几种组成,为确定其组成,现进行以下实验(各步骤均充分反应):
①取一定质量的粉末,加水搅拌后过滤,得到沉淀和无色溶液A;
②向①步得到的沉淀中加入足量稀硝酸,得到无色气体和蓝色溶液;
③将①步得到的无色溶液A进行如图所示的实验:
回答下列问题:
(1) 的化学式是 。
(2) 中一定存在的溶质的化学式是 。
(3)生成白色沉淀 的化学方程式是 。
(4)这包粉末中可能含有的物质的化学式是 。
答案
第一部分
1. C
2. C
【解析】A、食盐具有咸味,是常用的调味品,故A正确;
B、体温计中的金属是液态汞,故B正确;
C、发酵粉的主要成分是小苏打碳酸氢钠,故C错误;
D、生活中的铁制品都是铁的合金,故D正确,
故选C。
3. C
【解析】干冰是二氧化碳固体,化学式为 ;消石灰是氢氧化钙的俗称,化学式为 ;纯碱是碳酸钠的俗称,化学式为 ,而氢氧化钠()的俗称是火碱、烧碱、苛性钠;小苏打是碳酸氢钠的俗称,化学式为 。故C不正确。
4. B
【解析】A、食盐是常用的调味品,A正确;
B、熟石灰具有腐蚀性,不能用于治疗胃酸过多,B不正确;
C、氧气具有支持燃烧的性质,可用于炼钢,C正确;
D、活性炭具有吸附性,可用于冰箱除臭,D正确。
5. C
【解析】A、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,由于温度不变,所得溶液仍为该温度下的饱和溶液,溶解度不变,故选项错误。
B、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,溶质质量减少,故选项错误。
C、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,由于温度不变,所得溶液仍为该温度下的饱和溶液,溶质质量分数不变,故选项正确。
D、 时,给一定量的硝酸钠饱和溶液恒温蒸发水分,溶剂质量减少,有硝酸钠析出,溶液质量减少,故选项错误。
故选:C。
6. C
7. C
【解析】①在电解水实验中,“正氧负氢”,生成氢气和氧气的体积比约为 ,不符合题意;
②锌和硫酸铜反应:, 份的锌置换出 份的铜,固体质量减小,溶液质量增加,待完全反应后,不再变化,铁与硫酸铜反应:, 份的铁置换出 份的铜,固体质量增加,溶液质量减小,待完全反应后,不再变化,锌的活动性比铁强,完全反应所需时间短,符合题意;
③向稀盐酸中滴加 溶液,一开始 小于 ,随着反应的进行,氢氧化钠和稀盐酸反应生成氯化钠和水, 逐渐增大,待恰好完全反应时,,后氢氧化钠过量,,符合题意;
④分别向等质量大理石中滴加相同的稀盐酸(足量),接触面积越大,反应速率越快,故粉末状的反应速率快,但是最后生成二氧化碳的质量相同,不符合题意。
故②③正确。
故选C。
第二部分
8. (1) ①;②
(2) 加快溶解速率
9. (1)
【解析】加入盐酸生成无色气体则该气体是二氧化碳,原混合物中一定会有碳酸钾。二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为 。
(2) 、 ; 、
【解析】因为碳酸钾在第一步中已完全反应,则加入氯化钡有白色沉淀则是说明存在硫酸根,化肥中一定含有硫酸钾,则此化肥一定含有 、 ,可能含有 、 。
10. (1) ①
② 与碳酸钠充分反应
③ 大于;不洗涤,碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大
(2) ① 二氧化碳(空气)
② 黄;白色固体变蓝色
③
11. (1) ; 、
【解析】硝酸铜溶于水显蓝色,硝酸铵和碱混合研磨会生成有刺激性气味的氨气,氯离子和银离子会生成氯化银沉淀,碳酸根离子和钡离子会生成碳酸钡沉淀。少量固体与熟石灰研磨,无氨味,说明原固体中不含 ;固体样品溶于水且溶液呈无色,硝酸铜溶于水显蓝色,说明该固体一定不含 ,且 和 最多只能含一种,实验 中加入稀硝酸无气体产生,说明该固体一定不含 ;加入 产生白色沉淀,说明该固体中一定含有氯化钠;溶液 通入 产生白色沉淀说明该固体中一定含 和 , 和 反应生成 ,碳酸钠再与 生成 沉淀;实验 中加入的是过量的硝酸银,所以反应后的滤液中含有硝酸银,硝酸银和氯化钠会生成氯化银沉淀和硝酸钠,所以滤液 中也含有硝酸钠,则实验 所得滤液 中的溶质有 、 、 、 。 通过推导可知,取少量固体与熟石灰研磨,无氨味。由此判断:原固体中一定不含 ; 通过实验 、 判断:原固体中一定含有 ,一定不含 、 。
(2) 、
【解析】氢氧化钠和二氧化碳反应生成碳酸钠,碳酸钠和硝酸钡会生成碳酸钡沉淀和硝酸钠,所以取无色溶液 ,向其中通入 ,产生白色沉淀。由此判断:原固体中一定还含有 、 。
(3) 、
【解析】通过分析可知,实验 中加入的是过量的硝酸银,所以反应后的滤液中含有硝酸银,硝酸银和氯化钠会生成氯化银沉淀和硝酸钠,所以滤液 中也含有硝酸钠,则实验 所得滤液 中的溶质有 、 、 、 。
12. (1) 熟石灰(合理即可);过滤;黑色粉末中一定不含铁粉或氧化铜;(或过氧化氢);木条复燃
【解析】铵盐与碱性物质混合研磨会放出氨气,所以取适量黑色物质与熟石灰混合置于研钵内研磨,嗅到氨味,再用湿润的红色石蕊试纸检测,试纸变蓝,证明黑色物质中含有铵盐。小敏将黑色物质加入适量的水中搅拌溶解,静置后过滤,取不溶物进行实验。取适量黑色滤渣装入试管中,再加入过量稀盐酸,无气泡生成,溶液不变色,说明黑色粉末中一定不含铁粉或氧化铜。取适量黑色滤渣装入另一支试管中,再加入 溶液,向该试管中伸入带火星的小木条,木条复燃,说明有氧气生成,则黑色粉末中含有二氧化锰。
(2)
【解析】二氧化锰催化过氧化氢分解生成水和氧气,化学方程式为 。
13. (1)
(2) 、
(3)
(4) 、
第1页(共1 页)
