弱电解质的电离
图片预览




文档简介
课件16张PPT。第一节 弱电解质的电离第八章 水溶液中的电离平衡 选修4 第三章一、强电解质和弱电解质1、电解质:2、电离方程式的书写:H2SO4
CH3COOH H2CO3
Fe(OH)3 NH3·H2O Al(OH)3
Al2(SO4)3
NaHSO4 a水溶液; b熔融
NaHCO3小结:常见的强酸、弱酸和强碱弱碱例1:下列叙述中能说明某物质是弱电解质的是( )
A.熔化时不导电
B.不是离子化合物,而是极性化合物
C.水溶液的导电能力很差
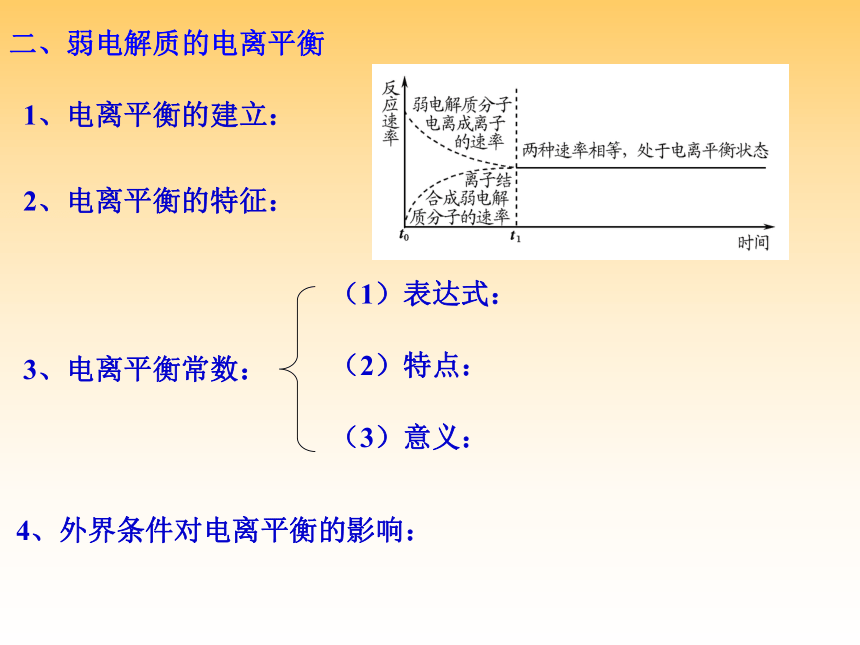
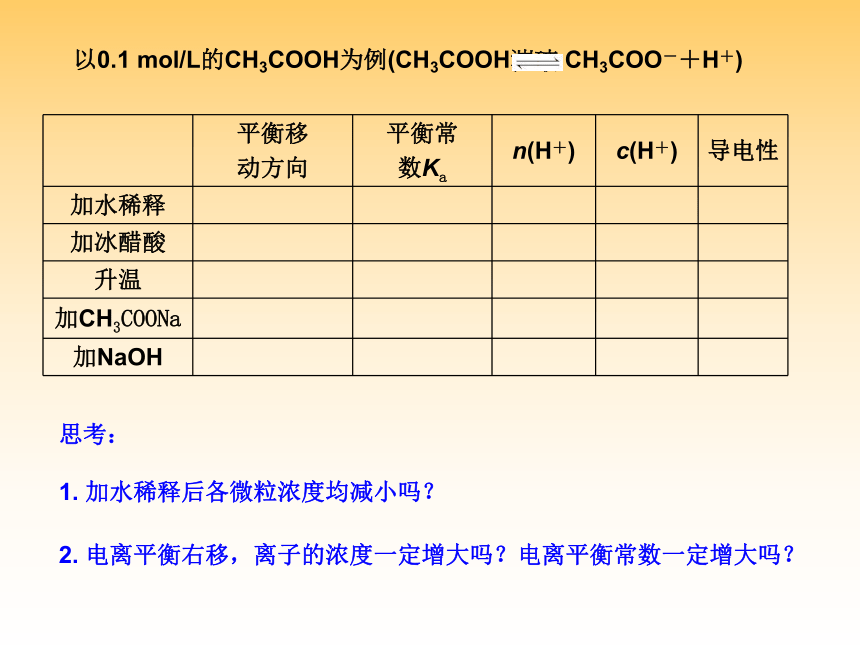
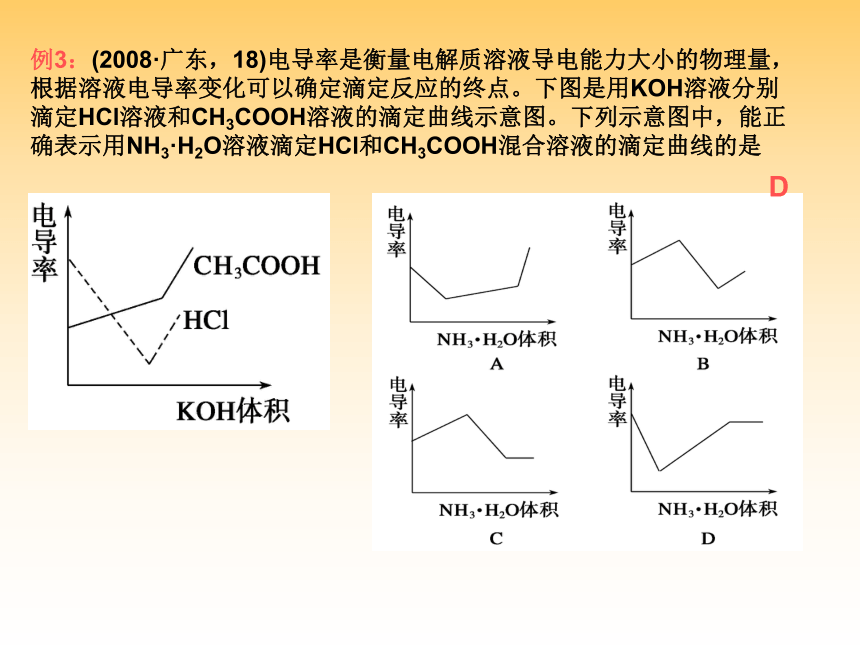
D.溶液中溶质分子和电离出的离子共存D二、弱电解质的电离平衡1、电离平衡的建立:2、电离平衡的特征:3、电离平衡常数:4、外界条件对电离平衡的影响:(1)表达式:(2)特点:(3)意义:以0.1 mol/L的CH3COOH为例(CH3COOH?? CH3COO-+H+)2. 电离平衡右移,离子的浓度一定增大吗?电离平衡常数一定增大吗?1. 加水稀释后各微粒浓度均减小吗?思考:B例3:(2008·广东,18)电导率是衡量电解质溶液导电能力大小的物理量,
根据溶液电导率变化可以确定滴定反应的终点。下图是用KOH溶液分别
滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正
确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是 D小结:强酸与弱酸的比较 例4:醋酸是一种常见的一元弱酸,为了证明醋酸是弱电
解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。
该同学设计了如下方案,其中错误的是( ) A.先配制一定量的 0.10 mol/L CH3COOH 溶液,然后测溶
液的 pH,若 pH 大于 1,则可证明醋酸是弱电解质
B.先配制一定量 0.01 mol/L 和 0.10 mol/L 的 CH3COOH 溶
液,分别用 pH 计测它们的 pH,若两者的 pH 相差小于 1 个单位,
则可证明醋酸是弱电解质
C.取等体积、等 pH 的 CH3COOH 溶液和盐酸分别与足量
锌反应,测得反应过程中醋酸产生 H2 较慢且最终产生 H2 较多,
则醋酸为弱酸
D.配制一定量的 CH3COONa 溶液,测其 pH,若常温下 pH
大于 7,则可证明醋酸是弱电解质C讨论:证明醋酸是弱酸的方法有哪些?例5 (2012年延边模拟)下列各组比较中,前者比后者大的是( )
A.25℃时,pH均为2的H2SO4和盐酸中氢离子的物质的量浓度
B.25℃时,pH均为2的盐酸和CH2COOH溶液中溶质的物质的量浓度
C.同温度、同浓度的NaCl溶液和氨水的导电能力
D.25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度C例6(2010年重庆高考)pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液体积为 Vx,Vy,则( )
A.x为弱酸,VxVy
C.y为弱酸,VxVyC5、电离平衡常数的计算:P114【答案】 5.7×10-10例7 :例8 :对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表是几种常见弱酸的电离平衡常数(25℃)。回答下列问题:
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为__________________________________________________。
(2)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3,数值越来越小的原因是__________。
(3)弱酸质子理论认为:凡是提供质子的分子或离子是酸,凡是能接受质子的分子或离子是碱。试判断:
①H3PO4水溶液中,具有两性的微粒有________。
②CH3COO-、HCO、CO、PO、H2PO、S2-离子的碱性由弱到强的顺序为___________________________________________。(4)电离平衡常数是用实验的方法测定出来的。现已经测得25℃时,c mol·L-1的醋酸溶液中c(H+)=a mol·L-1,试用a、c表示该温度下醋酸的电离平衡常数K(CH3COOH)=________。小结:
CH3COOH H2CO3
Fe(OH)3 NH3·H2O Al(OH)3
Al2(SO4)3
NaHSO4 a水溶液; b熔融
NaHCO3小结:常见的强酸、弱酸和强碱弱碱例1:下列叙述中能说明某物质是弱电解质的是( )
A.熔化时不导电
B.不是离子化合物,而是极性化合物
C.水溶液的导电能力很差
D.溶液中溶质分子和电离出的离子共存D二、弱电解质的电离平衡1、电离平衡的建立:2、电离平衡的特征:3、电离平衡常数:4、外界条件对电离平衡的影响:(1)表达式:(2)特点:(3)意义:以0.1 mol/L的CH3COOH为例(CH3COOH?? CH3COO-+H+)2. 电离平衡右移,离子的浓度一定增大吗?电离平衡常数一定增大吗?1. 加水稀释后各微粒浓度均减小吗?思考:B例3:(2008·广东,18)电导率是衡量电解质溶液导电能力大小的物理量,
根据溶液电导率变化可以确定滴定反应的终点。下图是用KOH溶液分别
滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正
确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是 D小结:强酸与弱酸的比较 例4:醋酸是一种常见的一元弱酸,为了证明醋酸是弱电
解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。
该同学设计了如下方案,其中错误的是( ) A.先配制一定量的 0.10 mol/L CH3COOH 溶液,然后测溶
液的 pH,若 pH 大于 1,则可证明醋酸是弱电解质
B.先配制一定量 0.01 mol/L 和 0.10 mol/L 的 CH3COOH 溶
液,分别用 pH 计测它们的 pH,若两者的 pH 相差小于 1 个单位,
则可证明醋酸是弱电解质
C.取等体积、等 pH 的 CH3COOH 溶液和盐酸分别与足量
锌反应,测得反应过程中醋酸产生 H2 较慢且最终产生 H2 较多,
则醋酸为弱酸
D.配制一定量的 CH3COONa 溶液,测其 pH,若常温下 pH
大于 7,则可证明醋酸是弱电解质C讨论:证明醋酸是弱酸的方法有哪些?例5 (2012年延边模拟)下列各组比较中,前者比后者大的是( )
A.25℃时,pH均为2的H2SO4和盐酸中氢离子的物质的量浓度
B.25℃时,pH均为2的盐酸和CH2COOH溶液中溶质的物质的量浓度
C.同温度、同浓度的NaCl溶液和氨水的导电能力
D.25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度C例6(2010年重庆高考)pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液体积为 Vx,Vy,则( )
A.x为弱酸,Vx
C.y为弱酸,Vx
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为__________________________________________________。
(2)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3,数值越来越小的原因是__________。
(3)弱酸质子理论认为:凡是提供质子的分子或离子是酸,凡是能接受质子的分子或离子是碱。试判断:
①H3PO4水溶液中,具有两性的微粒有________。
②CH3COO-、HCO、CO、PO、H2PO、S2-离子的碱性由弱到强的顺序为___________________________________________。(4)电离平衡常数是用实验的方法测定出来的。现已经测得25℃时,c mol·L-1的醋酸溶液中c(H+)=a mol·L-1,试用a、c表示该温度下醋酸的电离平衡常数K(CH3COOH)=________。小结:
