2021-2022学年高二上学期化学苏教版(2020)选择性必修1 3.4.2沉淀溶解平衡原理的应用课件
文档属性
| 名称 | 2021-2022学年高二上学期化学苏教版(2020)选择性必修1 3.4.2沉淀溶解平衡原理的应用课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-27 12:25:13 | ||
图片预览







文档简介
(共22张PPT)
沉淀溶解平衡原理的应用
选自苏教版 《化学反应原理》专题3
第四单元 难溶电解质的沉淀溶解平衡
工业废水污
染的河流
工业废水使鱼
虾死亡
工业废水的处理
工业废水
重金属离子(如Cu2+、Hg2+等)转化成沉淀
沉淀溶解平衡的应用
1、原则:生成沉淀的反应能发生,且进行得越完全越好。
2、意义:在物质的检验、提纯及工厂废水的处理等方面有重要意义。
一、沉淀的生成
Qc>Ksp,生成沉淀
(3)方法
①、加沉淀剂:如沉淀Cu2+、Hg2+等,
以Na2S、H2S做沉淀剂
Cu2++S2-=CuS↓
Hg2++S2-=HgS↓
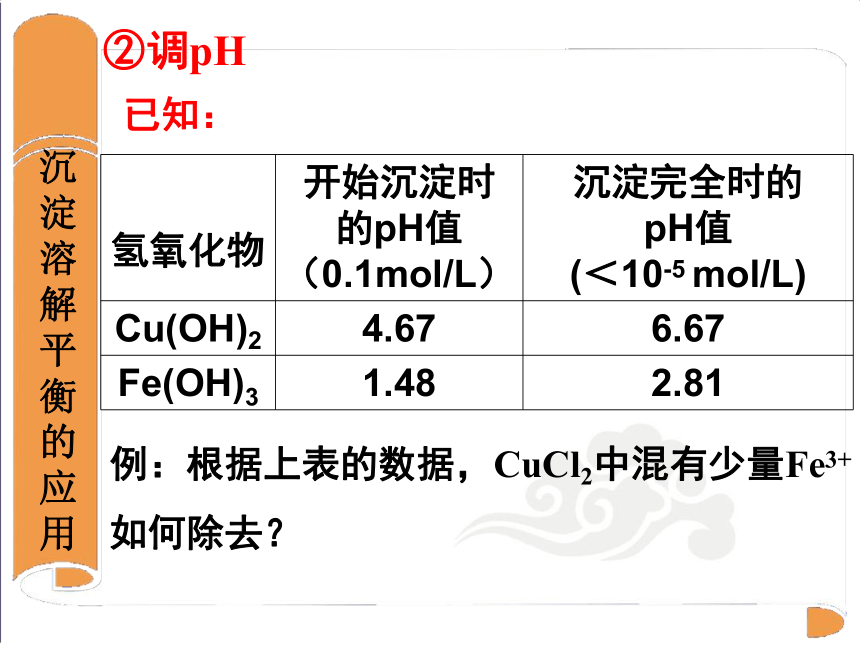
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的
pH值
(<10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
已知:
例:根据上表的数据,CuCl2中混有少量Fe3+
如何除去?
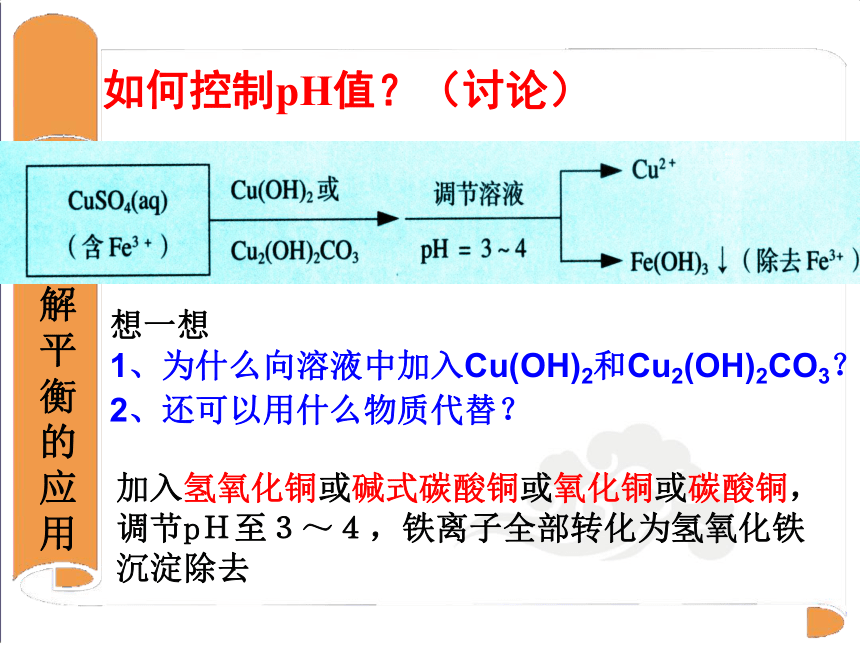
②调pH
如何控制pH值?(讨论)
加入氢氧化铜或碱式碳酸铜或氧化铜或碳酸铜,调节pH至3~4,铁离子全部转化为氢氧化铁沉淀除去
想一想
1、为什么向溶液中加入Cu(OH)2和Cu2(OH)2CO3?
2、还可以用什么物质代替?
根据上表,CuCl2中混有少量Fe3+、 Fe2+如何除去?
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的
pH值
(<10-5 mol/L)
Fe(OH)2 6.34 8.34
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
先把Fe2+氧化成Fe3+,加入氢氧化铜或碱式碳酸铜或氧化铜,然后调PH至3到4使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
氧化剂:氯气,双氧水,氧气
要求:不引入杂质
③氧化还原法
④同离子效应法
例如硫酸钡在硫酸中的溶解度比在纯水中小
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
BaSO4(s) Ba2 +(aq)+SO42- (aq)
实验一:取一支试管,向其中滴加2ml氯化钠溶液,然后向其中逐滴加入硝酸银溶液,观察现象并记录。
实验二:向实验1的试管里滴加碘化钾溶液,观测现象并纪录。
实验三:向实验2的试管中滴加硫化钠溶液。
实验现象 离子方程式
实验1
实验2
实验3
产生白色沉淀
Ag++Cl-=AgCl↓
白色沉淀→黄色沉淀
AgCl+I- AgI+Cl-
黄色沉淀→黑色沉淀
2AgI+S2- Ag2S+2I-
实验探究
已知AgCl、 AgI和Ag2S的KSP为 1.8×10-10、
8.3×10-17、
1.6×10-49 ,
分析沉淀转化的方向。
规律探究
AgCl Ag+ + Cl-
+
KI == I- + K+
AgI
2AgI 2Ag+ + 2I-
Na2S == S2- + 2Na+
+
Ag2S
(1)实质:沉淀溶解平衡的移动
(2)一般规律:沉淀溶解平衡是溶解能力相对较强的物质转化为溶解能力相对较弱的物质,即Ksp大转化为Ksp小
二、沉淀的转化
吃糖为何会出现龋齿?
含氟牙膏为何可以预防龋齿?
Ca5(PO4)3OH(s)
5Ca2+(aq) + 3PO43-(aq) + OH- (aq)
提示:糖在酶的作用下产生了一种有机弱酸
3、沉淀的转化在生活中的应用
化学与生活
牙齿的保护
含氟牙膏的使用
5Ca2+ + 3PO43- + F- = Ca5(PO4)3F
使用含氟牙膏,可以使难溶物转化为更难溶物质。氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固
注:氟过量会导致氟斑牙,因此,生活在水中含氟量较高的地区的人,不宜使用含氟牙膏
锅炉水垢中除了CaCO3、Mg(OH)2外,还含有难溶于水和酸的 CaSO4 ,如何清除?
难点:如何清除CaSO4?
难溶物 CaSO4 CaCO3
溶解度/g 2.1×10-1 1.5 ×10-3
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 : 但BaSO4不溶于酸,这给转化为其他钡盐带来了困难,但若能将其转化为易溶于酸的BaCO3,再BaCO3制备其他钡盐则要容易得多。
BaSO4 Ba2+ + SO42-
+
BaCO3(s)
BaSO4 + CO32- BaCO3 +SO42-
①饱和Na2CO3溶液
②移走上层溶液
H+
(重复①②操作)
BaSO4 、BaCO3
Ba2+
BaSO4
……
BaCO3
Na2CO3 CO32- + 2Na+
(1)实质:是设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动
例:CaCO3易溶于HCl
①酸(碱)溶解法
三、沉淀的溶解
例:Al(OH)3既溶于HCl,又溶于NaOH
②难溶于水的电解质溶于某些盐溶液
例:Mg(OH)2溶于NH4Cl溶液
(2) 必要条件: Qc < Ksp ,
(3)方法
1、将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。对上述过程,下列理解或解释中正确的是( )
A、Ksp(AgCl)<Ksp(AgBr)
B、上述实验说明AgCl没有AgBr稳定
C因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
D.若在AgCl浊液中直接加入NaBr溶液,也会产生 浅黄色沉淀
【随堂练习】
D
我们学到了什么?
沉淀溶解平衡的应用
1、沉淀的生成
2、沉淀的转化
3、沉淀的溶解
KSP和沉
淀
溶
解
平
衡
的
移
动
解决沉淀溶解平衡问题的一般思路
1、龋齿的形成和防治
2、锅炉除水垢
3、工业处理重晶石
沉淀溶解平衡原理的应用
选自苏教版 《化学反应原理》专题3
第四单元 难溶电解质的沉淀溶解平衡
工业废水污
染的河流
工业废水使鱼
虾死亡
工业废水的处理
工业废水
重金属离子(如Cu2+、Hg2+等)转化成沉淀
沉淀溶解平衡的应用
1、原则:生成沉淀的反应能发生,且进行得越完全越好。
2、意义:在物质的检验、提纯及工厂废水的处理等方面有重要意义。
一、沉淀的生成
Qc>Ksp,生成沉淀
(3)方法
①、加沉淀剂:如沉淀Cu2+、Hg2+等,
以Na2S、H2S做沉淀剂
Cu2++S2-=CuS↓
Hg2++S2-=HgS↓
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的
pH值
(<10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
已知:
例:根据上表的数据,CuCl2中混有少量Fe3+
如何除去?
②调pH
如何控制pH值?(讨论)
加入氢氧化铜或碱式碳酸铜或氧化铜或碳酸铜,调节pH至3~4,铁离子全部转化为氢氧化铁沉淀除去
想一想
1、为什么向溶液中加入Cu(OH)2和Cu2(OH)2CO3?
2、还可以用什么物质代替?
根据上表,CuCl2中混有少量Fe3+、 Fe2+如何除去?
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的
pH值
(<10-5 mol/L)
Fe(OH)2 6.34 8.34
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
先把Fe2+氧化成Fe3+,加入氢氧化铜或碱式碳酸铜或氧化铜,然后调PH至3到4使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
氧化剂:氯气,双氧水,氧气
要求:不引入杂质
③氧化还原法
④同离子效应法
例如硫酸钡在硫酸中的溶解度比在纯水中小
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
BaSO4(s) Ba2 +(aq)+SO42- (aq)
实验一:取一支试管,向其中滴加2ml氯化钠溶液,然后向其中逐滴加入硝酸银溶液,观察现象并记录。
实验二:向实验1的试管里滴加碘化钾溶液,观测现象并纪录。
实验三:向实验2的试管中滴加硫化钠溶液。
实验现象 离子方程式
实验1
实验2
实验3
产生白色沉淀
Ag++Cl-=AgCl↓
白色沉淀→黄色沉淀
AgCl+I- AgI+Cl-
黄色沉淀→黑色沉淀
2AgI+S2- Ag2S+2I-
实验探究
已知AgCl、 AgI和Ag2S的KSP为 1.8×10-10、
8.3×10-17、
1.6×10-49 ,
分析沉淀转化的方向。
规律探究
AgCl Ag+ + Cl-
+
KI == I- + K+
AgI
2AgI 2Ag+ + 2I-
Na2S == S2- + 2Na+
+
Ag2S
(1)实质:沉淀溶解平衡的移动
(2)一般规律:沉淀溶解平衡是溶解能力相对较强的物质转化为溶解能力相对较弱的物质,即Ksp大转化为Ksp小
二、沉淀的转化
吃糖为何会出现龋齿?
含氟牙膏为何可以预防龋齿?
Ca5(PO4)3OH(s)
5Ca2+(aq) + 3PO43-(aq) + OH- (aq)
提示:糖在酶的作用下产生了一种有机弱酸
3、沉淀的转化在生活中的应用
化学与生活
牙齿的保护
含氟牙膏的使用
5Ca2+ + 3PO43- + F- = Ca5(PO4)3F
使用含氟牙膏,可以使难溶物转化为更难溶物质。氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固
注:氟过量会导致氟斑牙,因此,生活在水中含氟量较高的地区的人,不宜使用含氟牙膏
锅炉水垢中除了CaCO3、Mg(OH)2外,还含有难溶于水和酸的 CaSO4 ,如何清除?
难点:如何清除CaSO4?
难溶物 CaSO4 CaCO3
溶解度/g 2.1×10-1 1.5 ×10-3
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 : 但BaSO4不溶于酸,这给转化为其他钡盐带来了困难,但若能将其转化为易溶于酸的BaCO3,再BaCO3制备其他钡盐则要容易得多。
BaSO4 Ba2+ + SO42-
+
BaCO3(s)
BaSO4 + CO32- BaCO3 +SO42-
①饱和Na2CO3溶液
②移走上层溶液
H+
(重复①②操作)
BaSO4 、BaCO3
Ba2+
BaSO4
……
BaCO3
Na2CO3 CO32- + 2Na+
(1)实质:是设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动
例:CaCO3易溶于HCl
①酸(碱)溶解法
三、沉淀的溶解
例:Al(OH)3既溶于HCl,又溶于NaOH
②难溶于水的电解质溶于某些盐溶液
例:Mg(OH)2溶于NH4Cl溶液
(2) 必要条件: Qc < Ksp ,
(3)方法
1、将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。对上述过程,下列理解或解释中正确的是( )
A、Ksp(AgCl)<Ksp(AgBr)
B、上述实验说明AgCl没有AgBr稳定
C因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
D.若在AgCl浊液中直接加入NaBr溶液,也会产生 浅黄色沉淀
【随堂练习】
D
我们学到了什么?
沉淀溶解平衡的应用
1、沉淀的生成
2、沉淀的转化
3、沉淀的溶解
KSP和沉
淀
溶
解
平
衡
的
移
动
解决沉淀溶解平衡问题的一般思路
1、龋齿的形成和防治
2、锅炉除水垢
3、工业处理重晶石
