2021-2022学年高二上学期化学苏教版(2020)选择性必修1 1.1化学反应的焓变课件
文档属性
| 名称 | 2021-2022学年高二上学期化学苏教版(2020)选择性必修1 1.1化学反应的焓变课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-27 12:30:26 | ||
图片预览










文档简介
(共53张PPT)
专题1 化学反应与能量变化
第一单元 化学反应的热效应
化学反应的焓变
在研究物质的能量变化时,把相互联系的物质区分为体系和环境两部分。
体系:被研究的物质系统。
环境:体系以外,与体系发生质量、能量交换的物质系统。
例如:
教室内部的物质系统也可以作为“体系”,则教室之外为“环境”,教室可以与环境发生能量(如传热)交换,也可以发生质量(如空气通过门窗进出)交换。
思考讨论
请举例说明体系和环境。
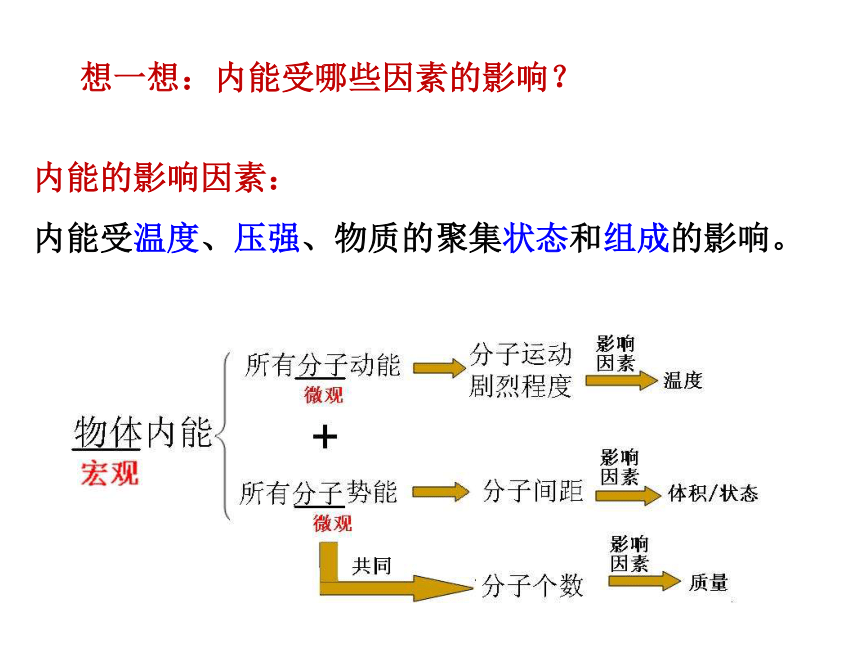
内能:物质的各种能量的总和称为内能。
想一想:如果是静止不动的物质,它具有能量吗?
冰块温度虽然低,但其内部的分子都在做无规则运动;燃烧的火,温度很高,分子运动更剧烈。
物质内部除了有分子运动产生的能量外,还有其他形式的能量。
内能的普遍性:一切物质皆有内能。
想一想:内能受哪些因素的影响?
内能的影响因素:
内能受温度、压强、物质的聚集状态和组成的影响。
内能的绝对值无法直接测得,但内能的变化可以通过变化过程中体系吸收(或放出)的热对内(或外)所做的功的形式表现出来。
焓是与内能有关的物理量。用符号H表示。
焓的数值的变化称为焓变。用符号ΔH表示。
化学变化既有物质变化,又有能量变化。
能量的转换以发生化学反应的物质为基础,遵循能量守恒定律。
化学反应中能量变化的应用
一、反应热 焓变
1、定义:
2、符号:△H
3、单位:kJ·mol-1或 kJ/mol
在恒温、恒压时的反应热又称为“焓变”。
化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热.
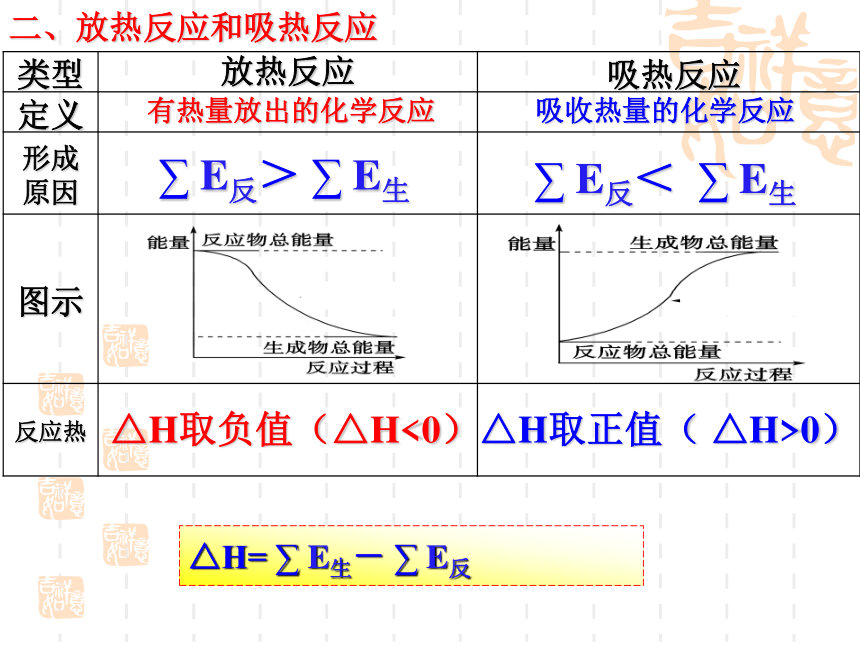
二、放热反应和吸热反应
类型
定义
形成原因
图示
反应热
有热量放出的化学反应
吸收热量的化学反应
∑ E反> ∑ E生
∑ E反< ∑ E生
△H取负值(△H<0)
△H取正值( △H>0)
△H= ∑ E生- ∑ E反
放热反应
吸热反应
常见的放热反应和吸热反应
1.所有的燃烧、爆炸反应
放热反应
吸热反应
1.氢氧化钡与氯化铵晶体的反应
CaO + H2O === Ca(OH)2
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 ↑ +10H2O
H+ +OH- === H2O
2Al + Fe2O3 ===== Al2O3 + 2Fe
高温
高温
2.C(s) + CO2(g) === 2CO(g)
4.大多数分解反应
高温
3. C(s) + H2O(g) ==== CO(g) + H2(g)
2.金属与酸或水的反应
3.酸碱中和反应
4.大多数化合反应
5.铝热反应
5.所有的电离过程
6.所有的水解反应
加热后才能发生的化学反应不一定是吸热反应;
吸热反应不一定要加热才能发生。
△H的计算
1. △H= ∑ E生- ∑ E反
△H=断键吸收的能量-成键释放的能量
化学反应中化学键的断裂和形成是反应过程中能量
变化的本质原因
反应物断键所吸收的总能量 < 生成物成键放出的总能量
反应物断键所吸收的总能量 > 生成物成键放出的总能量
放热反应
吸热反应
一般来说,物质能量越低,越稳定,键能越大。
△H=反应物的总键能-生成物的总键能
1、下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着能量的变化
B、放热反应不需要加热即可发生
C、需要加热条件的化学反应都是吸热反应
D、化学反应是吸热还是放热决定于生成物具有总能量和反应物具有总能量
E、分解反应肯定是吸热反应
F、可燃物的燃烧放出热量
G、一个具体的化学反应不是吸热反应就是放热反应
BCE
2、下列变化属于放热反应的有 .
属于吸热反应的有 .
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④烧碱加入水中
⑤氯酸钾分解制氧气 ⑥铝热反应
⑦点燃的镁条继续在CO2中继续燃烧
⑧生石灰跟水反应生成熟石灰
⑨Ba(OH)2·8H2O和NH4Cl的反应
⑩ C与CO2的反应
⑥⑦⑧
②⑤⑨⑩
请观察下列表示氢气在氧气中燃烧生成水的反应热效应的化学方程式,分析其在书写上与化学方程式有何不同。
P3交流与讨论
2H2(g)+ O2(g)=2H2O(g) △H=-483.6KJ/mol
H2(g)+1/2 O2(g)=H2O(l) △H=-285.8KJ/mol
2H2(g)+ O2(g)=2H2O(l) △H=-571.6KJ/mol
H2(g)+1/2 O2(g)=H2O(g) △H=-241.8KJ/mol
三、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式叫热化学方程式。
如:C(s)+O2(g)==CO2(g) △H=-393.6kJ mol-1
3.书写注意事项:
(1)注明温度压强,绝大多数298k,101.3kPa 可不注明
(4)△H的符号、单位、数值
(放热ΔH为“-”,吸热ΔH为“+”;ΔH的单位:kJ·mol-1 (kJ/mol);数值要与方程式的化学计量数相对应)
(3)化学计量数不表示分子个数,只表示物质的量,可为整数或者简单分数
(2)注明聚集状态(s , l , g , aq),不标“↑”或“↓”
2.表示意义:
1molC与1mol O2完全反应,生成1molCO2气体,放出393.6kJ热量
(5)逆向反应△H符号相反,数值不变;可逆反应中△H是指完全反应时的焓变。
(1)N2H4(l)+O2(g)=N2(g)+ 2H2O(g)
ΔH= -622.08kJ·mol-1
X
(2)N2H4(l)+O2(g)=N2(g)+ 2H2O(l)
ΔH=622.08kJ·mol-1
(3)N2H4(l)+O2(g)=N2(g)+ 2H2O(l)
ΔH=-622.08kJ·mol-1
X
(5) N2H4(l)+ O2(g)= N2(g)+ H2O(l)
ΔH=-311.04kJ·mol-1
X
(1)N2H4+O2=N2+ 2H2O ΔH=-622.08kJ·mol-1
[P3交流与讨论] 判断下列热化学方程式是否正确
[P5问题解决]写出下列反应的热化学方程式:
1、N2 (g)与H2 (g)反应生成1molNH3 (g) ,放出46.1KJ热量。
2、1molC2H5OH (l)完全 燃烧生成CO2 (g) 和H2O (l) ,放出1366.8KJ热量。
3、标况下,44.8LC2H2 (g)在O2 (g)中完全燃烧生成CO2 (g)和H2O (l) ,放出2599.2KJ热量
4、24gC(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收262.6KJ热量。
N2(g)+3/2 H2(g)=NH3( g ) ΔH=-46.1kJ·mol-1
C2H5OH (l) + 3O2(g)= 2CO2(g) +3H2O(l) △H= - 1366.8KJ·mol -1
2C2H2(g)+5O2(g)=4CO2(g) +2H2O(l) △H= - 2599.2kJ·mol -1
C( S,石墨) + H2O (g)= CO (g) + H2(g) △H =+131.3kJ·mol -1
[P5问题解决]
已知断裂1mol H2 (g)中的H-H键需消耗436kJ 的能量,断裂1mol O2 (g)中的共价键需要吸收498kJ的能量, 生成H2O (g)中的1mol H-O键能够放出463kJ的能量。试写出O2 (g)与H2 (g)反应生成H2O (g)的热化学方程式。
2H2(g) + O2(g) === 2H2O(g) △H=- 482 KJ/mol
共价键 H-H N≡N H-N
键能/kJ·mol-1 436 946 391
写出合成氨反应的热化学方程式。
N2(g) + 3H2(g) 2NH3 (g) △H=- 92KJ mol-1
该热化学方程式的表示意义?
3、热化学方程式表示的意义
1)表示什么物质参加反应,结果生成什么物质
2)反应物和生成物之间的质量比、物质的量比
3)反应物完全变成生成物后所放出或吸收的热量。
质→量→能
H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol
在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A.H2(g)+Cl2(g)=2HCl(g); △H1=-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g); △H2=-Q2
B.C(s)+1/2O2(g)=CO (g); △H1=-Q1
C(s)+O2(g)=CO2 (g); △H2=-Q2
C.2H2(g)+O2(g)=2H2O(l); △H1=-Q1
2H2(g)+O2(g)=2H2O(g); △H2=-Q2
B
已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、ad>0 C、2a=b< 0 D、2c=d>0
C
H+(aq)+OH-(aq)=H2O(l) △H= -57.3 kJ/mol
(1)定义:在稀溶液中,酸和碱发生中和反应而生成1mol水时放出的热量。
(2)实质:
1、中和热
H++OH-=H2O
强酸与强碱的稀溶液发生中和反应生成1mol水,放出的热量为57.3KJ
四、 反应热的测定
注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热量小于57.3KJ
2、中和热的测定
⑴实验药品:
⑵实验仪器:
50ml 0.50mol∕L的 HCl ,
50ml 0.50mol∕L的 NaOH
简易量热计
⑶实验原理
Q = cmΔt
Q: 中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。比热容(单位质量的物质升高1℃所需吸收的热量)
Δt:反应前后溶液温度的差值。
= C×(m酸+ m碱)×(t3- )
= 4.18J/(g·℃)×(50g+ 50g)×(t3- ) ℃
= 418×(t3- ) J
= 0.418×(t3- ) KJ
是中和热吗?
大烧杯(500 mL)
小烧杯(100 mL)
温度计
泡沫塑料或纸条
泡沫塑料板或硬纸板(中心有两个小孔)
环形玻璃搅拌棒
保温隔热、
减少热量损失
(4)实验步骤:
组装量热器
能否用环形铜丝搅拌棒?
①用量筒最取50 mL 0.50 mol/L盐酸,倒入简易量热计中,测量并记录盐酸的温度(t1)。
然后把温度计上的酸用水冲洗干净。
②用另一量筒量取50 mL 0.50 mol/L NaOH溶液,并测量并记录NaOH溶液的温度(t2)。
不冲洗,温度计上的酸会和碱发生中和反应而使热量散失
③将量筒中的NaOH溶液迅速倒入盛有HCl的简易量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,观察温度计的温度变化,准确读出并记录反应体系的最高温度(t3)。
温度 实验次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
HCl NaOH 平均值
1 24.4 25.0 26.5
2 22.0 22.4 25.6
3 25.0 25.2 28.4
1.8
3.4
3.3
④重复实验三次,取测量所得数据的平均值作为计算依据。
24.7
22.2
25.1
×
×
1.量取溶液的体积有误差。
2.温度计的读数有误差。
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢,导致实验误差。
5.隔热操作不到位,致使实验过程中热量损失而导致误差。
6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。
(4)误差分析
1、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么?
可以保证盐酸完全反应,使测得的热量更加准确。
2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小
关系为 。
△H1> △H3 > △H2
弱酸和弱碱电离时吸热,使测得中和热的数值偏低。
浓硫酸稀释放热,使测得中和热的数值偏高。
1、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
变小
变小
变小
3、为了减小误差。某同学在实验中两次测定中和热。第一次是用50 mL 0.50 mol/L的盐酸和50 mL 0.50 mol/L氢氧化钠,第二次是用100 mL 0.50 mol/L的盐酸和100 mL 0.50mol/L的NaOH溶液。请你预测该同学两次反应放出的热量 ,测得的中和热结果 (相等或者不相等)。
相等
不相等
强酸与强碱的稀溶液的中和热:△H=-57.3KJ/mol
讨论:如何测出这个反应的反应热:
C(s)+1/2O2(g)==CO(g) ;ΔH1=
不管化学反应是一步完成或分几步完成,其反应热是相同的。
化学反应的焓变( ΔH)只与反应体系的始态和终态有关,而与反应的途径无关。
五、盖斯定律
ΔH、ΔH1、ΔH2之间有何关系?
ΔH=ΔH1+ΔH2
ΔH
A
C
ΔH1
B
ΔH2
①C(s)+1/2O2(g)==CO(g) ΔH1=
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以, ΔH1 =ΔH3- ΔH2 =-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol
讨论:如何测出这个反应的反应热:
C(s)+1/2O2(g)==CO(g) ;ΔH1=
【观察与思考】
(2)H2(g)+1/2 O2(g)=H2O(l) △H2=-285.8KJ/mol
(1)H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8KJ/mol
① - ② 得 H2O(l) = H2O(g) (3)
△H3=△H1-△H2= + 44KJ/mol
(1) 若一个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的ΔH也可以由这几个反应的的焓变相加减而得到。
(2)若一个反应的 ΔH= a kJ/mol,则其逆反应的 ΔH= - a kJ/mol。
盖斯定律的应用
根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变:
C(石墨)+O2(g)=CO2(g) △H1=-393.5KJ/mol ①
2H2(g)+O2(g)=2H2O(l) △H2=-571.6KJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599.2KJ/mol ③
[P9问题解决]
① ×2 + ② ×1/2 -③×1/2 得
2C(石墨)+ H2(g) = C2H2(g)
△H = △H1 ×2 + △H2 ×1/2 - △H3 ×1/2
△H = +226.8KJ/mol
同温同压下,比较Q1与Q2 、 △H1与△H2的大小
S(g)+O2(g) == SO2(g) △H1= - Q1 (1)
S(s)+O2(g) == SO2(g) △H2= - Q2 (2)
Q1>Q2 △H1 < △H2
H2(g) + 1/2O2(g) == H2O(g) △H1= - Q1 (1)
H2(g) + 1/2O2(g) == H2O(l) △H2= - Q2 (2)
Q1 < Q2 △H1 > △H2
- (2)得 H2O(l) == H2O(g) △H3 = △H1 - △H2
=- Q1 + Q2 > 0
(1) - (2)得 S(g) == S(s) △H3 = △H1 - △H2
=- Q1 + Q2 < 0
不同生产水平的社会中
人均消耗的能量
原始社会
早期的农业社会
8×103 kJ/天
5×104 kJ/天
【你知道吗】
你平均每天要消耗多少能量?
简单机械工业社会
3×105 kJ/D(天)
现代信息社会
1×106 kJ/D(天)
传统能源:化石燃料
新能源:太阳能、核能、生物质能、地热能、海洋能、氢能、潮汐能等。
一次能源:
化石燃料、太阳能、风能、核能、生物质能、海洋能、潮汐能等
二次能源:电力、氢能
新能源的特点:
资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
不可再生能源
你所了解的传统能源有哪些? 新能源又有哪些?
能源又可以分为一次能源和二次能源。一次能源是指直接取自自然界,没有加工转换的各种能量和资源;二次能源是指由一次能源经过加工转换后得到的能源。
1、定义:在101kPa时,lmol物质完全燃烧的反应热,叫做该物质的标准燃烧热。
C→CO2(g) H→H2O(l)
S→SO2(g) N→N2(g)
一、标准燃烧热
二、热值
1、定义:在101kPa时,l g 物质完全燃烧的反应热
2、单位:KJ/g
2、符号:△H
3、单位:KJ/mol
标准燃烧热和中和热的区别与联系
1mol反应物完全燃烧时放出的热量;不同反应物,标准燃烧热不同。
生成1mol水时放出的热量;强酸与强碱的中和热都约为57.3kJ/mol 。
标准燃烧热
中和热
相同点
不同点
能量变化
H
标准
含义
放热反应
H<0;单位:kJ/mol
1mol可燃物
生成1mol水
1、下列各组物质的标准燃烧热相等的是( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素
B
H2(g)+1/2O2(g)=H2O(l); = -285.8 kJ/mol
H
H2(g)+1/2O2(g)=H2O(g); = -241.8 kJ/mol
H
2H2(g)+O2(g)=2H2O(g); = -483.6 kJ/mol
H
2H2(g)+O2(g)=2H2O(l); = -571.6 kJ/mol
H
2、已知热化学方程式:
则氢气的标准燃烧热为:________
-285.8 kJ/mol
3、下列有关燃烧热的说法是否正确的?
⑴150kPa时,1molC完全燃烧,放出的热量为C的燃烧热
⑵101kPa时,1molC燃烧生成CO时,放出的热量为C的燃烧热
⑶101kPa时,4gH2燃烧生成液态水时,放出的热量为H2的燃烧热
×
×
×
4、4.0 g硫粉在O2中完全燃烧,放出37 kJ热量,计算S的燃烧热。
5、已知:辛烷的燃烧热为5518KJ/mol,写出表示辛烷燃烧热的热化学反应方程式。
C8`H18(l) + 25/2 O2(g)== 8 CO2(g) + 9H2O (l)
△H=-5518KJ/mol
注意:书写表示燃烧热的热化学方程式时,要以1mol可燃物为标准来配平。
△H=-37×32/4= -296 (KJ/mol)
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。C+H2O=CO+H2
已知:C(s)+O2(g)=CO2(g) △H1=-393.5KJ/mol
H2(g)+1/2O2(g)=H2O(g) △H2=-241.8KJ/mol
CO(g)+1/2O2(g)=CO2(g) △H3=-283.0KJ/mol
甲同学认为:“煤燃烧时加少量的水,可以使煤炭燃烧放出更多的热量。”
乙同学认为:“将煤转化为水煤气再燃烧放出的热量与直接燃烧煤放出的热量一样,而将煤转化为水煤气会增加消耗,因此,将煤转化为水煤气得不偿失。”
你认为他们说得有道理吗?
[P10 交流与讨论]
[思考1]在许多场合将煤块直接燃烧,这种燃烧方式存在什么缺陷?
1、煤的燃烧热虽高但煤与空气接触面积不够,内部煤的燃烧效率低
2、直接燃烧会使其中含硫转化成二氧化硫。引起大气污染
[思考2]那如何提高煤燃烧效率的方法?你认为“交流与讨论”中的观点怎样?
提高煤转化率:
1、做成蜂窝状,增大接触面积。
2、煤的液化
3、煤的汽化
煤转化为水煤气与直接获得的能量是一样的,将煤转化成水煤气增加耗能。但提高了燃烧效率除去了硫,避免了二氧化硫污染大气
使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
节约能源的重要措施:
科学地控制燃烧反应,使燃料充分燃烧,提高能源的利用率。
资料卡
通过降低反应温度的节能措施——P11阅读材料
作业:
课课练
人有了知识,就会具备各种分析能力,
明辨是非的能力。
所以我们要勤恳读书,广泛阅读,
古人说“书中自有黄金屋。
”通过阅读科技书籍,我们能丰富知识,
培养逻辑思维能力;
通过阅读文学作品,我们能提高文学鉴赏水平,
培养文学情趣;
通过阅读报刊,我们能增长见识,扩大自己的知识面。
有许多书籍还能培养我们的道德情操,
给我们巨大的精神力量,
鼓舞我们前进。
专题1 化学反应与能量变化
第一单元 化学反应的热效应
化学反应的焓变
在研究物质的能量变化时,把相互联系的物质区分为体系和环境两部分。
体系:被研究的物质系统。
环境:体系以外,与体系发生质量、能量交换的物质系统。
例如:
教室内部的物质系统也可以作为“体系”,则教室之外为“环境”,教室可以与环境发生能量(如传热)交换,也可以发生质量(如空气通过门窗进出)交换。
思考讨论
请举例说明体系和环境。
内能:物质的各种能量的总和称为内能。
想一想:如果是静止不动的物质,它具有能量吗?
冰块温度虽然低,但其内部的分子都在做无规则运动;燃烧的火,温度很高,分子运动更剧烈。
物质内部除了有分子运动产生的能量外,还有其他形式的能量。
内能的普遍性:一切物质皆有内能。
想一想:内能受哪些因素的影响?
内能的影响因素:
内能受温度、压强、物质的聚集状态和组成的影响。
内能的绝对值无法直接测得,但内能的变化可以通过变化过程中体系吸收(或放出)的热对内(或外)所做的功的形式表现出来。
焓是与内能有关的物理量。用符号H表示。
焓的数值的变化称为焓变。用符号ΔH表示。
化学变化既有物质变化,又有能量变化。
能量的转换以发生化学反应的物质为基础,遵循能量守恒定律。
化学反应中能量变化的应用
一、反应热 焓变
1、定义:
2、符号:△H
3、单位:kJ·mol-1或 kJ/mol
在恒温、恒压时的反应热又称为“焓变”。
化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热.
二、放热反应和吸热反应
类型
定义
形成原因
图示
反应热
有热量放出的化学反应
吸收热量的化学反应
∑ E反> ∑ E生
∑ E反< ∑ E生
△H取负值(△H<0)
△H取正值( △H>0)
△H= ∑ E生- ∑ E反
放热反应
吸热反应
常见的放热反应和吸热反应
1.所有的燃烧、爆炸反应
放热反应
吸热反应
1.氢氧化钡与氯化铵晶体的反应
CaO + H2O === Ca(OH)2
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 ↑ +10H2O
H+ +OH- === H2O
2Al + Fe2O3 ===== Al2O3 + 2Fe
高温
高温
2.C(s) + CO2(g) === 2CO(g)
4.大多数分解反应
高温
3. C(s) + H2O(g) ==== CO(g) + H2(g)
2.金属与酸或水的反应
3.酸碱中和反应
4.大多数化合反应
5.铝热反应
5.所有的电离过程
6.所有的水解反应
加热后才能发生的化学反应不一定是吸热反应;
吸热反应不一定要加热才能发生。
△H的计算
1. △H= ∑ E生- ∑ E反
△H=断键吸收的能量-成键释放的能量
化学反应中化学键的断裂和形成是反应过程中能量
变化的本质原因
反应物断键所吸收的总能量 < 生成物成键放出的总能量
反应物断键所吸收的总能量 > 生成物成键放出的总能量
放热反应
吸热反应
一般来说,物质能量越低,越稳定,键能越大。
△H=反应物的总键能-生成物的总键能
1、下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着能量的变化
B、放热反应不需要加热即可发生
C、需要加热条件的化学反应都是吸热反应
D、化学反应是吸热还是放热决定于生成物具有总能量和反应物具有总能量
E、分解反应肯定是吸热反应
F、可燃物的燃烧放出热量
G、一个具体的化学反应不是吸热反应就是放热反应
BCE
2、下列变化属于放热反应的有 .
属于吸热反应的有 .
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④烧碱加入水中
⑤氯酸钾分解制氧气 ⑥铝热反应
⑦点燃的镁条继续在CO2中继续燃烧
⑧生石灰跟水反应生成熟石灰
⑨Ba(OH)2·8H2O和NH4Cl的反应
⑩ C与CO2的反应
⑥⑦⑧
②⑤⑨⑩
请观察下列表示氢气在氧气中燃烧生成水的反应热效应的化学方程式,分析其在书写上与化学方程式有何不同。
P3交流与讨论
2H2(g)+ O2(g)=2H2O(g) △H=-483.6KJ/mol
H2(g)+1/2 O2(g)=H2O(l) △H=-285.8KJ/mol
2H2(g)+ O2(g)=2H2O(l) △H=-571.6KJ/mol
H2(g)+1/2 O2(g)=H2O(g) △H=-241.8KJ/mol
三、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式叫热化学方程式。
如:C(s)+O2(g)==CO2(g) △H=-393.6kJ mol-1
3.书写注意事项:
(1)注明温度压强,绝大多数298k,101.3kPa 可不注明
(4)△H的符号、单位、数值
(放热ΔH为“-”,吸热ΔH为“+”;ΔH的单位:kJ·mol-1 (kJ/mol);数值要与方程式的化学计量数相对应)
(3)化学计量数不表示分子个数,只表示物质的量,可为整数或者简单分数
(2)注明聚集状态(s , l , g , aq),不标“↑”或“↓”
2.表示意义:
1molC与1mol O2完全反应,生成1molCO2气体,放出393.6kJ热量
(5)逆向反应△H符号相反,数值不变;可逆反应中△H是指完全反应时的焓变。
(1)N2H4(l)+O2(g)=N2(g)+ 2H2O(g)
ΔH= -622.08kJ·mol-1
X
(2)N2H4(l)+O2(g)=N2(g)+ 2H2O(l)
ΔH=622.08kJ·mol-1
(3)N2H4(l)+O2(g)=N2(g)+ 2H2O(l)
ΔH=-622.08kJ·mol-1
X
(5) N2H4(l)+ O2(g)= N2(g)+ H2O(l)
ΔH=-311.04kJ·mol-1
X
(1)N2H4+O2=N2+ 2H2O ΔH=-622.08kJ·mol-1
[P3交流与讨论] 判断下列热化学方程式是否正确
[P5问题解决]写出下列反应的热化学方程式:
1、N2 (g)与H2 (g)反应生成1molNH3 (g) ,放出46.1KJ热量。
2、1molC2H5OH (l)完全 燃烧生成CO2 (g) 和H2O (l) ,放出1366.8KJ热量。
3、标况下,44.8LC2H2 (g)在O2 (g)中完全燃烧生成CO2 (g)和H2O (l) ,放出2599.2KJ热量
4、24gC(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收262.6KJ热量。
N2(g)+3/2 H2(g)=NH3( g ) ΔH=-46.1kJ·mol-1
C2H5OH (l) + 3O2(g)= 2CO2(g) +3H2O(l) △H= - 1366.8KJ·mol -1
2C2H2(g)+5O2(g)=4CO2(g) +2H2O(l) △H= - 2599.2kJ·mol -1
C( S,石墨) + H2O (g)= CO (g) + H2(g) △H =+131.3kJ·mol -1
[P5问题解决]
已知断裂1mol H2 (g)中的H-H键需消耗436kJ 的能量,断裂1mol O2 (g)中的共价键需要吸收498kJ的能量, 生成H2O (g)中的1mol H-O键能够放出463kJ的能量。试写出O2 (g)与H2 (g)反应生成H2O (g)的热化学方程式。
2H2(g) + O2(g) === 2H2O(g) △H=- 482 KJ/mol
共价键 H-H N≡N H-N
键能/kJ·mol-1 436 946 391
写出合成氨反应的热化学方程式。
N2(g) + 3H2(g) 2NH3 (g) △H=- 92KJ mol-1
该热化学方程式的表示意义?
3、热化学方程式表示的意义
1)表示什么物质参加反应,结果生成什么物质
2)反应物和生成物之间的质量比、物质的量比
3)反应物完全变成生成物后所放出或吸收的热量。
质→量→能
H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol
在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A.H2(g)+Cl2(g)=2HCl(g); △H1=-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g); △H2=-Q2
B.C(s)+1/2O2(g)=CO (g); △H1=-Q1
C(s)+O2(g)=CO2 (g); △H2=-Q2
C.2H2(g)+O2(g)=2H2O(l); △H1=-Q1
2H2(g)+O2(g)=2H2O(g); △H2=-Q2
B
已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、a
C
H+(aq)+OH-(aq)=H2O(l) △H= -57.3 kJ/mol
(1)定义:在稀溶液中,酸和碱发生中和反应而生成1mol水时放出的热量。
(2)实质:
1、中和热
H++OH-=H2O
强酸与强碱的稀溶液发生中和反应生成1mol水,放出的热量为57.3KJ
四、 反应热的测定
注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热量小于57.3KJ
2、中和热的测定
⑴实验药品:
⑵实验仪器:
50ml 0.50mol∕L的 HCl ,
50ml 0.50mol∕L的 NaOH
简易量热计
⑶实验原理
Q = cmΔt
Q: 中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。比热容(单位质量的物质升高1℃所需吸收的热量)
Δt:反应前后溶液温度的差值。
= C×(m酸+ m碱)×(t3- )
= 4.18J/(g·℃)×(50g+ 50g)×(t3- ) ℃
= 418×(t3- ) J
= 0.418×(t3- ) KJ
是中和热吗?
大烧杯(500 mL)
小烧杯(100 mL)
温度计
泡沫塑料或纸条
泡沫塑料板或硬纸板(中心有两个小孔)
环形玻璃搅拌棒
保温隔热、
减少热量损失
(4)实验步骤:
组装量热器
能否用环形铜丝搅拌棒?
①用量筒最取50 mL 0.50 mol/L盐酸,倒入简易量热计中,测量并记录盐酸的温度(t1)。
然后把温度计上的酸用水冲洗干净。
②用另一量筒量取50 mL 0.50 mol/L NaOH溶液,并测量并记录NaOH溶液的温度(t2)。
不冲洗,温度计上的酸会和碱发生中和反应而使热量散失
③将量筒中的NaOH溶液迅速倒入盛有HCl的简易量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,观察温度计的温度变化,准确读出并记录反应体系的最高温度(t3)。
温度 实验次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
HCl NaOH 平均值
1 24.4 25.0 26.5
2 22.0 22.4 25.6
3 25.0 25.2 28.4
1.8
3.4
3.3
④重复实验三次,取测量所得数据的平均值作为计算依据。
24.7
22.2
25.1
×
×
1.量取溶液的体积有误差。
2.温度计的读数有误差。
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢,导致实验误差。
5.隔热操作不到位,致使实验过程中热量损失而导致误差。
6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。
(4)误差分析
1、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么?
可以保证盐酸完全反应,使测得的热量更加准确。
2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小
关系为 。
△H1> △H3 > △H2
弱酸和弱碱电离时吸热,使测得中和热的数值偏低。
浓硫酸稀释放热,使测得中和热的数值偏高。
1、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
变小
变小
变小
3、为了减小误差。某同学在实验中两次测定中和热。第一次是用50 mL 0.50 mol/L的盐酸和50 mL 0.50 mol/L氢氧化钠,第二次是用100 mL 0.50 mol/L的盐酸和100 mL 0.50mol/L的NaOH溶液。请你预测该同学两次反应放出的热量 ,测得的中和热结果 (相等或者不相等)。
相等
不相等
强酸与强碱的稀溶液的中和热:△H=-57.3KJ/mol
讨论:如何测出这个反应的反应热:
C(s)+1/2O2(g)==CO(g) ;ΔH1=
不管化学反应是一步完成或分几步完成,其反应热是相同的。
化学反应的焓变( ΔH)只与反应体系的始态和终态有关,而与反应的途径无关。
五、盖斯定律
ΔH、ΔH1、ΔH2之间有何关系?
ΔH=ΔH1+ΔH2
ΔH
A
C
ΔH1
B
ΔH2
①C(s)+1/2O2(g)==CO(g) ΔH1=
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以, ΔH1 =ΔH3- ΔH2 =-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol
讨论:如何测出这个反应的反应热:
C(s)+1/2O2(g)==CO(g) ;ΔH1=
【观察与思考】
(2)H2(g)+1/2 O2(g)=H2O(l) △H2=-285.8KJ/mol
(1)H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8KJ/mol
① - ② 得 H2O(l) = H2O(g) (3)
△H3=△H1-△H2= + 44KJ/mol
(1) 若一个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的ΔH也可以由这几个反应的的焓变相加减而得到。
(2)若一个反应的 ΔH= a kJ/mol,则其逆反应的 ΔH= - a kJ/mol。
盖斯定律的应用
根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变:
C(石墨)+O2(g)=CO2(g) △H1=-393.5KJ/mol ①
2H2(g)+O2(g)=2H2O(l) △H2=-571.6KJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599.2KJ/mol ③
[P9问题解决]
① ×2 + ② ×1/2 -③×1/2 得
2C(石墨)+ H2(g) = C2H2(g)
△H = △H1 ×2 + △H2 ×1/2 - △H3 ×1/2
△H = +226.8KJ/mol
同温同压下,比较Q1与Q2 、 △H1与△H2的大小
S(g)+O2(g) == SO2(g) △H1= - Q1 (1)
S(s)+O2(g) == SO2(g) △H2= - Q2 (2)
Q1>Q2 △H1 < △H2
H2(g) + 1/2O2(g) == H2O(g) △H1= - Q1 (1)
H2(g) + 1/2O2(g) == H2O(l) △H2= - Q2 (2)
Q1 < Q2 △H1 > △H2
- (2)得 H2O(l) == H2O(g) △H3 = △H1 - △H2
=- Q1 + Q2 > 0
(1) - (2)得 S(g) == S(s) △H3 = △H1 - △H2
=- Q1 + Q2 < 0
不同生产水平的社会中
人均消耗的能量
原始社会
早期的农业社会
8×103 kJ/天
5×104 kJ/天
【你知道吗】
你平均每天要消耗多少能量?
简单机械工业社会
3×105 kJ/D(天)
现代信息社会
1×106 kJ/D(天)
传统能源:化石燃料
新能源:太阳能、核能、生物质能、地热能、海洋能、氢能、潮汐能等。
一次能源:
化石燃料、太阳能、风能、核能、生物质能、海洋能、潮汐能等
二次能源:电力、氢能
新能源的特点:
资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
不可再生能源
你所了解的传统能源有哪些? 新能源又有哪些?
能源又可以分为一次能源和二次能源。一次能源是指直接取自自然界,没有加工转换的各种能量和资源;二次能源是指由一次能源经过加工转换后得到的能源。
1、定义:在101kPa时,lmol物质完全燃烧的反应热,叫做该物质的标准燃烧热。
C→CO2(g) H→H2O(l)
S→SO2(g) N→N2(g)
一、标准燃烧热
二、热值
1、定义:在101kPa时,l g 物质完全燃烧的反应热
2、单位:KJ/g
2、符号:△H
3、单位:KJ/mol
标准燃烧热和中和热的区别与联系
1mol反应物完全燃烧时放出的热量;不同反应物,标准燃烧热不同。
生成1mol水时放出的热量;强酸与强碱的中和热都约为57.3kJ/mol 。
标准燃烧热
中和热
相同点
不同点
能量变化
H
标准
含义
放热反应
H<0;单位:kJ/mol
1mol可燃物
生成1mol水
1、下列各组物质的标准燃烧热相等的是( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素
B
H2(g)+1/2O2(g)=H2O(l); = -285.8 kJ/mol
H
H2(g)+1/2O2(g)=H2O(g); = -241.8 kJ/mol
H
2H2(g)+O2(g)=2H2O(g); = -483.6 kJ/mol
H
2H2(g)+O2(g)=2H2O(l); = -571.6 kJ/mol
H
2、已知热化学方程式:
则氢气的标准燃烧热为:________
-285.8 kJ/mol
3、下列有关燃烧热的说法是否正确的?
⑴150kPa时,1molC完全燃烧,放出的热量为C的燃烧热
⑵101kPa时,1molC燃烧生成CO时,放出的热量为C的燃烧热
⑶101kPa时,4gH2燃烧生成液态水时,放出的热量为H2的燃烧热
×
×
×
4、4.0 g硫粉在O2中完全燃烧,放出37 kJ热量,计算S的燃烧热。
5、已知:辛烷的燃烧热为5518KJ/mol,写出表示辛烷燃烧热的热化学反应方程式。
C8`H18(l) + 25/2 O2(g)== 8 CO2(g) + 9H2O (l)
△H=-5518KJ/mol
注意:书写表示燃烧热的热化学方程式时,要以1mol可燃物为标准来配平。
△H=-37×32/4= -296 (KJ/mol)
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。C+H2O=CO+H2
已知:C(s)+O2(g)=CO2(g) △H1=-393.5KJ/mol
H2(g)+1/2O2(g)=H2O(g) △H2=-241.8KJ/mol
CO(g)+1/2O2(g)=CO2(g) △H3=-283.0KJ/mol
甲同学认为:“煤燃烧时加少量的水,可以使煤炭燃烧放出更多的热量。”
乙同学认为:“将煤转化为水煤气再燃烧放出的热量与直接燃烧煤放出的热量一样,而将煤转化为水煤气会增加消耗,因此,将煤转化为水煤气得不偿失。”
你认为他们说得有道理吗?
[P10 交流与讨论]
[思考1]在许多场合将煤块直接燃烧,这种燃烧方式存在什么缺陷?
1、煤的燃烧热虽高但煤与空气接触面积不够,内部煤的燃烧效率低
2、直接燃烧会使其中含硫转化成二氧化硫。引起大气污染
[思考2]那如何提高煤燃烧效率的方法?你认为“交流与讨论”中的观点怎样?
提高煤转化率:
1、做成蜂窝状,增大接触面积。
2、煤的液化
3、煤的汽化
煤转化为水煤气与直接获得的能量是一样的,将煤转化成水煤气增加耗能。但提高了燃烧效率除去了硫,避免了二氧化硫污染大气
使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
节约能源的重要措施:
科学地控制燃烧反应,使燃料充分燃烧,提高能源的利用率。
资料卡
通过降低反应温度的节能措施——P11阅读材料
作业:
课课练
人有了知识,就会具备各种分析能力,
明辨是非的能力。
所以我们要勤恳读书,广泛阅读,
古人说“书中自有黄金屋。
”通过阅读科技书籍,我们能丰富知识,
培养逻辑思维能力;
通过阅读文学作品,我们能提高文学鉴赏水平,
培养文学情趣;
通过阅读报刊,我们能增长见识,扩大自己的知识面。
有许多书籍还能培养我们的道德情操,
给我们巨大的精神力量,
鼓舞我们前进。
