8.3 酸和碱的反应同步练习-2021-2022学年九年级化学科粤版(2012)下册(word版 含解析)
文档属性
| 名称 | 8.3 酸和碱的反应同步练习-2021-2022学年九年级化学科粤版(2012)下册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 149.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-24 14:20:18 | ||
图片预览



文档简介
8.3 酸和碱的反应2021~2022学年九年级化学同步练习(科粤版2012)
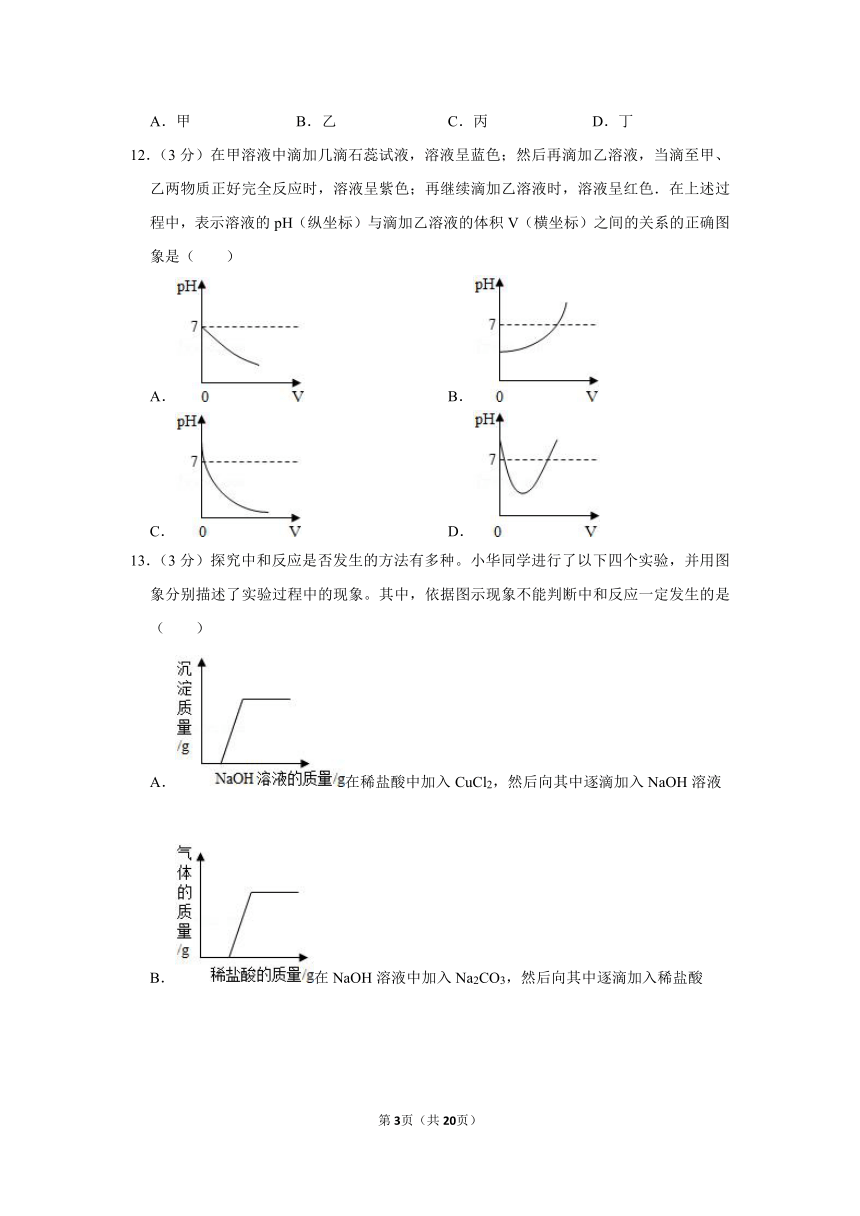
一、选择题(共6小题,每小题3分,满分18分)
1.(3分)将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )
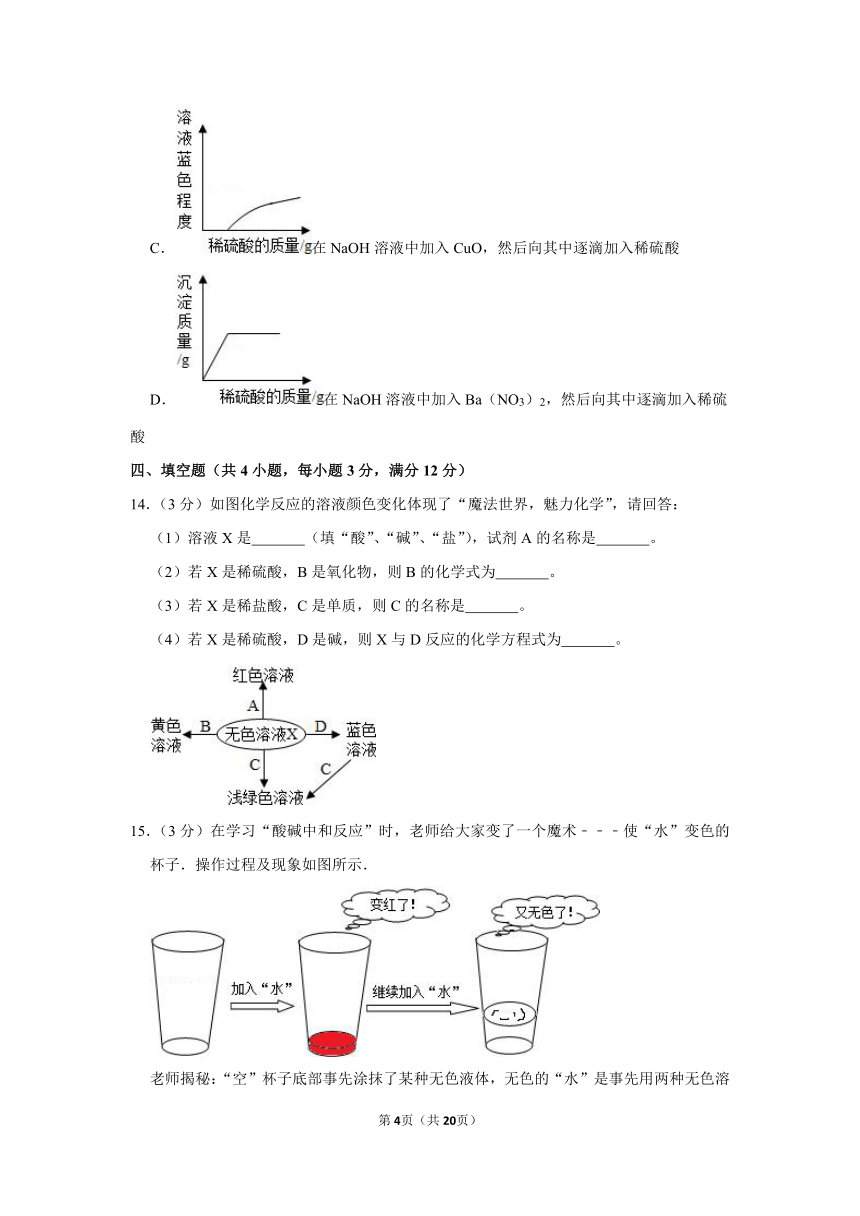
A.6 B.8 C.11 D.14
2.(3分)下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数
D.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数
3.(3分)下列物质溶于水,所得溶液的pH大于7的是( )
A.CO2 B.HCl C.NaCl D.Ca(OH)2
4.(3分)向pH=11的溶液中滴加石蕊试剂,溶液呈( )
A.无色 B.紫色 C.红色 D.蓝色
5.(3分)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液 C.稀醋酸 D.KNO3溶液
6.(3分)小烧杯中盛有含石蕊的氢氧化钠溶液。逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )
A.紫色﹣﹣红色﹣﹣蓝色 B.蓝色﹣﹣紫色﹣﹣红色
C.蓝色﹣﹣红色﹣﹣紫色 D.紫色﹣﹣蓝色﹣﹣红色
二、填空题(共1小题,每小题3分,满分3分)
7.(3分)(1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成 色,pH 7(填“>”、“<”或“=”),逐滴向锥形瓶中滴入盐酸并振荡,观察到的现象是 ,溶液的pH (填“增大”或“减小”).
(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用 的方法.
三、选择题(共6小题,每小题3分,满分18分)
8.(3分)向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的( )
A.Mg B.H2O C.NaOH D.CaCO3
9.(3分)在A+B→盐+水的反应中,A和B不可能是( )
A.HCl和NaOH B.CO2 和NaOH
C.H2SO4和Fe2O3 D.H2SO4 和BaCl2
10.(3分)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.A点时的溶液能使酚酞试液变红
D.C点时,溶液中的溶质只有氯化钠
11.(3分)如图Ⅰ中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图Ⅱ所示变化关系的是( )
A.甲 B.乙 C.丙 D.丁
12.(3分)在甲溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加乙溶液,当滴至甲、乙两物质正好完全反应时,溶液呈紫色;再继续滴加乙溶液时,溶液呈红色.在上述过程中,表示溶液的pH(纵坐标)与滴加乙溶液的体积V(横坐标)之间的关系的正确图象是( )
A. B.
C. D.
13.(3分)探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图象分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )
A.在稀盐酸中加入CuCl2,然后向其中逐滴加入NaOH溶液
B.在NaOH溶液中加入Na2CO3,然后向其中逐滴加入稀盐酸
C.在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D.在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
四、填空题(共4小题,每小题3分,满分12分)
14.(3分)如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是 (填“酸”、“碱”、“盐”),试剂A的名称是 。
(2)若X是稀硫酸,B是氧化物,则B的化学式为 。
(3)若X是稀盐酸,C是单质,则C的名称是 。
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为 。
15.(3分)在学习“酸碱中和反应”时,老师给大家变了一个魔术﹣﹣﹣使“水”变色的杯子.操作过程及现象如图所示.
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成.请回答下列问题:
(1)“空”杯内涂抹的物质可能是 .
(2)此过程中发生反应的化学方程式可能是 .
(3)最终溶液为无色,能否说明该溶液一定呈中性? (选填“能”或“不能”),理由是 .
16.(3分)某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是 ,理由是 。
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究。
实验方案 测溶液的pH 滴加Na2CO3溶液 滴加BaCl2溶液
实验操作
实验现象 试纸变色,对比比色卡,pH<7 产生白色沉淀
实验结论 溶液中有H2SO4 溶液中有H2SO4 溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是 ;
②实验方案中也有一个是错误的,错误的原因是 。
17.(3分)用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(1)该实验是将 (选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.
(2)当加入溶液的质量a为20g时,求所得溶液中溶质的质量.
科粤版九年级下册《8.3 酸和碱的反应》2021年同步练习卷(2)
参考答案与试题解析
一、选择题(共6小题,每小题3分,满分18分)
1.(3分)将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )
A.6 B.8 C.11 D.14
【分析】pH=10的溶液为碱性溶液,加水稀释,溶液的碱性随加水量而减弱,pH也就随之减小。溶液逐渐接近中性,但溶液始终为碱性溶液,即溶液的pH无限接近7但永远不能到达7,故加水稀释后,所得溶液的pH值应大于7小于10才有可能;
【解答】解:A、pH=10的氢氧化钠溶液加水稀释,稀释后碱性减弱PH减小,但溶液始终为碱性溶液,即溶液的pH无限接近7但永远不能到达7或小于7;故错
B、加水稀释后,所得溶液的pH值应大于7小于10;故对
C、pH=10的溶液,加水稀释,溶液的碱性随加水量而减弱稀释后pH值应小于10;故错
D、pH=10的溶液,加水稀释,溶液的碱性随加水量而减弱稀释后pH值应小于10;故错
故选:B。
【点评】溶液加水稀释时,溶液的酸碱性会随着稀释而减弱,但不会使酸碱性变成中性,更不可能使酸性变为碱性或碱性变为酸性。
2.(3分)下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数
D.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数
【分析】测定pH最简单的方法是使用pH试纸,测定时,用玻璃棒蘸取待测溶液,滴在pH试纸上,然后再与标准比色卡对照,便可测出溶液的pH.
【解答】解:A、将pH试纸投入待测液,会污染试剂,故选项说法错误。
B、用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数,故选项说法正确。
C、不能用蒸馏水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,故选项说法错误。
D、用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数,会由于溶液的蒸发使测定结果不准确,故选项说法错误。
故选:B。
【点评】本题难度不大,考查pH试纸的使用方法,掌握正确的测定溶液pH的操作方法是正确解答此类题的关键.
3.(3分)下列物质溶于水,所得溶液的pH大于7的是( )
A.CO2 B.HCl C.NaCl D.Ca(OH)2
【分析】当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此结合常见化学物质的酸碱性进行分析判断即可.
【解答】解:A、CO2与水反应生成碳酸,碳酸显酸性,pH小于7,故选项错误。
B、HCl溶于水形成盐酸,盐酸显酸性,pH小于7,故选项错误。
C、NaCl溶于水形成氯化钠溶液,氯化钠溶液显中性,pH等小于7,故选项错误。
D、Ca(OH)2溶于水形成氢氧化钙溶液,氢氧化钙溶液显碱性,pH等大于7,故选项正确。
故选:D。
【点评】本题难度不大,掌握常见化学物质的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键.
4.(3分)向pH=11的溶液中滴加石蕊试剂,溶液呈( )
A.无色 B.紫色 C.红色 D.蓝色
【分析】可以根据石蕊的变色情况以及溶液的pH值和溶液的酸碱性之间的关系分析解答.
【解答】解:酸性溶液可使石蕊变红,碱性溶液可使石蕊变蓝;pH=11,说明溶液显碱性,所以向pH=11的溶液中滴加石蕊试剂,溶液呈蓝色;
故选:D。
【点评】了解相关知识即可正确解答:石蕊的变色情况是“酸红碱蓝中不变”;pH<7的溶液显酸性,pH>7的溶液显碱性,pH=7的溶液是中性.
5.(3分)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液 C.稀醋酸 D.KNO3溶液
【分析】将含有盐酸的废水由酸性调至中性,也就是除去盐酸,利用酸的化学性质进行分析判断即可.
【解答】解:A、AgNO3溶液与盐酸反应生成氯化银沉淀和硝酸,反应后废水仍显酸性,不能将废水调至中性。
B、NaOH溶液与盐酸反应生成氯化钠和水,生成的氯化钠溶液显中性,能将废水调至中性。
C、稀醋酸显酸性,加入稀醋酸后废水仍显酸性,不能将废水调至中性。
D、KNO3溶液显中性,加入KNO3溶液后废水仍显酸性,不能将废水调至中性。
综上所分析:只有B选项符合要求。
故选:B。
【点评】本题难度不大,理解题意(排放前加入的试剂能将废水调至中性)、掌握酸的化学性质是正确解答本题的关键.
6.(3分)小烧杯中盛有含石蕊的氢氧化钠溶液。逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )
A.紫色﹣﹣红色﹣﹣蓝色 B.蓝色﹣﹣紫色﹣﹣红色
C.蓝色﹣﹣红色﹣﹣紫色 D.紫色﹣﹣蓝色﹣﹣红色
【分析】根据石蕊遇碱变蓝色,遇到强酸强碱盐显紫色,遇酸变红色进行分析。
【解答】解:石蕊在氢氧化钠溶液中显蓝色,加入盐酸刚好反应时,溶液呈现中性,石蕊显紫色,盐酸过量后,显酸性,石蕊变红色。
故选:B。
【点评】本体主要考查了酸碱指示剂在酸碱盐中的变色情况,要加以理解记忆。
二、填空题(共1小题,每小题3分,满分3分)
7.(3分)(1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成 红 色,pH > 7(填“>”、“<”或“=”),逐滴向锥形瓶中滴入盐酸并振荡,观察到的现象是 溶液由红色变为无色 ,溶液的pH 减小 (填“增大”或“减小”).
(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用 加水或加入氢氧化钠溶液 的方法.
【分析】根据已有的知识进行分析,酚酞试液遇碱性溶液变红,在酸性或中性溶液中为无色,氢氧化钠能与盐酸发生化学反应,碱性溶液的pH大于7,酸性溶液的pH小于7,要使酸性溶液的pH增大,可以使用加水稀释或加入碱性物质与酸反应的方法.
【解答】解:(1)氢氧化钠溶液呈碱性,能使酚酞试液变红,碱性溶液的pH大于7,加入盐酸,则盐酸能与氢氧化钠反应而使碱性消失,酚酞在酸性或中性溶液中为无色,故会看到溶液由红色逐渐变为无色,碱性逐渐消失,则溶液的pH减小,故答案为:红,>,溶液由红色变为无色,减小;
(2)酸性溶液越稀,则pH越大,可以加水使pH增大,也可以加入碱性物质与盐酸反应的方法,故答案为:加水或加入氢氧化钠溶液.
【点评】解:本题考查了碱的性质,完成此题,可以依据已有的知识进行.
三、选择题(共6小题,每小题3分,满分18分)
8.(3分)向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的( )
A.Mg B.H2O C.NaOH D.CaCO3
【分析】稀盐酸呈酸性,通过图中信息可以知道溶液的pH值增大,最后溶液呈碱性,所以可以判断向稀盐酸中加入的为碱性物质,可以据此解答。
【解答】解:A、镁为活泼金属可以消耗盐酸,而使溶液的pH值增大,但是溶液的pH值不会大于7,故A错误;
B、水为中性物质,可以减低稀盐酸的酸性,但是溶液始终呈酸性,故B错误;
C、氢氧化钠为碱,可以和稀盐酸反应,而使溶液的酸性减弱,当恰好完全反应时溶液的pH值为7,继续加入氢氧化钠则溶液呈碱性,而使pH值大于7,故C正确;
D、碳酸钙可以消耗盐酸,而使溶液的pH值增大,但是不能大于7,故D错误。
故选:C。
【点评】要想解答好这类题目,首先要理解和熟记溶液的酸碱性与pH值的关系等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,细心地探究、推理后,按照题目要求对症下药,进行认真地选择或解答即可。
9.(3分)在A+B→盐+水的反应中,A和B不可能是( )
A.HCl和NaOH B.CO2 和NaOH
C.H2SO4和Fe2O3 D.H2SO4 和BaCl2
【分析】根据所学物质的性质来解答该题,其中能够生成盐和水的反应通常为:金属氧化物和酸的反应、部分非金属氧化物和碱的反应以及酸碱中和反应,可以据此解答该题。
【解答】解:A、HCl和NaOH属于中和反应,能够生成盐和水,故A不符合题意;
B、二氧化碳和氢氧化钠反应生成了碳酸钠和水,其中碳酸钠为盐类,故B不符合题意;
C、硫酸和氧化铁反应生成了硫酸铁和水,其中硫酸铁为盐类,故C不符合题意;
D、硫酸和氯化钡反应生成了硫酸钡沉淀和盐酸,故D符合题意。
故选:D。
【点评】熟练掌握酸碱盐的化学性质,该考点命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对酸碱盐的化学性质的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力。并且经常将其与酸碱指示剂及其性质、金属的化学性质、酸的用途、中和反应等相结合进行考查。
10.(3分)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.A点时的溶液能使酚酞试液变红
D.C点时,溶液中的溶质只有氯化钠
【分析】氢氧化钠溶液呈碱性,其pH大于7,盐酸呈酸性,其pH小于7,氢氧化钠溶液和盐酸可以发生中和反应,恰好完全反应时其pH等于7,氢氧化钠过量时显碱性,盐酸过量时显酸性。
【解答】解:A、根据图象可以看出,开始时溶液的pH大于7,溶液呈碱性,故是向氢氧化钠溶液中加入稀盐酸,故A错误;
B、B点对应的pH等于7,表明氢氧化钠溶液和稀盐酸恰好完全反应,故B正确;
C、从图象可以看出,A点溶液呈碱性,酚酞试液在碱性溶液中显红色,故C说法正确;
D、C点的pH继续减小,说明酸还没有完全反应,故溶液中含有氯化氢溶质,故D错误,
故选:BC。
【点评】本题以图象的形式考查了酸碱中和反应过程中溶液pH的变化,完成此题,要抓住曲线变化的趋势和关键点的意义。
11.(3分)如图Ⅰ中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图Ⅱ所示变化关系的是( )
A.甲 B.乙 C.丙 D.丁
【分析】根据两物质相互混合过程中溶液酸碱度的变化,图象中pH值的变化是从大于7逐渐的减小到小于7,进行分析判断.
【解答】解:图象中pH值的变化是从大于7逐渐的减小到小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把酸性溶液滴加到碱性溶液中。
A、碳酸钠与水混合,不是将把酸性溶液滴加到碱性溶液中,故选项错误。
B、碳酸钠与氢氧化钙反应,不是将把酸性溶液滴加到碱性溶液中,故选项错误。
C、硫酸与水混合,不是将把酸性溶液滴加到碱性溶液中,故选项错误。
D、硫酸与氢氧化钙反应生成硫酸钙和水,是将把酸性溶液滴加到碱性溶液中,故选项正确。
故选:D。
【点评】本题难度不是很大,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解化学反应是正确解答本题的关键.
12.(3分)在甲溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加乙溶液,当滴至甲、乙两物质正好完全反应时,溶液呈紫色;再继续滴加乙溶液时,溶液呈红色.在上述过程中,表示溶液的pH(纵坐标)与滴加乙溶液的体积V(横坐标)之间的关系的正确图象是( )
A. B.
C. D.
【分析】利用PH值与溶液酸碱性的关系,并结合中和反应的知识解决,抓住滴加前与恰好反应后两个关键段进行选择即可.
【解答】解:石蕊遇碱变蓝,遇酸变红。故滴加前是碱的溶液PH>7,即A、B不正确;恰好反应后碱被中和掉,溶液呈中性PH=7,继续滴加变红说明酸过量PH<7,随着滴加酸性越来越强,PH值越来越小。
故选:C。
【点评】此题考查了溶液酸碱性与PH的关系,通过图象的方式反映了酸碱中和的过程,是一道指示剂与酸碱溶液反应的新题与好题.
13.(3分)探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图象分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )
A.在稀盐酸中加入CuCl2,然后向其中逐滴加入NaOH溶液
B.在NaOH溶液中加入Na2CO3,然后向其中逐滴加入稀盐酸
C.在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D.在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
【分析】本题选项都是对两种溶液放入酸进行的设计,分析四个选项可以看出它们放入酸时,先要发生中和反应,再进行其它反应同时出现现象,判断是否发生中和反应则是看图象一开始是否有一段体现了中和反应的发生过程,即没有现象发生的一段图象纵坐标为零,而后对各选项的反应的具体分析找到解决此问题的突破口。
【解答】解:A、在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液,开始是先与盐酸反应,再与氯化铜反应生成沉淀,开始一段无沉淀就是中和反应的过程,故A正确;
B、在NaOH溶液中加入Na2CO3,然后向其中逐滴加入稀盐酸,开始是先与氢氧化钠反应无气体,气体为零,故B正确;
C、在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸,开始是与氢氧化钠反应无硫酸铜生成,溶液不变蓝,故C正确;
D、在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸,开始反应时硫酸根离子与钡离子结合会生成硫酸钡沉淀,即使是沉淀完成后氢氧化钠与硫酸不反应的现象也是该图象的情况,故D错误。
故选:D。
【点评】本题是对化学反应及图象的考查,解题的重点是能正确的分析变化的过程,读懂图象并与反应相结合是解题的关键所在,是一道训练学生分析问题能力的习题。
四、填空题(共4小题,每小题3分,满分12分)
14.(3分)如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是 酸 (填“酸”、“碱”、“盐”),试剂A的名称是 紫色石蕊试液 。
(2)若X是稀硫酸,B是氧化物,则B的化学式为 Fe2O3 。
(3)若X是稀盐酸,C是单质,则C的名称是 铁 。
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为 H2SO4+Cu(OH)2═CuSO4+2H2O 。
【分析】根据图框的信息及所学知识,可知黄色溶液应该是铁盐的溶液,浅绿色的溶液应该是亚铁盐的溶液,蓝色溶液应该是铜盐的溶液,那么无色溶液就应该是酸的溶液,从而可以得出,紫色石蕊遇酸变红色,故A为紫色石蕊,B为氧化铁,C为铁,D为氢氧化铜,同时蓝色溶液可以与C反应生成浅绿色溶液,也可以验证C为铁,据此可以完成该题的解答。
【解答】解:根据分析可知黄色溶液、蓝色溶液、浅绿色溶液都是盐的溶液,能够与三种物质反应生成可溶性的且带颜色的盐的只有酸的溶液,所以X应该为酸,和酸反应生成红色溶液的就是紫色石蕊试液,故本题答案为:酸 紫色石蕊试液
(2)若X为稀硫酸,B为氧化物,它们生成的是黄色溶液,我们知道的黄色溶液应该为铁盐的溶液,所以B应该为氧化铁,故本题答案为:Fe2O3
(3)我们所学的浅绿色的溶液只有亚铁盐的溶液,当X为稀盐酸,C为单质时,那么可以知道C应该为单质铁,故本题答案为:铁
(4)我们所学的蓝色溶液只有铜盐的溶液,所以在这里和稀硫酸反应的碱应该为氢氧化铜,故本题答案为:H2SO4+Cu(OH)2═CuSO4+2H2O
【点评】本题为推断题,做这类题目关键是从题干中根据所学知识找出题眼﹣﹣﹣﹣﹣突破口,然后顺藤摸瓜理出各物质之间的反应,并判断出各物质。
15.(3分)在学习“酸碱中和反应”时,老师给大家变了一个魔术﹣﹣﹣使“水”变色的杯子.操作过程及现象如图所示.
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成.请回答下列问题:
(1)“空”杯内涂抹的物质可能是 碱溶液(如NaOH) .
(2)此过程中发生反应的化学方程式可能是 NaOH+HCl═NaCl+H2O(答案不唯一) .
(3)最终溶液为无色,能否说明该溶液一定呈中性? 不能 (选填“能”或“不能”),理由是 酚酞在酸性溶液中也呈无色 .
【分析】可从酚酞遇碱溶液变红的角度分析液体变色情况;
(1)酚酞在酸溶液中呈无色,在碱性溶液中显红色;
(2)根据酸碱中和写化学方程式,主要化学式和配平;
(3)根据酚酞在酸性溶液中呈无色判断.
【解答】解:(1)根据颜色的变化,“空”杯内涂抹的物质可能是碱溶液(如NaOH),无色的“水”是酸溶液和酚酞试液混合而成.
(2)此过程中发生反应的化学方程式可能是:NaOH+HCl═NaCl+H2O(答案不唯一).
(3)最终溶液为无色,不能说明该溶液一定呈中性,因为酚酞在酸性溶液中也呈无色,也就是说,如果溶液呈酸性,最后也是无色的.
故答案为:(1)碱溶液(如NaOH).
(2)NaOH+HCl═NaCl+H2O(答案不唯一).
(3)不能;酚酞在酸性溶液中也呈无色.
【点评】了解溶液的酸碱性,熟悉指示剂在酸碱性溶液中的变色情况是解答此类题的关键.
16.(3分)某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 H2SO4+2NaOH=Na2SO4+2H2O 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四: 有Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是 猜想三 ,理由是 H2SO4和NaOH在溶液中不能共存 。
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 NaOH 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究。
实验方案 测溶液的pH 滴加Na2CO3溶液 滴加BaCl2溶液
实验操作
实验现象 试纸变色,对比比色卡,pH<7 有气泡产生 产生白色沉淀
实验结论 溶液中有H2SO4 溶液中有H2SO4 溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是 pH试纸浸入溶液中 ;
②实验方案中也有一个是错误的,错误的原因是 Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在 。
【分析】【学生板演】硫酸和氢氧化钠反应生成硫酸钠和水,注意化学式的写法和配平;
【假设猜想】根据酸碱不能共存判断不合理的猜想;
【实验探究】根据碳酸钠和硫酸反应能生成二氧化碳气体解答;
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀。
【解答】解:【学生板演】硫酸和氢氧化钠反应生成硫酸钠和水,化学方程式为H2SO4+2NaOH═Na2SO4+2H2O;
【假设猜想】硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量,当氢氧化钠过量时,反应后溶液中的溶质为硫酸钠和氢氧化钠,故猜想三为氢氧化钠和硫酸钠,酸碱过量,但不能同时过量,因为酸碱不能共存,会继续反应,故猜想三不合理;
【实验探究】(1)硫酸铜和氢氧化钠反应能生成氢氧化铜蓝色沉淀,因此溶液中滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠。
(2)溶液中有硫酸,滴加碳酸钠后,碳酸钠会和硫酸反应生成二氧化碳气体,因此会看到产生气泡。
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸;
故答案为:【学生板演】H2SO4+2NaOH=Na2SO4+2H2O;
【假设猜想】有Na2SO4和NaOH;猜想三;H2SO4和NaOH在溶液中不能共存;
【实验探究】(1)NaOH;(2)有气泡产生;
【评价反思】①pH试纸浸入溶液中;②Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在。
【点评】此题通过中和反应考查了化学方程式的书写,实验方案设计、实验操作以及实验方案的评价,解答时要全面审题,认真解答。
17.(3分)用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(1)该实验是将 氢氧化钠溶液 (选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.
(2)当加入溶液的质量a为20g时,求所得溶液中溶质的质量.
【分析】(1)根据图象中pH值的变化是从小于7逐渐的增大到大于7,进行分析确定操作的过程.
(2)根据溶质质量=溶液质量×溶质的质量分数,列式表示出当加入氢氧化钠溶液的质量为20g时溶质的质量,进而根据化学方程式计算出所得溶液中溶质的质量即可.
【解答】解:(1)由图象可知,pH值是开始时小于7逐渐的增大到7然后大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH升高,说明是把氢氧化钠溶液滴加到稀盐酸中.故答案为:氢氧化钠溶液.
(2)设溶液中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 58.5
20g×10% x
,x=2.925g
答:所得溶液中溶质的质量为2.925g.
【点评】本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.
声明:试题解析著作权属所有,未经书面同意,不得复制发布
日期:2022/1/24 9:27:57;用户:15877047552;邮箱:15877047552;学号:38945411第2页(共3页)
一、选择题(共6小题,每小题3分,满分18分)
1.(3分)将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )
A.6 B.8 C.11 D.14
2.(3分)下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数
D.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数
3.(3分)下列物质溶于水,所得溶液的pH大于7的是( )
A.CO2 B.HCl C.NaCl D.Ca(OH)2
4.(3分)向pH=11的溶液中滴加石蕊试剂,溶液呈( )
A.无色 B.紫色 C.红色 D.蓝色
5.(3分)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液 C.稀醋酸 D.KNO3溶液
6.(3分)小烧杯中盛有含石蕊的氢氧化钠溶液。逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )
A.紫色﹣﹣红色﹣﹣蓝色 B.蓝色﹣﹣紫色﹣﹣红色
C.蓝色﹣﹣红色﹣﹣紫色 D.紫色﹣﹣蓝色﹣﹣红色
二、填空题(共1小题,每小题3分,满分3分)
7.(3分)(1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成 色,pH 7(填“>”、“<”或“=”),逐滴向锥形瓶中滴入盐酸并振荡,观察到的现象是 ,溶液的pH (填“增大”或“减小”).
(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用 的方法.
三、选择题(共6小题,每小题3分,满分18分)
8.(3分)向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的( )
A.Mg B.H2O C.NaOH D.CaCO3
9.(3分)在A+B→盐+水的反应中,A和B不可能是( )
A.HCl和NaOH B.CO2 和NaOH
C.H2SO4和Fe2O3 D.H2SO4 和BaCl2
10.(3分)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.A点时的溶液能使酚酞试液变红
D.C点时,溶液中的溶质只有氯化钠
11.(3分)如图Ⅰ中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图Ⅱ所示变化关系的是( )
A.甲 B.乙 C.丙 D.丁
12.(3分)在甲溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加乙溶液,当滴至甲、乙两物质正好完全反应时,溶液呈紫色;再继续滴加乙溶液时,溶液呈红色.在上述过程中,表示溶液的pH(纵坐标)与滴加乙溶液的体积V(横坐标)之间的关系的正确图象是( )
A. B.
C. D.
13.(3分)探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图象分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )
A.在稀盐酸中加入CuCl2,然后向其中逐滴加入NaOH溶液
B.在NaOH溶液中加入Na2CO3,然后向其中逐滴加入稀盐酸
C.在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D.在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
四、填空题(共4小题,每小题3分,满分12分)
14.(3分)如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是 (填“酸”、“碱”、“盐”),试剂A的名称是 。
(2)若X是稀硫酸,B是氧化物,则B的化学式为 。
(3)若X是稀盐酸,C是单质,则C的名称是 。
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为 。
15.(3分)在学习“酸碱中和反应”时,老师给大家变了一个魔术﹣﹣﹣使“水”变色的杯子.操作过程及现象如图所示.
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成.请回答下列问题:
(1)“空”杯内涂抹的物质可能是 .
(2)此过程中发生反应的化学方程式可能是 .
(3)最终溶液为无色,能否说明该溶液一定呈中性? (选填“能”或“不能”),理由是 .
16.(3分)某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是 ,理由是 。
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究。
实验方案 测溶液的pH 滴加Na2CO3溶液 滴加BaCl2溶液
实验操作
实验现象 试纸变色,对比比色卡,pH<7 产生白色沉淀
实验结论 溶液中有H2SO4 溶液中有H2SO4 溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是 ;
②实验方案中也有一个是错误的,错误的原因是 。
17.(3分)用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(1)该实验是将 (选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.
(2)当加入溶液的质量a为20g时,求所得溶液中溶质的质量.
科粤版九年级下册《8.3 酸和碱的反应》2021年同步练习卷(2)
参考答案与试题解析
一、选择题(共6小题,每小题3分,满分18分)
1.(3分)将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )
A.6 B.8 C.11 D.14
【分析】pH=10的溶液为碱性溶液,加水稀释,溶液的碱性随加水量而减弱,pH也就随之减小。溶液逐渐接近中性,但溶液始终为碱性溶液,即溶液的pH无限接近7但永远不能到达7,故加水稀释后,所得溶液的pH值应大于7小于10才有可能;
【解答】解:A、pH=10的氢氧化钠溶液加水稀释,稀释后碱性减弱PH减小,但溶液始终为碱性溶液,即溶液的pH无限接近7但永远不能到达7或小于7;故错
B、加水稀释后,所得溶液的pH值应大于7小于10;故对
C、pH=10的溶液,加水稀释,溶液的碱性随加水量而减弱稀释后pH值应小于10;故错
D、pH=10的溶液,加水稀释,溶液的碱性随加水量而减弱稀释后pH值应小于10;故错
故选:B。
【点评】溶液加水稀释时,溶液的酸碱性会随着稀释而减弱,但不会使酸碱性变成中性,更不可能使酸性变为碱性或碱性变为酸性。
2.(3分)下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数
D.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数
【分析】测定pH最简单的方法是使用pH试纸,测定时,用玻璃棒蘸取待测溶液,滴在pH试纸上,然后再与标准比色卡对照,便可测出溶液的pH.
【解答】解:A、将pH试纸投入待测液,会污染试剂,故选项说法错误。
B、用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数,故选项说法正确。
C、不能用蒸馏水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,故选项说法错误。
D、用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数,会由于溶液的蒸发使测定结果不准确,故选项说法错误。
故选:B。
【点评】本题难度不大,考查pH试纸的使用方法,掌握正确的测定溶液pH的操作方法是正确解答此类题的关键.
3.(3分)下列物质溶于水,所得溶液的pH大于7的是( )
A.CO2 B.HCl C.NaCl D.Ca(OH)2
【分析】当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此结合常见化学物质的酸碱性进行分析判断即可.
【解答】解:A、CO2与水反应生成碳酸,碳酸显酸性,pH小于7,故选项错误。
B、HCl溶于水形成盐酸,盐酸显酸性,pH小于7,故选项错误。
C、NaCl溶于水形成氯化钠溶液,氯化钠溶液显中性,pH等小于7,故选项错误。
D、Ca(OH)2溶于水形成氢氧化钙溶液,氢氧化钙溶液显碱性,pH等大于7,故选项正确。
故选:D。
【点评】本题难度不大,掌握常见化学物质的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键.
4.(3分)向pH=11的溶液中滴加石蕊试剂,溶液呈( )
A.无色 B.紫色 C.红色 D.蓝色
【分析】可以根据石蕊的变色情况以及溶液的pH值和溶液的酸碱性之间的关系分析解答.
【解答】解:酸性溶液可使石蕊变红,碱性溶液可使石蕊变蓝;pH=11,说明溶液显碱性,所以向pH=11的溶液中滴加石蕊试剂,溶液呈蓝色;
故选:D。
【点评】了解相关知识即可正确解答:石蕊的变色情况是“酸红碱蓝中不变”;pH<7的溶液显酸性,pH>7的溶液显碱性,pH=7的溶液是中性.
5.(3分)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液 C.稀醋酸 D.KNO3溶液
【分析】将含有盐酸的废水由酸性调至中性,也就是除去盐酸,利用酸的化学性质进行分析判断即可.
【解答】解:A、AgNO3溶液与盐酸反应生成氯化银沉淀和硝酸,反应后废水仍显酸性,不能将废水调至中性。
B、NaOH溶液与盐酸反应生成氯化钠和水,生成的氯化钠溶液显中性,能将废水调至中性。
C、稀醋酸显酸性,加入稀醋酸后废水仍显酸性,不能将废水调至中性。
D、KNO3溶液显中性,加入KNO3溶液后废水仍显酸性,不能将废水调至中性。
综上所分析:只有B选项符合要求。
故选:B。
【点评】本题难度不大,理解题意(排放前加入的试剂能将废水调至中性)、掌握酸的化学性质是正确解答本题的关键.
6.(3分)小烧杯中盛有含石蕊的氢氧化钠溶液。逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )
A.紫色﹣﹣红色﹣﹣蓝色 B.蓝色﹣﹣紫色﹣﹣红色
C.蓝色﹣﹣红色﹣﹣紫色 D.紫色﹣﹣蓝色﹣﹣红色
【分析】根据石蕊遇碱变蓝色,遇到强酸强碱盐显紫色,遇酸变红色进行分析。
【解答】解:石蕊在氢氧化钠溶液中显蓝色,加入盐酸刚好反应时,溶液呈现中性,石蕊显紫色,盐酸过量后,显酸性,石蕊变红色。
故选:B。
【点评】本体主要考查了酸碱指示剂在酸碱盐中的变色情况,要加以理解记忆。
二、填空题(共1小题,每小题3分,满分3分)
7.(3分)(1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成 红 色,pH > 7(填“>”、“<”或“=”),逐滴向锥形瓶中滴入盐酸并振荡,观察到的现象是 溶液由红色变为无色 ,溶液的pH 减小 (填“增大”或“减小”).
(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用 加水或加入氢氧化钠溶液 的方法.
【分析】根据已有的知识进行分析,酚酞试液遇碱性溶液变红,在酸性或中性溶液中为无色,氢氧化钠能与盐酸发生化学反应,碱性溶液的pH大于7,酸性溶液的pH小于7,要使酸性溶液的pH增大,可以使用加水稀释或加入碱性物质与酸反应的方法.
【解答】解:(1)氢氧化钠溶液呈碱性,能使酚酞试液变红,碱性溶液的pH大于7,加入盐酸,则盐酸能与氢氧化钠反应而使碱性消失,酚酞在酸性或中性溶液中为无色,故会看到溶液由红色逐渐变为无色,碱性逐渐消失,则溶液的pH减小,故答案为:红,>,溶液由红色变为无色,减小;
(2)酸性溶液越稀,则pH越大,可以加水使pH增大,也可以加入碱性物质与盐酸反应的方法,故答案为:加水或加入氢氧化钠溶液.
【点评】解:本题考查了碱的性质,完成此题,可以依据已有的知识进行.
三、选择题(共6小题,每小题3分,满分18分)
8.(3分)向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的( )
A.Mg B.H2O C.NaOH D.CaCO3
【分析】稀盐酸呈酸性,通过图中信息可以知道溶液的pH值增大,最后溶液呈碱性,所以可以判断向稀盐酸中加入的为碱性物质,可以据此解答。
【解答】解:A、镁为活泼金属可以消耗盐酸,而使溶液的pH值增大,但是溶液的pH值不会大于7,故A错误;
B、水为中性物质,可以减低稀盐酸的酸性,但是溶液始终呈酸性,故B错误;
C、氢氧化钠为碱,可以和稀盐酸反应,而使溶液的酸性减弱,当恰好完全反应时溶液的pH值为7,继续加入氢氧化钠则溶液呈碱性,而使pH值大于7,故C正确;
D、碳酸钙可以消耗盐酸,而使溶液的pH值增大,但是不能大于7,故D错误。
故选:C。
【点评】要想解答好这类题目,首先要理解和熟记溶液的酸碱性与pH值的关系等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,细心地探究、推理后,按照题目要求对症下药,进行认真地选择或解答即可。
9.(3分)在A+B→盐+水的反应中,A和B不可能是( )
A.HCl和NaOH B.CO2 和NaOH
C.H2SO4和Fe2O3 D.H2SO4 和BaCl2
【分析】根据所学物质的性质来解答该题,其中能够生成盐和水的反应通常为:金属氧化物和酸的反应、部分非金属氧化物和碱的反应以及酸碱中和反应,可以据此解答该题。
【解答】解:A、HCl和NaOH属于中和反应,能够生成盐和水,故A不符合题意;
B、二氧化碳和氢氧化钠反应生成了碳酸钠和水,其中碳酸钠为盐类,故B不符合题意;
C、硫酸和氧化铁反应生成了硫酸铁和水,其中硫酸铁为盐类,故C不符合题意;
D、硫酸和氯化钡反应生成了硫酸钡沉淀和盐酸,故D符合题意。
故选:D。
【点评】熟练掌握酸碱盐的化学性质,该考点命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对酸碱盐的化学性质的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力。并且经常将其与酸碱指示剂及其性质、金属的化学性质、酸的用途、中和反应等相结合进行考查。
10.(3分)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.A点时的溶液能使酚酞试液变红
D.C点时,溶液中的溶质只有氯化钠
【分析】氢氧化钠溶液呈碱性,其pH大于7,盐酸呈酸性,其pH小于7,氢氧化钠溶液和盐酸可以发生中和反应,恰好完全反应时其pH等于7,氢氧化钠过量时显碱性,盐酸过量时显酸性。
【解答】解:A、根据图象可以看出,开始时溶液的pH大于7,溶液呈碱性,故是向氢氧化钠溶液中加入稀盐酸,故A错误;
B、B点对应的pH等于7,表明氢氧化钠溶液和稀盐酸恰好完全反应,故B正确;
C、从图象可以看出,A点溶液呈碱性,酚酞试液在碱性溶液中显红色,故C说法正确;
D、C点的pH继续减小,说明酸还没有完全反应,故溶液中含有氯化氢溶质,故D错误,
故选:BC。
【点评】本题以图象的形式考查了酸碱中和反应过程中溶液pH的变化,完成此题,要抓住曲线变化的趋势和关键点的意义。
11.(3分)如图Ⅰ中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图Ⅱ所示变化关系的是( )
A.甲 B.乙 C.丙 D.丁
【分析】根据两物质相互混合过程中溶液酸碱度的变化,图象中pH值的变化是从大于7逐渐的减小到小于7,进行分析判断.
【解答】解:图象中pH值的变化是从大于7逐渐的减小到小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把酸性溶液滴加到碱性溶液中。
A、碳酸钠与水混合,不是将把酸性溶液滴加到碱性溶液中,故选项错误。
B、碳酸钠与氢氧化钙反应,不是将把酸性溶液滴加到碱性溶液中,故选项错误。
C、硫酸与水混合,不是将把酸性溶液滴加到碱性溶液中,故选项错误。
D、硫酸与氢氧化钙反应生成硫酸钙和水,是将把酸性溶液滴加到碱性溶液中,故选项正确。
故选:D。
【点评】本题难度不是很大,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解化学反应是正确解答本题的关键.
12.(3分)在甲溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加乙溶液,当滴至甲、乙两物质正好完全反应时,溶液呈紫色;再继续滴加乙溶液时,溶液呈红色.在上述过程中,表示溶液的pH(纵坐标)与滴加乙溶液的体积V(横坐标)之间的关系的正确图象是( )
A. B.
C. D.
【分析】利用PH值与溶液酸碱性的关系,并结合中和反应的知识解决,抓住滴加前与恰好反应后两个关键段进行选择即可.
【解答】解:石蕊遇碱变蓝,遇酸变红。故滴加前是碱的溶液PH>7,即A、B不正确;恰好反应后碱被中和掉,溶液呈中性PH=7,继续滴加变红说明酸过量PH<7,随着滴加酸性越来越强,PH值越来越小。
故选:C。
【点评】此题考查了溶液酸碱性与PH的关系,通过图象的方式反映了酸碱中和的过程,是一道指示剂与酸碱溶液反应的新题与好题.
13.(3分)探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图象分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )
A.在稀盐酸中加入CuCl2,然后向其中逐滴加入NaOH溶液
B.在NaOH溶液中加入Na2CO3,然后向其中逐滴加入稀盐酸
C.在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D.在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
【分析】本题选项都是对两种溶液放入酸进行的设计,分析四个选项可以看出它们放入酸时,先要发生中和反应,再进行其它反应同时出现现象,判断是否发生中和反应则是看图象一开始是否有一段体现了中和反应的发生过程,即没有现象发生的一段图象纵坐标为零,而后对各选项的反应的具体分析找到解决此问题的突破口。
【解答】解:A、在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液,开始是先与盐酸反应,再与氯化铜反应生成沉淀,开始一段无沉淀就是中和反应的过程,故A正确;
B、在NaOH溶液中加入Na2CO3,然后向其中逐滴加入稀盐酸,开始是先与氢氧化钠反应无气体,气体为零,故B正确;
C、在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸,开始是与氢氧化钠反应无硫酸铜生成,溶液不变蓝,故C正确;
D、在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸,开始反应时硫酸根离子与钡离子结合会生成硫酸钡沉淀,即使是沉淀完成后氢氧化钠与硫酸不反应的现象也是该图象的情况,故D错误。
故选:D。
【点评】本题是对化学反应及图象的考查,解题的重点是能正确的分析变化的过程,读懂图象并与反应相结合是解题的关键所在,是一道训练学生分析问题能力的习题。
四、填空题(共4小题,每小题3分,满分12分)
14.(3分)如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是 酸 (填“酸”、“碱”、“盐”),试剂A的名称是 紫色石蕊试液 。
(2)若X是稀硫酸,B是氧化物,则B的化学式为 Fe2O3 。
(3)若X是稀盐酸,C是单质,则C的名称是 铁 。
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为 H2SO4+Cu(OH)2═CuSO4+2H2O 。
【分析】根据图框的信息及所学知识,可知黄色溶液应该是铁盐的溶液,浅绿色的溶液应该是亚铁盐的溶液,蓝色溶液应该是铜盐的溶液,那么无色溶液就应该是酸的溶液,从而可以得出,紫色石蕊遇酸变红色,故A为紫色石蕊,B为氧化铁,C为铁,D为氢氧化铜,同时蓝色溶液可以与C反应生成浅绿色溶液,也可以验证C为铁,据此可以完成该题的解答。
【解答】解:根据分析可知黄色溶液、蓝色溶液、浅绿色溶液都是盐的溶液,能够与三种物质反应生成可溶性的且带颜色的盐的只有酸的溶液,所以X应该为酸,和酸反应生成红色溶液的就是紫色石蕊试液,故本题答案为:酸 紫色石蕊试液
(2)若X为稀硫酸,B为氧化物,它们生成的是黄色溶液,我们知道的黄色溶液应该为铁盐的溶液,所以B应该为氧化铁,故本题答案为:Fe2O3
(3)我们所学的浅绿色的溶液只有亚铁盐的溶液,当X为稀盐酸,C为单质时,那么可以知道C应该为单质铁,故本题答案为:铁
(4)我们所学的蓝色溶液只有铜盐的溶液,所以在这里和稀硫酸反应的碱应该为氢氧化铜,故本题答案为:H2SO4+Cu(OH)2═CuSO4+2H2O
【点评】本题为推断题,做这类题目关键是从题干中根据所学知识找出题眼﹣﹣﹣﹣﹣突破口,然后顺藤摸瓜理出各物质之间的反应,并判断出各物质。
15.(3分)在学习“酸碱中和反应”时,老师给大家变了一个魔术﹣﹣﹣使“水”变色的杯子.操作过程及现象如图所示.
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成.请回答下列问题:
(1)“空”杯内涂抹的物质可能是 碱溶液(如NaOH) .
(2)此过程中发生反应的化学方程式可能是 NaOH+HCl═NaCl+H2O(答案不唯一) .
(3)最终溶液为无色,能否说明该溶液一定呈中性? 不能 (选填“能”或“不能”),理由是 酚酞在酸性溶液中也呈无色 .
【分析】可从酚酞遇碱溶液变红的角度分析液体变色情况;
(1)酚酞在酸溶液中呈无色,在碱性溶液中显红色;
(2)根据酸碱中和写化学方程式,主要化学式和配平;
(3)根据酚酞在酸性溶液中呈无色判断.
【解答】解:(1)根据颜色的变化,“空”杯内涂抹的物质可能是碱溶液(如NaOH),无色的“水”是酸溶液和酚酞试液混合而成.
(2)此过程中发生反应的化学方程式可能是:NaOH+HCl═NaCl+H2O(答案不唯一).
(3)最终溶液为无色,不能说明该溶液一定呈中性,因为酚酞在酸性溶液中也呈无色,也就是说,如果溶液呈酸性,最后也是无色的.
故答案为:(1)碱溶液(如NaOH).
(2)NaOH+HCl═NaCl+H2O(答案不唯一).
(3)不能;酚酞在酸性溶液中也呈无色.
【点评】了解溶液的酸碱性,熟悉指示剂在酸碱性溶液中的变色情况是解答此类题的关键.
16.(3分)某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 H2SO4+2NaOH=Na2SO4+2H2O 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四: 有Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是 猜想三 ,理由是 H2SO4和NaOH在溶液中不能共存 。
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 NaOH 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究。
实验方案 测溶液的pH 滴加Na2CO3溶液 滴加BaCl2溶液
实验操作
实验现象 试纸变色,对比比色卡,pH<7 有气泡产生 产生白色沉淀
实验结论 溶液中有H2SO4 溶液中有H2SO4 溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是 pH试纸浸入溶液中 ;
②实验方案中也有一个是错误的,错误的原因是 Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在 。
【分析】【学生板演】硫酸和氢氧化钠反应生成硫酸钠和水,注意化学式的写法和配平;
【假设猜想】根据酸碱不能共存判断不合理的猜想;
【实验探究】根据碳酸钠和硫酸反应能生成二氧化碳气体解答;
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀。
【解答】解:【学生板演】硫酸和氢氧化钠反应生成硫酸钠和水,化学方程式为H2SO4+2NaOH═Na2SO4+2H2O;
【假设猜想】硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量,当氢氧化钠过量时,反应后溶液中的溶质为硫酸钠和氢氧化钠,故猜想三为氢氧化钠和硫酸钠,酸碱过量,但不能同时过量,因为酸碱不能共存,会继续反应,故猜想三不合理;
【实验探究】(1)硫酸铜和氢氧化钠反应能生成氢氧化铜蓝色沉淀,因此溶液中滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠。
(2)溶液中有硫酸,滴加碳酸钠后,碳酸钠会和硫酸反应生成二氧化碳气体,因此会看到产生气泡。
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸;
故答案为:【学生板演】H2SO4+2NaOH=Na2SO4+2H2O;
【假设猜想】有Na2SO4和NaOH;猜想三;H2SO4和NaOH在溶液中不能共存;
【实验探究】(1)NaOH;(2)有气泡产生;
【评价反思】①pH试纸浸入溶液中;②Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在。
【点评】此题通过中和反应考查了化学方程式的书写,实验方案设计、实验操作以及实验方案的评价,解答时要全面审题,认真解答。
17.(3分)用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(1)该实验是将 氢氧化钠溶液 (选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.
(2)当加入溶液的质量a为20g时,求所得溶液中溶质的质量.
【分析】(1)根据图象中pH值的变化是从小于7逐渐的增大到大于7,进行分析确定操作的过程.
(2)根据溶质质量=溶液质量×溶质的质量分数,列式表示出当加入氢氧化钠溶液的质量为20g时溶质的质量,进而根据化学方程式计算出所得溶液中溶质的质量即可.
【解答】解:(1)由图象可知,pH值是开始时小于7逐渐的增大到7然后大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH升高,说明是把氢氧化钠溶液滴加到稀盐酸中.故答案为:氢氧化钠溶液.
(2)设溶液中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 58.5
20g×10% x
,x=2.925g
答:所得溶液中溶质的质量为2.925g.
【点评】本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.
声明:试题解析著作权属所有,未经书面同意,不得复制发布
日期:2022/1/24 9:27:57;用户:15877047552;邮箱:15877047552;学号:38945411第2页(共3页)
