11.1生活中常见的盐(第3课时)课件(共28张PPT)
文档属性
| 名称 | 11.1生活中常见的盐(第3课时)课件(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-25 00:00:00 | ||
图片预览




文档简介
(共28张PPT)
课题1
生活中常见的盐
课时 3
第十一单元 盐 化肥
2021-2022学年九年级化学下册同步(人教版)
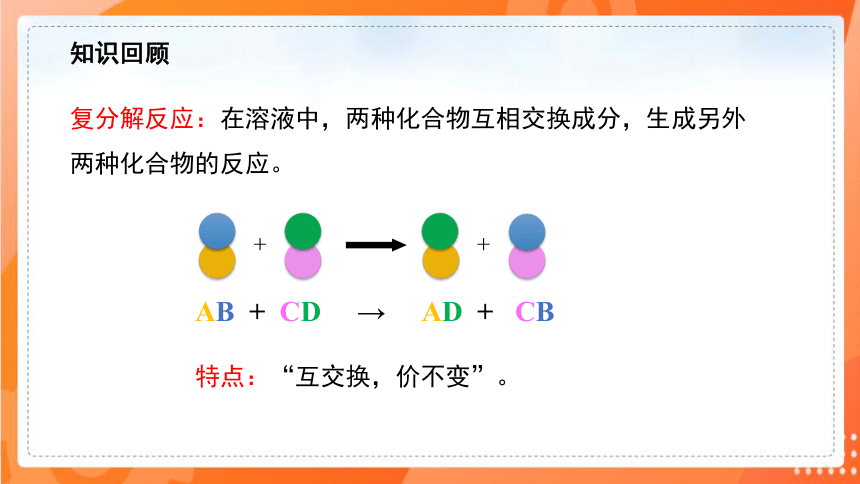
+
+
AB + CD → AD + CB
知识回顾
特点:“互交换,价不变”。
复分解反应:在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应。
交流讨论:下列四个化学反应是复分解反应吗?为什么?
思考:什么条件下复分解反应才能发生呢?
①BaCO3+2HCl==BaCl2+H2O+CO2↑
②Ca(OH)2 +CO2 == CaCO3↓+H2O
③2NaOH + CO2== Na2CO3+H2O
④H2SO4+2NaOH==Na2SO4+2H2O
⑤AgNO3+NaCl=AgCl ↓+NaNO3
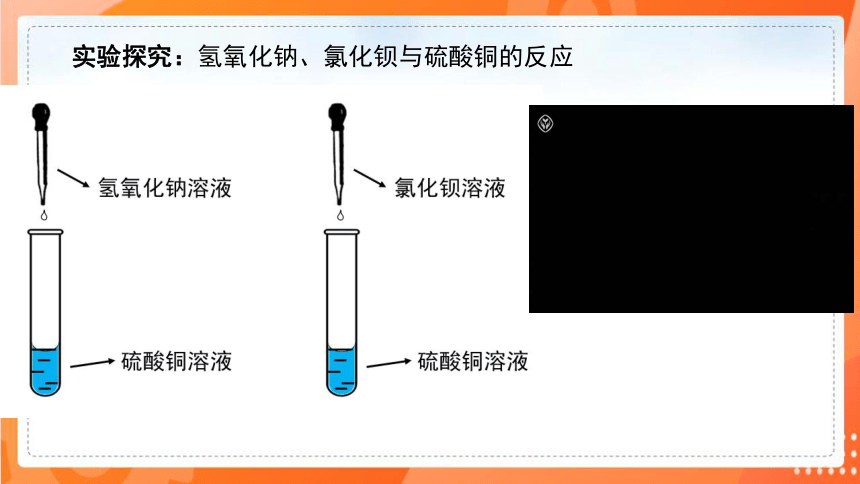
实验探究:氢氧化钠、氯化钡与硫酸铜的反应
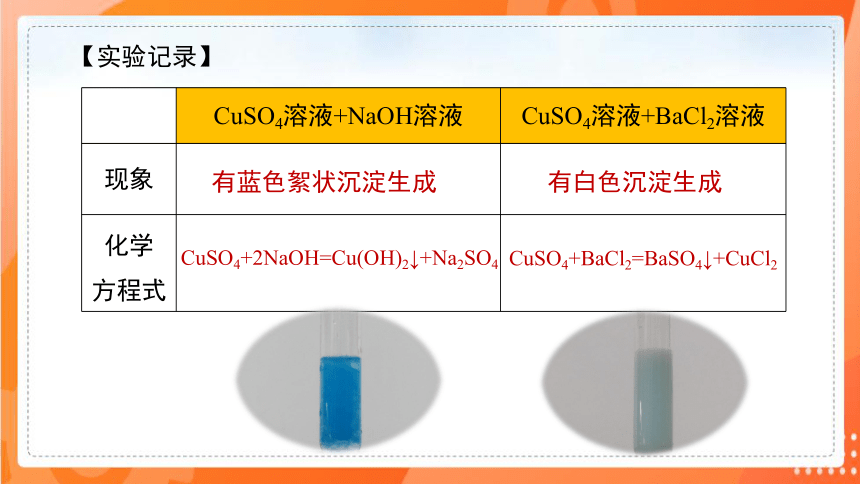
【实验记录】
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学 方程式
有蓝色絮状沉淀生成
CuSO4+BaCl2=BaSO4↓+CuCl2
有白色沉淀生成
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
交流讨论:这两个反应是复分解反应吗?有什么共同之处?
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
CuSO4+2NaOH= Cu(OH)2↓ + Na2SO4
复分解反应
都有
沉淀生成
注意:并不是有沉淀生成的反应就是复分解反应,
如Ca(OH)2 +CO2 == CaCO3↓+H2O
交流讨论:中和反应(如NaOH+HCl=NaCl+H2O)是否属于复分解反应?两者在概念上有何不同?
中和反应属于复分解反应。
中和反应特指的是酸和碱的反应。
复分解反应指的是两种化合物相互交换成分生成另外两种化合物的反应,是一种基本反应类型。
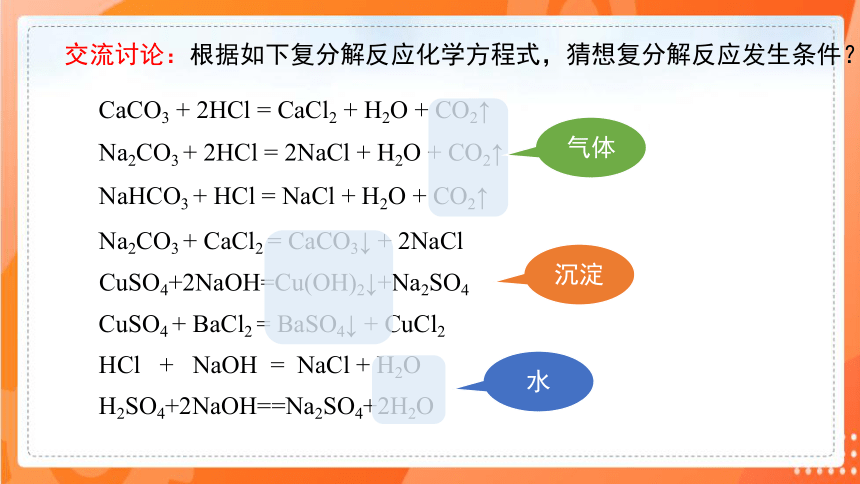
H2SO4+2NaOH==Na2SO4+2H2O
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
HCl + NaOH = NaCl + H2O
交流讨论:根据如下复分解反应化学方程式,猜想复分解反应发生条件?
气体
沉淀
水
复分解反应发生的条件:
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀、气体或水时,复分解反应才能发生。
视频:美丽的沉淀反应
探究:NaOH溶液和稀盐酸反应
Na+
OH-
H+
Cl-
H2O
实 质:
旁观者:
Na+和Cl-
溶液中H+和OH-的离子数目减少。
复分解反应的实质:
溶液中的阴阳离子重新结合成沉淀、气体或水而减少。
实质:
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
CO2
CO2
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
Na2CO3+2HCl=2NaCl+H2O+CO2↑
BaCl2+Na2SO4=BaSO4↓+2NaCl
(1)酸+金属氧化物→盐+水
H2SO4+CuO=CuSO4+H2O
(2)酸+碱→盐+水
(3)酸+盐→新盐+新酸
2HCl+Na2CO3=2NaCl+H2O+CO2↑
(4)碱+盐→新碱+新盐
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
(5)盐+盐→两种新盐
Na2CO3+CaCl2=CaCO3↓+2NaCl
HCl+NaOH=NaCl+H2O
复分解反应的五种类型
酸、碱、盐溶解性
1.常见的_______________;
2.常见的碱中只有五种溶于水:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)____________________;
5.硫酸盐__________________;
6.碳酸盐:含_____________________的碳酸盐溶于水。
微溶物
酸大多溶于水
不溶于水的有AgCl
不溶于水的有BaSO4
钾、钠、铵根离子
酸类易溶除硅酸;
碱溶钾、钠、铵和钡;
钾、钠、铵盐、硝酸盐,都能溶在水中间;
盐酸盐不溶银;
硫酸盐不溶钡;
碳酸盐很简单,能溶只有钾、钠、铵。
部分酸、碱、盐的溶解性口诀
☆方法小结:解此类题的关键是先双互换,后判断生成物中是否有水、气体或沉淀 。
交流讨论:根据复分解反应发生的条件,并利用书后附录I的信息,判断稀硫酸与下表中的四种化合物的溶液是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
能
能
能
不能
有水生成
无水、气体、沉淀生成
有气体生成
有沉淀生成
1.盐+金属→新盐+新金属
反应发生条件:
①参加反应的盐必须溶于水;
②在金属活动性顺序里,与盐反应的金属应排在盐溶液中金属的前面;
③K、Ca、Na在盐溶液中一般先与水反应。
总结:盐的化学性质
Fe+CuSO4 ==Cu+FeSO4
Cu+2AgNO3 ==2Ag+Cu(NO3)2
2.盐+酸→新盐+新酸
总结:盐的化学性质
反应发生条件:
①酸可溶;
②符合复分解反应发生的条件。
CaCO3+2HCl == CaCl2+H2O+CO2↑
AgNO3 + HCl == AgCl↓+HNO3
3.盐+碱→新盐+新碱
总结:盐的化学性质
反应发生条件:
①反应物均可溶于水;
②符合复分解反应发生的条件。
CuSO4 + 2NaOH == Cu(OH)2↓ + Na2SO4
FeCl3 + 3NaOH == 3NaCl + Fe(OH)3↓
4.盐1+盐2→新盐1+新盐2
总结:盐的化学性质
反应发生条件:
①反应物均可溶于水;
②符合复分解反应发生的条件。
BaCl2+CuSO4 == BaSO4↓+CuCl2
Ba(NO3) 2+Na2CO3 == BaCO3↓+2NaNO3
物 质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
NaCl
NaOH
H2SO4
CO2
C
Fe
物质的分类
课堂小结
1.复分解反应
①定义:由两种化合物互相交换成分,生成另外两种化合物的反应;
②发生的条件:生成物中有气体、沉淀或水;
③实质:酸碱盐电离出的离子互相结合生成沉淀、气体或者水的过程。
2.酸、碱、盐溶解性。
3.盐的化学性质。
4.物质的分类
1.下列各组物质中,能相互反应且反应类型属于复分解反应的是( )
A.锌和稀盐酸
B.二氧化碳和水
C.氯化钠溶液和硝酸钾溶液
D.氢氧化钠和稀硫酸
课堂练习
D
2.向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,对其中发生的反应的说法错误的是( )
A.反应会产生白色沉淀
B.化学方程式为Ca(OH)2+Na2CO3 == CaCO3+2NaOH
C.两种化合物互相交换成分生成另两种化合物
D.属于复分解反应
B
3.将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )
A.CaCl2、HCl、NaNO3
B.KOH、HCl、(NH4)2SO4
C.K2CO3、Ba(NO3)2、NaOH
D.FeCl3、NaCl、KNO3
A
4.下列溶液,不用其他试剂就能将组内物质鉴别出来的是( )
A.NaOH KOH MgCl2 H2SO4
B.NaCl HCl H2SO4 AgNO3
C.CuSO4 NaOH BaCl2 HCl
D.KCl HCl NaOH BaCl2
C
5.有三瓶失去标签的无色溶液,只知道它们分别是氯化钠溶液、稀盐酸和氢氧化钠溶液中的各一种。下列四种试剂中,能将上述三种无色溶液一次鉴别出来的是( )
A.酚酞试液 B.CaCO3粉末
C.KNO3溶液 D.石蕊试液
D
https://www.21cnjy.com/help/help_extract.php
课题1
生活中常见的盐
课时 3
第十一单元 盐 化肥
2021-2022学年九年级化学下册同步(人教版)
+
+
AB + CD → AD + CB
知识回顾
特点:“互交换,价不变”。
复分解反应:在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应。
交流讨论:下列四个化学反应是复分解反应吗?为什么?
思考:什么条件下复分解反应才能发生呢?
①BaCO3+2HCl==BaCl2+H2O+CO2↑
②Ca(OH)2 +CO2 == CaCO3↓+H2O
③2NaOH + CO2== Na2CO3+H2O
④H2SO4+2NaOH==Na2SO4+2H2O
⑤AgNO3+NaCl=AgCl ↓+NaNO3
实验探究:氢氧化钠、氯化钡与硫酸铜的反应
【实验记录】
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学 方程式
有蓝色絮状沉淀生成
CuSO4+BaCl2=BaSO4↓+CuCl2
有白色沉淀生成
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
交流讨论:这两个反应是复分解反应吗?有什么共同之处?
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
CuSO4+2NaOH= Cu(OH)2↓ + Na2SO4
复分解反应
都有
沉淀生成
注意:并不是有沉淀生成的反应就是复分解反应,
如Ca(OH)2 +CO2 == CaCO3↓+H2O
交流讨论:中和反应(如NaOH+HCl=NaCl+H2O)是否属于复分解反应?两者在概念上有何不同?
中和反应属于复分解反应。
中和反应特指的是酸和碱的反应。
复分解反应指的是两种化合物相互交换成分生成另外两种化合物的反应,是一种基本反应类型。
H2SO4+2NaOH==Na2SO4+2H2O
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
HCl + NaOH = NaCl + H2O
交流讨论:根据如下复分解反应化学方程式,猜想复分解反应发生条件?
气体
沉淀
水
复分解反应发生的条件:
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀、气体或水时,复分解反应才能发生。
视频:美丽的沉淀反应
探究:NaOH溶液和稀盐酸反应
Na+
OH-
H+
Cl-
H2O
实 质:
旁观者:
Na+和Cl-
溶液中H+和OH-的离子数目减少。
复分解反应的实质:
溶液中的阴阳离子重新结合成沉淀、气体或水而减少。
实质:
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
CO2
CO2
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
Na2CO3+2HCl=2NaCl+H2O+CO2↑
BaCl2+Na2SO4=BaSO4↓+2NaCl
(1)酸+金属氧化物→盐+水
H2SO4+CuO=CuSO4+H2O
(2)酸+碱→盐+水
(3)酸+盐→新盐+新酸
2HCl+Na2CO3=2NaCl+H2O+CO2↑
(4)碱+盐→新碱+新盐
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
(5)盐+盐→两种新盐
Na2CO3+CaCl2=CaCO3↓+2NaCl
HCl+NaOH=NaCl+H2O
复分解反应的五种类型
酸、碱、盐溶解性
1.常见的_______________;
2.常见的碱中只有五种溶于水:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)____________________;
5.硫酸盐__________________;
6.碳酸盐:含_____________________的碳酸盐溶于水。
微溶物
酸大多溶于水
不溶于水的有AgCl
不溶于水的有BaSO4
钾、钠、铵根离子
酸类易溶除硅酸;
碱溶钾、钠、铵和钡;
钾、钠、铵盐、硝酸盐,都能溶在水中间;
盐酸盐不溶银;
硫酸盐不溶钡;
碳酸盐很简单,能溶只有钾、钠、铵。
部分酸、碱、盐的溶解性口诀
☆方法小结:解此类题的关键是先双互换,后判断生成物中是否有水、气体或沉淀 。
交流讨论:根据复分解反应发生的条件,并利用书后附录I的信息,判断稀硫酸与下表中的四种化合物的溶液是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
能
能
能
不能
有水生成
无水、气体、沉淀生成
有气体生成
有沉淀生成
1.盐+金属→新盐+新金属
反应发生条件:
①参加反应的盐必须溶于水;
②在金属活动性顺序里,与盐反应的金属应排在盐溶液中金属的前面;
③K、Ca、Na在盐溶液中一般先与水反应。
总结:盐的化学性质
Fe+CuSO4 ==Cu+FeSO4
Cu+2AgNO3 ==2Ag+Cu(NO3)2
2.盐+酸→新盐+新酸
总结:盐的化学性质
反应发生条件:
①酸可溶;
②符合复分解反应发生的条件。
CaCO3+2HCl == CaCl2+H2O+CO2↑
AgNO3 + HCl == AgCl↓+HNO3
3.盐+碱→新盐+新碱
总结:盐的化学性质
反应发生条件:
①反应物均可溶于水;
②符合复分解反应发生的条件。
CuSO4 + 2NaOH == Cu(OH)2↓ + Na2SO4
FeCl3 + 3NaOH == 3NaCl + Fe(OH)3↓
4.盐1+盐2→新盐1+新盐2
总结:盐的化学性质
反应发生条件:
①反应物均可溶于水;
②符合复分解反应发生的条件。
BaCl2+CuSO4 == BaSO4↓+CuCl2
Ba(NO3) 2+Na2CO3 == BaCO3↓+2NaNO3
物 质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
NaCl
NaOH
H2SO4
CO2
C
Fe
物质的分类
课堂小结
1.复分解反应
①定义:由两种化合物互相交换成分,生成另外两种化合物的反应;
②发生的条件:生成物中有气体、沉淀或水;
③实质:酸碱盐电离出的离子互相结合生成沉淀、气体或者水的过程。
2.酸、碱、盐溶解性。
3.盐的化学性质。
4.物质的分类
1.下列各组物质中,能相互反应且反应类型属于复分解反应的是( )
A.锌和稀盐酸
B.二氧化碳和水
C.氯化钠溶液和硝酸钾溶液
D.氢氧化钠和稀硫酸
课堂练习
D
2.向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,对其中发生的反应的说法错误的是( )
A.反应会产生白色沉淀
B.化学方程式为Ca(OH)2+Na2CO3 == CaCO3+2NaOH
C.两种化合物互相交换成分生成另两种化合物
D.属于复分解反应
B
3.将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )
A.CaCl2、HCl、NaNO3
B.KOH、HCl、(NH4)2SO4
C.K2CO3、Ba(NO3)2、NaOH
D.FeCl3、NaCl、KNO3
A
4.下列溶液,不用其他试剂就能将组内物质鉴别出来的是( )
A.NaOH KOH MgCl2 H2SO4
B.NaCl HCl H2SO4 AgNO3
C.CuSO4 NaOH BaCl2 HCl
D.KCl HCl NaOH BaCl2
C
5.有三瓶失去标签的无色溶液,只知道它们分别是氯化钠溶液、稀盐酸和氢氧化钠溶液中的各一种。下列四种试剂中,能将上述三种无色溶液一次鉴别出来的是( )
A.酚酞试液 B.CaCO3粉末
C.KNO3溶液 D.石蕊试液
D
https://www.21cnjy.com/help/help_extract.php
同课章节目录
