氨气的性质
图片预览





文档简介
课件29张PPT。第四节 氨 硝酸 硫酸
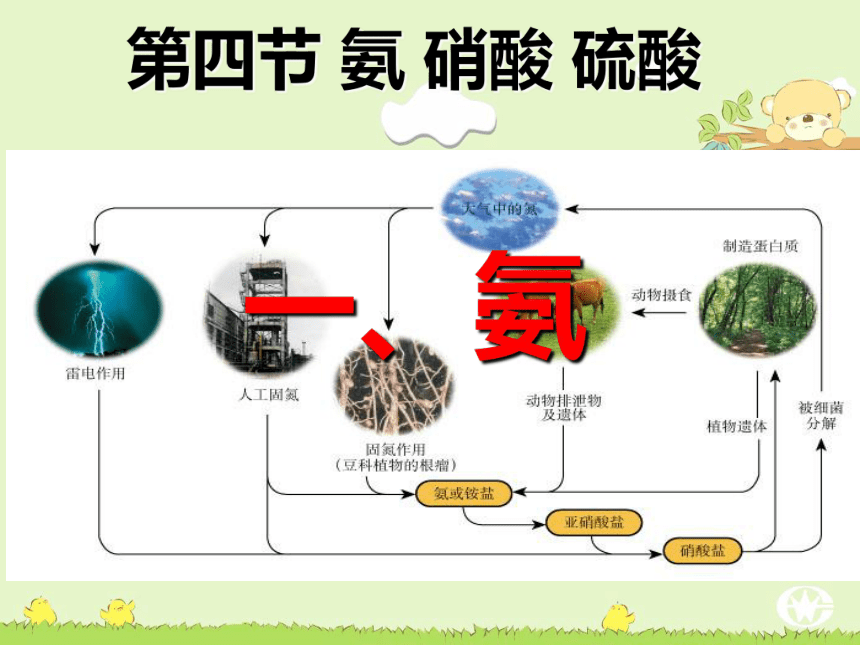
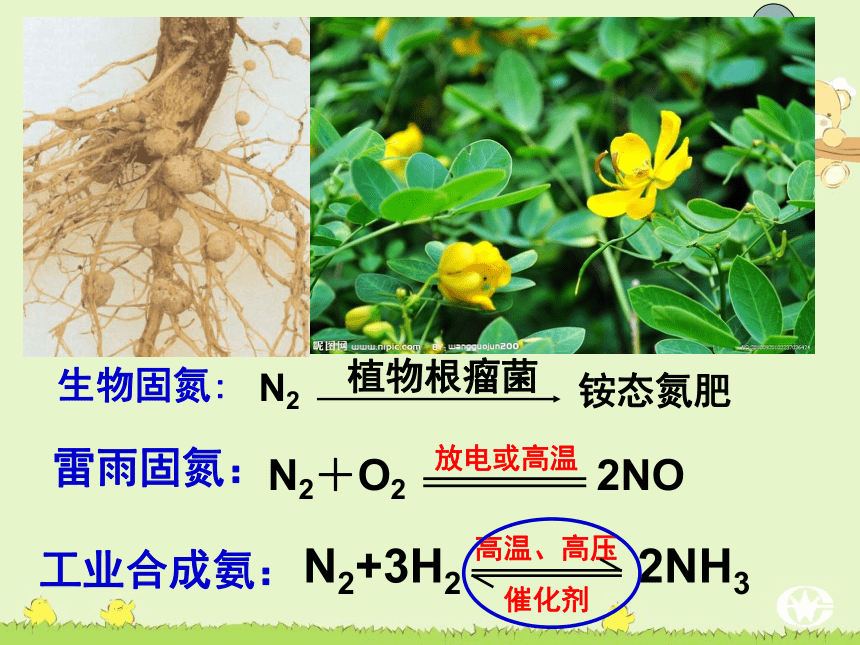
一、氨氮的固定(固氮):
将游离态的氮转变为氮的化合物工业合成氨: 雷雨固氮: 生物固氮:植物根瘤菌N2铵态氮肥氨气弗里茨·哈伯 1904年,哈伯开始研究合成氨的工业化生产,并于1909年获得成功,成为第一个从空气中制造出氨的科学家。使人类从此摆脱了依靠天然氮肥的被动局面,加速了世界农业的发展。哈伯也从此成了世界闻名的大科学家。为表彰哈伯的这一贡献,瑞典科学院把1918年的诺贝尔化学奖颁给了哈伯。 由于在第一次世界大战中,哈伯担任化学兵工厂厂长,负责研制、生产氯气、芥子气等毒气,并使用于战争之中,造成近百万人伤亡。虽然按照他自己的说法,这是“为了尽早结束战争”,但哈伯这一行径,仍然遭到了美、英、法、中等国科学家们的谴责,哈伯的妻子伊美娃也以自杀的方式以示抗议。
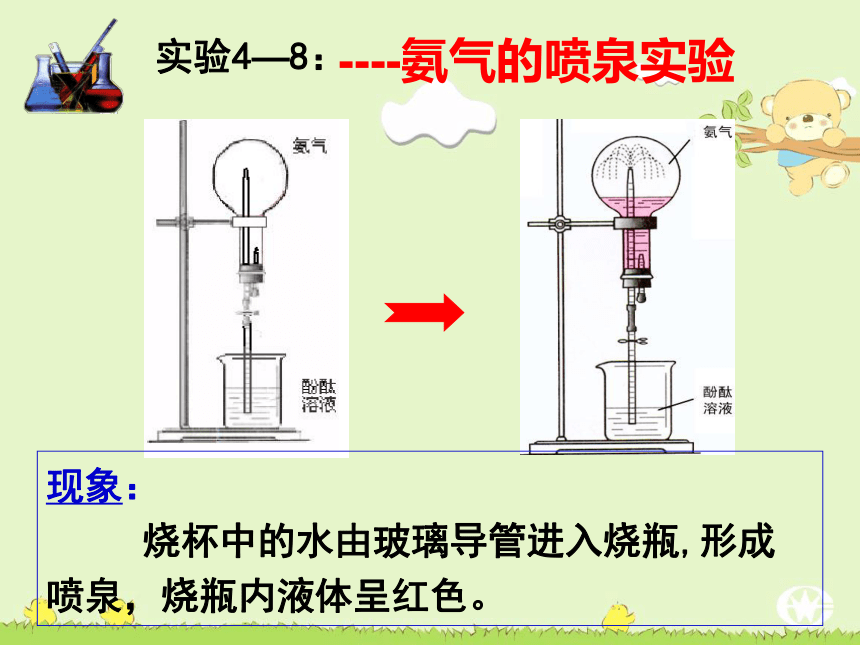
天使与魔鬼的化身五、氨气用途四、氨气的制取三、铵盐的性质二、氨气的化学性质一、氨气的物理性质 在日常生活中,在哪里最易闻到氨的气味?NH3说:这关我什么事?无色的气体密度比空气小易液化(沸点:-33.5℃)色、态:气 味:密 度:其 他:有刺激性气味极易溶于水(1 : 700)溶解性:一、氨的物理性质 ----氨气的喷泉实验实验4—8:
演示实验结合实验现象,思考以下问题:①烧瓶内为什么能形成喷泉?胶头滴管(预先吸入水)的作用?
②溶液为什么变成红色?----氨气的喷泉实验实验4—8:现象:
烧杯中的水由玻璃导管进入烧瓶,形成喷泉,烧瓶内液体呈红色。结合实验现象,思考以下问题:①烧瓶内为什么能形成喷泉?胶头滴管(预先吸入水)的作用?
②溶液为什么变成红色? 氨气极易溶于水,使烧瓶内外形成较大的压强差,烧杯内的水被压入烧瓶,形成喷泉。氨气与水反应生成显碱性的物质。思考与交流喷泉实验失败的原因:① 实验用的烧瓶不干燥
② 氨气未充满烧瓶
③ 塞子未塞紧
④ 由胶头滴管挤入烧瓶内的水太少喷泉实验成功的关键:干燥、集满、不漏气利用该装置,还有哪些气体也能做喷泉实验?想一想:①易溶于水的气体:
②易溶于碱的气体:HCl、SO2、NO2…… CO2、SO2、Cl2 ……(1)原理:形成压强差小结:喷泉实验① 减少“上瓶”的压强(2)方法:② 增加“下瓶”的压强(3)气-液组合可形成喷泉:①水与易溶于水的气体:HCl、SO2、NO2
②碱与易溶于碱的气体:CO2、SO2、Cl2城市中常见的人造喷泉及火山爆发的原理与上述的原理相似。1、与水的反应 二、氨的化学性质 ① NH3?H2O 不稳定,受热易分解。NH3+H2ONH3?H2O氨水的性质:(一水合氨 )阅读P98[资料卡片]——氨水为什么显碱性?大部分少部分② NH3?H2O 呈弱碱性思考:氨水中存在哪些分子、哪些离子?NH4+ + OH-氨气:高中阶段唯一的一种碱性气体 纯净物混合物NH3分子NH3 NH3·H2O H2O
NH4+ OH- H+③氨水的成分:
分子:想一想:氨水与液氨有什么不同?NH4+、H2ONH3、NH3?H2O 、OH-、H+离子:(极少量)(最多)现象:产生大量的白烟NH3 + HCl = NH4Cl 可用于检验NH32、与酸的反应 为什么蘸有浓氨水的玻璃棒靠近蘸有浓盐酸的玻璃棒时会放出白烟?思考:(白烟)2NH3 + H2SO4 = (NH4)2SO4
NH3 + HNO3 = NH4NO3铵盐 尝试写出NH3与硫酸、硝酸反应的化学反应方程式。氨的催化氧化3、氨的还原性(与氧气的反应)还原剂氧化剂20e--3+20-2-2课本P98思考与交流铵态氮肥四、铵盐1.物理性质都是晶体,都易溶于水由铵根离子和酸根离子构成的化合物。(1)铵盐受热易分解2. 化学性质NH3↑+HCl↑NH3 ↑+H2O↑ +CO2↑2NH3↑+H2O ↑+CO2 ↑规律:铵盐受热易分解,一般生成NH3。 * 硝酸铵、硫酸铵的受热分解反应复杂* 铵盐的保存:受热分解,试管壁上有固体生成。密封包装并放在阴凉通风处(2)铵盐与碱反应规律:
铵盐都与强碱在加热条件下反应放出氨气。∴铵盐不能跟碱性物质混合使用和保存。用于实验室制取氨气,用于NH4+的检验。应用:四.氨的实验室制法(3)装置:(5)收集:(6)验满:(7)尾气吸收:(1)试剂:(2)原理:固+固→加热型向下排空气法湿润的红色石蕊试纸变蓝
或蘸浓盐酸的玻璃棒(与氧气的制取装置相同)酸溶液或水(装置处理)氯化铵晶体、消石灰固体(4)干燥:碱石灰、固体氧化钙、固体氢氧化钠(白烟)1、棉花的作用:防止空气形成较大对流,提高集气的速度和纯度。2、干燥氨气的常用试剂:CaO、碱石灰等碱性干燥剂注意:无水CaCl2不能干燥NH3(形成CaCl2· 8NH3)注意: 除了利用上述方法之外,实验室有没有其他简单可行的方法来快速制得氨气?浓氨水方法一:加热浓氨水制氨气方法二:碱石灰吸水、溶解时放热浓氨水加碱石灰法氨的用途制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料致冷剂五、氨的用途:——重要的化工原料一、物理性质五、氨气的用途四、氨气的制取二、化学性质三、铵盐的性质
一、氨氮的固定(固氮):
将游离态的氮转变为氮的化合物工业合成氨: 雷雨固氮: 生物固氮:植物根瘤菌N2铵态氮肥氨气弗里茨·哈伯 1904年,哈伯开始研究合成氨的工业化生产,并于1909年获得成功,成为第一个从空气中制造出氨的科学家。使人类从此摆脱了依靠天然氮肥的被动局面,加速了世界农业的发展。哈伯也从此成了世界闻名的大科学家。为表彰哈伯的这一贡献,瑞典科学院把1918年的诺贝尔化学奖颁给了哈伯。 由于在第一次世界大战中,哈伯担任化学兵工厂厂长,负责研制、生产氯气、芥子气等毒气,并使用于战争之中,造成近百万人伤亡。虽然按照他自己的说法,这是“为了尽早结束战争”,但哈伯这一行径,仍然遭到了美、英、法、中等国科学家们的谴责,哈伯的妻子伊美娃也以自杀的方式以示抗议。
天使与魔鬼的化身五、氨气用途四、氨气的制取三、铵盐的性质二、氨气的化学性质一、氨气的物理性质 在日常生活中,在哪里最易闻到氨的气味?NH3说:这关我什么事?无色的气体密度比空气小易液化(沸点:-33.5℃)色、态:气 味:密 度:其 他:有刺激性气味极易溶于水(1 : 700)溶解性:一、氨的物理性质 ----氨气的喷泉实验实验4—8:
演示实验结合实验现象,思考以下问题:①烧瓶内为什么能形成喷泉?胶头滴管(预先吸入水)的作用?
②溶液为什么变成红色?----氨气的喷泉实验实验4—8:现象:
烧杯中的水由玻璃导管进入烧瓶,形成喷泉,烧瓶内液体呈红色。结合实验现象,思考以下问题:①烧瓶内为什么能形成喷泉?胶头滴管(预先吸入水)的作用?
②溶液为什么变成红色? 氨气极易溶于水,使烧瓶内外形成较大的压强差,烧杯内的水被压入烧瓶,形成喷泉。氨气与水反应生成显碱性的物质。思考与交流喷泉实验失败的原因:① 实验用的烧瓶不干燥
② 氨气未充满烧瓶
③ 塞子未塞紧
④ 由胶头滴管挤入烧瓶内的水太少喷泉实验成功的关键:干燥、集满、不漏气利用该装置,还有哪些气体也能做喷泉实验?想一想:①易溶于水的气体:
②易溶于碱的气体:HCl、SO2、NO2…… CO2、SO2、Cl2 ……(1)原理:形成压强差小结:喷泉实验① 减少“上瓶”的压强(2)方法:② 增加“下瓶”的压强(3)气-液组合可形成喷泉:①水与易溶于水的气体:HCl、SO2、NO2
②碱与易溶于碱的气体:CO2、SO2、Cl2城市中常见的人造喷泉及火山爆发的原理与上述的原理相似。1、与水的反应 二、氨的化学性质 ① NH3?H2O 不稳定,受热易分解。NH3+H2ONH3?H2O氨水的性质:(一水合氨 )阅读P98[资料卡片]——氨水为什么显碱性?大部分少部分② NH3?H2O 呈弱碱性思考:氨水中存在哪些分子、哪些离子?NH4+ + OH-氨气:高中阶段唯一的一种碱性气体 纯净物混合物NH3分子NH3 NH3·H2O H2O
NH4+ OH- H+③氨水的成分:
分子:想一想:氨水与液氨有什么不同?NH4+、H2ONH3、NH3?H2O 、OH-、H+离子:(极少量)(最多)现象:产生大量的白烟NH3 + HCl = NH4Cl 可用于检验NH32、与酸的反应 为什么蘸有浓氨水的玻璃棒靠近蘸有浓盐酸的玻璃棒时会放出白烟?思考:(白烟)2NH3 + H2SO4 = (NH4)2SO4
NH3 + HNO3 = NH4NO3铵盐 尝试写出NH3与硫酸、硝酸反应的化学反应方程式。氨的催化氧化3、氨的还原性(与氧气的反应)还原剂氧化剂20e--3+20-2-2课本P98思考与交流铵态氮肥四、铵盐1.物理性质都是晶体,都易溶于水由铵根离子和酸根离子构成的化合物。(1)铵盐受热易分解2. 化学性质NH3↑+HCl↑NH3 ↑+H2O↑ +CO2↑2NH3↑+H2O ↑+CO2 ↑规律:铵盐受热易分解,一般生成NH3。 * 硝酸铵、硫酸铵的受热分解反应复杂* 铵盐的保存:受热分解,试管壁上有固体生成。密封包装并放在阴凉通风处(2)铵盐与碱反应规律:
铵盐都与强碱在加热条件下反应放出氨气。∴铵盐不能跟碱性物质混合使用和保存。用于实验室制取氨气,用于NH4+的检验。应用:四.氨的实验室制法(3)装置:(5)收集:(6)验满:(7)尾气吸收:(1)试剂:(2)原理:固+固→加热型向下排空气法湿润的红色石蕊试纸变蓝
或蘸浓盐酸的玻璃棒(与氧气的制取装置相同)酸溶液或水(装置处理)氯化铵晶体、消石灰固体(4)干燥:碱石灰、固体氧化钙、固体氢氧化钠(白烟)1、棉花的作用:防止空气形成较大对流,提高集气的速度和纯度。2、干燥氨气的常用试剂:CaO、碱石灰等碱性干燥剂注意:无水CaCl2不能干燥NH3(形成CaCl2· 8NH3)注意: 除了利用上述方法之外,实验室有没有其他简单可行的方法来快速制得氨气?浓氨水方法一:加热浓氨水制氨气方法二:碱石灰吸水、溶解时放热浓氨水加碱石灰法氨的用途制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料致冷剂五、氨的用途:——重要的化工原料一、物理性质五、氨气的用途四、氨气的制取二、化学性质三、铵盐的性质
