江苏省邗江中学2012-2013学年高二上学期期中考试化学(必修)试题(有答案)
文档属性
| 名称 | 江苏省邗江中学2012-2013学年高二上学期期中考试化学(必修)试题(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 64.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-21 12:02:18 | ||
图片预览


文档简介
江苏省邗江中学2012-2013学年度第一学期期中考试
高二化学(必修)
可能用到的相对原子质量:H :1 C: 12 N: 14 O:16 Na:23 Ba:137
第I卷(选择题,共69分)
一、选择题(本题共23小题,每题只有1个正确答案,每小题3分,共69分)
1.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一。碳酸氢钠属于
A.酸 B.碱 C.盐 D.混合物
2.下列物质中,属于电解质的是
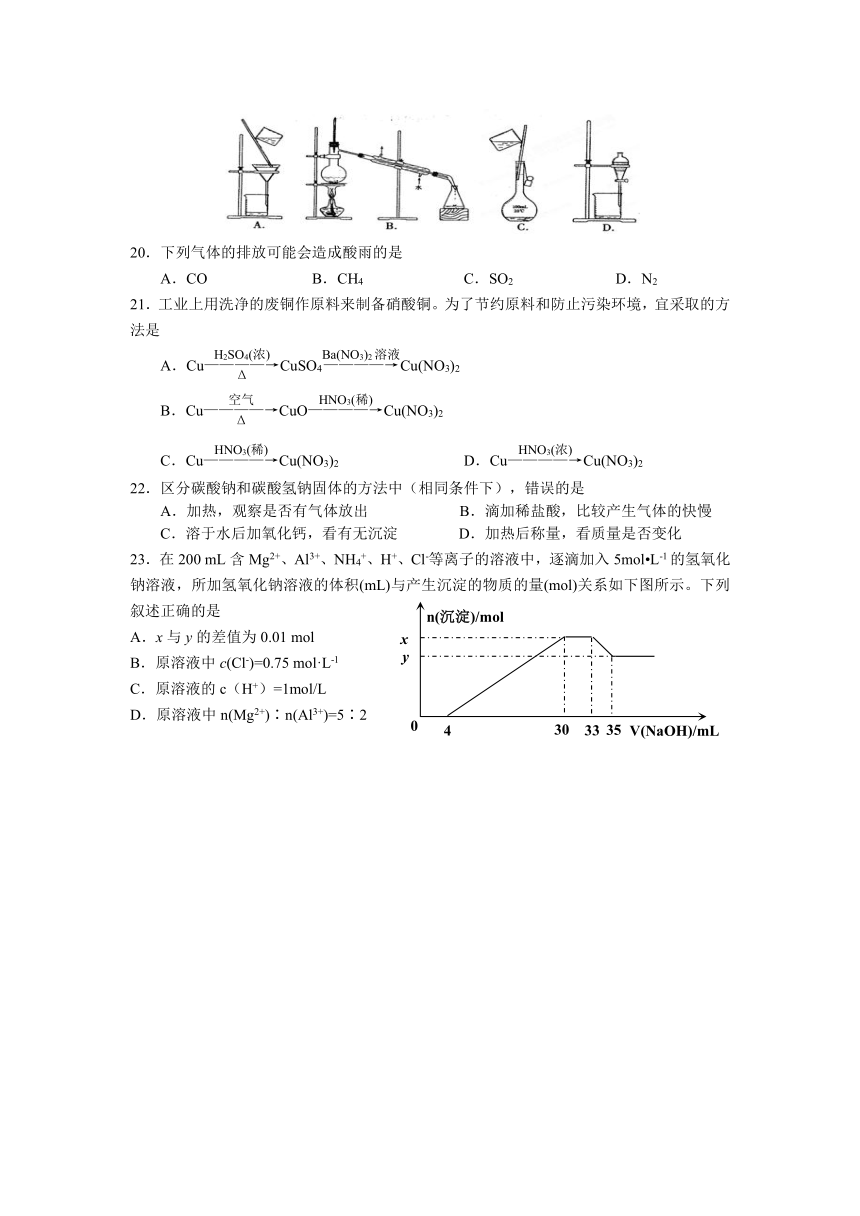
A.硫酸 B.铜 C.酒精 D.蔗糖
3.在溶液中能大量共存的离子组是
A.Na+、OH一、HCO3- B.NH4+、NO3—、OH—
C.H+、K+、CO32-、 D.Ba2+、OH一、C1—
4.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D.海水中含有溴元素,只需经过物理变化就可以得到溴单质
5.下列物质,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
6.下物质间的转化通过一步化学反应不能实现的是
A.Fe → Fe3O4 B.CuO → Cu(OH)2 C.HCl → C12 D.Na → Na2O
7.下列单质中,最难跟氢气发生反应的是
A.O2 B.N2 C.F2 D.Cl2
8.下列有关物质检验的实验结论正确的是
实 验 操 作
现 象
实 验 结 论
A.
向某溶液中加入硝酸酸化的氯化钡溶液
生成白色沉淀
溶液中一定含有SO42-
B.
将某气体通入品红溶液中
品红溶液褪色
该气体一定是SO2
C.
往某溶液中加入KSCN溶液
显血红色
溶液中一定含有Fe3+
D.
往某溶液中加入盐酸
产生无色气体
溶液中一定含有CO32-
9.下列物质与其用途相符合的是
①Cl2—作消毒剂;②AgBr—制胶卷,感光纸;③AgI—人工降雨;
④加碘食盐—预防甲状腺肿大;⑤淀粉—检验I2的存在;⑥NaClO—漂白纺织物
A.②③④⑤⑥ B.①②④⑤⑥ C.②③④⑤ D.全部
10.下列有关铝的叙述中不正确的是
A.铝合金的强度和硬度都比纯铝的大
B.铝制的容器可以贮存浓硫酸或浓硝酸
C.铝表面的氧化膜可用盐酸或氢氧化钠溶液除去
D.工业上电解氯化铝溶液可分解得到铝和氯气
11.NA为阿伏加德罗常数,下列叙述正确的是
A.80g硝酸铵中含有氮原子数为NA
B.16 g氧气和16 g臭氧所含的原子数均为NA
C.2mol金属铝与足量的盐酸反应,共失去了4NA个电子
D.0.l mol N2分子中所含的电子数为7NA
12.下列试剂的保存方法错误的是
A.少量的钠保存在煤油中 B.浓硝酸保存在无色玻璃瓶中
C.新制的氯水保存在棕色玻璃瓶中 D.氢氧化钠溶液保存在具橡皮塞的玻璃瓶中
13.下列离子方程式正确的是
A.稀硫酸与氢氧化钡溶液反应:H++OH一=H2O
B.钠与水反应:.Na+ H2O=Na++OH一+ H2↑
C.铝与氢氧化钠溶液反应:2Al+2OH一+2H2O=2A1O2-+3 H2↑
D.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
14.工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是 Fe2O3+3CO =2Fe+3CO2 ,对于该反应,下列说法正确的是
A.该反应是置换反应 B.氧元素的化合价降低
C.Fe2O3发生还原反应 D.CO为氧化剂
15.下列有关物质用途的说法中,不正确的是
A.漂白精能漂白是因为Ca(ClO)2中的 ClO-有强氧化性
B.明矾能够消毒杀菌是利用了胶体的吸附性
C.氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多
D.二氧化硅可用于制造光导纤维
16.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞
17.下列反应属于氧化还原反应的是
A.H2SO4+2NaOH = Na2SO4+2H2O
B.2NaHCO3 Na2CO3 + CO2↑ + H2O
C.NH3 + HCl = NH4Cl
D.CuO + H2 Cu + H2O
18、下列物质均能使某些有色物质褪色,其引起的褪色过程属于物理变化的是
A.二氧化硫 B.氯气 C.漂白粉 D、活性炭
19.下列实验操作中,不能用于物质分离的是
20.下列气体的排放可能会造成酸雨的是
A.CO B.CH4 C.SO2 D.N2
21.工业上用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
A.CuCuSO4Cu(NO3)2
B.CuCuOCu(NO3)2
C.CuCu(NO3)2 D.CuCu(NO3)2
22.区分碳酸钠和碳酸氢钠固体的方法中(相同条件下),错误的是
A.加热,观察是否有气体放出 B.滴加稀盐酸,比较产生气体的快慢
C.溶于水后加氧化钙,看有无沉淀 D.加热后称量,看质量是否变化
23.在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
A.x与y的差值为0.01 mol
B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的c(H+)=1mol/L
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
第II卷(共31分)
24.(1)(5分)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
1、取少量待测液,仔细观察,呈无色;
2、向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是_______________,一定没有的阳离子是___________________。还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)_______________,现象是_______________________。
(2)(10分)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。某同学在探究铁的化合物的相互转化时,进行了如下实验。请你参与讨论。
实验操作:向20 mL的FeSO4溶液中,滴加浓溴水,振荡。
实验现象:溶液由浅绿色(近乎无色)变成黄色。
1、溶液颜色发生改变的原因可能是 (用选项符号表示)。
①使溶液呈黄色的微粒是Br2 ②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
2、为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
操作
实验现象及结论
方案1
取少量黄色溶液,加入NaOH
最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应
方案2
取少量黄色溶液,加入淀粉碘化钾溶液
溶液变蓝色,说明未发生化学反应
方案3
取少量黄色溶液,加入四氯化碳,振荡
下层溶液呈橙红色,说明未发生化学反应
①方案1的结论是否合理 (填“合理”或“不合理”)。
②方案2的结论明显不合理,可能发生反应的离子方程式为 。
③方案3的结论也不合理,理由是 。
④`你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
25.(6分)下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质。(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)B是__________,H是_____________。(填化学式)
(2)写出J与D反应转化为G的离子方程式_________________________________。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式
?__________________________________________________________。
26.(10分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了两种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用稀酸将CO32-转化为CO2,测定CO2的质量。
(1)方案一的操作步骤有:①称量样品W1 g并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量沉淀W2 g并进行恒重操作,最后称量沉淀W3 g。
称量时所需定量实验仪器为__________。根据方案一的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
(2)方案二的实验装置如下图:
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④缓缓鼓入空气数分钟;⑤关闭止水夹,缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
根据方案二的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是___________________。如果没有装置A和实验操作④⑦,会导致测量结果______________(填“偏大”、“偏小”或“无影响”)。有同学认为空气中的水蒸气会进入干燥管导致测量结果__________(填“偏大”、“偏小”或“无影响”),改进措施可以是________________________。
江苏省邗江中学2012-2013学年度第一学期期中考试
高二化学(必修)答题纸
第II卷(共31分)
24.(1)_______________, _______________________。
_______________, _______________________。
(2)1、_______________。
2、①_______________________。
② _______________________。
③__________________________________________________________________。
④__________________________________________________________________
__________________________________________________________________。
25.(1)__________, _____________。
(2)__________________________________________________________。
(3)?__________________________________________________________。
26.(1)__________。
__________________。
(2)______________________。
__________________________。
___________________。
___________________。
____________, ________________________。
江苏省邗江中学2012-2013学年度第一学期期中考试
高二化学(必修)
参考答案及评分标准
一、选择题(每题3分,共69分)
1
2
3
4
5
6
7
8
9
10
11
12
C
A
D
C
D
B
B
C
D
D
B
B
13
14
15
16
17
18
19
20
21
22
23
C
C
A
B
D
D
C
C
B
C
A
二、非选择题
24、(1)Al3+、NH4+(2分);Fe3+(1分);
焰色反应(1分);透过蓝色钴玻璃呈紫色(1分)。
(2)1、①②③(2分)
2、① 不合理;(2分)
② Br2+2I-=I2+2Br-(2分)
③ 溴水可能过量(2分)
④ 取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+(2分)
25、(1)Fe2O3、Fe(OH)2(2分);
(2)Fe+2Fe3+=3Fe2+(2分);
(3)2Al+2H2O+2NaOH=2NaAlO2+3H2(2分)。
26、(1)托盘天平(1分);106W3/197W1(2分);
(2)53(W3-W1)/22W2(2分);
吸收空气中的CO2,减少误差(1分);
吸收气体中是水蒸汽,减少误差(1分);
偏小(1分);偏大(1分);
在干燥管后加一装有碱石灰的干燥管(1分)。
高二化学(必修)
可能用到的相对原子质量:H :1 C: 12 N: 14 O:16 Na:23 Ba:137
第I卷(选择题,共69分)
一、选择题(本题共23小题,每题只有1个正确答案,每小题3分,共69分)
1.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一。碳酸氢钠属于
A.酸 B.碱 C.盐 D.混合物
2.下列物质中,属于电解质的是
A.硫酸 B.铜 C.酒精 D.蔗糖
3.在溶液中能大量共存的离子组是
A.Na+、OH一、HCO3- B.NH4+、NO3—、OH—
C.H+、K+、CO32-、 D.Ba2+、OH一、C1—
4.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D.海水中含有溴元素,只需经过物理变化就可以得到溴单质
5.下列物质,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
6.下物质间的转化通过一步化学反应不能实现的是
A.Fe → Fe3O4 B.CuO → Cu(OH)2 C.HCl → C12 D.Na → Na2O
7.下列单质中,最难跟氢气发生反应的是
A.O2 B.N2 C.F2 D.Cl2
8.下列有关物质检验的实验结论正确的是
实 验 操 作
现 象
实 验 结 论
A.
向某溶液中加入硝酸酸化的氯化钡溶液
生成白色沉淀
溶液中一定含有SO42-
B.
将某气体通入品红溶液中
品红溶液褪色
该气体一定是SO2
C.
往某溶液中加入KSCN溶液
显血红色
溶液中一定含有Fe3+
D.
往某溶液中加入盐酸
产生无色气体
溶液中一定含有CO32-
9.下列物质与其用途相符合的是
①Cl2—作消毒剂;②AgBr—制胶卷,感光纸;③AgI—人工降雨;
④加碘食盐—预防甲状腺肿大;⑤淀粉—检验I2的存在;⑥NaClO—漂白纺织物
A.②③④⑤⑥ B.①②④⑤⑥ C.②③④⑤ D.全部
10.下列有关铝的叙述中不正确的是
A.铝合金的强度和硬度都比纯铝的大
B.铝制的容器可以贮存浓硫酸或浓硝酸
C.铝表面的氧化膜可用盐酸或氢氧化钠溶液除去
D.工业上电解氯化铝溶液可分解得到铝和氯气
11.NA为阿伏加德罗常数,下列叙述正确的是
A.80g硝酸铵中含有氮原子数为NA
B.16 g氧气和16 g臭氧所含的原子数均为NA
C.2mol金属铝与足量的盐酸反应,共失去了4NA个电子
D.0.l mol N2分子中所含的电子数为7NA
12.下列试剂的保存方法错误的是
A.少量的钠保存在煤油中 B.浓硝酸保存在无色玻璃瓶中
C.新制的氯水保存在棕色玻璃瓶中 D.氢氧化钠溶液保存在具橡皮塞的玻璃瓶中
13.下列离子方程式正确的是
A.稀硫酸与氢氧化钡溶液反应:H++OH一=H2O
B.钠与水反应:.Na+ H2O=Na++OH一+ H2↑
C.铝与氢氧化钠溶液反应:2Al+2OH一+2H2O=2A1O2-+3 H2↑
D.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
14.工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是 Fe2O3+3CO =2Fe+3CO2 ,对于该反应,下列说法正确的是
A.该反应是置换反应 B.氧元素的化合价降低
C.Fe2O3发生还原反应 D.CO为氧化剂
15.下列有关物质用途的说法中,不正确的是
A.漂白精能漂白是因为Ca(ClO)2中的 ClO-有强氧化性
B.明矾能够消毒杀菌是利用了胶体的吸附性
C.氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多
D.二氧化硅可用于制造光导纤维
16.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞
17.下列反应属于氧化还原反应的是
A.H2SO4+2NaOH = Na2SO4+2H2O
B.2NaHCO3 Na2CO3 + CO2↑ + H2O
C.NH3 + HCl = NH4Cl
D.CuO + H2 Cu + H2O
18、下列物质均能使某些有色物质褪色,其引起的褪色过程属于物理变化的是
A.二氧化硫 B.氯气 C.漂白粉 D、活性炭
19.下列实验操作中,不能用于物质分离的是
20.下列气体的排放可能会造成酸雨的是
A.CO B.CH4 C.SO2 D.N2
21.工业上用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
A.CuCuSO4Cu(NO3)2
B.CuCuOCu(NO3)2
C.CuCu(NO3)2 D.CuCu(NO3)2
22.区分碳酸钠和碳酸氢钠固体的方法中(相同条件下),错误的是
A.加热,观察是否有气体放出 B.滴加稀盐酸,比较产生气体的快慢
C.溶于水后加氧化钙,看有无沉淀 D.加热后称量,看质量是否变化
23.在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
A.x与y的差值为0.01 mol
B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的c(H+)=1mol/L
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
第II卷(共31分)
24.(1)(5分)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
1、取少量待测液,仔细观察,呈无色;
2、向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是_______________,一定没有的阳离子是___________________。还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)_______________,现象是_______________________。
(2)(10分)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。某同学在探究铁的化合物的相互转化时,进行了如下实验。请你参与讨论。
实验操作:向20 mL的FeSO4溶液中,滴加浓溴水,振荡。
实验现象:溶液由浅绿色(近乎无色)变成黄色。
1、溶液颜色发生改变的原因可能是 (用选项符号表示)。
①使溶液呈黄色的微粒是Br2 ②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
2、为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
操作
实验现象及结论
方案1
取少量黄色溶液,加入NaOH
最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应
方案2
取少量黄色溶液,加入淀粉碘化钾溶液
溶液变蓝色,说明未发生化学反应
方案3
取少量黄色溶液,加入四氯化碳,振荡
下层溶液呈橙红色,说明未发生化学反应
①方案1的结论是否合理 (填“合理”或“不合理”)。
②方案2的结论明显不合理,可能发生反应的离子方程式为 。
③方案3的结论也不合理,理由是 。
④`你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
25.(6分)下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质。(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)B是__________,H是_____________。(填化学式)
(2)写出J与D反应转化为G的离子方程式_________________________________。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式
?__________________________________________________________。
26.(10分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了两种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用稀酸将CO32-转化为CO2,测定CO2的质量。
(1)方案一的操作步骤有:①称量样品W1 g并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量沉淀W2 g并进行恒重操作,最后称量沉淀W3 g。
称量时所需定量实验仪器为__________。根据方案一的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
(2)方案二的实验装置如下图:
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④缓缓鼓入空气数分钟;⑤关闭止水夹,缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
根据方案二的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是___________________。如果没有装置A和实验操作④⑦,会导致测量结果______________(填“偏大”、“偏小”或“无影响”)。有同学认为空气中的水蒸气会进入干燥管导致测量结果__________(填“偏大”、“偏小”或“无影响”),改进措施可以是________________________。
江苏省邗江中学2012-2013学年度第一学期期中考试
高二化学(必修)答题纸
第II卷(共31分)
24.(1)_______________, _______________________。
_______________, _______________________。
(2)1、_______________。
2、①_______________________。
② _______________________。
③__________________________________________________________________。
④__________________________________________________________________
__________________________________________________________________。
25.(1)__________, _____________。
(2)__________________________________________________________。
(3)?__________________________________________________________。
26.(1)__________。
__________________。
(2)______________________。
__________________________。
___________________。
___________________。
____________, ________________________。
江苏省邗江中学2012-2013学年度第一学期期中考试
高二化学(必修)
参考答案及评分标准
一、选择题(每题3分,共69分)
1
2
3
4
5
6
7
8
9
10
11
12
C
A
D
C
D
B
B
C
D
D
B
B
13
14
15
16
17
18
19
20
21
22
23
C
C
A
B
D
D
C
C
B
C
A
二、非选择题
24、(1)Al3+、NH4+(2分);Fe3+(1分);
焰色反应(1分);透过蓝色钴玻璃呈紫色(1分)。
(2)1、①②③(2分)
2、① 不合理;(2分)
② Br2+2I-=I2+2Br-(2分)
③ 溴水可能过量(2分)
④ 取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+(2分)
25、(1)Fe2O3、Fe(OH)2(2分);
(2)Fe+2Fe3+=3Fe2+(2分);
(3)2Al+2H2O+2NaOH=2NaAlO2+3H2(2分)。
26、(1)托盘天平(1分);106W3/197W1(2分);
(2)53(W3-W1)/22W2(2分);
吸收空气中的CO2,减少误差(1分);
吸收气体中是水蒸汽,减少误差(1分);
偏小(1分);偏大(1分);
在干燥管后加一装有碱石灰的干燥管(1分)。
同课章节目录
