第九单元 溶液测试题—2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第九单元 溶液测试题—2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 202.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-27 10:53:05 | ||
图片预览


文档简介
第九单元《溶液》测试题
一、单选题
1.下列说法正确的是
A.通过电解水实验说明水由氢气和氧气组成的
B.100g98%的浓硫酸加入400g水稀释能得到19.6%的稀硫酸
C.电器着火用水扑灭,以降低可燃物的着火点
D.C、CO和CO2都具有可燃性和还原性
2.如图所示,向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是
A.氢氧化钠 B.碳酸钙
C.硝酸铵和氢氧化钙 D.氯化钠
3.下列物质不能溶于水形成溶液的是
A.花生油 B.蔗糖 C.食盐 D.味精
4.下列实验现象描述正确的是
A.硫在空气中燃烧发出明亮蓝色火焰
B.向20℃蔗糖饱和溶液中加入少量食盐,食盐溶解
C.CO还原黑色粉末变成红色
D.一氧化碳通入澄清石灰水,石灰水变浑浊
5.从化学的角度对下列词句进行解释,错误的是
A.点石成金——化学反应中元素种类可以发生改变
B.用洗洁精可除去油污——洗洁精对油污有乳化作用
C.真金不怕火炼——金的化学性质不活泼
D.用铜和黄铜相互刻画,铜上留有更深的划痕——合金的硬度比组成它的纯金属大
6.下列说法错误的是
A.蜡烛在空气中燃烧固体质量减少,违背了质量守恒定律
B.用洗涤剂去油污属于乳化现象
C.常见的净水方法有沉降、过滤、吸附、蒸馏等
D.可利用加热铜粉的方法来测定空气中氧气的体积分数
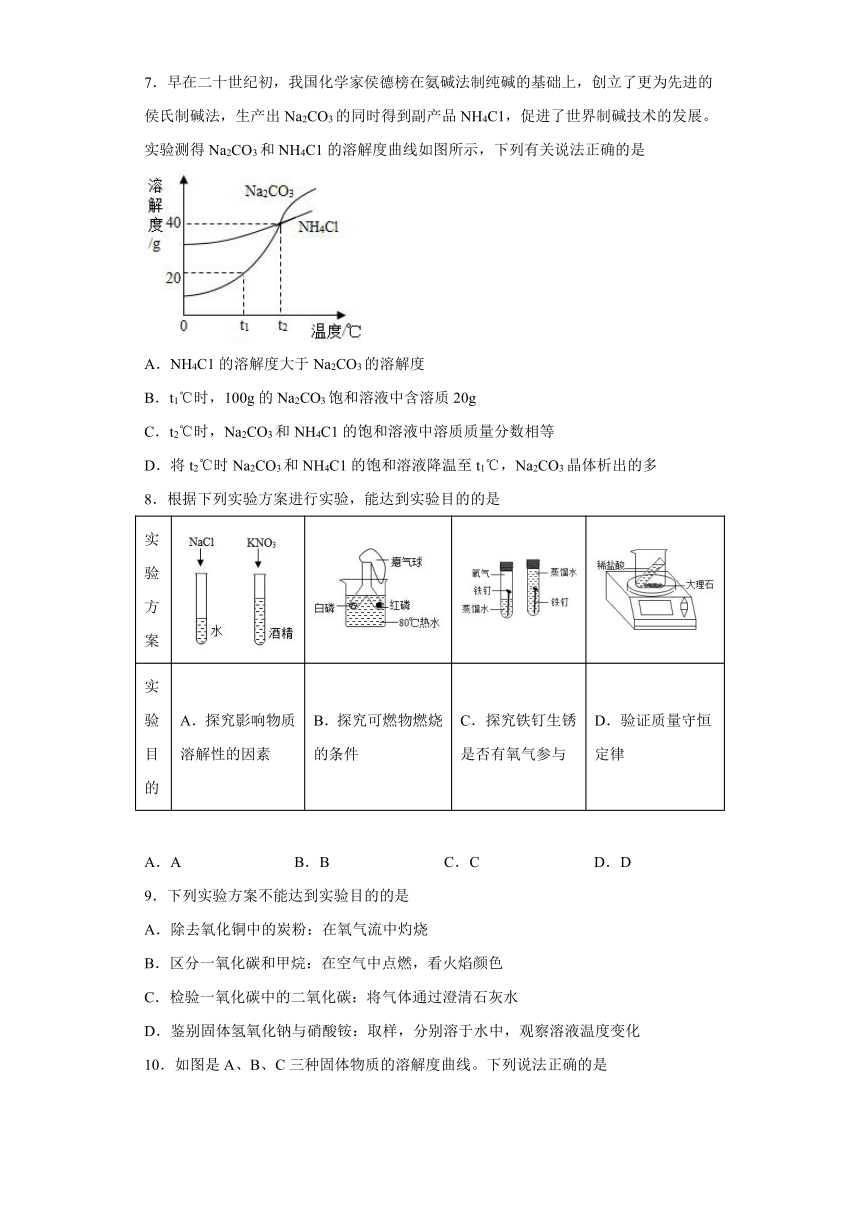
7.早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4C1,促进了世界制碱技术的发展。实验测得Na2CO3和NH4C1的溶解度曲线如图所示,下列有关说法正确的是
A.NH4C1的溶解度大于Na2CO3的溶解度
B.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
C.t2℃时,Na2CO3和NH4C1的饱和溶液中溶质质量分数相等
D.将t2℃时Na2CO3和NH4C1的饱和溶液降温至t1℃,Na2CO3晶体析出的多
8.根据下列实验方案进行实验,能达到实验目的的是
实验 方案
实验 目的 A.探究影响物质溶解性的因素 B.探究可燃物燃烧的条件 C.探究铁钉生锈是否有氧气参与 D.验证质量守恒定律
A.A B.B C.C D.D
9.下列实验方案不能达到实验目的的是
A.除去氧化铜中的炭粉:在氧气流中灼烧
B.区分一氧化碳和甲烷:在空气中点燃,看火焰颜色
C.检验一氧化碳中的二氧化碳:将气体通过澄清石灰水
D.鉴别固体氢氧化钠与硝酸铵:取样,分别溶于水中,观察溶液温度变化
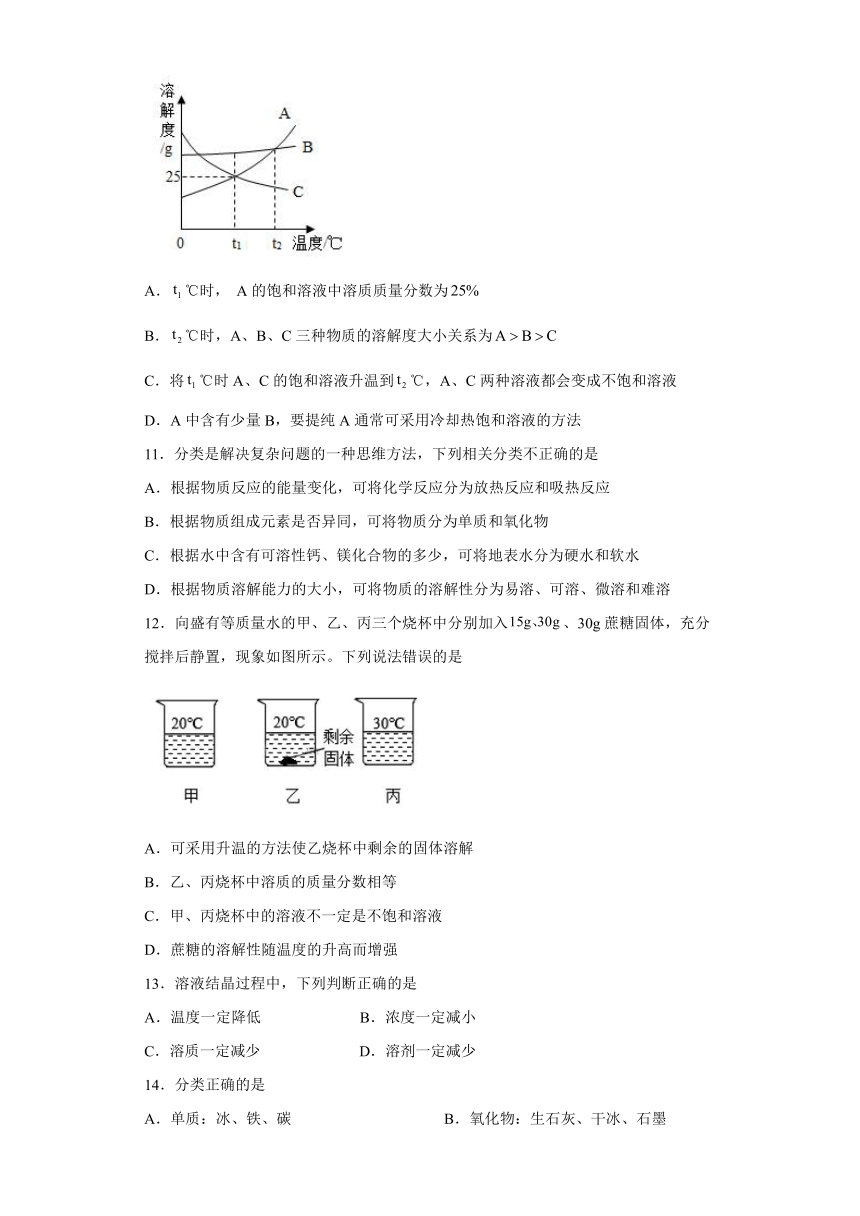
10.如图是A、B、C三种固体物质的溶解度曲线。下列说法正确的是
A.℃时, A的饱和溶液中溶质质量分数为
B.℃时,A、B、C三种物质的溶解度大小关系为
C.将℃时A、C的饱和溶液升温到℃,A、C两种溶液都会变成不饱和溶液
D.A中含有少量B,要提纯A通常可采用冷却热饱和溶液的方法
11.分类是解决复杂问题的一种思维方法,下列相关分类不正确的是
A.根据物质反应的能量变化,可将化学反应分为放热反应和吸热反应
B.根据物质组成元素是否异同,可将物质分为单质和氧化物
C.根据水中含有可溶性钙、镁化合物的多少,可将地表水分为硬水和软水
D.根据物质溶解能力的大小,可将物质的溶解性分为易溶、可溶、微溶和难溶
12.向盛有等质量水的甲、乙、丙三个烧杯中分别加入、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增强
13.溶液结晶过程中,下列判断正确的是
A.温度一定降低 B.浓度一定减小
C.溶质一定减少 D.溶剂一定减少
14.分类正确的是
A.单质:冰、铁、碳 B.氧化物:生石灰、干冰、石墨
C.溶液:矿泉水、石灰水、蒸馏水 D.晶体:胆矾、氯化钠、硝酸钾
15.图像能直观表达化学中各种变化的关系,加深对化学知识的理解。有关下列图像的描述,正确的一项是
A.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
B.向相同质量相同溶质质量分数的稀硫酸中加入足量的铁粉和锌粉
C.将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中
D.向一定质量的饱和氢氧化钙溶液中加入氧化钙
二、填空题
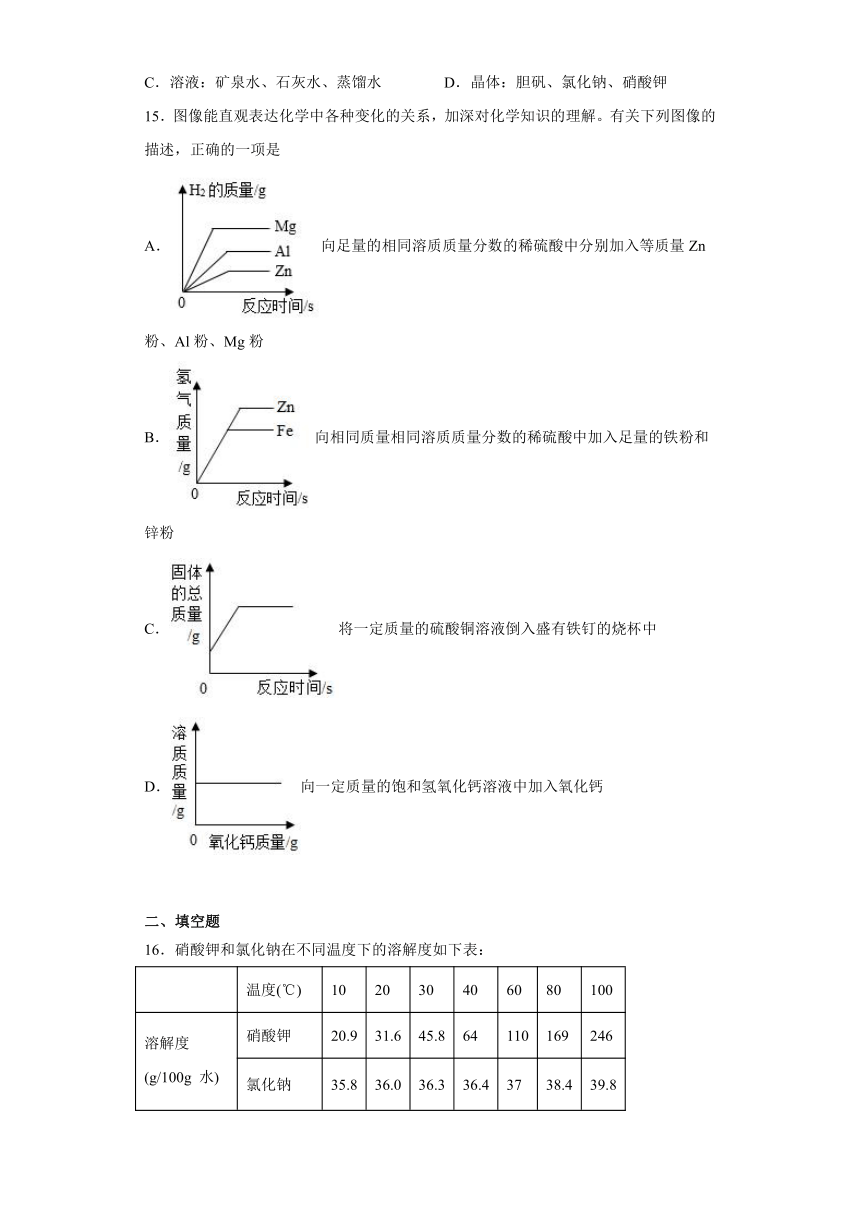
16.硝酸钾和氯化钠在不同温度下的溶解度如下表:
温度(℃) 10 20 30 40 60 80 100
溶解度 (g/100g 水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36.0 36.3 36.4 37 38.4 39.8
(1)10℃时,硝酸钾的溶解度___________(填“>”、“<”或“=”)氯化钠的溶解度。
(2)20℃时,20 克氯化钠固体放入 50 克水中,所得溶液___________(填“是”或“不是”)饱和溶液,溶液的质量为___________克。
(3)现有硝酸钾和氯化钠的固体混合物 146g,为了提纯其中的硝酸钾。设计如下实验:
I.操作A 的名称是___________。
II.原混合物中硝酸钾的纯度(质量分数)___________(列式即可)。
III.若降温到 10℃,能否得到纯净的硝酸钾?请结合相关数据分析说明。___________
17.硝酸钾、氯化钾的溶解度曲线如图所示。
(1)t2℃时硝酸钾的溶解度为______g/100g水,P点的含义是______。
(2)若硝酸钾中混有少量的氯化钾,可采用______的方法提纯硝酸钾(填“蒸发结晶”或“降温结晶”)。
(3)t2℃时,将30g氯化钾加入到50g水中,充分溶解后形成的溶液的是______(填“饱和溶液”或“不饱和溶液“),其溶液的溶质质量分数为______(结果精确到0.1%)。
(4)将接近饱和的硝酸钾溶液转化为饱和溶液的方法是______(写二种方法)。
(5)t2℃相同质量的硝酸钾和氯化钾饱和溶液,降至t1℃时,析出晶体的质量,硝酸钾______氯化钾(填“大于“或“小于”或"等于”),t2℃,分别将100g和50g两份硝酸钾饱和溶液蒸发10g水,恢复到t2℃,析出晶体的质量,前者______后者(填“大于“或“小于“或“等于“)。
18.水是重要的自然资源。
(1)要除去河水中的悬浮杂质,可以通过______操作来实现:
(2)某污水中含有硫酸铜,则其中的硫酸铜是由______构成的;
(3)氯化钠溶液中溶质的化学式为______。
19.如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是______。
(2)在30 ℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是______溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用______的方法提纯乙。
(4)将30 ℃时甲、乙、丙三种物质的饱和溶液降温到10 ℃,则其溶质质量分数不变的物质是______。
(5)20℃时甲、乙、丙三种物质的溶解度由大到小的顺序是______。
三、推断题
20.A~F是初中化学常见的物质,A是空气的主要成分,B常温下是液体,C是年产量最多的金属。它们之间的存在如图的转化关系。
(1)B的化学式为__________。
(2)E的一种用途是__________。
(3)反应①的基本反应类型为______________。
(4)反应①的化学方程式为______________。
21.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
22.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
四、实验题
23.根据如图所示的实验回答问题。
(1)实验甲,一段时间后,试管_______的铁钉生锈,植物油的作用是_______,对比试管①②的现象,得出的结论是_____。
(2)实验乙,配制一定溶质质量分数的溶液,正确的操作顺序为_____。溶解时用玻璃棒搅拌,其目的是_____。经检测所配制氯化钠溶液的溶质质量分数偏小,其原因可能是_____(填序号)。
①用量筒量取水时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用于溶解的烧杯中有少量的蒸馏水 ④转移溶液时有部分液体溅出
(3)实验丙,实验时先要通入一氧化碳气体的目的是_______。反应结束后先停止加热,继续通CO的目的是_______,除了检验反应生成二氧化碳外, B装置还具有的作用是______。写出CO还原Fe2O3的化学方程式______。
24.实验室欲配制100g质量分数为20%的食盐溶液。请完成下列问题:
(1)要准确配置该溶液需要称量氯化钠______g,需要量取水______mL(水的密度1g/mL)。
(2)完成本实验,所需仪器除B、E外,还必须选用上述仪器中的______(填仪器编号),是否还缺少玻璃仪器______(填“是”或“否”),______(若缺少填仪器名称,若不缺则不填)。
(3)如果称量食盐时,托盘天平的指针偏向左边,则所配溶液的质量分数将______(填“偏大”或“偏小”或“不变”);如果量取水的体积时,操作者的视线是俯视,则所配溶液的质量分数将______(同上)。
(4)准确配置好的溶液取出10mL后的浓度为______。
五、计算题
25.为测定某氯化钠溶液中溶质的质量分数,做如下实验:向烧杯中加入10 g该氯化钠溶液,然后向其中滴加硝酸银溶液,发生反应生成氯化银沉淀。滴加硝酸银溶液质量与产生沉淀质量关系如图所示。根据实验计算:
(1)该反应生成沉淀的质量为______克。
(2)该氯化钠溶液中溶质的质量分数为多少?(提示:化学反应方程式为 NaCl+AgNO3=NaNO3+AgCl↓)
26.某食品加工厂生产的酱油中氯化钠的质量分数为15%~18%,该厂日产酱油15t。试计算该厂每月(按30天计)消耗氯化钠的质量。
参考答案
1.B 2.C 3.A 4.B 5.A 6.A 7.C 8.C 9.B 10.D 11.B 12.B 13.C 14.D 15.C
16.(1)<
(2) 是 68
(3) 过滤 ×100% 否,10℃时氯化钠的溶解度为35.8g,降温至10℃时,溶液中36g氯化钠会有部分氯化钠与硝酸钾一起结晶析出,则得到的硝酸钾晶体中混有氯化钠
17.(1) 63.9 t1℃时,氯化钾和硝酸钾的溶解度相等
(2)降温结晶
(3) 饱和溶液 28.6%
(4)降温或恒温蒸发水或加入硝酸钾固体(任写二种)
(5) 大于 等于
18.(1)过滤
(2)Cu2+和
(3)NaCl
19.(1)20℃时,甲乙两物质的溶解度相等
(2)饱和
(3)蒸发结晶
(4)丙
(5)甲=乙>丙
20.H2O 灭火等 置换反应 Fe+2HCl=FeCl2+H2↑
21.75 a>b>c
22.过滤 此温度下碳酸氢钠的溶解度较小 氯化铵的溶解度受温度的影响较大 Na+、NH4+ CO2 温度高于60℃时,碳酸氢钠开始分解
23.(1) ① 隔绝氧气,防止氧气溶于水 铁生锈需要氧气
(2) CBDEA 加速溶解 ②③
(3) 排尽空气,防止爆炸 防止铁被氧化 收集一氧化碳,防止污染空气
24.(1) 20.0 80.0
(2) DG 是 胶头滴管
(3) 偏大 偏大
(4)20%
25.(1)2.87
(2)解:设参与反应的氯化钠的质量是x
x=1.17g
则氯化钠溶液中溶质的质量分数为×100%═11.7%。
答:该氯化钠溶液中溶质的质量分数为11.7%。
26.该厂每月(按30天计)最低消耗氯化钠的质量:15t×30×15%=67.5t;
该厂每月(按30天计)最高消耗氯化钠的质量:15t×30×18%=81t;
故该厂每月(按30天计)消耗氯化钠的质量为67.5t~81t
一、单选题
1.下列说法正确的是
A.通过电解水实验说明水由氢气和氧气组成的
B.100g98%的浓硫酸加入400g水稀释能得到19.6%的稀硫酸
C.电器着火用水扑灭,以降低可燃物的着火点
D.C、CO和CO2都具有可燃性和还原性
2.如图所示,向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是
A.氢氧化钠 B.碳酸钙
C.硝酸铵和氢氧化钙 D.氯化钠
3.下列物质不能溶于水形成溶液的是
A.花生油 B.蔗糖 C.食盐 D.味精
4.下列实验现象描述正确的是
A.硫在空气中燃烧发出明亮蓝色火焰
B.向20℃蔗糖饱和溶液中加入少量食盐,食盐溶解
C.CO还原黑色粉末变成红色
D.一氧化碳通入澄清石灰水,石灰水变浑浊
5.从化学的角度对下列词句进行解释,错误的是
A.点石成金——化学反应中元素种类可以发生改变
B.用洗洁精可除去油污——洗洁精对油污有乳化作用
C.真金不怕火炼——金的化学性质不活泼
D.用铜和黄铜相互刻画,铜上留有更深的划痕——合金的硬度比组成它的纯金属大
6.下列说法错误的是
A.蜡烛在空气中燃烧固体质量减少,违背了质量守恒定律
B.用洗涤剂去油污属于乳化现象
C.常见的净水方法有沉降、过滤、吸附、蒸馏等
D.可利用加热铜粉的方法来测定空气中氧气的体积分数
7.早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4C1,促进了世界制碱技术的发展。实验测得Na2CO3和NH4C1的溶解度曲线如图所示,下列有关说法正确的是
A.NH4C1的溶解度大于Na2CO3的溶解度
B.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
C.t2℃时,Na2CO3和NH4C1的饱和溶液中溶质质量分数相等
D.将t2℃时Na2CO3和NH4C1的饱和溶液降温至t1℃,Na2CO3晶体析出的多
8.根据下列实验方案进行实验,能达到实验目的的是
实验 方案
实验 目的 A.探究影响物质溶解性的因素 B.探究可燃物燃烧的条件 C.探究铁钉生锈是否有氧气参与 D.验证质量守恒定律
A.A B.B C.C D.D
9.下列实验方案不能达到实验目的的是
A.除去氧化铜中的炭粉:在氧气流中灼烧
B.区分一氧化碳和甲烷:在空气中点燃,看火焰颜色
C.检验一氧化碳中的二氧化碳:将气体通过澄清石灰水
D.鉴别固体氢氧化钠与硝酸铵:取样,分别溶于水中,观察溶液温度变化
10.如图是A、B、C三种固体物质的溶解度曲线。下列说法正确的是
A.℃时, A的饱和溶液中溶质质量分数为
B.℃时,A、B、C三种物质的溶解度大小关系为
C.将℃时A、C的饱和溶液升温到℃,A、C两种溶液都会变成不饱和溶液
D.A中含有少量B,要提纯A通常可采用冷却热饱和溶液的方法
11.分类是解决复杂问题的一种思维方法,下列相关分类不正确的是
A.根据物质反应的能量变化,可将化学反应分为放热反应和吸热反应
B.根据物质组成元素是否异同,可将物质分为单质和氧化物
C.根据水中含有可溶性钙、镁化合物的多少,可将地表水分为硬水和软水
D.根据物质溶解能力的大小,可将物质的溶解性分为易溶、可溶、微溶和难溶
12.向盛有等质量水的甲、乙、丙三个烧杯中分别加入、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增强
13.溶液结晶过程中,下列判断正确的是
A.温度一定降低 B.浓度一定减小
C.溶质一定减少 D.溶剂一定减少
14.分类正确的是
A.单质:冰、铁、碳 B.氧化物:生石灰、干冰、石墨
C.溶液:矿泉水、石灰水、蒸馏水 D.晶体:胆矾、氯化钠、硝酸钾
15.图像能直观表达化学中各种变化的关系,加深对化学知识的理解。有关下列图像的描述,正确的一项是
A.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
B.向相同质量相同溶质质量分数的稀硫酸中加入足量的铁粉和锌粉
C.将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中
D.向一定质量的饱和氢氧化钙溶液中加入氧化钙
二、填空题
16.硝酸钾和氯化钠在不同温度下的溶解度如下表:
温度(℃) 10 20 30 40 60 80 100
溶解度 (g/100g 水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36.0 36.3 36.4 37 38.4 39.8
(1)10℃时,硝酸钾的溶解度___________(填“>”、“<”或“=”)氯化钠的溶解度。
(2)20℃时,20 克氯化钠固体放入 50 克水中,所得溶液___________(填“是”或“不是”)饱和溶液,溶液的质量为___________克。
(3)现有硝酸钾和氯化钠的固体混合物 146g,为了提纯其中的硝酸钾。设计如下实验:
I.操作A 的名称是___________。
II.原混合物中硝酸钾的纯度(质量分数)___________(列式即可)。
III.若降温到 10℃,能否得到纯净的硝酸钾?请结合相关数据分析说明。___________
17.硝酸钾、氯化钾的溶解度曲线如图所示。
(1)t2℃时硝酸钾的溶解度为______g/100g水,P点的含义是______。
(2)若硝酸钾中混有少量的氯化钾,可采用______的方法提纯硝酸钾(填“蒸发结晶”或“降温结晶”)。
(3)t2℃时,将30g氯化钾加入到50g水中,充分溶解后形成的溶液的是______(填“饱和溶液”或“不饱和溶液“),其溶液的溶质质量分数为______(结果精确到0.1%)。
(4)将接近饱和的硝酸钾溶液转化为饱和溶液的方法是______(写二种方法)。
(5)t2℃相同质量的硝酸钾和氯化钾饱和溶液,降至t1℃时,析出晶体的质量,硝酸钾______氯化钾(填“大于“或“小于”或"等于”),t2℃,分别将100g和50g两份硝酸钾饱和溶液蒸发10g水,恢复到t2℃,析出晶体的质量,前者______后者(填“大于“或“小于“或“等于“)。
18.水是重要的自然资源。
(1)要除去河水中的悬浮杂质,可以通过______操作来实现:
(2)某污水中含有硫酸铜,则其中的硫酸铜是由______构成的;
(3)氯化钠溶液中溶质的化学式为______。
19.如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是______。
(2)在30 ℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是______溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用______的方法提纯乙。
(4)将30 ℃时甲、乙、丙三种物质的饱和溶液降温到10 ℃,则其溶质质量分数不变的物质是______。
(5)20℃时甲、乙、丙三种物质的溶解度由大到小的顺序是______。
三、推断题
20.A~F是初中化学常见的物质,A是空气的主要成分,B常温下是液体,C是年产量最多的金属。它们之间的存在如图的转化关系。
(1)B的化学式为__________。
(2)E的一种用途是__________。
(3)反应①的基本反应类型为______________。
(4)反应①的化学方程式为______________。
21.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
22.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
四、实验题
23.根据如图所示的实验回答问题。
(1)实验甲,一段时间后,试管_______的铁钉生锈,植物油的作用是_______,对比试管①②的现象,得出的结论是_____。
(2)实验乙,配制一定溶质质量分数的溶液,正确的操作顺序为_____。溶解时用玻璃棒搅拌,其目的是_____。经检测所配制氯化钠溶液的溶质质量分数偏小,其原因可能是_____(填序号)。
①用量筒量取水时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用于溶解的烧杯中有少量的蒸馏水 ④转移溶液时有部分液体溅出
(3)实验丙,实验时先要通入一氧化碳气体的目的是_______。反应结束后先停止加热,继续通CO的目的是_______,除了检验反应生成二氧化碳外, B装置还具有的作用是______。写出CO还原Fe2O3的化学方程式______。
24.实验室欲配制100g质量分数为20%的食盐溶液。请完成下列问题:
(1)要准确配置该溶液需要称量氯化钠______g,需要量取水______mL(水的密度1g/mL)。
(2)完成本实验,所需仪器除B、E外,还必须选用上述仪器中的______(填仪器编号),是否还缺少玻璃仪器______(填“是”或“否”),______(若缺少填仪器名称,若不缺则不填)。
(3)如果称量食盐时,托盘天平的指针偏向左边,则所配溶液的质量分数将______(填“偏大”或“偏小”或“不变”);如果量取水的体积时,操作者的视线是俯视,则所配溶液的质量分数将______(同上)。
(4)准确配置好的溶液取出10mL后的浓度为______。
五、计算题
25.为测定某氯化钠溶液中溶质的质量分数,做如下实验:向烧杯中加入10 g该氯化钠溶液,然后向其中滴加硝酸银溶液,发生反应生成氯化银沉淀。滴加硝酸银溶液质量与产生沉淀质量关系如图所示。根据实验计算:
(1)该反应生成沉淀的质量为______克。
(2)该氯化钠溶液中溶质的质量分数为多少?(提示:化学反应方程式为 NaCl+AgNO3=NaNO3+AgCl↓)
26.某食品加工厂生产的酱油中氯化钠的质量分数为15%~18%,该厂日产酱油15t。试计算该厂每月(按30天计)消耗氯化钠的质量。
参考答案
1.B 2.C 3.A 4.B 5.A 6.A 7.C 8.C 9.B 10.D 11.B 12.B 13.C 14.D 15.C
16.(1)<
(2) 是 68
(3) 过滤 ×100% 否,10℃时氯化钠的溶解度为35.8g,降温至10℃时,溶液中36g氯化钠会有部分氯化钠与硝酸钾一起结晶析出,则得到的硝酸钾晶体中混有氯化钠
17.(1) 63.9 t1℃时,氯化钾和硝酸钾的溶解度相等
(2)降温结晶
(3) 饱和溶液 28.6%
(4)降温或恒温蒸发水或加入硝酸钾固体(任写二种)
(5) 大于 等于
18.(1)过滤
(2)Cu2+和
(3)NaCl
19.(1)20℃时,甲乙两物质的溶解度相等
(2)饱和
(3)蒸发结晶
(4)丙
(5)甲=乙>丙
20.H2O 灭火等 置换反应 Fe+2HCl=FeCl2+H2↑
21.75 a>b>c
22.过滤 此温度下碳酸氢钠的溶解度较小 氯化铵的溶解度受温度的影响较大 Na+、NH4+ CO2 温度高于60℃时,碳酸氢钠开始分解
23.(1) ① 隔绝氧气,防止氧气溶于水 铁生锈需要氧气
(2) CBDEA 加速溶解 ②③
(3) 排尽空气,防止爆炸 防止铁被氧化 收集一氧化碳,防止污染空气
24.(1) 20.0 80.0
(2) DG 是 胶头滴管
(3) 偏大 偏大
(4)20%
25.(1)2.87
(2)解:设参与反应的氯化钠的质量是x
x=1.17g
则氯化钠溶液中溶质的质量分数为×100%═11.7%。
答:该氯化钠溶液中溶质的质量分数为11.7%。
26.该厂每月(按30天计)最低消耗氯化钠的质量:15t×30×15%=67.5t;
该厂每月(按30天计)最高消耗氯化钠的质量:15t×30×18%=81t;
故该厂每月(按30天计)消耗氯化钠的质量为67.5t~81t
同课章节目录
