第十单元课题2酸和碱的中和反应课件—2021—2022学年九年级化学人教版下册(共29张PPT)
文档属性
| 名称 | 第十单元课题2酸和碱的中和反应课件—2021—2022学年九年级化学人教版下册(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-27 00:00:00 | ||
图片预览





文档简介
(共29张PPT)
酸和碱的中和反应
学习目标
1、知道中和反应的定义,明确中和反应的实质是什么。
2、能熟练书写4个常见酸和碱的中和反应方程式.
3、会举出在实际生产和生活中酸和碱的中和反应的应用.
实验探究--------酸和碱之间能否反应
取一根干净的试管,往其中加入适量的稀盐酸,然后再加入适量的氢氧化钠溶液,仔细观察现象。
分析上面这个实验
没有明显实验现象,不能作出判断它们之间是否发生了反应。 假设或猜想可能这两种物质根本就没有反应。或可能两种物质反应了,只不过是没有明显的现象。
思考
如何证明氢氧化钠溶液与稀盐酸确实发生了反应?
想一想怎样设计实验证明呢?
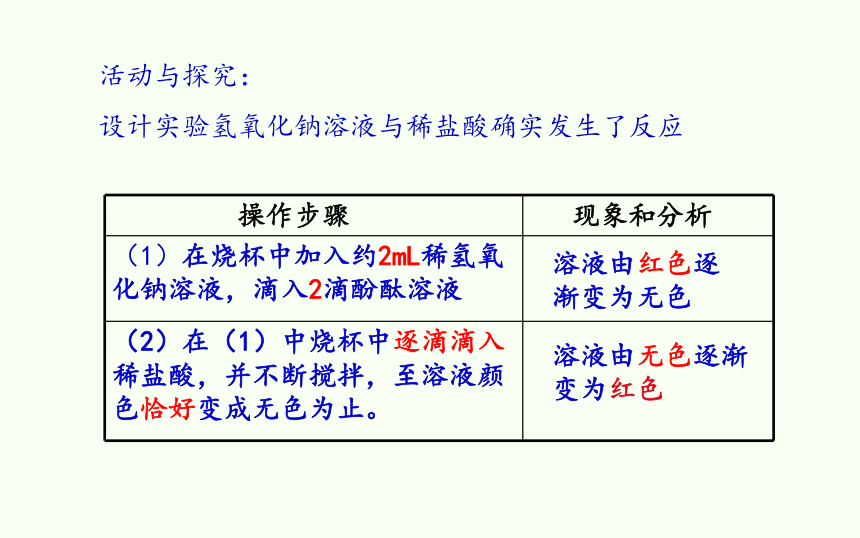
活动与探究:
设计实验氢氧化钠溶液与稀盐酸确实发生了反应
操作步骤 现象和分析
(1)在烧杯中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液
(2)在(1)中烧杯中逐滴滴入稀盐酸,并不断搅拌,至溶液颜色恰好变成无色为止。
溶液由无色逐渐变为红色
溶液由红色逐渐变为无色
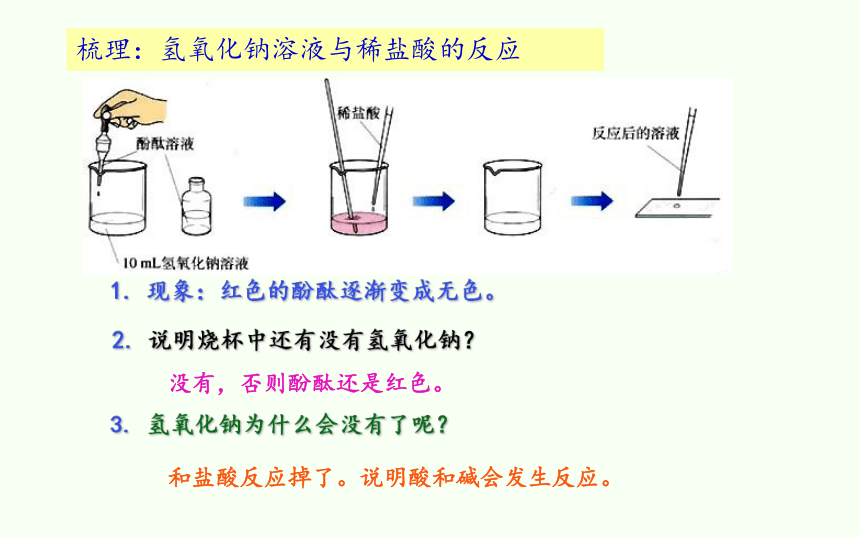
梳理:氢氧化钠溶液与稀盐酸的反应
1. 现象:红色的酚酞逐渐变成无色。
2. 说明烧杯中还有没有氢氧化钠?
3. 氢氧化钠为什么会没有了呢?
没有,否则酚酞还是红色。
和盐酸反应掉了。说明酸和碱会发生反应。
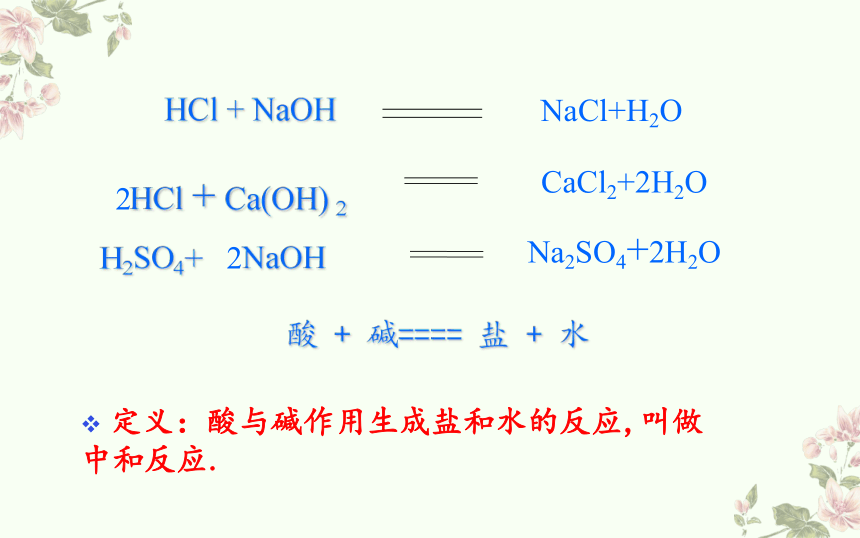
NaCl+H2O
HCl + NaOH
HCl + Ca(OH) 2
H2SO4+ 2NaOH
CaCl2+2H2O
Na2SO4+2H2O
2
酸 + 碱==== 盐 + 水
定义:酸与碱作用生成盐和水的反应,叫做中和反应.
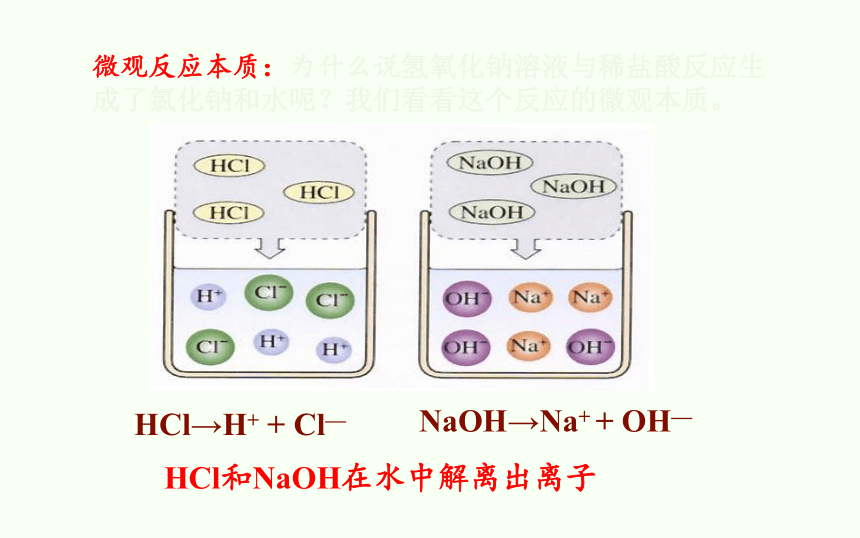
HCl→H+ + Cl—
NaOH→Na+ + OH—
HCl和NaOH在水中解离出离子
微观反应本质:为什么说氢氧化钠溶液与稀盐酸反应生成了氯化钠和水呢?我们看看这个反应的微观本质。
Na+ + Cl- + H2O
H+ + Cl-
+
Na+ + OH-
=
反应中,只有氢离子和氢氧根离子发生反应,而钠离子和氯离子并没有反应,所以这个反应的微观本质是
H+ + OH- = H2O
想一想
有人说:凡是生成盐和水的反应就是中和反应,请问对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 ==== 盐 + 水
酸 + 碱 ==== 盐 + 水
碱 + 非金属氧化物 ==== 盐 + 水。
下列反应,属于中和反应的是 ( )
A 、 Zn +2HCl == ZnCl2 + H2
B、 CuO + 2HCl == CuCl2 + H2O
C 、 Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D 、AgNO3 + HCl == AgCl + HNO3
练习
C
学以致用
举出在实际生产和生活中酸和碱的中和反应的应用
1.改变土壤的酸碱性
植物需要在一定酸碱性的土壤中生长,
但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长。
问题(一)应怎样去改变酸性土壤?
用熟石灰中和。
改良土壤的酸碱性
熟石灰
2.处理工厂的废水
你会处理废水吗?
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
应在排放前用碱性物质(例如熟石灰)进行中和处理。
你能写出化学方程式吗?
Ca(OH)2 + H2 SO4 === CaSO4 + 2H2O
用于医疗和日常生活中
我们来了解胃药治疗胃酸过多的原理。
此药中含有氢氧化铝
3.用于医药
胃乐胶囊的主要成分
你知道它的作用吗?
胃酸的主要成分是
盐酸
氢氧化铝
Al(OH)3 + 3HCl === AlCl3 + 3H2O
(1)氢氧化铝能中和过多胃酸
你能写出化学方程式吗?
用于医药(2)
被蚊虫叮咬后,叮咬处很快肿成大包,这是因为蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿痛。如果涂一些含有碱性物质的药水,就可以减轻痛痒。
pH的范围通常在0~14之间
pH=7时,溶液呈中性
pH<7时,溶液呈酸性
pH>7时,溶液呈碱性
三、溶液酸碱度的表示法——pH
测定pH最简便的方法:用pH试纸
测定时,在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取待测溶液滴在pH试纸上,把试纸显示的颜色跟标准比色卡对照,即可得出溶液的pH。
标准比色卡
pH试纸
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
0 2 4 6 8 10 12 14 16 18 V/m L
2 1
向稀盐酸中滴加氢氧化钠溶液的过程中溶液酸碱性变化的曲线图如下 :
10
11
12
9
8
7
6
5
4 3
(1)当滴入氢氧化钠溶液不足时,pH<7,溶液显酸性,HCl有剩余。
(2)当滴入氢氧化钠溶液与HCl恰好完全反应时,pH=7,溶液显中性。
(3)当滴入氢氧化钠溶液过量时,pH>7,溶液显碱性,氢氧化钠有剩余。
酸性食品
蛋黄、甜点、白糖、金枪鱼、比目鱼、火腿、鸡肉、猪肉、牛肉、面包、小麦、白米、花生、啤酒、海苔、巧克力、葱
碱性食品
葡萄、海带、柑橘、柿子、黄瓜、胡萝卜、大豆、番茄、香蕉、草莓、蛋白、柠檬、菠菜、红豆、苹果、豆腐、卷心菜、油菜、梨、土豆
温馨提示:食品的酸碱性与pH无关。
【知识手册】
(1)化工生产中许多反应必须在一定pH的溶液里才能进行;
(2)在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
(3)测定雨水的pH,可以了解空气的污染情况;
(4)测定人体内或排出的液体的pH,可以了解人体的健康情况。
了解溶液的酸碱度有重要的意义
人体内的一些液体和排泄物的正常pH范围
血浆 7.35 ~ 7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
乳汁 6.6 ~ 7.6
胆汁 7.1 ~ 7.3
胰液 7.5 ~ 8.0
尿液 4.7 ~ 8.4
溶液酸碱度对头发的影响
溶液酸碱度对头发的影响
pH=1 pH=4 pH=7 pH=10 pH=13
观察头发光泽
拉断的难易程度
光泽好
较好
正常
不好
很不好
难
较难
易
很易
正常
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液,然后再用微酸性的护发素来保护头发。
酸和碱的中和反应
学习目标
1、知道中和反应的定义,明确中和反应的实质是什么。
2、能熟练书写4个常见酸和碱的中和反应方程式.
3、会举出在实际生产和生活中酸和碱的中和反应的应用.
实验探究--------酸和碱之间能否反应
取一根干净的试管,往其中加入适量的稀盐酸,然后再加入适量的氢氧化钠溶液,仔细观察现象。
分析上面这个实验
没有明显实验现象,不能作出判断它们之间是否发生了反应。 假设或猜想可能这两种物质根本就没有反应。或可能两种物质反应了,只不过是没有明显的现象。
思考
如何证明氢氧化钠溶液与稀盐酸确实发生了反应?
想一想怎样设计实验证明呢?
活动与探究:
设计实验氢氧化钠溶液与稀盐酸确实发生了反应
操作步骤 现象和分析
(1)在烧杯中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液
(2)在(1)中烧杯中逐滴滴入稀盐酸,并不断搅拌,至溶液颜色恰好变成无色为止。
溶液由无色逐渐变为红色
溶液由红色逐渐变为无色
梳理:氢氧化钠溶液与稀盐酸的反应
1. 现象:红色的酚酞逐渐变成无色。
2. 说明烧杯中还有没有氢氧化钠?
3. 氢氧化钠为什么会没有了呢?
没有,否则酚酞还是红色。
和盐酸反应掉了。说明酸和碱会发生反应。
NaCl+H2O
HCl + NaOH
HCl + Ca(OH) 2
H2SO4+ 2NaOH
CaCl2+2H2O
Na2SO4+2H2O
2
酸 + 碱==== 盐 + 水
定义:酸与碱作用生成盐和水的反应,叫做中和反应.
HCl→H+ + Cl—
NaOH→Na+ + OH—
HCl和NaOH在水中解离出离子
微观反应本质:为什么说氢氧化钠溶液与稀盐酸反应生成了氯化钠和水呢?我们看看这个反应的微观本质。
Na+ + Cl- + H2O
H+ + Cl-
+
Na+ + OH-
=
反应中,只有氢离子和氢氧根离子发生反应,而钠离子和氯离子并没有反应,所以这个反应的微观本质是
H+ + OH- = H2O
想一想
有人说:凡是生成盐和水的反应就是中和反应,请问对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 ==== 盐 + 水
酸 + 碱 ==== 盐 + 水
碱 + 非金属氧化物 ==== 盐 + 水。
下列反应,属于中和反应的是 ( )
A 、 Zn +2HCl == ZnCl2 + H2
B、 CuO + 2HCl == CuCl2 + H2O
C 、 Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D 、AgNO3 + HCl == AgCl + HNO3
练习
C
学以致用
举出在实际生产和生活中酸和碱的中和反应的应用
1.改变土壤的酸碱性
植物需要在一定酸碱性的土壤中生长,
但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长。
问题(一)应怎样去改变酸性土壤?
用熟石灰中和。
改良土壤的酸碱性
熟石灰
2.处理工厂的废水
你会处理废水吗?
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
应在排放前用碱性物质(例如熟石灰)进行中和处理。
你能写出化学方程式吗?
Ca(OH)2 + H2 SO4 === CaSO4 + 2H2O
用于医疗和日常生活中
我们来了解胃药治疗胃酸过多的原理。
此药中含有氢氧化铝
3.用于医药
胃乐胶囊的主要成分
你知道它的作用吗?
胃酸的主要成分是
盐酸
氢氧化铝
Al(OH)3 + 3HCl === AlCl3 + 3H2O
(1)氢氧化铝能中和过多胃酸
你能写出化学方程式吗?
用于医药(2)
被蚊虫叮咬后,叮咬处很快肿成大包,这是因为蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿痛。如果涂一些含有碱性物质的药水,就可以减轻痛痒。
pH的范围通常在0~14之间
pH=7时,溶液呈中性
pH<7时,溶液呈酸性
pH>7时,溶液呈碱性
三、溶液酸碱度的表示法——pH
测定pH最简便的方法:用pH试纸
测定时,在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取待测溶液滴在pH试纸上,把试纸显示的颜色跟标准比色卡对照,即可得出溶液的pH。
标准比色卡
pH试纸
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
0 2 4 6 8 10 12 14 16 18 V/m L
2 1
向稀盐酸中滴加氢氧化钠溶液的过程中溶液酸碱性变化的曲线图如下 :
10
11
12
9
8
7
6
5
4 3
(1)当滴入氢氧化钠溶液不足时,pH<7,溶液显酸性,HCl有剩余。
(2)当滴入氢氧化钠溶液与HCl恰好完全反应时,pH=7,溶液显中性。
(3)当滴入氢氧化钠溶液过量时,pH>7,溶液显碱性,氢氧化钠有剩余。
酸性食品
蛋黄、甜点、白糖、金枪鱼、比目鱼、火腿、鸡肉、猪肉、牛肉、面包、小麦、白米、花生、啤酒、海苔、巧克力、葱
碱性食品
葡萄、海带、柑橘、柿子、黄瓜、胡萝卜、大豆、番茄、香蕉、草莓、蛋白、柠檬、菠菜、红豆、苹果、豆腐、卷心菜、油菜、梨、土豆
温馨提示:食品的酸碱性与pH无关。
【知识手册】
(1)化工生产中许多反应必须在一定pH的溶液里才能进行;
(2)在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
(3)测定雨水的pH,可以了解空气的污染情况;
(4)测定人体内或排出的液体的pH,可以了解人体的健康情况。
了解溶液的酸碱度有重要的意义
人体内的一些液体和排泄物的正常pH范围
血浆 7.35 ~ 7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
乳汁 6.6 ~ 7.6
胆汁 7.1 ~ 7.3
胰液 7.5 ~ 8.0
尿液 4.7 ~ 8.4
溶液酸碱度对头发的影响
溶液酸碱度对头发的影响
pH=1 pH=4 pH=7 pH=10 pH=13
观察头发光泽
拉断的难易程度
光泽好
较好
正常
不好
很不好
难
较难
易
很易
正常
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液,然后再用微酸性的护发素来保护头发。
同课章节目录
