第3章《简单的有机化合物》测试卷
文档属性
| 名称 | 第3章《简单的有机化合物》测试卷 |  | |
| 格式 | doc | ||
| 文件大小 | 114.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-29 21:05:40 | ||
图片预览



文档简介
第3章《简单的有机化合物》测试卷
一、单选题(共15小题)
1.下列关于苯燃烧的现象解释不正确的是( )
A. 苯燃烧火焰明亮是因为苯中氢元素的含量较低
B. 苯燃烧产生大量黑烟是因为苯的含碳量较高
C. 等质量苯和甲烷分别燃烧,苯消耗氧气少,是因为苯中氢的含量较低
D. 苯完全燃烧的产物是二氧化碳和水,二者的物质的量比为2∶1
2.下列说法中正确的是( )
A. 含有碳、氢、氧三种元素的化合物一定是有机物
B. 有机物都难溶于水,都是非电解质
C. 烃是含有碳元素和氢元素的化合物
D. 甲烷是最简单的烃类有机物
3.某高分子材料的结构简式为,组成该化合物的单体可能为
其中正确的组合是( )
A. ①②③
B. ①③④
C. ③④⑤
D. ②③⑤
4.用括号中的试剂和方法除去各物质中的杂质,正确的是( )
A. 甲烷中的乙烯(酸性高锰酸钾溶液,洗气)
B. 乙醇中的乙酸(NaOH溶液,分液)
C. 乙醇中的水(CaO,蒸馏)
D. 乙酸乙酯中的乙酸(加入浓硫酸和过量乙醇并加热)
5.芳香族化合物M的结构简式为,下列关于有机物M的说法正确的是( )
A. 有机物M的分子式为C10H12O3
B. 1 mol Na2CO3最多能消耗1 mol有机物M
C. 1 mol M和足量金属钠反应生成22.4 L气体
D. 有机物M能发生取代、氧化、还原和加聚反应
6.下列各组物质可用银氨溶液鉴别的是( )
A. 淀粉和纤维素
B. 葡萄糖和蔗糖
C. 蔗糖和淀粉
D. 葡萄糖和麦芽糖
7.乙醇分子结构中各种化学键如图所示,
关于乙醇在各种反应中断键的说明不正确的是( )
A. 与乙酸反应生成乙酸乙酯时,键①断裂
B. 与金属钠反应时,键①断裂
C. 在铜催化下和氧气反应时,键①⑤断裂
D. 在CH3CH2OH+HBr―→CH3CH2Br+H2O 中,键②断裂
8.下列有关氨基酸的理解正确的是( )
A. 氨基酸在人体中被分解,不能用于合成新蛋白质
B. 氨基酸包括甘氨酸、色氨酸和丙氨酸三种
C. 氨基酸的结构中一定含氨基和羧基,且氨基与羧基连在相邻的碳原子上
D. 氨基酸与碱反应生成盐类物质
9.下列各分子的原子都处于同一平面的有 ( )
A. 甲烷
B. 乙烯
C. 氨气
D. 一氯甲烷
10.溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如下图所示的装置来制取(该反应放出热量)。制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象。下列说法错误的是( )
A. 制备溴苯的反应属于取代反应
B. 白雾出现是因为溴化氢易挥发且极易溶于水
C. 装置图中长直玻璃导管仅起导气作用
D. 溴苯中溶有少量的溴,可用氢氧化钠溶液洗涤除去
11.聚氯乙烯简称PVC,是当今世界上产量最大、应用最广的热塑性塑料之一。化学工作者和广大消费者十分关注PVC保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自塑料中残留的PVC单体以及不符合国家标准的增塑剂。下列选项中的事实能支持“PVC保鲜膜对人体健康带来危害”的假设是( )
A. PVC塑料属于有机物
B. 使用的有机助剂能提高PVC塑料的性质
C. 含氯的化合物不一定有毒
D. 在高温下会分解出有毒物质
12.我国本土药学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理学或医学奖。已知二羟甲戊酸()是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
A. 与乙醇发生酯化反应生成产物的分子式为C8H18O4
B. 能发生加成反应,不能发生取代反应
C. 在铜催化下可以与氧气发生反应
D. 标准状况下1 mol该有机物可以与足量金属钠反应产生22.4 L H2
13.下列关于乙烯的叙述中,不正确的是( )
A. 是一种无色无味、不溶于水的气体
B. 能燃烧火焰明亮、伴有黑烟产生
C. 完全燃烧后的产物能使石灰水变浑浊
D. 完全燃烧生成的二氧化碳和水的物质的量不相等
14.下列关于有机高分子化合物的说法正确的是( )
A. 高级脂肪酸甘油酯相对分子质量很大,属于高分子化合物
B. 缩聚反应的单体至少有两种物质
C. 线性高分子的长链上可以带支链
D. 电木具有热塑性
15.新型弹性材料“丁苯吡橡胶”的结构简式如图所示。其单体可能是下列6种中的几种,其中正确的组合是( )
①
②CH2==CH—CH==CH2
③
④CH3CH==CHCH3
⑤
⑥CH2==CH—N==CH2
A. ②③⑥
B. ②③⑤
C. ①②⑥
D. ②④⑥
二、实验题(共3小题)
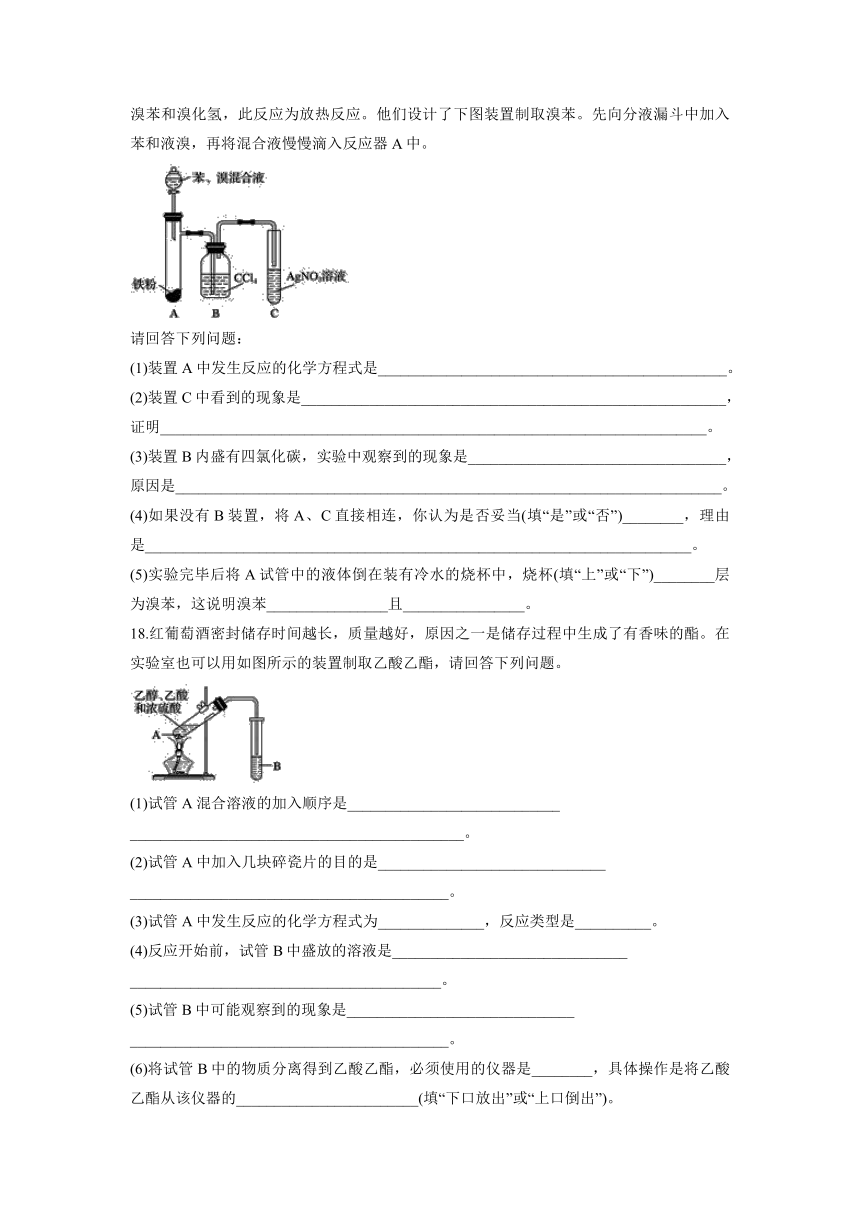
16.探究苯与溴反应生成溴苯的实验可用如图所示装置,分析装置并完成下列题目:
(1)关闭止水夹F,打开止水夹C,由A口向装有少量苯的三口烧瓶中加入过量液溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的化学方程式为_________________________。
(2)D、E试管内出现的现象分别为:D.____________________,E.__________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时,松开止水夹F,关闭止水夹C,可以看到的现象是________________________________________________________________________
________________________________________________________________________。
17.某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
请回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________________。
(2)装置C中看到的现象是________________________________________________________,
证明________________________________________________________________________。
(3)装置B内盛有四氯化碳,实验中观察到的现象是__________________________________,
原因是________________________________________________________________________。
(4)如果没有B装置,将A、C直接相连,你认为是否妥当(填“是”或“否”)________,理由是________________________________________________________________________。
(5)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯(填“上”或“下”)________层为溴苯,这说明溴苯________________且________________。
18.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题。
(1)试管A混合溶液的加入顺序是____________________________
____________________________________________。
(2)试管A中加入几块碎瓷片的目的是______________________________
__________________________________________。
(3)试管A中发生反应的化学方程式为______________,反应类型是__________。
(4)反应开始前,试管B中盛放的溶液是_______________________________
_________________________________________。
(5)试管B中可能观察到的现象是______________________________
__________________________________________。
(6)将试管B中的物质分离得到乙酸乙酯,必须使用的仪器是________,具体操作是将乙酸乙酯从该仪器的________________________(填“下口放出”或“上口倒出”)。
三、计算题(共3小题)
19.已知6.2克某有机物在氧气中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加5.4克,干燥管的质量增加8.8克。
(1)计算确定该有机物的最简式。
(2)相同条件下,若该有机物蒸气相对氢气的密度为31,计算确定该有机物的分子式。
20.在常温下的一密闭容器中事先放入1.56 g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?
(2)通入氧气的质量最大应是多少?
21.某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48 L混合气体通过足量的溴水,结果溴水增重3.36 g,求原混合气体中各烃的体积分数。
四、填空题(共3小题)
22.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋的主要酸性成分苹果酸的结构简式为HOOCCHOHCH2COOH。请回答下列问题:
(1)苹果酸中含有的官能团的名称是________、____________________________
____________________________________________;
(2)苹果酸的分子式为________;
(3)1 mol苹果酸与足量金属钠反应,能生成标准状况下的氢气________L;
(4)苹果酸可能发生的反应是________;
A.与氢氧化钠溶液反应
B.与石蕊溶液作用
C.与乙酸在一定条件下酯化
D.与乙醇在一定条件下酯化
23.下列四种有机物:①CH3CH(OH)COOH、②HOOC—COOH、③CH3CH2COOH、④CH3CH2OH,回答下列问题:
(1)它们等物质的量分别与足量碳酸氢钠溶液反应,产生气体的体积最多的是______________;
(2)若将碳酸氢钠改为金属钠,则产生气体的体积由多到少的顺序是怎样的____________;
(3)若将碳酸氢钠改为氢氧化钠,则消耗氢氧化钠由多到少的顺序是____________。
24.乙酸是生活中常见的有机物之一,回答下列问题:
(1)乙酸的官能团的名称为________________________________________。
(2)用食醋清除暖瓶内壁附着的水垢(碳酸钙),反应的化学方程式是________________________________________________________________________。
(3)乙酸与乙醇反应生成具有香味的乙酸乙酯的反应类型是____________。
答案解析
1.【答案】A
【解析】烃的燃烧现象与其含碳量和含氢量有关。含碳量越高火焰越明亮、产生的黑烟越浓;烃中氢元素的质量分数越大,相同质量完全燃烧时的耗氧量越大;根据苯的分子式可知,苯完全燃烧的产物是二氧化碳和水,二者的物质的量比为2∶1。
2.【答案】D
【解析】由碳、氢、氧三种元素组成的化合物不一定是有机物,如碳酸是无机物;某些有机物(如乙酸)易溶于水,其水溶液能导电,乙酸是电解质;烃是仅含有碳元素和氢元素的有机物;
烃一定含有碳和氢两种元素;甲烷是最简单的烃类有机物。
3.【答案】B
【解析】高聚物的结构简式的主链含有6个C原子,且含有碳碳双键,则该有机物的单体可能有两种或3种;由于碳碳双键位于链节的中间位置,如果中间四个碳原子为一种单体,则主链中其他的两种物质只含有1个C,无法形成碳碳双键,所以该有机物分子的单体有3种,从左向右按照每2个C断开,然后分别将两个半键闭合即可该有机物的单体分别为、、
,故选B。
4.【答案】C
【解析】乙烯可被氧化为二氧化碳,会引入新杂质,A错误;乙酸与氢氧化钠反应生成乙酸钠,溶于水、乙醇与之不分层,B错误;乙酸与乙醇的酯化反应是可逆反应,即使乙醇过量,也不能将乙酸除尽,且引入新杂质,D错误。
5.【答案】D
【解析】根据有机物的结构简式可知,M分子中的碳原子数为10、氧原子数为3、不饱和度为6,则氢原子数为2×10+2-2×6=10,则M的分子式为C10H10O3,A项错误;1 mol M分子中含有1 mol羧基,因此1 mol Na2CO3最多能消耗2 mol有机物M,B项错误;未指明气体是否为标准状况,无法求出生成气体的体积,C项错误;M中含有碳碳双键,能发生氧化、还原、加聚反应;含有羟基,能发生氧化、取代反应;含有羧基,能发生取代反应,D项正确。
6.【答案】B
【解析】葡萄糖、麦芽糖具有还原性,能与银氨溶液发生银镜反应;蔗糖、淀粉、纤维素为非还原性糖,不能与银氨溶液发生银镜反应。
7.【答案】C
【解析】乙醇与金属钠反应、与乙酸反应时,都是断裂的羟基上的氢氧键即①键;乙醇的催化氧化反应中,断裂的是羟基上的氢氧键及与羟基所连的碳氢键即①③键断裂;在CH3CH2OH+HBr―→CH3CH2Br+H2O 反应中键②断裂。
8.【答案】D
【解析】A项,氨基酸在人体中可合成新的蛋白质,该项错误。B项,氨基酸的种类有很多,不止三种,该项错误。C项,氨基酸的氨基与羧基也可以连在同一个碳原子上,如α 氨基酸,该项错误。D项正确。
9.【答案】B
【解析】甲烷分子为正四面体,乙烯分子为平面结构,氨分子为三角锥形,一氯甲烷为四面体结构。
10.【答案】C
【解析】苯和液溴混合后撒入铁粉,在铁作催化剂条件下,苯环上的氢原子被溴原子取代生成溴苯,属于取代反应;溴化氢溶于水易形成白雾;苯和溴在铁的作用下反应剧烈,可以达到沸腾,使苯和溴成为蒸汽,在经过长导管时,可以将之冷凝并回流下来,长导管的作用是导气和冷凝回流;溴苯与氢氧化钠不反应,溴与氢氧化钠反应生成溴化钠和次溴酸钠,可用氢氧化钠溶液洗涤除去溴苯中的溴。
11.【答案】D
【解析】有机物及有机助剂不一定对人体有害,有机助剂提高PVC塑料的性能与健康无关,故A、B项不正确;含氯化合物不一定有毒和PVC与健康无直接关系,故C项不能支持,PVC在高温下会分解生成HCl等有害物质,故D项可支持假设。
12.【答案】C
【解析】A项,二羟甲戊酸结构中含一个—COOH,与乙醇发生酯化反应生成物中有一个酯基,其分子式为C8H16O4,错误;B项,不能发生加成反应,能发生取代反应,错误;C项,该物质中含—CH2OH,在铜催化下能与氧气发生反应,正确;D项,1 mol 该有机物与足量金属钠反应可生成1.5 mol氢气,错误。
13.【答案】D
【解析】乙烯是一种无色无味、不溶于水的气体,能燃烧火焰明亮、伴有黑烟产生,燃烧产物为二氧化碳和水,二氧化碳能使石灰水变浑浊。由乙烯的分子式(C2H4)可知,乙烯燃烧生成二氧化碳和水的物质的量相等。
14.【答案】C
【解析】油脂的相对分子质量在10 000以下,不是高分子;有机物酧CHCH3C錙由一种单体缩聚而成,单体为CHHOCH3COOH;线型高分子可能含有支链,如聚丙烯,也可能不含支链,如聚乙烯; 电木属于体型的高分子,具有热固性;故选C。
15.【答案】B
【解析】以聚合物主链的碳碳双键为中心的四个C原子断开,单键变双键,双键变单键;其他无碳碳双键的,则每两个C原子断开,两个C原子之间单键变双键即可。得到相应的单体是CH2==CH—CH==CH2、、。因此正确组合是②③⑤,选项B正确。
16.【答案】(1)+Br2+HBr (2)石蕊溶液变红 有淡黄色沉淀生成 (3)洗气瓶内水面上出现大量白雾
【解析】在溴化铁做催化剂的条件下,苯和液溴反应生成溴苯和溴化氢,溴化氢遇水蒸气产生白雾,遇硝酸银溶液产生淡黄色溴化银沉淀。
17.【答案】(1)2Fe+3Br22FeBr3 +Br2+HBr
(2)导管口有白雾,试管内有淡黄色的沉淀生成 有溴化氢生成
(3)液体变橙色 反应放热,挥发逸出的溴蒸气溶于四氯化碳中
(4)否 挥发逸出的溴蒸气能与硝酸银溶液反应
(5)下 不溶于水 密度比水大
【解析】在催化剂溴化铁的作用下,苯与溴发生取代反应,生成溴苯和溴化氢。溴化氢极易与水蒸气形成白雾,其水溶液能与硝酸银溶液反应,生成淡黄色沉淀溴化银(不溶于硝酸),因此常用硝酸银溶液检验溴化氢的生成,证明溴和苯能发生取代反应。装置B中的四氯化碳能吸收挥发逸出的苯、溴蒸气,排除溴蒸气对溴化氢检验的干扰。
18.【答案】(1)先加入乙醇、再加入浓硫酸、最后加入乙酸
(2)防止液体暴沸
(3)CH3COOH+CH3CH2OHCH3COOC2H5+H2O 酯化反应(或取代反应)
(4)饱和碳酸钠溶液
(5)液面上有透明不溶于水、具有香味的油状液体生成
(6)分液漏斗 上口倒出
【解析】分析解题的基点:乙酸乙酯制取实验的相关问题。
①药品加入顺序:先加入乙醇、再加入浓硫酸、最后加入乙酸;
②浓硫酸的作用:催化剂和吸水剂;
③产品乙酸乙酯的收集与净化:饱和碳酸钠溶液的作用;
④玻璃导管不能插入碳酸钠溶液液面下:防止倒吸;
⑤观察到的现象:上层为油状液体,具有果香气味;
⑥分离乙酸乙酯的方法与仪器:分液漏斗;
⑦制取反应原理:化学方程式、可逆反应;
⑧实验装置的改进:球形干燥管(起冷凝作用并能防止倒吸)。
19.【答案】(1)该有机物的最简式为CH3O (2)该有机物的分子式为C2H6O2
【解析】(1)被浓硫酸吸收的燃烧产物为H2O,其质量为5.4克;被碱石灰吸收的燃烧产物为CO2,其质量为8.8克。
5.4克H2O中含氢元素0.6克,
8.8克CO2中含碳元素2.4克, (2.4 + 0.6)克<6.2克,
6.2克该有机物含有氧元素3.2克,
有机物分子中C、H、O原子个数比为1∶3∶1,
该有机物的最简式为CH3O,
(2)该有机物蒸气相对氢气的密度为31,其相对分子质量为62,(12×1+1×3+16×1)n=62,n=2,分子式为C2H6O2。
20.【答案】(1)1≤≤2.5 (2)0.8 g
【解析】(1)本题可通过方程式的叠加方法进行解答:
C2H6+3.5O2―→2CO2+3H2O①
2CO2+2Na2O2===2Na2CO3+O2②
2H2O+2Na2O2===4NaOH+O2↑③
由于在室温下水是液体,可参加反应,也可不参加反应,因此可用极端法判断:
若水参加反应,则有①+②+1.5×③:
C2H6+5Na2O2+O2===2Na2CO3+6NaOH④
若水不参加反应,则有①+②:
C2H6+2Na2O2+2.5O2===2Na2CO3+3H2O⑤
故不难得出正确结论。
(2)通入氧气最大量时按⑤进行。
nO2=nNa2O2=×=0.025 mol
mO2=0.025 mol×32 g·mol-1=0.8 g
21.【答案】甲烷:60%,丙烯:40%。
【解析】混合气体的平均相对分子质量为13.2×2=26.4,必有甲烷,混合气体的物质的量为4.48 L÷22.4 L·mol-1=0.2 mol,混合气体的质量为0.2 mol×26.4 g·mol-1=5.28 g,甲烷的物质的量为(5.28 g-3.36 g)÷16 g·mol-1=0.12 mol,设烯烃的分子式为CnH2n,
(0.2 mol-0.12 mol)×14ng·mol-1=3.36 g,
解得n=3,烯烃为丙烯,
甲烷的体积分数为(0.12 mol÷0.2 mol)×100%=60%;
丙烯的体积分数为(0.08 mol÷0.2 mol)×100%=40%。
22.【答案】(1)羟基 羧基 (2)C4H6O5 (3)33.6 (4)ABCD
【解析】分析解题的基点:有机物分子中官能团的识别及其性质推断。
苹果酸中含有2个—COOH和1个—OH,都可以与钠反应产生氢气,故1 mol 苹果酸与足量钠反应可产生氢气 1.5 mol。它含有—COOH可与石蕊溶液作用,可与氢氧化钠、乙醇反应。它含有—OH可与乙酸发生酯化反应。
23.【答案】(1)②
(2)①=②>③=④
(3)②>①=③>④=0
【解析】分析解题的基点:羧基和羟基氢原子活泼性强弱不同。只有羧基能与碳酸氢钠溶液、氢氧化钠溶液反应,羟基不能与碳酸氢钠溶液、氢氧化钠溶液反应,但二者都能与金属钠反应。
24.【答案】(1)羧基 (2)2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑
(3)酯化反应
【解析】分析解题的基点:乙酸的官能团(羧基),乙酸的性质(酸性比碳酸强、能发生酯化反应)。
一、单选题(共15小题)
1.下列关于苯燃烧的现象解释不正确的是( )
A. 苯燃烧火焰明亮是因为苯中氢元素的含量较低
B. 苯燃烧产生大量黑烟是因为苯的含碳量较高
C. 等质量苯和甲烷分别燃烧,苯消耗氧气少,是因为苯中氢的含量较低
D. 苯完全燃烧的产物是二氧化碳和水,二者的物质的量比为2∶1
2.下列说法中正确的是( )
A. 含有碳、氢、氧三种元素的化合物一定是有机物
B. 有机物都难溶于水,都是非电解质
C. 烃是含有碳元素和氢元素的化合物
D. 甲烷是最简单的烃类有机物
3.某高分子材料的结构简式为,组成该化合物的单体可能为
其中正确的组合是( )
A. ①②③
B. ①③④
C. ③④⑤
D. ②③⑤
4.用括号中的试剂和方法除去各物质中的杂质,正确的是( )
A. 甲烷中的乙烯(酸性高锰酸钾溶液,洗气)
B. 乙醇中的乙酸(NaOH溶液,分液)
C. 乙醇中的水(CaO,蒸馏)
D. 乙酸乙酯中的乙酸(加入浓硫酸和过量乙醇并加热)
5.芳香族化合物M的结构简式为,下列关于有机物M的说法正确的是( )
A. 有机物M的分子式为C10H12O3
B. 1 mol Na2CO3最多能消耗1 mol有机物M
C. 1 mol M和足量金属钠反应生成22.4 L气体
D. 有机物M能发生取代、氧化、还原和加聚反应
6.下列各组物质可用银氨溶液鉴别的是( )
A. 淀粉和纤维素
B. 葡萄糖和蔗糖
C. 蔗糖和淀粉
D. 葡萄糖和麦芽糖
7.乙醇分子结构中各种化学键如图所示,
关于乙醇在各种反应中断键的说明不正确的是( )
A. 与乙酸反应生成乙酸乙酯时,键①断裂
B. 与金属钠反应时,键①断裂
C. 在铜催化下和氧气反应时,键①⑤断裂
D. 在CH3CH2OH+HBr―→CH3CH2Br+H2O 中,键②断裂
8.下列有关氨基酸的理解正确的是( )
A. 氨基酸在人体中被分解,不能用于合成新蛋白质
B. 氨基酸包括甘氨酸、色氨酸和丙氨酸三种
C. 氨基酸的结构中一定含氨基和羧基,且氨基与羧基连在相邻的碳原子上
D. 氨基酸与碱反应生成盐类物质
9.下列各分子的原子都处于同一平面的有 ( )
A. 甲烷
B. 乙烯
C. 氨气
D. 一氯甲烷
10.溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如下图所示的装置来制取(该反应放出热量)。制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象。下列说法错误的是( )
A. 制备溴苯的反应属于取代反应
B. 白雾出现是因为溴化氢易挥发且极易溶于水
C. 装置图中长直玻璃导管仅起导气作用
D. 溴苯中溶有少量的溴,可用氢氧化钠溶液洗涤除去
11.聚氯乙烯简称PVC,是当今世界上产量最大、应用最广的热塑性塑料之一。化学工作者和广大消费者十分关注PVC保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自塑料中残留的PVC单体以及不符合国家标准的增塑剂。下列选项中的事实能支持“PVC保鲜膜对人体健康带来危害”的假设是( )
A. PVC塑料属于有机物
B. 使用的有机助剂能提高PVC塑料的性质
C. 含氯的化合物不一定有毒
D. 在高温下会分解出有毒物质
12.我国本土药学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理学或医学奖。已知二羟甲戊酸()是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
A. 与乙醇发生酯化反应生成产物的分子式为C8H18O4
B. 能发生加成反应,不能发生取代反应
C. 在铜催化下可以与氧气发生反应
D. 标准状况下1 mol该有机物可以与足量金属钠反应产生22.4 L H2
13.下列关于乙烯的叙述中,不正确的是( )
A. 是一种无色无味、不溶于水的气体
B. 能燃烧火焰明亮、伴有黑烟产生
C. 完全燃烧后的产物能使石灰水变浑浊
D. 完全燃烧生成的二氧化碳和水的物质的量不相等
14.下列关于有机高分子化合物的说法正确的是( )
A. 高级脂肪酸甘油酯相对分子质量很大,属于高分子化合物
B. 缩聚反应的单体至少有两种物质
C. 线性高分子的长链上可以带支链
D. 电木具有热塑性
15.新型弹性材料“丁苯吡橡胶”的结构简式如图所示。其单体可能是下列6种中的几种,其中正确的组合是( )
①
②CH2==CH—CH==CH2
③
④CH3CH==CHCH3
⑤
⑥CH2==CH—N==CH2
A. ②③⑥
B. ②③⑤
C. ①②⑥
D. ②④⑥
二、实验题(共3小题)
16.探究苯与溴反应生成溴苯的实验可用如图所示装置,分析装置并完成下列题目:
(1)关闭止水夹F,打开止水夹C,由A口向装有少量苯的三口烧瓶中加入过量液溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的化学方程式为_________________________。
(2)D、E试管内出现的现象分别为:D.____________________,E.__________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时,松开止水夹F,关闭止水夹C,可以看到的现象是________________________________________________________________________
________________________________________________________________________。
17.某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
请回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________________。
(2)装置C中看到的现象是________________________________________________________,
证明________________________________________________________________________。
(3)装置B内盛有四氯化碳,实验中观察到的现象是__________________________________,
原因是________________________________________________________________________。
(4)如果没有B装置,将A、C直接相连,你认为是否妥当(填“是”或“否”)________,理由是________________________________________________________________________。
(5)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯(填“上”或“下”)________层为溴苯,这说明溴苯________________且________________。
18.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题。
(1)试管A混合溶液的加入顺序是____________________________
____________________________________________。
(2)试管A中加入几块碎瓷片的目的是______________________________
__________________________________________。
(3)试管A中发生反应的化学方程式为______________,反应类型是__________。
(4)反应开始前,试管B中盛放的溶液是_______________________________
_________________________________________。
(5)试管B中可能观察到的现象是______________________________
__________________________________________。
(6)将试管B中的物质分离得到乙酸乙酯,必须使用的仪器是________,具体操作是将乙酸乙酯从该仪器的________________________(填“下口放出”或“上口倒出”)。
三、计算题(共3小题)
19.已知6.2克某有机物在氧气中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加5.4克,干燥管的质量增加8.8克。
(1)计算确定该有机物的最简式。
(2)相同条件下,若该有机物蒸气相对氢气的密度为31,计算确定该有机物的分子式。
20.在常温下的一密闭容器中事先放入1.56 g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?
(2)通入氧气的质量最大应是多少?
21.某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48 L混合气体通过足量的溴水,结果溴水增重3.36 g,求原混合气体中各烃的体积分数。
四、填空题(共3小题)
22.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋的主要酸性成分苹果酸的结构简式为HOOCCHOHCH2COOH。请回答下列问题:
(1)苹果酸中含有的官能团的名称是________、____________________________
____________________________________________;
(2)苹果酸的分子式为________;
(3)1 mol苹果酸与足量金属钠反应,能生成标准状况下的氢气________L;
(4)苹果酸可能发生的反应是________;
A.与氢氧化钠溶液反应
B.与石蕊溶液作用
C.与乙酸在一定条件下酯化
D.与乙醇在一定条件下酯化
23.下列四种有机物:①CH3CH(OH)COOH、②HOOC—COOH、③CH3CH2COOH、④CH3CH2OH,回答下列问题:
(1)它们等物质的量分别与足量碳酸氢钠溶液反应,产生气体的体积最多的是______________;
(2)若将碳酸氢钠改为金属钠,则产生气体的体积由多到少的顺序是怎样的____________;
(3)若将碳酸氢钠改为氢氧化钠,则消耗氢氧化钠由多到少的顺序是____________。
24.乙酸是生活中常见的有机物之一,回答下列问题:
(1)乙酸的官能团的名称为________________________________________。
(2)用食醋清除暖瓶内壁附着的水垢(碳酸钙),反应的化学方程式是________________________________________________________________________。
(3)乙酸与乙醇反应生成具有香味的乙酸乙酯的反应类型是____________。
答案解析
1.【答案】A
【解析】烃的燃烧现象与其含碳量和含氢量有关。含碳量越高火焰越明亮、产生的黑烟越浓;烃中氢元素的质量分数越大,相同质量完全燃烧时的耗氧量越大;根据苯的分子式可知,苯完全燃烧的产物是二氧化碳和水,二者的物质的量比为2∶1。
2.【答案】D
【解析】由碳、氢、氧三种元素组成的化合物不一定是有机物,如碳酸是无机物;某些有机物(如乙酸)易溶于水,其水溶液能导电,乙酸是电解质;烃是仅含有碳元素和氢元素的有机物;
烃一定含有碳和氢两种元素;甲烷是最简单的烃类有机物。
3.【答案】B
【解析】高聚物的结构简式的主链含有6个C原子,且含有碳碳双键,则该有机物的单体可能有两种或3种;由于碳碳双键位于链节的中间位置,如果中间四个碳原子为一种单体,则主链中其他的两种物质只含有1个C,无法形成碳碳双键,所以该有机物分子的单体有3种,从左向右按照每2个C断开,然后分别将两个半键闭合即可该有机物的单体分别为、、
,故选B。
4.【答案】C
【解析】乙烯可被氧化为二氧化碳,会引入新杂质,A错误;乙酸与氢氧化钠反应生成乙酸钠,溶于水、乙醇与之不分层,B错误;乙酸与乙醇的酯化反应是可逆反应,即使乙醇过量,也不能将乙酸除尽,且引入新杂质,D错误。
5.【答案】D
【解析】根据有机物的结构简式可知,M分子中的碳原子数为10、氧原子数为3、不饱和度为6,则氢原子数为2×10+2-2×6=10,则M的分子式为C10H10O3,A项错误;1 mol M分子中含有1 mol羧基,因此1 mol Na2CO3最多能消耗2 mol有机物M,B项错误;未指明气体是否为标准状况,无法求出生成气体的体积,C项错误;M中含有碳碳双键,能发生氧化、还原、加聚反应;含有羟基,能发生氧化、取代反应;含有羧基,能发生取代反应,D项正确。
6.【答案】B
【解析】葡萄糖、麦芽糖具有还原性,能与银氨溶液发生银镜反应;蔗糖、淀粉、纤维素为非还原性糖,不能与银氨溶液发生银镜反应。
7.【答案】C
【解析】乙醇与金属钠反应、与乙酸反应时,都是断裂的羟基上的氢氧键即①键;乙醇的催化氧化反应中,断裂的是羟基上的氢氧键及与羟基所连的碳氢键即①③键断裂;在CH3CH2OH+HBr―→CH3CH2Br+H2O 反应中键②断裂。
8.【答案】D
【解析】A项,氨基酸在人体中可合成新的蛋白质,该项错误。B项,氨基酸的种类有很多,不止三种,该项错误。C项,氨基酸的氨基与羧基也可以连在同一个碳原子上,如α 氨基酸,该项错误。D项正确。
9.【答案】B
【解析】甲烷分子为正四面体,乙烯分子为平面结构,氨分子为三角锥形,一氯甲烷为四面体结构。
10.【答案】C
【解析】苯和液溴混合后撒入铁粉,在铁作催化剂条件下,苯环上的氢原子被溴原子取代生成溴苯,属于取代反应;溴化氢溶于水易形成白雾;苯和溴在铁的作用下反应剧烈,可以达到沸腾,使苯和溴成为蒸汽,在经过长导管时,可以将之冷凝并回流下来,长导管的作用是导气和冷凝回流;溴苯与氢氧化钠不反应,溴与氢氧化钠反应生成溴化钠和次溴酸钠,可用氢氧化钠溶液洗涤除去溴苯中的溴。
11.【答案】D
【解析】有机物及有机助剂不一定对人体有害,有机助剂提高PVC塑料的性能与健康无关,故A、B项不正确;含氯化合物不一定有毒和PVC与健康无直接关系,故C项不能支持,PVC在高温下会分解生成HCl等有害物质,故D项可支持假设。
12.【答案】C
【解析】A项,二羟甲戊酸结构中含一个—COOH,与乙醇发生酯化反应生成物中有一个酯基,其分子式为C8H16O4,错误;B项,不能发生加成反应,能发生取代反应,错误;C项,该物质中含—CH2OH,在铜催化下能与氧气发生反应,正确;D项,1 mol 该有机物与足量金属钠反应可生成1.5 mol氢气,错误。
13.【答案】D
【解析】乙烯是一种无色无味、不溶于水的气体,能燃烧火焰明亮、伴有黑烟产生,燃烧产物为二氧化碳和水,二氧化碳能使石灰水变浑浊。由乙烯的分子式(C2H4)可知,乙烯燃烧生成二氧化碳和水的物质的量相等。
14.【答案】C
【解析】油脂的相对分子质量在10 000以下,不是高分子;有机物酧CHCH3C錙由一种单体缩聚而成,单体为CHHOCH3COOH;线型高分子可能含有支链,如聚丙烯,也可能不含支链,如聚乙烯; 电木属于体型的高分子,具有热固性;故选C。
15.【答案】B
【解析】以聚合物主链的碳碳双键为中心的四个C原子断开,单键变双键,双键变单键;其他无碳碳双键的,则每两个C原子断开,两个C原子之间单键变双键即可。得到相应的单体是CH2==CH—CH==CH2、、。因此正确组合是②③⑤,选项B正确。
16.【答案】(1)+Br2+HBr (2)石蕊溶液变红 有淡黄色沉淀生成 (3)洗气瓶内水面上出现大量白雾
【解析】在溴化铁做催化剂的条件下,苯和液溴反应生成溴苯和溴化氢,溴化氢遇水蒸气产生白雾,遇硝酸银溶液产生淡黄色溴化银沉淀。
17.【答案】(1)2Fe+3Br22FeBr3 +Br2+HBr
(2)导管口有白雾,试管内有淡黄色的沉淀生成 有溴化氢生成
(3)液体变橙色 反应放热,挥发逸出的溴蒸气溶于四氯化碳中
(4)否 挥发逸出的溴蒸气能与硝酸银溶液反应
(5)下 不溶于水 密度比水大
【解析】在催化剂溴化铁的作用下,苯与溴发生取代反应,生成溴苯和溴化氢。溴化氢极易与水蒸气形成白雾,其水溶液能与硝酸银溶液反应,生成淡黄色沉淀溴化银(不溶于硝酸),因此常用硝酸银溶液检验溴化氢的生成,证明溴和苯能发生取代反应。装置B中的四氯化碳能吸收挥发逸出的苯、溴蒸气,排除溴蒸气对溴化氢检验的干扰。
18.【答案】(1)先加入乙醇、再加入浓硫酸、最后加入乙酸
(2)防止液体暴沸
(3)CH3COOH+CH3CH2OHCH3COOC2H5+H2O 酯化反应(或取代反应)
(4)饱和碳酸钠溶液
(5)液面上有透明不溶于水、具有香味的油状液体生成
(6)分液漏斗 上口倒出
【解析】分析解题的基点:乙酸乙酯制取实验的相关问题。
①药品加入顺序:先加入乙醇、再加入浓硫酸、最后加入乙酸;
②浓硫酸的作用:催化剂和吸水剂;
③产品乙酸乙酯的收集与净化:饱和碳酸钠溶液的作用;
④玻璃导管不能插入碳酸钠溶液液面下:防止倒吸;
⑤观察到的现象:上层为油状液体,具有果香气味;
⑥分离乙酸乙酯的方法与仪器:分液漏斗;
⑦制取反应原理:化学方程式、可逆反应;
⑧实验装置的改进:球形干燥管(起冷凝作用并能防止倒吸)。
19.【答案】(1)该有机物的最简式为CH3O (2)该有机物的分子式为C2H6O2
【解析】(1)被浓硫酸吸收的燃烧产物为H2O,其质量为5.4克;被碱石灰吸收的燃烧产物为CO2,其质量为8.8克。
5.4克H2O中含氢元素0.6克,
8.8克CO2中含碳元素2.4克, (2.4 + 0.6)克<6.2克,
6.2克该有机物含有氧元素3.2克,
有机物分子中C、H、O原子个数比为1∶3∶1,
该有机物的最简式为CH3O,
(2)该有机物蒸气相对氢气的密度为31,其相对分子质量为62,(12×1+1×3+16×1)n=62,n=2,分子式为C2H6O2。
20.【答案】(1)1≤≤2.5 (2)0.8 g
【解析】(1)本题可通过方程式的叠加方法进行解答:
C2H6+3.5O2―→2CO2+3H2O①
2CO2+2Na2O2===2Na2CO3+O2②
2H2O+2Na2O2===4NaOH+O2↑③
由于在室温下水是液体,可参加反应,也可不参加反应,因此可用极端法判断:
若水参加反应,则有①+②+1.5×③:
C2H6+5Na2O2+O2===2Na2CO3+6NaOH④
若水不参加反应,则有①+②:
C2H6+2Na2O2+2.5O2===2Na2CO3+3H2O⑤
故不难得出正确结论。
(2)通入氧气最大量时按⑤进行。
nO2=nNa2O2=×=0.025 mol
mO2=0.025 mol×32 g·mol-1=0.8 g
21.【答案】甲烷:60%,丙烯:40%。
【解析】混合气体的平均相对分子质量为13.2×2=26.4,必有甲烷,混合气体的物质的量为4.48 L÷22.4 L·mol-1=0.2 mol,混合气体的质量为0.2 mol×26.4 g·mol-1=5.28 g,甲烷的物质的量为(5.28 g-3.36 g)÷16 g·mol-1=0.12 mol,设烯烃的分子式为CnH2n,
(0.2 mol-0.12 mol)×14ng·mol-1=3.36 g,
解得n=3,烯烃为丙烯,
甲烷的体积分数为(0.12 mol÷0.2 mol)×100%=60%;
丙烯的体积分数为(0.08 mol÷0.2 mol)×100%=40%。
22.【答案】(1)羟基 羧基 (2)C4H6O5 (3)33.6 (4)ABCD
【解析】分析解题的基点:有机物分子中官能团的识别及其性质推断。
苹果酸中含有2个—COOH和1个—OH,都可以与钠反应产生氢气,故1 mol 苹果酸与足量钠反应可产生氢气 1.5 mol。它含有—COOH可与石蕊溶液作用,可与氢氧化钠、乙醇反应。它含有—OH可与乙酸发生酯化反应。
23.【答案】(1)②
(2)①=②>③=④
(3)②>①=③>④=0
【解析】分析解题的基点:羧基和羟基氢原子活泼性强弱不同。只有羧基能与碳酸氢钠溶液、氢氧化钠溶液反应,羟基不能与碳酸氢钠溶液、氢氧化钠溶液反应,但二者都能与金属钠反应。
24.【答案】(1)羧基 (2)2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑
(3)酯化反应
【解析】分析解题的基点:乙酸的官能团(羧基),乙酸的性质(酸性比碳酸强、能发生酯化反应)。
