2022年中考化学一轮复习第九单元溶液检测题(word版 无答案)
文档属性
| 名称 | 2022年中考化学一轮复习第九单元溶液检测题(word版 无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 107.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-28 13:55:50 | ||
图片预览


文档简介
2022中考化学一轮复习 第九单元 溶液 检测题
一.选择题
1. 下列叙述正确的是( )
A. 饱和溶液加热时会变成不饱和溶液
B. 饱和溶液加热时仍然是饱和溶液
C. 大多数物质的饱和溶液加热时会变成不饱和溶液
D. 饱和溶液降温时,会有晶体析出
2. 下列关于溶液的说法正确的是( )
A. 溶液一定是无色的
B. 溶质只能是固体物质
C. 溶液是均一的、稳定的混合物
D. 将少量泥土放入水中,充分搅拌,可以得到溶液
3. 如果把厨房中的①食盐、②料酒、③豆油、④白糖、⑤面粉、⑥面酱分别放入水中充分搅拌,能够得到溶液的是( )
A. ①②④
B. ①②⑥
C. ④⑤⑥
D. ③⑤⑥
4. 实验室配制50 g质量分数为6%的氯化钠溶液,整个配制过程如图所示,其正确的操作顺序是( )
A. ③①②④⑤
B. ①③④②⑤
C. ③①④②⑤
D. ①④③②⑤
5. 室温时,从100 g饱和硝酸钾溶液中取出10 g溶液,那么剩余的硝酸钾溶液( )
A. 还是饱和溶液
B. 变成不饱和溶液了
C. 硝酸钾质量没变
D. 硝酸钾和水的质量没变
6. 室温下,饱和食盐水露置在干燥的空气中,过一段时间后有少量固体析出,这是因为( )
A. 氯化钠的溶解度减小了
B. 溶液中溶质的质量分数减小了
C. 溶剂质量减小了
D. 溶液变成不饱和溶液了
7. 现有30 ℃时的氯化钾饱和溶液,在下列情况下溶液中溶质的质量分数不变的是( )
A. 温度不变,向溶液中加入氯化钾晶体
B. 温度不变,向溶液中加入水
C. 降低温度至10 ℃
D. 升高温度蒸发掉一部分水,温度保持在40 ℃
8. 如图,是A,B两种物质的溶解度曲线,下列说法正确的是( )
A. A,B两种物质的溶解度都随温度的升高而增大
B. 降低温度可使接近饱和的B溶液变为饱和
C. A,B两种物质的溶解度均为25 g
D.t2℃时,A物质的溶解度大于B物质的溶解度
9. 将时硝酸钾饱和溶液冷却到,温度变化前后,保持不变的是
A.溶质质量 B.溶液质量 C.溶剂质量 D.溶质的质量分数
10. 下列化学实验能够成功的是( )
A. 小明用木炭代替红磷做测定空气中氧气含量的实验
B. 小颖用锌、铁、铜和稀盐酸确定锌、铁、铜三种金属的活动性
C. 小聪在20 ℃配制36%的氯化钠溶液(20 ℃时氯化钠的溶解度为36 g)
D. 小青将过量的木炭粉和少量氧化铜粉的混合物置于蒸发皿里加强热,得到纯净的铜
11. 下列有关溶液的说法,正确的是( )
A. 溶液一定是无色液体
B. 溶液一定是均一、稳定的混合物
C. 将KNO3的不饱和溶液变成饱和溶液,溶液中溶质的质量分数一定变大
D. 20 ℃时硝酸钾的溶解度是31.6 g,说明该温度下100 g硝酸钾溶液中含有硝酸钾31.6 g
12. 如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是( )
A. 升高温度能使乙物质的不饱和溶液变成饱和溶液
B. 在t1℃时,M点表示甲、乙两物质的溶解度相等
C. 在t2℃时,N点表示甲物质的不饱和溶液
D. 在t1℃时,50 g水可以溶解25 g甲物质
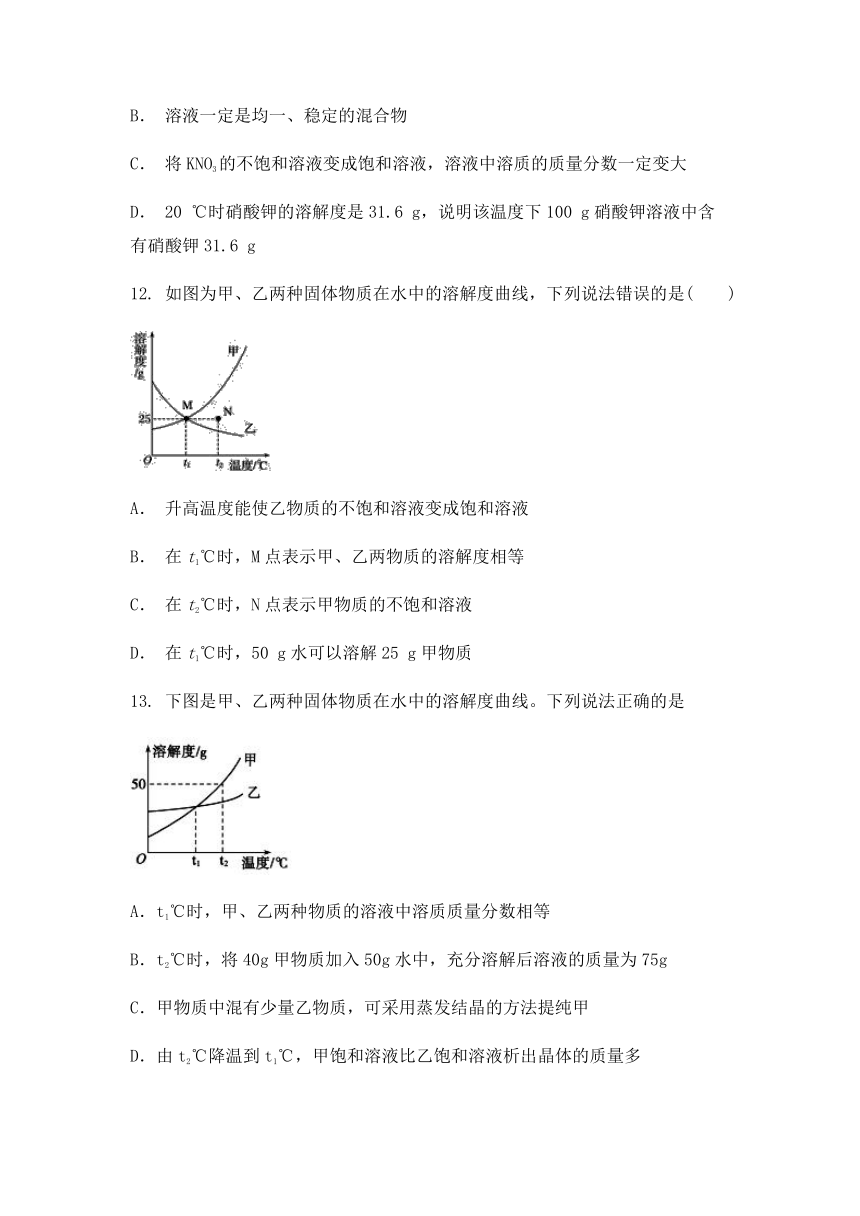
13. 下图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙两种物质的溶液中溶质质量分数相等
B.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为75g
C.甲物质中混有少量乙物质,可采用蒸发结晶的方法提纯甲
D.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
14. 下图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为错误的是( )
A.t1℃时,M、N两物质溶液的溶质质量分数相等
B. N物质的溶解度随温度的升高而降低
C.t2℃时,M物质的溶解度大于N物质的溶解度
D. 由t1℃升温到t2℃时,N物质溶液的溶质质量分数可能改变
二.填空题
15. 请你各举一个实例,证明下列有关溶液的叙述是错误的。
(1)溶液一定是无色的。实例:________溶液不是无色的。
(2)均一、稳定的液体都是溶液。实例:________是均一、稳定的液体,但不是溶液。
(3)溶液中的溶质一定是固体。实例:________可作溶质,但不是固体。
(4)溶液中的溶剂一定是水。实例:________。
(5)某溶液中的溶质只可能是一种。实例:________。
16. 如图为甲、乙两种固体物质的溶解度曲线,请根据图示回答下列问题:
(1)在 ℃时,甲、乙两物质的溶解度相等;
(2)t2℃时,甲物质的溶解度是 g;
(3)将t2℃时甲物质的饱和溶液降温至t1℃,溶液中溶质的质量分数 (填“增大”、“减小”或“不变”);
(4)要使接近饱和的乙溶液转化为饱和溶液,可以采用的一种方法是 .
17. 我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3 的溶解度曲线“消失”了,其原因可能是_____。
18. 根据下列坐标图回答:
(1)图一表示甲、乙、丙三种物质的溶解度曲线。
①t2℃时,甲、乙的溶解度均为________。
②将甲、乙、丙三种物质t1℃时的饱和溶液升温到t3℃,所得溶液中溶质的质量分数最大的是________。
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数。取模拟海水(含NaCl、MgCl2)2 000 g,向溶液中滴加10%的硝酸银溶液,其沉淀质量变化如图二。
①沉淀的化学式为________。
②模拟海水中氯的质量分数是________。
三.实验探究题
19. 塘沽十一中化学学习小组同学在实验室中练习配制一定溶质质量分数的溶液。
(1) 用氯化钠固体配制50g质量分数为6%的氯化钠溶液:
①需要氯化钠的质量为________g。
②称取氯化钠时,若托盘天平出现了右盘低的现象(如图A),接下来的操作应是________。
A 左边的平衡螺母向左调 B 右盘中添加砝码 C 向左移动游码 D 左盘中增加氯化钠
③量取水时,若仰视读数(如图B),会使配制的溶液溶质质量分数________(填“偏大” 或“偏小”)。
(2) 用已配好的质量分数为6%的氯化钠溶液,配制50 g质量分数为3%的氯化钠溶液:
①需要质量分数为6%的氯化钠溶液________ g,水________mL(水的密度为1 g/cm3)。
②本实验需要用到的仪器有________。
(3) 把配制好的上述两种溶液分别装入________ 中(选填“广口瓶”或“细口瓶”),盖好瓶塞并贴上标签。
20. 实验室进行粗盐的提纯。
(1)涉及的操作有:①过滤②溶解③蒸发结晶。正确的顺序是_____。(填序号)
(2)用托盘天平称量所需粗盐的质量,托盘天平调节平衡后,接下来的操作是_____(填序号)①在右盘中添加砝码,需要用游码时移动到相应刻度、②在托盘上分别放质量相等的纸、③在左盘中添加粗盐
(3)图1中玻璃棒的作用是搅棒,_____。当_____时停止加热。
(4)配制溶液①用质量分数为5%的氯化钠溶液配制70g质量分数为3%的氯化钠溶液,需要水的质量是_____g.量取水的体积(水的密度为1g/mL),请在图2标出所需水的体积示数。②从表中找出稀释的过程需要用到的数据(20℃)是_____g/cm3。
浓度% 1 2 3 4 5 6 7
密度g/cm3 1.005 1.013 1.02 1.027 1.034 1.041 1.043
四.计算题
21. 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12 g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图:
(1)纯碱恰好完全反应时,生成CO2的质量为_____________g。
(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)
(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?
22. 生理盐水是溶质质量分数约为0.9%的氯化钠溶液。现用500克生理盐水给患者输液,进入患者体内的氯化钠的质量约为多少克?若用溶质质量分数为18%的氯化钠溶液配制500克溶质质量分数为0.9%的生理盐水,需18%的氯化钠溶液多少克?需水多少克?(写出计算过程)
一.选择题
1. 下列叙述正确的是( )
A. 饱和溶液加热时会变成不饱和溶液
B. 饱和溶液加热时仍然是饱和溶液
C. 大多数物质的饱和溶液加热时会变成不饱和溶液
D. 饱和溶液降温时,会有晶体析出
2. 下列关于溶液的说法正确的是( )
A. 溶液一定是无色的
B. 溶质只能是固体物质
C. 溶液是均一的、稳定的混合物
D. 将少量泥土放入水中,充分搅拌,可以得到溶液
3. 如果把厨房中的①食盐、②料酒、③豆油、④白糖、⑤面粉、⑥面酱分别放入水中充分搅拌,能够得到溶液的是( )
A. ①②④
B. ①②⑥
C. ④⑤⑥
D. ③⑤⑥
4. 实验室配制50 g质量分数为6%的氯化钠溶液,整个配制过程如图所示,其正确的操作顺序是( )
A. ③①②④⑤
B. ①③④②⑤
C. ③①④②⑤
D. ①④③②⑤
5. 室温时,从100 g饱和硝酸钾溶液中取出10 g溶液,那么剩余的硝酸钾溶液( )
A. 还是饱和溶液
B. 变成不饱和溶液了
C. 硝酸钾质量没变
D. 硝酸钾和水的质量没变
6. 室温下,饱和食盐水露置在干燥的空气中,过一段时间后有少量固体析出,这是因为( )
A. 氯化钠的溶解度减小了
B. 溶液中溶质的质量分数减小了
C. 溶剂质量减小了
D. 溶液变成不饱和溶液了
7. 现有30 ℃时的氯化钾饱和溶液,在下列情况下溶液中溶质的质量分数不变的是( )
A. 温度不变,向溶液中加入氯化钾晶体
B. 温度不变,向溶液中加入水
C. 降低温度至10 ℃
D. 升高温度蒸发掉一部分水,温度保持在40 ℃
8. 如图,是A,B两种物质的溶解度曲线,下列说法正确的是( )
A. A,B两种物质的溶解度都随温度的升高而增大
B. 降低温度可使接近饱和的B溶液变为饱和
C. A,B两种物质的溶解度均为25 g
D.t2℃时,A物质的溶解度大于B物质的溶解度
9. 将时硝酸钾饱和溶液冷却到,温度变化前后,保持不变的是
A.溶质质量 B.溶液质量 C.溶剂质量 D.溶质的质量分数
10. 下列化学实验能够成功的是( )
A. 小明用木炭代替红磷做测定空气中氧气含量的实验
B. 小颖用锌、铁、铜和稀盐酸确定锌、铁、铜三种金属的活动性
C. 小聪在20 ℃配制36%的氯化钠溶液(20 ℃时氯化钠的溶解度为36 g)
D. 小青将过量的木炭粉和少量氧化铜粉的混合物置于蒸发皿里加强热,得到纯净的铜
11. 下列有关溶液的说法,正确的是( )
A. 溶液一定是无色液体
B. 溶液一定是均一、稳定的混合物
C. 将KNO3的不饱和溶液变成饱和溶液,溶液中溶质的质量分数一定变大
D. 20 ℃时硝酸钾的溶解度是31.6 g,说明该温度下100 g硝酸钾溶液中含有硝酸钾31.6 g
12. 如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是( )
A. 升高温度能使乙物质的不饱和溶液变成饱和溶液
B. 在t1℃时,M点表示甲、乙两物质的溶解度相等
C. 在t2℃时,N点表示甲物质的不饱和溶液
D. 在t1℃时,50 g水可以溶解25 g甲物质
13. 下图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙两种物质的溶液中溶质质量分数相等
B.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为75g
C.甲物质中混有少量乙物质,可采用蒸发结晶的方法提纯甲
D.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
14. 下图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为错误的是( )
A.t1℃时,M、N两物质溶液的溶质质量分数相等
B. N物质的溶解度随温度的升高而降低
C.t2℃时,M物质的溶解度大于N物质的溶解度
D. 由t1℃升温到t2℃时,N物质溶液的溶质质量分数可能改变
二.填空题
15. 请你各举一个实例,证明下列有关溶液的叙述是错误的。
(1)溶液一定是无色的。实例:________溶液不是无色的。
(2)均一、稳定的液体都是溶液。实例:________是均一、稳定的液体,但不是溶液。
(3)溶液中的溶质一定是固体。实例:________可作溶质,但不是固体。
(4)溶液中的溶剂一定是水。实例:________。
(5)某溶液中的溶质只可能是一种。实例:________。
16. 如图为甲、乙两种固体物质的溶解度曲线,请根据图示回答下列问题:
(1)在 ℃时,甲、乙两物质的溶解度相等;
(2)t2℃时,甲物质的溶解度是 g;
(3)将t2℃时甲物质的饱和溶液降温至t1℃,溶液中溶质的质量分数 (填“增大”、“减小”或“不变”);
(4)要使接近饱和的乙溶液转化为饱和溶液,可以采用的一种方法是 .
17. 我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3 的溶解度曲线“消失”了,其原因可能是_____。
18. 根据下列坐标图回答:
(1)图一表示甲、乙、丙三种物质的溶解度曲线。
①t2℃时,甲、乙的溶解度均为________。
②将甲、乙、丙三种物质t1℃时的饱和溶液升温到t3℃,所得溶液中溶质的质量分数最大的是________。
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数。取模拟海水(含NaCl、MgCl2)2 000 g,向溶液中滴加10%的硝酸银溶液,其沉淀质量变化如图二。
①沉淀的化学式为________。
②模拟海水中氯的质量分数是________。
三.实验探究题
19. 塘沽十一中化学学习小组同学在实验室中练习配制一定溶质质量分数的溶液。
(1) 用氯化钠固体配制50g质量分数为6%的氯化钠溶液:
①需要氯化钠的质量为________g。
②称取氯化钠时,若托盘天平出现了右盘低的现象(如图A),接下来的操作应是________。
A 左边的平衡螺母向左调 B 右盘中添加砝码 C 向左移动游码 D 左盘中增加氯化钠
③量取水时,若仰视读数(如图B),会使配制的溶液溶质质量分数________(填“偏大” 或“偏小”)。
(2) 用已配好的质量分数为6%的氯化钠溶液,配制50 g质量分数为3%的氯化钠溶液:
①需要质量分数为6%的氯化钠溶液________ g,水________mL(水的密度为1 g/cm3)。
②本实验需要用到的仪器有________。
(3) 把配制好的上述两种溶液分别装入________ 中(选填“广口瓶”或“细口瓶”),盖好瓶塞并贴上标签。
20. 实验室进行粗盐的提纯。
(1)涉及的操作有:①过滤②溶解③蒸发结晶。正确的顺序是_____。(填序号)
(2)用托盘天平称量所需粗盐的质量,托盘天平调节平衡后,接下来的操作是_____(填序号)①在右盘中添加砝码,需要用游码时移动到相应刻度、②在托盘上分别放质量相等的纸、③在左盘中添加粗盐
(3)图1中玻璃棒的作用是搅棒,_____。当_____时停止加热。
(4)配制溶液①用质量分数为5%的氯化钠溶液配制70g质量分数为3%的氯化钠溶液,需要水的质量是_____g.量取水的体积(水的密度为1g/mL),请在图2标出所需水的体积示数。②从表中找出稀释的过程需要用到的数据(20℃)是_____g/cm3。
浓度% 1 2 3 4 5 6 7
密度g/cm3 1.005 1.013 1.02 1.027 1.034 1.041 1.043
四.计算题
21. 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12 g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图:
(1)纯碱恰好完全反应时,生成CO2的质量为_____________g。
(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)
(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?
22. 生理盐水是溶质质量分数约为0.9%的氯化钠溶液。现用500克生理盐水给患者输液,进入患者体内的氯化钠的质量约为多少克?若用溶质质量分数为18%的氯化钠溶液配制500克溶质质量分数为0.9%的生理盐水,需18%的氯化钠溶液多少克?需水多少克?(写出计算过程)
同课章节目录
