2022年中考化学一轮复习基础提分卷——物质构成的奥秘(word版 无答案)
文档属性
| 名称 | 2022年中考化学一轮复习基础提分卷——物质构成的奥秘(word版 无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 180.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-28 13:58:30 | ||
图片预览


文档简介
2022年中考化学一轮复习基础提分卷——物质构成的奥秘
一、选择题
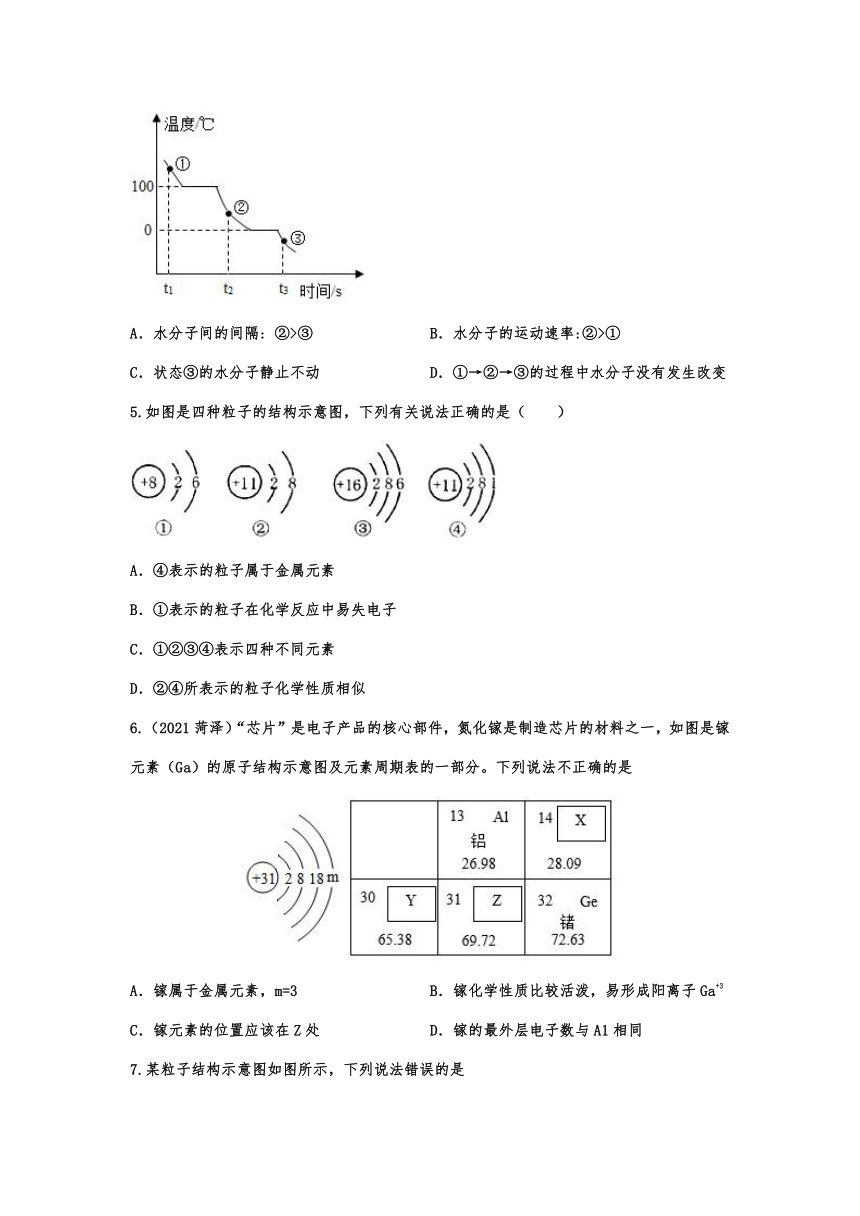
1.“茉莉的香气清新淡雅,能够使人心情放松;檀木的香气持久醇厚,能缓解紧张焦虑的情绪….”从微观角度分析,语句中隐含的分子性质有( )
①分子的质量很小;②分子之间有间隔;③分子是不断运动的;④不同分子性质不同.
A.①② B.③④ C.①③ D.②④
2.某同学为验证“分子是运动的”,设计了甲、乙、丙、丁四个实验.其中,能达到目的是( )
A.甲、乙、丙 B.甲、乙、丁 C.甲、丙、丁 D.乙、丙、丁
3.正在生产中的国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素和锂(Li)元素的本质区别是( )
A. 元素符号不同
B. 原子质量不同
C. 原子的质子数不同
D. 原子的电子数不同
4.一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图所示。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是( )
A.水分子间的间隔: ②>③ B.水分子的运动速率:②>①
C.状态③的水分子静止不动 D.①→②→③的过程中水分子没有发生改变
5.如图是四种粒子的结构示意图,下列有关说法正确的是( )
A.④表示的粒子属于金属元素
B.①表示的粒子在化学反应中易失电子
C.①②③④表示四种不同元素
D.②④所表示的粒子化学性质相似
6.(2021菏泽)“芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。下列说法不正确的是
A.镓属于金属元素,m=3 B.镓化学性质比较活泼,易形成阳离子Ga+3
C.镓元素的位置应该在Z处 D.镓的最外层电子数与A1相同
7.某粒子结构示意图如图所示,下列说法错误的是
A.若x=17,则该粒子符号为Cl- B.若x=18,则该粒子是原子
C.若x=19,则该粒子是阳离子 D.若x=20,则该粒子是由一个原子得到两个电子而形成
8.硫原子的结构示意图及在元素周期表中的信息如图,从图中获得的信息不正确的是( )
A.在硫原子的核外电子排布中,a=2、b=8 B.硫原子在化学反应中易得到2个电子变成S2﹣
C.硫原子中,质子数=核外电子数=16 D.硫元素在元素周期表中位于第六周期
9.推理是研究和学习化学的一种重要方法。正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,但电性相反。科学家已发现反氢原子。你推测反氢原子的结构可能是( )
A.由一个带负电的质子和一个带正电的电子构成
B.由一个质子和一个电子构成
C.由一个带负电的质子和一个电子构成
D.由一个质子和一个带正电的电子构成
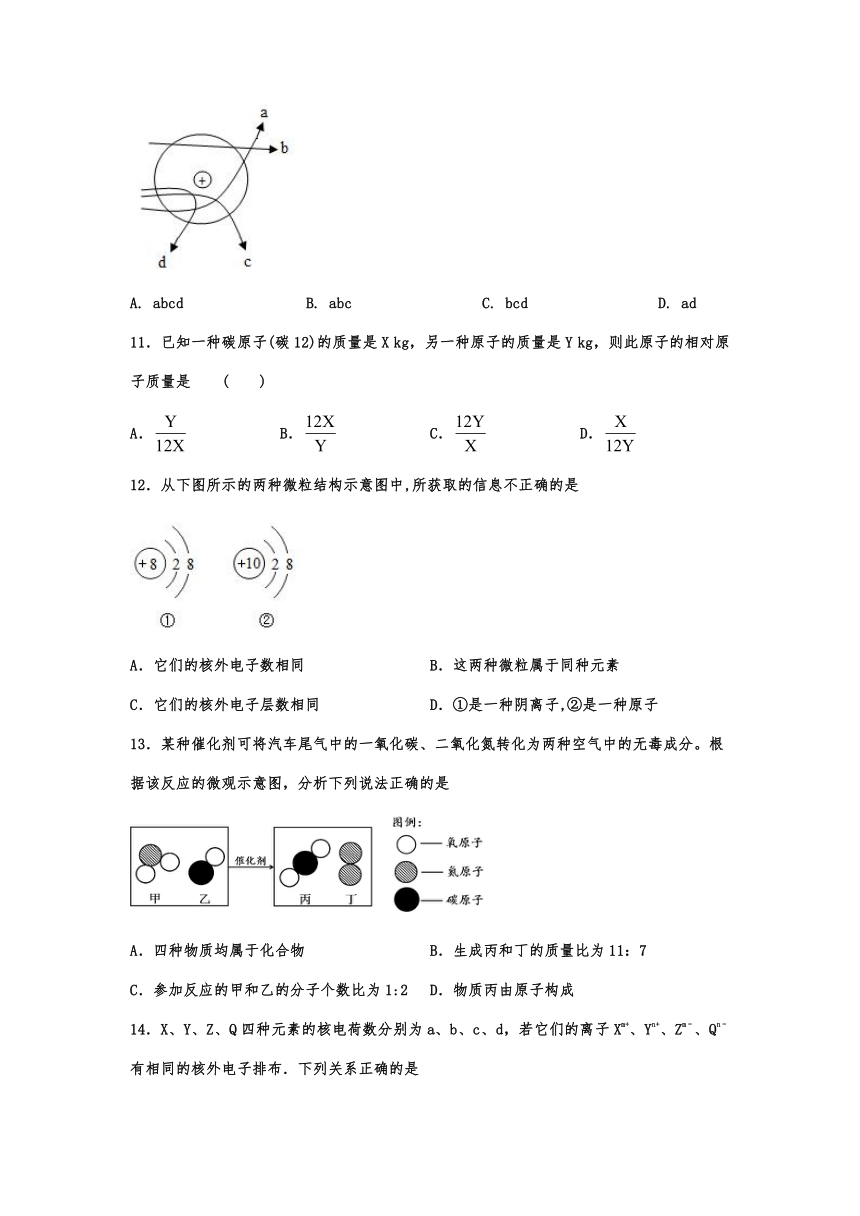
10.卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础。如图所示线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A. abcd B. abc C. bcd D. ad
11.已知一种碳原子(碳12)的质量是X kg,另一种原子的质量是Y kg,则此原子的相对原子质量是 ( )
A. B. C. D.
12.从下图所示的两种微粒结构示意图中,所获取的信息不正确的是
A.它们的核外电子数相同 B.这两种微粒属于同种元素
C.它们的核外电子层数相同 D.①是一种阴离子,②是一种原子
13.某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分。根据该反应的微观示意图,分析下列说法正确的是
A.四种物质均属于化合物 B.生成丙和丁的质量比为11:7
C.参加反应的甲和乙的分子个数比为1:2 D.物质丙由原子构成
14.X、Y、Z、Q四种元素的核电荷数分别为a、b、c、d,若它们的离子Xm+、Yn+、Zm﹣、Qn﹣有相同的核外电子排布.下列关系正确的是
A.a﹣b=n﹣m B.b﹣d=2n
C.c﹣d=m+n D.a﹣c=0
15.(2021昆明)嫦娥五号完成我国首次月球采样任务,带回1731g月壤,月壤中含有丰富的氦3.已知氦3的质子数为2,中子数为1.氦3的核外电子数为
A.1 B.2 C.3 D.4
二、非选择题
16.甲、乙、丙、丁四种元素:甲是空气中含量最多的元素;乙是地壳中含量最多的金属元素:丙是地壳中含量最多的元素;丁元素原子核外只有一个电子。请写出相关符号:
甲元素_____;乙元素_____;丙元素_____;丁的离子符号为_____。
17.解释下列事实或现象
(1)10mL酒精与10mL水混合,其体积小于20mL的原因是 。
(2)水银温度计能指示出温度高低的原因是 。
(3)白酒瓶敞口放置,酒的香味变淡,原因是 。
(4)气体容易压缩,而液体和固体难以压缩,原因是 。
18.阅读下面两条信息,回答问题。
信息一:金是一种广受欢迎的贵金属,有金黄色金属光泽,密度大,延展性好,而且金非常稳定,与大多数物质都不发生反应,常用来加工首饰。
信息二:金元素在自然界的含量非常稀少,它的化学符号是Au,原子序数是79,相对原子质量是197.00。
(1)根据信息一:找出金的物理性质和化学性质(各一条)
物理性质:____________________________________;
化学性质:____________________________________。
(2)金原子的核外电子数是______;质子数是______;中子数是______。
19.“见著知微,见微知著”是化学思维方法。从微观知宏观(如图)。
①微粒A最外层电子数是_____,在化学反应中容易_____(填“得”或“失”)电子。
②微粒A、B、C、D、E中,对应化学性质最稳定的原子是_____(填“编号”,下同),属于同一种元素的是_____。
20.(2021邵阳)中科院已研制出石墨烯芯片,石墨烯芯片的主要成分是碳。请根据下图提供的信息,回答相关问题:
(1)碳是第___________周期的元素;
(2)碳的相对原子质量是___________;
(3)与①化学性质相似的是___________(填序号);
(4)②和④形成化合物的化学式是___________。
21.元素周期表是化学学习的重要工具,依据下表回答问题:
(1)表中14号元素属于______(填“金属”或“非金属”)元素,该元素的化学性质与_______元素相似,即在常温下具有__________性。
(2)通过上表的分析可知:元素所在的周期数=该元素原子核外的___________________。
(3)在化学反应中,铝原子失电子形成铝离子,写出铝离子符号__________。
(4)钠元素与氧元素形成的化合物化学式为_____________。
22.同学们为研究分子的性质,做了如下三个实验。
(1)实验1中,观察到品红在_____(填“冷”或“热”)水中扩散更快。
(2)实验2中,观察到A烧杯溶液无明显变化,B烧杯溶液由无色变为红色,该现象说明分子具有的性质是_____。
(3)实验3中,称取a g酚酞溶液,放置1小时后读数变为a1 g。若用a g浓氨水代替酚酞溶液重复上述实验,1小时后读数变为a2 g。则a1_____a2(填“>”、“=”、“<”)。
23.“宏观辨识与微观探析”’是化学学科核心素养之一,化学学习要让学生既能够“见微知著”,也能够“见著知微”。金属钠在氯气中燃烧生成氯化钠,下图为氯化钠形成的示意图。
根据所给信息,请回答:
(1)钠原子的核外电子层数是 _______ ,在化学反应中易_______(填“得到”或 “失去”)电子。
(2)元素的化学性质主要是由原子的 __________________决定的。
(3)构成氯化钠的离子是________________(填微粒符号)。
24.浩然按图A所示装置进行试验,子晗在密闭的试管中进行实验(如图B所示),实验时,将胶头滴管里盛有的浓氨水滴入试管中。
(1)浩然在大烧杯外放一杯酚酞溶液的作用是________。
(2)与浩然的实验相比,子晗设计的实验的优点是:________。
(3)子晗能观察到的现象是________。他们实验探究的目的是_______。
(4)馨月按图C进行实验,容易被压缩的物质是_______。该实验证明了______。
25.碳12原子的质量为1.993×10-26kg,一种金原子的质量为3.27×10-25kg,计算该金原子的相对原子质量是多少?(结果保留到整数)
一、选择题
1.“茉莉的香气清新淡雅,能够使人心情放松;檀木的香气持久醇厚,能缓解紧张焦虑的情绪….”从微观角度分析,语句中隐含的分子性质有( )
①分子的质量很小;②分子之间有间隔;③分子是不断运动的;④不同分子性质不同.
A.①② B.③④ C.①③ D.②④
2.某同学为验证“分子是运动的”,设计了甲、乙、丙、丁四个实验.其中,能达到目的是( )
A.甲、乙、丙 B.甲、乙、丁 C.甲、丙、丁 D.乙、丙、丁
3.正在生产中的国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素和锂(Li)元素的本质区别是( )
A. 元素符号不同
B. 原子质量不同
C. 原子的质子数不同
D. 原子的电子数不同
4.一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图所示。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是( )
A.水分子间的间隔: ②>③ B.水分子的运动速率:②>①
C.状态③的水分子静止不动 D.①→②→③的过程中水分子没有发生改变
5.如图是四种粒子的结构示意图,下列有关说法正确的是( )
A.④表示的粒子属于金属元素
B.①表示的粒子在化学反应中易失电子
C.①②③④表示四种不同元素
D.②④所表示的粒子化学性质相似
6.(2021菏泽)“芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。下列说法不正确的是
A.镓属于金属元素,m=3 B.镓化学性质比较活泼,易形成阳离子Ga+3
C.镓元素的位置应该在Z处 D.镓的最外层电子数与A1相同
7.某粒子结构示意图如图所示,下列说法错误的是
A.若x=17,则该粒子符号为Cl- B.若x=18,则该粒子是原子
C.若x=19,则该粒子是阳离子 D.若x=20,则该粒子是由一个原子得到两个电子而形成
8.硫原子的结构示意图及在元素周期表中的信息如图,从图中获得的信息不正确的是( )
A.在硫原子的核外电子排布中,a=2、b=8 B.硫原子在化学反应中易得到2个电子变成S2﹣
C.硫原子中,质子数=核外电子数=16 D.硫元素在元素周期表中位于第六周期
9.推理是研究和学习化学的一种重要方法。正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,但电性相反。科学家已发现反氢原子。你推测反氢原子的结构可能是( )
A.由一个带负电的质子和一个带正电的电子构成
B.由一个质子和一个电子构成
C.由一个带负电的质子和一个电子构成
D.由一个质子和一个带正电的电子构成
10.卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础。如图所示线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A. abcd B. abc C. bcd D. ad
11.已知一种碳原子(碳12)的质量是X kg,另一种原子的质量是Y kg,则此原子的相对原子质量是 ( )
A. B. C. D.
12.从下图所示的两种微粒结构示意图中,所获取的信息不正确的是
A.它们的核外电子数相同 B.这两种微粒属于同种元素
C.它们的核外电子层数相同 D.①是一种阴离子,②是一种原子
13.某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分。根据该反应的微观示意图,分析下列说法正确的是
A.四种物质均属于化合物 B.生成丙和丁的质量比为11:7
C.参加反应的甲和乙的分子个数比为1:2 D.物质丙由原子构成
14.X、Y、Z、Q四种元素的核电荷数分别为a、b、c、d,若它们的离子Xm+、Yn+、Zm﹣、Qn﹣有相同的核外电子排布.下列关系正确的是
A.a﹣b=n﹣m B.b﹣d=2n
C.c﹣d=m+n D.a﹣c=0
15.(2021昆明)嫦娥五号完成我国首次月球采样任务,带回1731g月壤,月壤中含有丰富的氦3.已知氦3的质子数为2,中子数为1.氦3的核外电子数为
A.1 B.2 C.3 D.4
二、非选择题
16.甲、乙、丙、丁四种元素:甲是空气中含量最多的元素;乙是地壳中含量最多的金属元素:丙是地壳中含量最多的元素;丁元素原子核外只有一个电子。请写出相关符号:
甲元素_____;乙元素_____;丙元素_____;丁的离子符号为_____。
17.解释下列事实或现象
(1)10mL酒精与10mL水混合,其体积小于20mL的原因是 。
(2)水银温度计能指示出温度高低的原因是 。
(3)白酒瓶敞口放置,酒的香味变淡,原因是 。
(4)气体容易压缩,而液体和固体难以压缩,原因是 。
18.阅读下面两条信息,回答问题。
信息一:金是一种广受欢迎的贵金属,有金黄色金属光泽,密度大,延展性好,而且金非常稳定,与大多数物质都不发生反应,常用来加工首饰。
信息二:金元素在自然界的含量非常稀少,它的化学符号是Au,原子序数是79,相对原子质量是197.00。
(1)根据信息一:找出金的物理性质和化学性质(各一条)
物理性质:____________________________________;
化学性质:____________________________________。
(2)金原子的核外电子数是______;质子数是______;中子数是______。
19.“见著知微,见微知著”是化学思维方法。从微观知宏观(如图)。
①微粒A最外层电子数是_____,在化学反应中容易_____(填“得”或“失”)电子。
②微粒A、B、C、D、E中,对应化学性质最稳定的原子是_____(填“编号”,下同),属于同一种元素的是_____。
20.(2021邵阳)中科院已研制出石墨烯芯片,石墨烯芯片的主要成分是碳。请根据下图提供的信息,回答相关问题:
(1)碳是第___________周期的元素;
(2)碳的相对原子质量是___________;
(3)与①化学性质相似的是___________(填序号);
(4)②和④形成化合物的化学式是___________。
21.元素周期表是化学学习的重要工具,依据下表回答问题:
(1)表中14号元素属于______(填“金属”或“非金属”)元素,该元素的化学性质与_______元素相似,即在常温下具有__________性。
(2)通过上表的分析可知:元素所在的周期数=该元素原子核外的___________________。
(3)在化学反应中,铝原子失电子形成铝离子,写出铝离子符号__________。
(4)钠元素与氧元素形成的化合物化学式为_____________。
22.同学们为研究分子的性质,做了如下三个实验。
(1)实验1中,观察到品红在_____(填“冷”或“热”)水中扩散更快。
(2)实验2中,观察到A烧杯溶液无明显变化,B烧杯溶液由无色变为红色,该现象说明分子具有的性质是_____。
(3)实验3中,称取a g酚酞溶液,放置1小时后读数变为a1 g。若用a g浓氨水代替酚酞溶液重复上述实验,1小时后读数变为a2 g。则a1_____a2(填“>”、“=”、“<”)。
23.“宏观辨识与微观探析”’是化学学科核心素养之一,化学学习要让学生既能够“见微知著”,也能够“见著知微”。金属钠在氯气中燃烧生成氯化钠,下图为氯化钠形成的示意图。
根据所给信息,请回答:
(1)钠原子的核外电子层数是 _______ ,在化学反应中易_______(填“得到”或 “失去”)电子。
(2)元素的化学性质主要是由原子的 __________________决定的。
(3)构成氯化钠的离子是________________(填微粒符号)。
24.浩然按图A所示装置进行试验,子晗在密闭的试管中进行实验(如图B所示),实验时,将胶头滴管里盛有的浓氨水滴入试管中。
(1)浩然在大烧杯外放一杯酚酞溶液的作用是________。
(2)与浩然的实验相比,子晗设计的实验的优点是:________。
(3)子晗能观察到的现象是________。他们实验探究的目的是_______。
(4)馨月按图C进行实验,容易被压缩的物质是_______。该实验证明了______。
25.碳12原子的质量为1.993×10-26kg,一种金原子的质量为3.27×10-25kg,计算该金原子的相对原子质量是多少?(结果保留到整数)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
