阿伏加德罗定律推论及应用
图片预览



文档简介
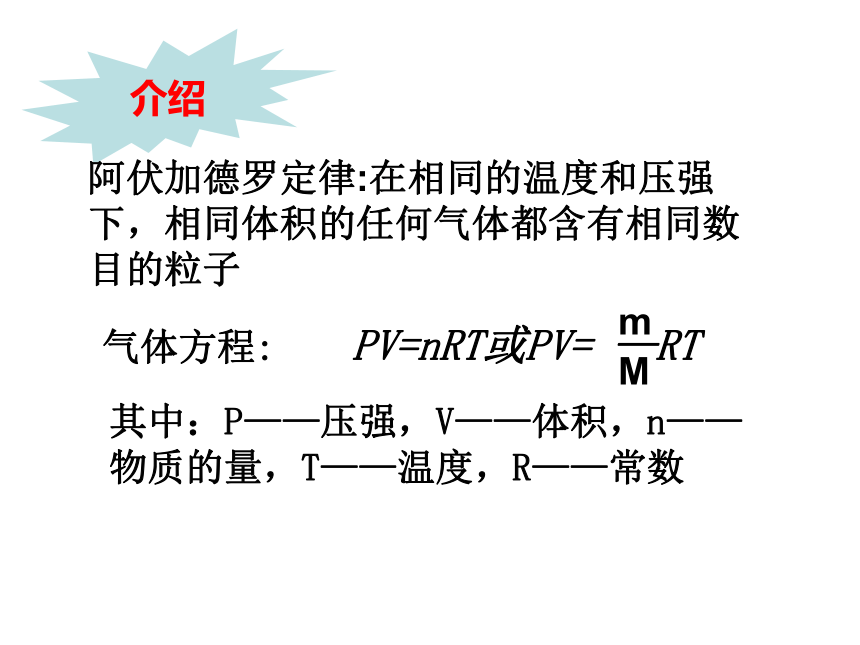
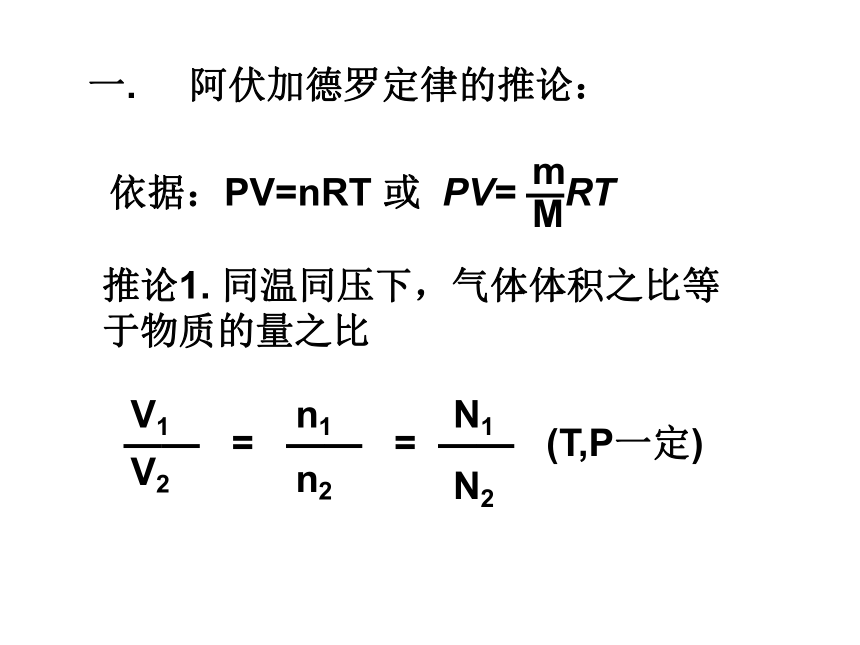
课件14张PPT。阿伏加德罗定律推论及应用其中:P——压强,V——体积,n——物质的量,T——温度,R——常数介绍阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子推论1. 同温同压下,气体体积之比等于物质的量之比一. 阿伏加德罗定律的推论:同温同压下,相同体积的下列气体中,质量最大的是( )
(A)氯气 (B)氢气 (C)氧气 (D)氮气 2.同温同压下,同物质的量的CH4气体与CO体积比是( )
(A)3:1 (B)1:1
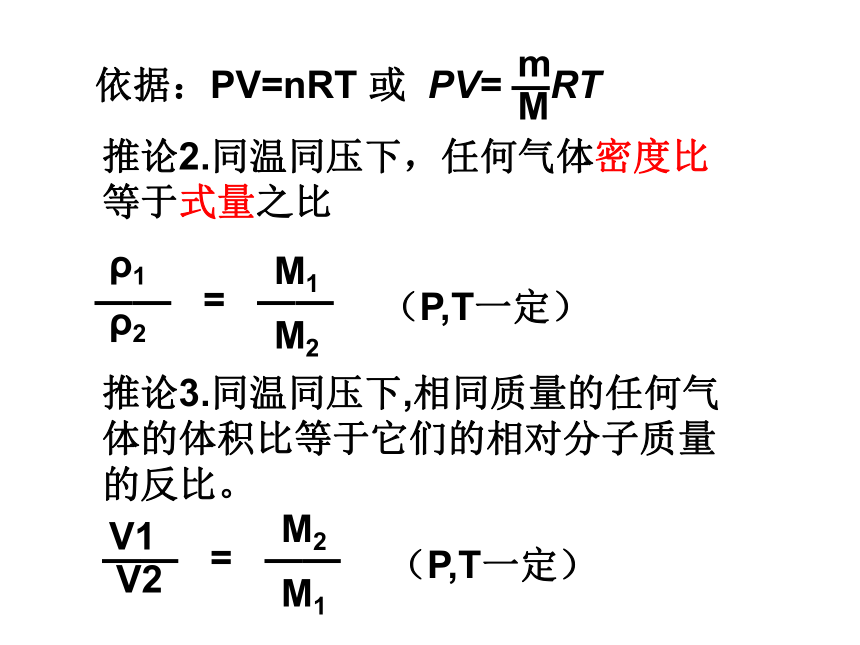
(C)1:3 (D)2:3 练一练AB推论2.同温同压下,任何气体密度比等于式量之比推论3.同温同压下,相同质量的任何气体的体积比等于它们的相对分子质量的反比。V11.同温同压下,等质量的二氧化硫和二氧化碳相比较,下列叙述中,正确的是( ) (A)密度比为16:11 (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16 2.在相同温度和压强下,下列气体密度最小的是( )
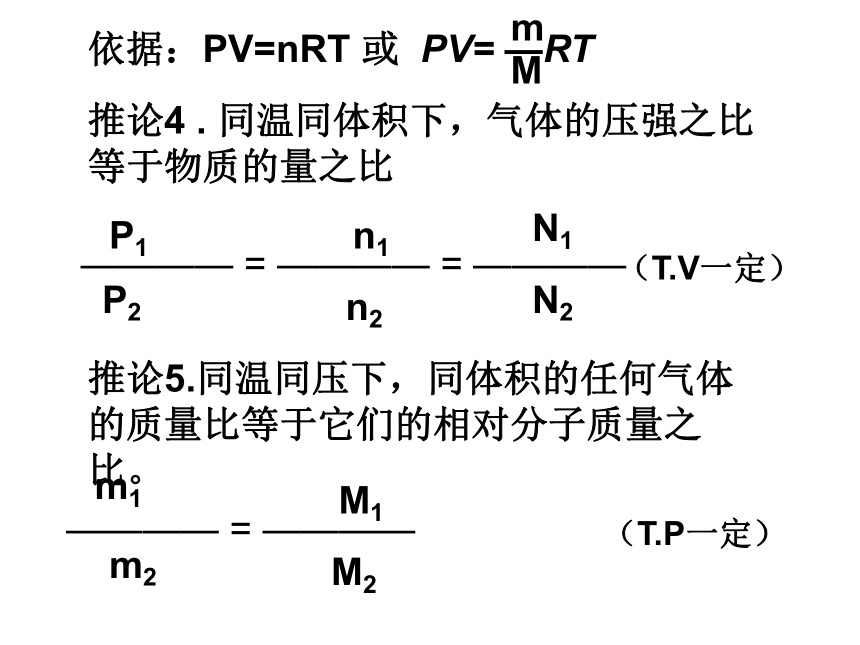
A. CO2 B.H2 C.O2 D.Cl2练一练ADB推论4 . 同温同体积下,气体的压强之比等于物质的量之比推论5.同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比。m1m21. 同温同体积下,相同压强的氢气和甲烷的原子个数之比是( )A.2:5 B.1:1 C.1:5 D.1:8A练一练2. 一个密闭容器中盛有11gCO2时,压强为1×104Pa.如果在相同温度下,把更多的CO2充入容器中,使容器内压强增至5×104Pa,这时容器内气体的分子数约为( )
A.3.3×1025 B. 3.3×1024
C. 7.5×1023 D. 7.5×1022C总结PV=nRTPM=ρRT 1.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的: (1)分子数之比为 ; (2)原子数之比为 ; (3)质量之比为 ___________________
(4)物质的量之比为 。 (5)密度之比为 ____________________
(6)摩尔质量之比为 。 课堂练习1:23:411:141:211:711:72.依照阿伏加德罗定律,下列叙述中正确的是( )
A.同温同压下,两种气体的体积之比等于摩尔质量之比。
B.同温同压下,两种气体的物质的量之比等于密度之比。
C.同温同压下,两种气体的摩尔质量之比等于密度之比。
D.同温同压下,两种气体的微粒数之比等于质量之比。c 3.现有两种气体,它们的分子量分别为MA:MB (1)当两种气体质量相同时,标准状况下A与B的体积比为 ,密度比为 ,所含分子数比为 。 (2)当两种气体(同温同压)的体积相同时,A和B的质量比为 。 MB:MAMA:MBMB:MAMA:MB 4.在一定温度和压强下,10体积气体A2跟30体积B2化合生成20体积某气体C,则C的化学式为( ) (A)AB (B)A2B (C)AB3 (D)AB2
5.同温同压下,500mL气体R的质量为1.2g, 1.5L O2的质量为2.4g, 则R的相对分子质量为( )
(A)24 (B)36 (C)48 (D)60CA 6.将H2、O2、N2三种气体分别装在三个容积相等的容器中,当温度和密度完全相同时,三种气体压强(P)的大小关系正确的是( ) (A)P(H2)=P(O2)=P(N2) (B)P(H2)>P(N2)>P(O2) (C)P(H2)>P(O2) >P(N2) (D)P(N2)>P(O2) >P(H2) B
(C)1:3 (D)2:3 练一练AB推论2.同温同压下,任何气体密度比等于式量之比推论3.同温同压下,相同质量的任何气体的体积比等于它们的相对分子质量的反比。V11.同温同压下,等质量的二氧化硫和二氧化碳相比较,下列叙述中,正确的是( ) (A)密度比为16:11 (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16 2.在相同温度和压强下,下列气体密度最小的是( )
A. CO2 B.H2 C.O2 D.Cl2练一练ADB推论4 . 同温同体积下,气体的压强之比等于物质的量之比推论5.同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比。m1m21. 同温同体积下,相同压强的氢气和甲烷的原子个数之比是( )A.2:5 B.1:1 C.1:5 D.1:8A练一练2. 一个密闭容器中盛有11gCO2时,压强为1×104Pa.如果在相同温度下,把更多的CO2充入容器中,使容器内压强增至5×104Pa,这时容器内气体的分子数约为( )
A.3.3×1025 B. 3.3×1024
C. 7.5×1023 D. 7.5×1022C总结PV=nRTPM=ρRT 1.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的: (1)分子数之比为 ; (2)原子数之比为 ; (3)质量之比为 ___________________
(4)物质的量之比为 。 (5)密度之比为 ____________________
(6)摩尔质量之比为 。 课堂练习1:23:411:141:211:711:72.依照阿伏加德罗定律,下列叙述中正确的是( )
A.同温同压下,两种气体的体积之比等于摩尔质量之比。
B.同温同压下,两种气体的物质的量之比等于密度之比。
C.同温同压下,两种气体的摩尔质量之比等于密度之比。
D.同温同压下,两种气体的微粒数之比等于质量之比。c 3.现有两种气体,它们的分子量分别为MA:MB (1)当两种气体质量相同时,标准状况下A与B的体积比为 ,密度比为 ,所含分子数比为 。 (2)当两种气体(同温同压)的体积相同时,A和B的质量比为 。 MB:MAMA:MBMB:MAMA:MB 4.在一定温度和压强下,10体积气体A2跟30体积B2化合生成20体积某气体C,则C的化学式为( ) (A)AB (B)A2B (C)AB3 (D)AB2
5.同温同压下,500mL气体R的质量为1.2g, 1.5L O2的质量为2.4g, 则R的相对分子质量为( )
(A)24 (B)36 (C)48 (D)60CA 6.将H2、O2、N2三种气体分别装在三个容积相等的容器中,当温度和密度完全相同时,三种气体压强(P)的大小关系正确的是( ) (A)P(H2)=P(O2)=P(N2) (B)P(H2)>P(N2)>P(O2) (C)P(H2)>P(O2) >P(N2) (D)P(N2)>P(O2) >P(H2) B
