原子结构与元素周期表
图片预览







文档简介
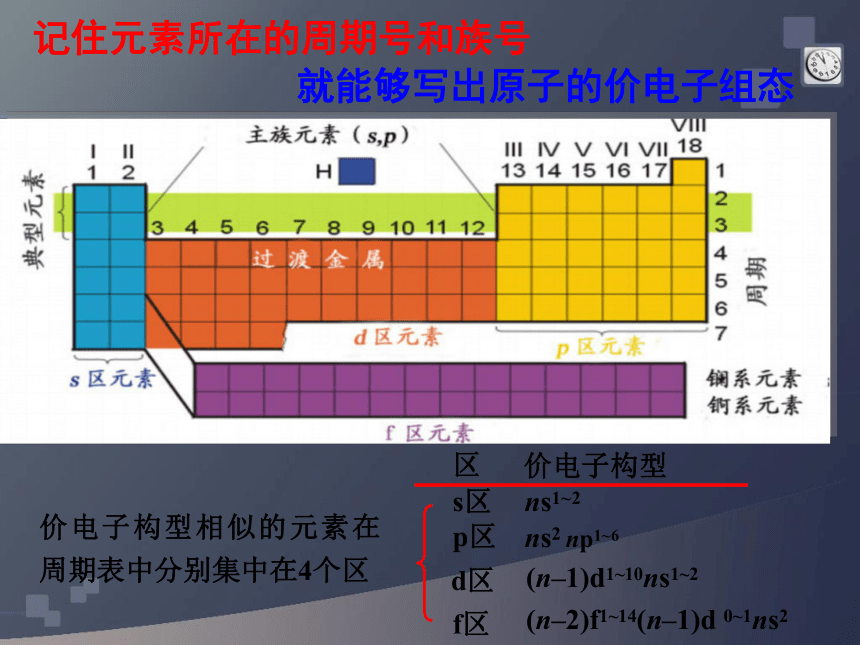
课件22张PPT。原子结构原子结构与元素周期表第二课时 区 价电子构型 s区 ns1~2 ns2 np1~6 记住元素所在的周期号和族号 p区 d区 f区(n–1)d1~10ns1~2(n–2)f1~14(n–1)d 0~1ns2价电子构型相似的元素在周期表中分别集中在4个区就能够写出原子的价电子组态考察元素周期表,探究下列问题:
1.元素周期表共有几个周期?每个周期各有多少种元素?写出每个周期开头第一个元素和结尾
元素的最外层电子的排产式的通式。为什么第一周期结尾元素的电子排布跟其他周期不同?【科学探究】 IA族 0族
ns1 ns2np6
其中He元素的最外层就是第一电子层所以是1s2 2.元素周期表共有多少个纵列?表上元素的
“外围电子排布”简称“价电子层”,这是由于这些
能级上的电子数可在化学反应中发生变化。每个
纵列的价电子层的电子总数是否相等?18个纵列,每个纵列价电子总数绝大多数
相等,个别不相等。【科学探究】【科学探究】 3.按电子排布,可把周期表里的元素划分
成5个区,如图1—16所示。除ds①区外, 区的
名称来自按构造原理最后填入电子的能级的符号。
s区、d区和p区分别有几个纵列?为什么s区、d
区和ds区的元素都是金属?s区元素:ⅠA和ⅡA族;
p区元素;ⅢA~ⅦA族元素。0族稀有气体也属于p区。
d区元素:ⅢB~Ⅷ族元素;
ds区元素:包括ⅠB和ⅡB族。
f区元素:包括镧系和锕系元素。 【科学探究】 4.元素周期表可分为哪些族?为什么副族
元素又称为过渡元素? 7个主族、7个副族、一个Ⅷ族、一个零族,
副族元素处于金属元素与非金属元素中间,因
而又称过渡元素。 【科学探究】 5.为什么在元素周期表中非金属主要集中
在右上角三角区内 (如图1—17)? 根据必修学习的元素周期律同一周期从左往右金属性逐渐减弱非金属逐渐增强,同一主族,从下往上金属性减弱,非金属性增强,所以周期系已知112种元素中只有22种非金属(包括稀有气体),它们集中在长式周期表p区右上角三角区内。【科学探究】 6.处于非金属三角区边缘的元素常被称为
半金属或准金属。为什么? 处于非金属三角区边界上的元素兼具金
属和非金属的特性,有时也称“半金属”或“准金
属”, 例如,硅是非金属,但其单质晶体为具蓝
灰色金属光泽的半导体,锗是金属,却跟硅一样
具金刚石型结构,也是半导体。二、元素周期律原子半径电 离 能电负性原子半径学与问 元素周期表中同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?元素周期表中,同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势? 原子半径的大小取决于两个相反的因素:一是电子的能层数,另一个是核电荷数。显然电子的能层数越大,电子间的负电排斥将使原子半径增大,所以同主族元素随着原子序数的增加,电子层数逐渐增多,原子半径逐渐增大。而当电子能层相同时,核电荷数越大,核对电子的吸引力也越大,将使原子半径缩小,所以同周期元素,从左往右,原子半径逐渐减小。 电 离 能 气态电中性原子在基态时失去最外层第一个电子成为+1价气态离子所需的能量叫做第一电离能。 电离能反映了原子失去电子倾向的大小。电离能越大,越难失去电子。再从正离子相继逐个失去电子所需的最
小能量则叫第二、第三、…电离能。各级电
离能的数值关系为I1<I2<I3…. 。例如:
Al(g) – e → Al+(g) I1= 578 kJ? mol-1
Al+(g) – e →Al2+(g) I2= 1823 kJ? mol-1
Al2+(g) – e →Al3+(g) I3= 2751 kJ? mol-1
电离能的大小反映了原子失去电子的难易。
电离能的大小主要决定于原子的有效核电荷、原子半径和原子的电子层结构同族总趋势:自上至下减小,与原子半径增大的趋势一致同周期总趋势:自左至右增大,与原子半径减小的趋势一致 1、观察下图回答:碱金属的电离能与碱金属的活泼性存在什么关系?学与问为什么原子的逐级电离能越来越大?这些数据与钠、镁、铝的化合价有什么关系?
数据的突跃变化说明了什么?学与问2、阅读分析表格数据:阅读理解1、基本概念: 化学键 键合电子 电负性2、阅读课本P20最后一段课文,简述电负性的意义:元素最高价氧化物对应水化物的酸碱性与电负性的关系电负性逐渐增大碱性逐渐增强,酸性逐渐减弱电负性逐渐减小电负性逐渐增大电负性电
负
性
增
大电负性增大同一周期元素电负性及金属性和非金属变化电负性增强,非金属性逐渐增强,金属性逐渐减弱电负性减小,非金属性逐渐减弱,金属性逐渐增强同一主族元素电负性及金属性和非金属变化Na
11钠Li
3锂K
19钾Rb
37铷Cs
55铯F
9氟Cl
17氯Br
35溴I
53碘At
85砹电负性逐渐减小金属性逐渐增强,非金属性逐渐减弱金属性逐渐减弱,非金属性逐渐增强科学探究课文P21 科学探究问题1课文P21 科学探究问题2锂和镁在空气中燃烧分别生成氧化锂和氧化镁
铍和铝的氢氧化物都是两性氢氧化物
硼酸和硅酸都是弱酸
上述锂和镁、铍和铝、硼和硅其电负性很接近,所以锂和镁、铍和铝、硼和硅元素之间金属性非金属性相似。
以上均证明了对角线规则的存在。
1.元素周期表共有几个周期?每个周期各有多少种元素?写出每个周期开头第一个元素和结尾
元素的最外层电子的排产式的通式。为什么第一周期结尾元素的电子排布跟其他周期不同?【科学探究】 IA族 0族
ns1 ns2np6
其中He元素的最外层就是第一电子层所以是1s2 2.元素周期表共有多少个纵列?表上元素的
“外围电子排布”简称“价电子层”,这是由于这些
能级上的电子数可在化学反应中发生变化。每个
纵列的价电子层的电子总数是否相等?18个纵列,每个纵列价电子总数绝大多数
相等,个别不相等。【科学探究】【科学探究】 3.按电子排布,可把周期表里的元素划分
成5个区,如图1—16所示。除ds①区外, 区的
名称来自按构造原理最后填入电子的能级的符号。
s区、d区和p区分别有几个纵列?为什么s区、d
区和ds区的元素都是金属?s区元素:ⅠA和ⅡA族;
p区元素;ⅢA~ⅦA族元素。0族稀有气体也属于p区。
d区元素:ⅢB~Ⅷ族元素;
ds区元素:包括ⅠB和ⅡB族。
f区元素:包括镧系和锕系元素。 【科学探究】 4.元素周期表可分为哪些族?为什么副族
元素又称为过渡元素? 7个主族、7个副族、一个Ⅷ族、一个零族,
副族元素处于金属元素与非金属元素中间,因
而又称过渡元素。 【科学探究】 5.为什么在元素周期表中非金属主要集中
在右上角三角区内 (如图1—17)? 根据必修学习的元素周期律同一周期从左往右金属性逐渐减弱非金属逐渐增强,同一主族,从下往上金属性减弱,非金属性增强,所以周期系已知112种元素中只有22种非金属(包括稀有气体),它们集中在长式周期表p区右上角三角区内。【科学探究】 6.处于非金属三角区边缘的元素常被称为
半金属或准金属。为什么? 处于非金属三角区边界上的元素兼具金
属和非金属的特性,有时也称“半金属”或“准金
属”, 例如,硅是非金属,但其单质晶体为具蓝
灰色金属光泽的半导体,锗是金属,却跟硅一样
具金刚石型结构,也是半导体。二、元素周期律原子半径电 离 能电负性原子半径学与问 元素周期表中同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?元素周期表中,同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势? 原子半径的大小取决于两个相反的因素:一是电子的能层数,另一个是核电荷数。显然电子的能层数越大,电子间的负电排斥将使原子半径增大,所以同主族元素随着原子序数的增加,电子层数逐渐增多,原子半径逐渐增大。而当电子能层相同时,核电荷数越大,核对电子的吸引力也越大,将使原子半径缩小,所以同周期元素,从左往右,原子半径逐渐减小。 电 离 能 气态电中性原子在基态时失去最外层第一个电子成为+1价气态离子所需的能量叫做第一电离能。 电离能反映了原子失去电子倾向的大小。电离能越大,越难失去电子。再从正离子相继逐个失去电子所需的最
小能量则叫第二、第三、…电离能。各级电
离能的数值关系为I1<I2<I3…. 。例如:
Al(g) – e → Al+(g) I1= 578 kJ? mol-1
Al+(g) – e →Al2+(g) I2= 1823 kJ? mol-1
Al2+(g) – e →Al3+(g) I3= 2751 kJ? mol-1
电离能的大小反映了原子失去电子的难易。
电离能的大小主要决定于原子的有效核电荷、原子半径和原子的电子层结构同族总趋势:自上至下减小,与原子半径增大的趋势一致同周期总趋势:自左至右增大,与原子半径减小的趋势一致 1、观察下图回答:碱金属的电离能与碱金属的活泼性存在什么关系?学与问为什么原子的逐级电离能越来越大?这些数据与钠、镁、铝的化合价有什么关系?
数据的突跃变化说明了什么?学与问2、阅读分析表格数据:阅读理解1、基本概念: 化学键 键合电子 电负性2、阅读课本P20最后一段课文,简述电负性的意义:元素最高价氧化物对应水化物的酸碱性与电负性的关系电负性逐渐增大碱性逐渐增强,酸性逐渐减弱电负性逐渐减小电负性逐渐增大电负性电
负
性
增
大电负性增大同一周期元素电负性及金属性和非金属变化电负性增强,非金属性逐渐增强,金属性逐渐减弱电负性减小,非金属性逐渐减弱,金属性逐渐增强同一主族元素电负性及金属性和非金属变化Na
11钠Li
3锂K
19钾Rb
37铷Cs
55铯F
9氟Cl
17氯Br
35溴I
53碘At
85砹电负性逐渐减小金属性逐渐增强,非金属性逐渐减弱金属性逐渐减弱,非金属性逐渐增强科学探究课文P21 科学探究问题1课文P21 科学探究问题2锂和镁在空气中燃烧分别生成氧化锂和氧化镁
铍和铝的氢氧化物都是两性氢氧化物
硼酸和硅酸都是弱酸
上述锂和镁、铍和铝、硼和硅其电负性很接近,所以锂和镁、铍和铝、硼和硅元素之间金属性非金属性相似。
以上均证明了对角线规则的存在。
