江苏省扬州市2021-2022学年高三上学期期末检测化学试题(Word版含答案)
文档属性
| 名称 | 江苏省扬州市2021-2022学年高三上学期期末检测化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-31 17:02:48 | ||
图片预览




文档简介
扬州市2021-2022学年高三上学期期末检测
化学2022.01
注意事项:
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共8页,包含选择题[第1题~第14题,共42分]、非选择题[第15题~第18题,共58分]两部分.本次考试时间为75分钟,满分100分.考试结束后,请将答题卡交回.
2.答题前,请考生务必将自己的学校、班级、姓名、学号、考生号、座位号用0.5毫米的,黑色签字笔写在答题卡上相应的位置.
3.选择题每小题选出答案后,请用2B铅笔在答题纸指定区域填涂,如需改动,用橡皮擦干净后,再填涂其它答案.非选择题请用05毫米的黑色签字笔在答题纸指定区域作答.在试卷或草稿纸上作答一律无效.
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚.
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cr-52 A1-27
选择题(共42分)
单项选择题:本题包括14小题,每小题3分,共计42分.每小题只有一个选项符合题意.
1.可用于鉴别天丝和铜氨纤维.以为原料制备涉及的反应有;.下列说法正确的是( )
A.属于非极性分子 B.属于碱性氧化物
C.和的反应属于氧化还原反应 D.在水溶液中电离出
2.可用于电镀.与溶液反应的方程式为.下列说法正确的是( )
A.中子数为35的铜原子: B.的结构示意图:
C.中存在极性键和非极性键 D.的电子式为
3.下列有关物质的性质与用途具有对应关系的是( )
A.易溶于水,可用作制冷剂 B.受热易分解,可用作氮肥
C.的化学性质稳定,可用作粮食保护气 D.(肼)具有氧化性,可用作高能燃料
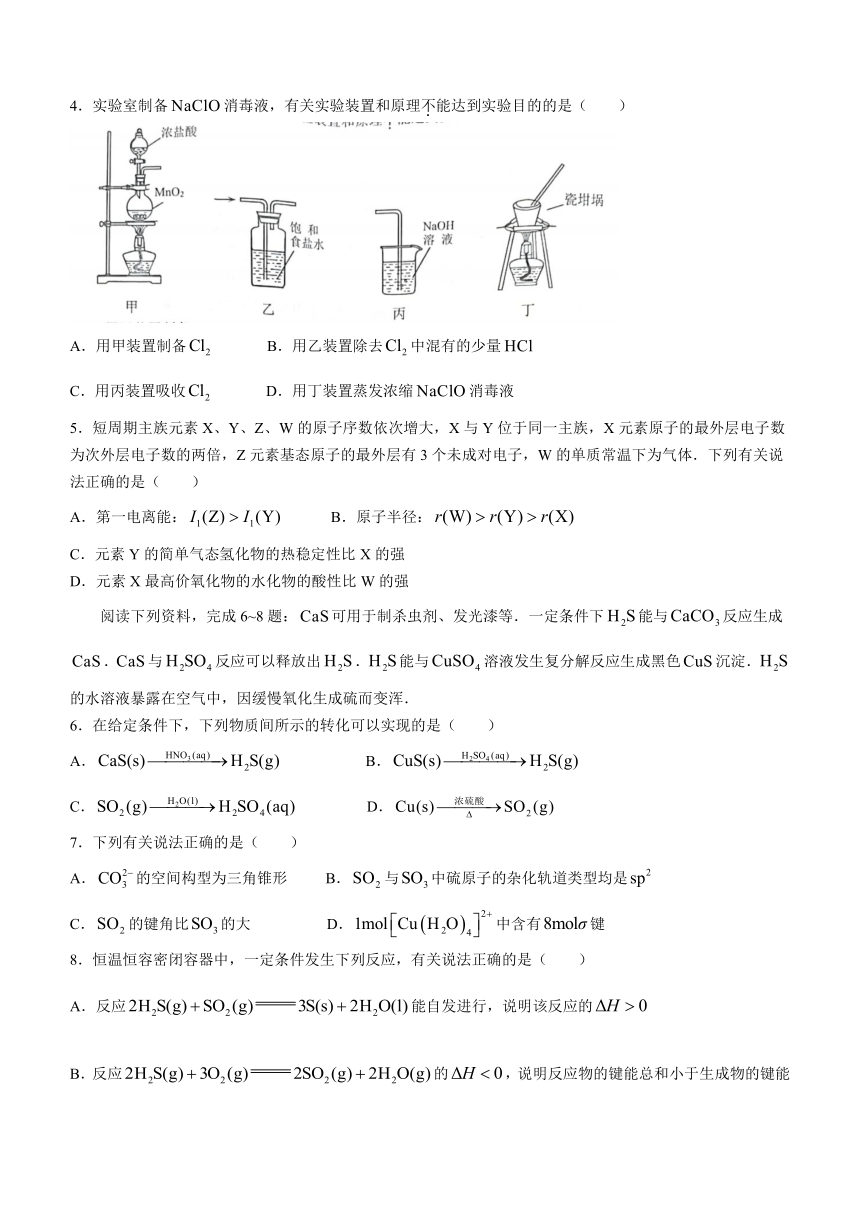
4.实验室制备消毒液,有关实验装置和原理不能达到实验目的的是( )
A.用甲装置制备 B.用乙装置除去中混有的少量
C.用丙装置吸收 D.用丁装置蒸发浓缩消毒液
5.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于同一主族,X元素原子的最外层电子数为次外层电子数的两倍,Z元素基态原子的最外层有3个未成对电子,W的单质常温下为气体.下列有关说法正确的是( )
A.第一电离能: B.原子半径:
C.元素Y的简单气态氢化物的热稳定性比X的强
D.元素X最高价氧化物的水化物的酸性比W的强
阅读下列资料,完成6~8题:可用于制杀虫剂、发光漆等.一定条件下能与反应生成.与反应可以释放出.能与溶液发生复分解反应生成黑色沉淀.的水溶液暴露在空气中,因缓慢氧化生成硫而变浑.
6.在给定条件下,下列物质间所示的转化可以实现的是( )
A. B.
C. D.
7.下列有关说法正确的是( )
A.的空间构型为三角锥形 B.与中硫原子的杂化轨道类型均是
C.的键角比的大 D.中含有键
8.恒温恒容密闭容器中,一定条件发生下列反应,有关说法正确的是( )
A.反应能自发进行,说明该反应的
B.反应的,说明反应物的键能总和小于生成物的键能总和
C.反应达平衡后,向该容器中充入少量,反应再次达平衡时,增大
D.反应达平衡后,向该容器中再充入少量,此时正反应速率增大,是因为反应物中活化分子百分数增大
9.以卤水(含较多)为原料制备的流程如下:
下列有关说法不正确的是( )
A.脱硫时主要反应的离子方程式为
B.过滤2所得固体的主要成分为
C.过滤2所得滤液中主要存在的离子:
D.的晶胞如右图所示,的配位数为6
10.物质Z是一种用于合成内分泌调节剂的药物中间体,其合成路线如下:
下列说法正确的是( )
A.X在浓硫酸催化下加热可发生消去反应 B.用溶液可鉴别化合物X和Y
C.Y在水中的溶解性比X在水中的溶解性好 D.化合物Z中含有手性碳原子
11.室温下取、氨水进行如下实验
实验1:将溶液和氨水等体积混合,混合溶液的.
实验2:将与,溶液等体积混合,生成红褐色沉淀.
实验3:向溶液中通入少量.
实验4:向中滴加盐酸.
下列说法正确的是( )
A.
B.实验2说明混合时溶液中存在
C.实验3中的水解程度减小
D.实验4所得混合溶液中
2.某水处理剂由纳米铁粉有任多孔炭粉的表面复合而成,利用原电池原理处理弱酸性废水中的时,其表面发生如图所示反应.下列说法正确的是( )
A.电池工作时,向负极移动 B.正极附近溶液的酸性增强
C.负极的电极反应式为
D.与单独使用纳米铁粉相比,该水处理剂能加快的去除速率
13.牙齿表面的矿物质可被溶解.向牙膏中添加均可增强护齿效果.已知
或
下列说法正确的是( )
A.溶解的离子方程式为:
B.比较溶液和溶液中粒子浓度,存在:
C.当时,可与反应转化为
D.溶液中:
14.选择性催化还原脱硝时,将和的混合气体以相同的流速通过填充有催化剂的反应器发生的主要反应为:.在不同温度下,仅改变的浓度,的脱除率与浓度的关系如图-1所示:温度为时,控制,和总物质的量相同,仅改变进行实验,的脱除率与的关系如图-2所示.下列说法不正确的是( )
A.浓度在之间时,随着浓度增大,脱除率明显升高的原因可能是与反应生成,而更易与反应
B.浓度相同,温度从升高到时,的脱除率下降的原因可能分解为和
C.当时,脱除率最高的原因可能是、在催化剂表面吸附量相当
D.当后,的脱除率随着增大而减小的原因可能是发生副反应生成了
非选择题(共58分)
15.(14分)以铬铁矿(含及少量)为原料,可制备、、,该工艺流程如下:
(1)“浸取”在、高压下进行,所得浸取液的溶质主要为,生成,的化学方程式为_________.“过滤1”所得滤渣的主要成分是、_________.
(2)“浸取”后,“酸化”时生成的可吸附形成沉淀,而“脱附”时两者分离,吸附与脱附的可能机理的示意图如图-1所示.
①在A的作用下,吸附剂表面出现“活性吸附位”,A的化学式为___________.
②“脱附”时加入溶液可有效脱除表面吸附的,该过程可描述为___________.
(3)“酸化”时铝元素的浓度随的变化如图2所示,太小或太大都会导致溶液中铝元素浓度偏高的原因是_____________.
(4)测定某溶液的浓度.准确量取溶液,加入过量溶液,充分反应.用的标准溶液滴定至终点,消耗溶液.实验测定原理为:.该溶液的物质的量浓度为__________(写出计算过程).
16.(14分)化合物F有抗肿瘤活性,其人工合成路线如下:
(1)B中含氧官能团的名称为_________:D中氮原子的杂化方式为_________.
(2)反应的可能机理为:,.其中X是可与A互变的同分异构体,为取代反应,X的结构简式为____________.
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________.
①能发生银镜反应和水解反应,且水解产物之一能使溶液显紫色;
②分子中含有两个苯环,且其中一个苯环上直接连有3个氨基:
③分子中有6种不同化学环境的氢.
(4)写出以和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________.
17.(15分)水杨醛亚胺的钴配合物可吸收形成氧载体,用于燃料油的氧化脱疏.
(1)制备钴配合物
向烧瓶中加入水杨醛亚胺、无水乙醇,水浴加热条件下迅速加入醋酸钴溶液.生成的沉淀冷却至室温后,抽滤,重结晶,干燥,得到水杨醛亚胺的钻配合物.
①基态核外电子排布式为__________.配合物B中的配位原子是__________.
②可供选择的实验装置如图-1所示,应选__________(填序号)用于制备,理由有_____________.
③为避免反应过程中生成的钴配合物吸收,可采用的方法为_________.
(2)制备醋酸钴溶液
利用废钴镍电池的金属电极芯(主要成分、,还含少量)可生产醋酸钴溶液.
已知:可将氧化:氧化性极强,在水溶液中不存在:在实验条件下,部分阳离子沉淀时溶液如下表.
沉淀物
开始沉淀 2.2 7.4 7.6 0.1 7.6
完全沉淀 3.2 8.9 9.4 1.1 9.2
①酸性溶液中加入可将氧化为,其离子方程式为__________.
②请补充完整实验方案:取一定量己粉碎的电极芯,加入稀充分溶解后过滤,所得滤液中含、、,__________,加入,溶液生成沉淀,用溶解得到醋酸钴溶液(实验中须使用的试剂:溶液、稀、溶液、溶液).
18.(15分)重整能获得氢能,同时能高效转化温室气体.
(1)重整反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应ll:
下,将的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各组分的物质的量分数如图-1所示.
①重整的主反应为__________(填“反应Ⅰ”、“反应Ⅱ”或“反应Ⅲ”),判断的理由是__________.
②时,平衡体系中物质的量分数比略大的原因是____________.
(2)重整过程中的积碳是反应催化剂失活的主要原因.积碳反应除反应Ⅲ外,还发生反应Ⅳ:
积碳反应能迅速到达平衡状态.重整反应中催化剂上产生的积碳的质量与温度的关系如图-2所示.
①__________
②温度低于时,积碳的质量随温度的升高而增多的原因是_________.
(3)在催化剂a和催化剂b分别作用下,重整反应相同时间,控制其他条件相同,催化剂表面均产生积碳.对附着积碳的催化剂a和催化剂b在空气中加热以除去积碳(该过程催化剂不发生反应),固体的质量变化如图-3所示.则重整反应中能保持较长时间催化活性的是__________(填“催化剂a”或“催化剂b”),判断的理由是________________________.
扬州市2021-2022学年高三上学期期末检测
化学参考答案
2022.1
一、单项选择题:共14题,每题3分,共42分。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A D C D A D B B C B C D D B
二、非选择题:共4题,共58分。
15.(14分)(不特别说明,每空2分)
(1)V2O5 + 2NaOH 2NaVO3 + H2O
MgO(多写 Fe3O4不扣分)
(2)①H+
②随着OH-浓度增大,OH-进攻活性吸附位,使从AlOOH表面脱除。
(3)pH太小生成Al3+溶解,pH太大不能完全沉淀。
(4)(1分)
= 0.1000 mol·L 1 × 30.00 mL × 10-3 = 3.00 ×10-3 mol(1分)
= 3.00 ×10-3 mol × = 1.00×10-3 mol(1分)
= 1.00×10-3 mol ÷ 0.01L = 0.10 mol·L 1(1分,不带单位扣1分)
16.(14分)
(1)醚键、酯基(2分); sp2,sp3(2分)
(2)(2分)
(3)或(3分)
(4)
(5分)
17. (15分)(不特别说明,每空2分)
(1)①[Ar]3d7 N、O
②Ⅰ(1分)
装置Ⅰ与外界气压相同且有冷凝回流作用,装置Ⅱ密闭体系不利于实验安全
③向装置中通入一定量N2(排出装置中的空气)、干燥过程中保持真空等
(合理措施皆可)
(2)①2Co2++ClO-+5H2O=Cl-+2Co(OH)3↓+4H+
②向滤液中加入足量H2O2溶液,充分反应后加入NaOH溶液调节pH略大于3.2,过滤;向所得滤液中加足量NaClO溶液,并用NaOH溶液调节1.1≤pH<7.6,过滤;向所得沉淀中加入稀H2SO4和H2O2溶液至完全溶解(4分)
18.(15分)(不特别说明,每空2分)
(1)①反应Ⅰ H2O的物质的量分数非常小;CO和H2的物质的量分数比较大,且比较接近②反应Ⅱ消耗CO2的量大于反应Ⅲ消耗CH4的量
(2)① 247
②温度低于700 ℃时,温度升高有利于反应Ⅲ进行,不利于反应Ⅳ,且温度对反应Ⅲ的影响大于对反应Ⅳ的影响(3分)
(3)催化剂b (1分)
剩余固体的质量与原始固体质量的比值越大,说明催化剂表面的积碳质量越小,催化活性保持时间就越长,催化剂b的剩余固体的质量与原始固体质量的比值大于催化剂a。(3分)
化学2022.01
注意事项:
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共8页,包含选择题[第1题~第14题,共42分]、非选择题[第15题~第18题,共58分]两部分.本次考试时间为75分钟,满分100分.考试结束后,请将答题卡交回.
2.答题前,请考生务必将自己的学校、班级、姓名、学号、考生号、座位号用0.5毫米的,黑色签字笔写在答题卡上相应的位置.
3.选择题每小题选出答案后,请用2B铅笔在答题纸指定区域填涂,如需改动,用橡皮擦干净后,再填涂其它答案.非选择题请用05毫米的黑色签字笔在答题纸指定区域作答.在试卷或草稿纸上作答一律无效.
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚.
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cr-52 A1-27
选择题(共42分)
单项选择题:本题包括14小题,每小题3分,共计42分.每小题只有一个选项符合题意.
1.可用于鉴别天丝和铜氨纤维.以为原料制备涉及的反应有;.下列说法正确的是( )
A.属于非极性分子 B.属于碱性氧化物
C.和的反应属于氧化还原反应 D.在水溶液中电离出
2.可用于电镀.与溶液反应的方程式为.下列说法正确的是( )
A.中子数为35的铜原子: B.的结构示意图:
C.中存在极性键和非极性键 D.的电子式为
3.下列有关物质的性质与用途具有对应关系的是( )
A.易溶于水,可用作制冷剂 B.受热易分解,可用作氮肥
C.的化学性质稳定,可用作粮食保护气 D.(肼)具有氧化性,可用作高能燃料
4.实验室制备消毒液,有关实验装置和原理不能达到实验目的的是( )
A.用甲装置制备 B.用乙装置除去中混有的少量
C.用丙装置吸收 D.用丁装置蒸发浓缩消毒液
5.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于同一主族,X元素原子的最外层电子数为次外层电子数的两倍,Z元素基态原子的最外层有3个未成对电子,W的单质常温下为气体.下列有关说法正确的是( )
A.第一电离能: B.原子半径:
C.元素Y的简单气态氢化物的热稳定性比X的强
D.元素X最高价氧化物的水化物的酸性比W的强
阅读下列资料,完成6~8题:可用于制杀虫剂、发光漆等.一定条件下能与反应生成.与反应可以释放出.能与溶液发生复分解反应生成黑色沉淀.的水溶液暴露在空气中,因缓慢氧化生成硫而变浑.
6.在给定条件下,下列物质间所示的转化可以实现的是( )
A. B.
C. D.
7.下列有关说法正确的是( )
A.的空间构型为三角锥形 B.与中硫原子的杂化轨道类型均是
C.的键角比的大 D.中含有键
8.恒温恒容密闭容器中,一定条件发生下列反应,有关说法正确的是( )
A.反应能自发进行,说明该反应的
B.反应的,说明反应物的键能总和小于生成物的键能总和
C.反应达平衡后,向该容器中充入少量,反应再次达平衡时,增大
D.反应达平衡后,向该容器中再充入少量,此时正反应速率增大,是因为反应物中活化分子百分数增大
9.以卤水(含较多)为原料制备的流程如下:
下列有关说法不正确的是( )
A.脱硫时主要反应的离子方程式为
B.过滤2所得固体的主要成分为
C.过滤2所得滤液中主要存在的离子:
D.的晶胞如右图所示,的配位数为6
10.物质Z是一种用于合成内分泌调节剂的药物中间体,其合成路线如下:
下列说法正确的是( )
A.X在浓硫酸催化下加热可发生消去反应 B.用溶液可鉴别化合物X和Y
C.Y在水中的溶解性比X在水中的溶解性好 D.化合物Z中含有手性碳原子
11.室温下取、氨水进行如下实验
实验1:将溶液和氨水等体积混合,混合溶液的.
实验2:将与,溶液等体积混合,生成红褐色沉淀.
实验3:向溶液中通入少量.
实验4:向中滴加盐酸.
下列说法正确的是( )
A.
B.实验2说明混合时溶液中存在
C.实验3中的水解程度减小
D.实验4所得混合溶液中
2.某水处理剂由纳米铁粉有任多孔炭粉的表面复合而成,利用原电池原理处理弱酸性废水中的时,其表面发生如图所示反应.下列说法正确的是( )
A.电池工作时,向负极移动 B.正极附近溶液的酸性增强
C.负极的电极反应式为
D.与单独使用纳米铁粉相比,该水处理剂能加快的去除速率
13.牙齿表面的矿物质可被溶解.向牙膏中添加均可增强护齿效果.已知
或
下列说法正确的是( )
A.溶解的离子方程式为:
B.比较溶液和溶液中粒子浓度,存在:
C.当时,可与反应转化为
D.溶液中:
14.选择性催化还原脱硝时,将和的混合气体以相同的流速通过填充有催化剂的反应器发生的主要反应为:.在不同温度下,仅改变的浓度,的脱除率与浓度的关系如图-1所示:温度为时,控制,和总物质的量相同,仅改变进行实验,的脱除率与的关系如图-2所示.下列说法不正确的是( )
A.浓度在之间时,随着浓度增大,脱除率明显升高的原因可能是与反应生成,而更易与反应
B.浓度相同,温度从升高到时,的脱除率下降的原因可能分解为和
C.当时,脱除率最高的原因可能是、在催化剂表面吸附量相当
D.当后,的脱除率随着增大而减小的原因可能是发生副反应生成了
非选择题(共58分)
15.(14分)以铬铁矿(含及少量)为原料,可制备、、,该工艺流程如下:
(1)“浸取”在、高压下进行,所得浸取液的溶质主要为,生成,的化学方程式为_________.“过滤1”所得滤渣的主要成分是、_________.
(2)“浸取”后,“酸化”时生成的可吸附形成沉淀,而“脱附”时两者分离,吸附与脱附的可能机理的示意图如图-1所示.
①在A的作用下,吸附剂表面出现“活性吸附位”,A的化学式为___________.
②“脱附”时加入溶液可有效脱除表面吸附的,该过程可描述为___________.
(3)“酸化”时铝元素的浓度随的变化如图2所示,太小或太大都会导致溶液中铝元素浓度偏高的原因是_____________.
(4)测定某溶液的浓度.准确量取溶液,加入过量溶液,充分反应.用的标准溶液滴定至终点,消耗溶液.实验测定原理为:.该溶液的物质的量浓度为__________(写出计算过程).
16.(14分)化合物F有抗肿瘤活性,其人工合成路线如下:
(1)B中含氧官能团的名称为_________:D中氮原子的杂化方式为_________.
(2)反应的可能机理为:,.其中X是可与A互变的同分异构体,为取代反应,X的结构简式为____________.
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________.
①能发生银镜反应和水解反应,且水解产物之一能使溶液显紫色;
②分子中含有两个苯环,且其中一个苯环上直接连有3个氨基:
③分子中有6种不同化学环境的氢.
(4)写出以和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________.
17.(15分)水杨醛亚胺的钴配合物可吸收形成氧载体,用于燃料油的氧化脱疏.
(1)制备钴配合物
向烧瓶中加入水杨醛亚胺、无水乙醇,水浴加热条件下迅速加入醋酸钴溶液.生成的沉淀冷却至室温后,抽滤,重结晶,干燥,得到水杨醛亚胺的钻配合物.
①基态核外电子排布式为__________.配合物B中的配位原子是__________.
②可供选择的实验装置如图-1所示,应选__________(填序号)用于制备,理由有_____________.
③为避免反应过程中生成的钴配合物吸收,可采用的方法为_________.
(2)制备醋酸钴溶液
利用废钴镍电池的金属电极芯(主要成分、,还含少量)可生产醋酸钴溶液.
已知:可将氧化:氧化性极强,在水溶液中不存在:在实验条件下,部分阳离子沉淀时溶液如下表.
沉淀物
开始沉淀 2.2 7.4 7.6 0.1 7.6
完全沉淀 3.2 8.9 9.4 1.1 9.2
①酸性溶液中加入可将氧化为,其离子方程式为__________.
②请补充完整实验方案:取一定量己粉碎的电极芯,加入稀充分溶解后过滤,所得滤液中含、、,__________,加入,溶液生成沉淀,用溶解得到醋酸钴溶液(实验中须使用的试剂:溶液、稀、溶液、溶液).
18.(15分)重整能获得氢能,同时能高效转化温室气体.
(1)重整反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应ll:
下,将的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各组分的物质的量分数如图-1所示.
①重整的主反应为__________(填“反应Ⅰ”、“反应Ⅱ”或“反应Ⅲ”),判断的理由是__________.
②时,平衡体系中物质的量分数比略大的原因是____________.
(2)重整过程中的积碳是反应催化剂失活的主要原因.积碳反应除反应Ⅲ外,还发生反应Ⅳ:
积碳反应能迅速到达平衡状态.重整反应中催化剂上产生的积碳的质量与温度的关系如图-2所示.
①__________
②温度低于时,积碳的质量随温度的升高而增多的原因是_________.
(3)在催化剂a和催化剂b分别作用下,重整反应相同时间,控制其他条件相同,催化剂表面均产生积碳.对附着积碳的催化剂a和催化剂b在空气中加热以除去积碳(该过程催化剂不发生反应),固体的质量变化如图-3所示.则重整反应中能保持较长时间催化活性的是__________(填“催化剂a”或“催化剂b”),判断的理由是________________________.
扬州市2021-2022学年高三上学期期末检测
化学参考答案
2022.1
一、单项选择题:共14题,每题3分,共42分。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A D C D A D B B C B C D D B
二、非选择题:共4题,共58分。
15.(14分)(不特别说明,每空2分)
(1)V2O5 + 2NaOH 2NaVO3 + H2O
MgO(多写 Fe3O4不扣分)
(2)①H+
②随着OH-浓度增大,OH-进攻活性吸附位,使从AlOOH表面脱除。
(3)pH太小生成Al3+溶解,pH太大不能完全沉淀。
(4)(1分)
= 0.1000 mol·L 1 × 30.00 mL × 10-3 = 3.00 ×10-3 mol(1分)
= 3.00 ×10-3 mol × = 1.00×10-3 mol(1分)
= 1.00×10-3 mol ÷ 0.01L = 0.10 mol·L 1(1分,不带单位扣1分)
16.(14分)
(1)醚键、酯基(2分); sp2,sp3(2分)
(2)(2分)
(3)或(3分)
(4)
(5分)
17. (15分)(不特别说明,每空2分)
(1)①[Ar]3d7 N、O
②Ⅰ(1分)
装置Ⅰ与外界气压相同且有冷凝回流作用,装置Ⅱ密闭体系不利于实验安全
③向装置中通入一定量N2(排出装置中的空气)、干燥过程中保持真空等
(合理措施皆可)
(2)①2Co2++ClO-+5H2O=Cl-+2Co(OH)3↓+4H+
②向滤液中加入足量H2O2溶液,充分反应后加入NaOH溶液调节pH略大于3.2,过滤;向所得滤液中加足量NaClO溶液,并用NaOH溶液调节1.1≤pH<7.6,过滤;向所得沉淀中加入稀H2SO4和H2O2溶液至完全溶解(4分)
18.(15分)(不特别说明,每空2分)
(1)①反应Ⅰ H2O的物质的量分数非常小;CO和H2的物质的量分数比较大,且比较接近②反应Ⅱ消耗CO2的量大于反应Ⅲ消耗CH4的量
(2)① 247
②温度低于700 ℃时,温度升高有利于反应Ⅲ进行,不利于反应Ⅳ,且温度对反应Ⅲ的影响大于对反应Ⅳ的影响(3分)
(3)催化剂b (1分)
剩余固体的质量与原始固体质量的比值越大,说明催化剂表面的积碳质量越小,催化活性保持时间就越长,催化剂b的剩余固体的质量与原始固体质量的比值大于催化剂a。(3分)
同课章节目录
