高中化学苏教版(2019)必修第二册 专题七 氮与社会可持续发展-含氮化合物的合理使用-氮肥制备探索之旅课件(22张ppt)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题七 氮与社会可持续发展-含氮化合物的合理使用-氮肥制备探索之旅课件(22张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-01 08:34:00 | ||
图片预览




文档简介
(共22张PPT)
氮肥制备探索之旅
苏教版 化学 必修第二册 专题七 氮与社会可持续发展
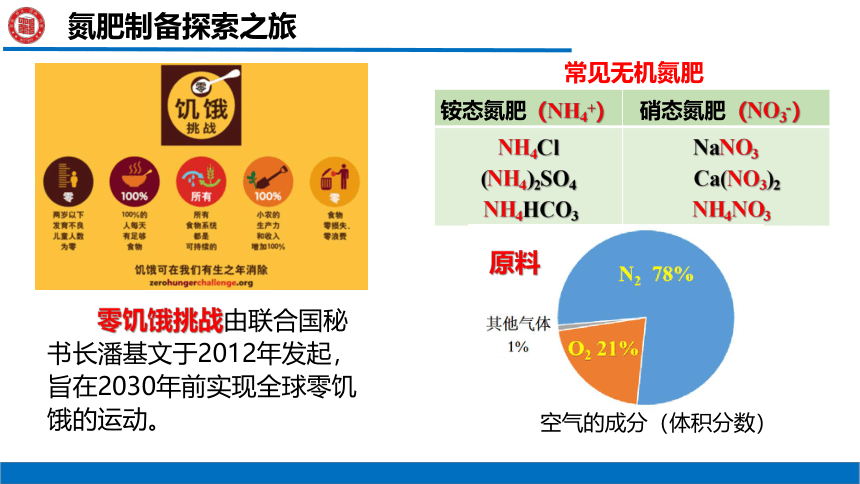
零饥饿挑战由联合国秘书长潘基文于2012年发起,旨在2030年前实现全球零饥饿的运动。
零饥饿挑战
铵态氮肥(NH4+) 硝态氮肥(NO3-)
NH4Cl (NH4)2SO4 NH4HCO3 NaNO3
Ca(NO3)2
NH4NO3
常见无机氮肥
氮肥制备探索之旅
原料
空气的成分(体积分数)
+5 +5
HNO3 NO3-
+4 +2
NO2 NO
-3 -3
NH3 NH4+
N
NO
●
●
●
NO2
HNO3
●
N2
●
●
NH3
●
氢化物
单质
氧化物
酸
盐
物质类别
0
+2
-3
+4
+5
化合价
碱
NO3-
NH4+
(硝态氮肥)
(铵态氮肥)
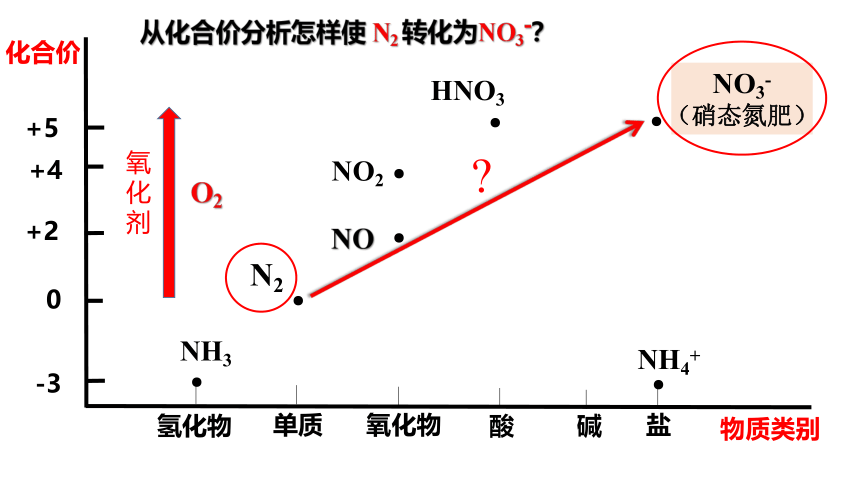
请在学案的价类图中标出下列含氮化合物所在的位置。
HNO3 NO3- NO2 NO NH3 NH4+
NO3-
(硝态氮肥)
NO
●
●
●
NO2
HNO3
●
N2
氧
化
剂
●
NH3
NH4+
●
O2
从化合价分析怎样使 N2 转化为NO3-?
●
氢化物
单质
氧化物
酸
盐
物质类别
0
+2
-3
+4
+5
化合价
碱
氮肥制备探索之旅
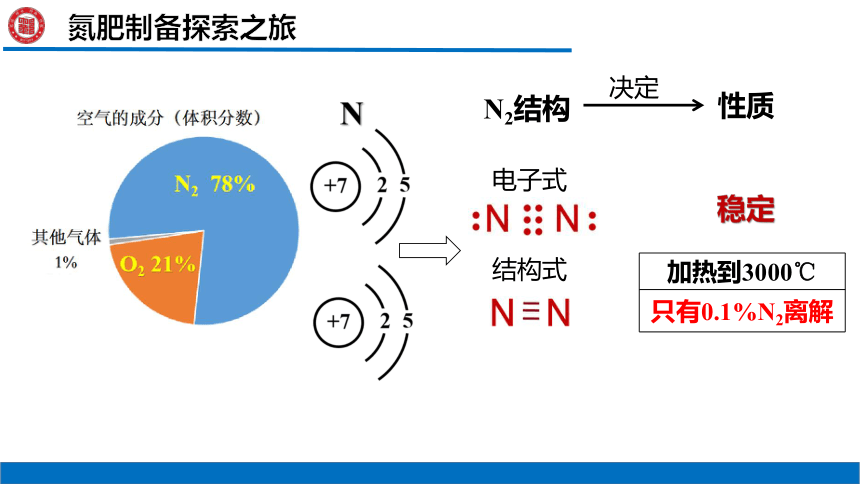
N2结构
性质
稳定
决定
加热到3000℃
只有0.1%N2离解
N
结构式
电子式
0
+2
-3
+4
+5
化合价
NO
●
●
●
NO2
HNO3
●
N2
氧
化
剂
●
NH3
NH4+
●
O2
O2
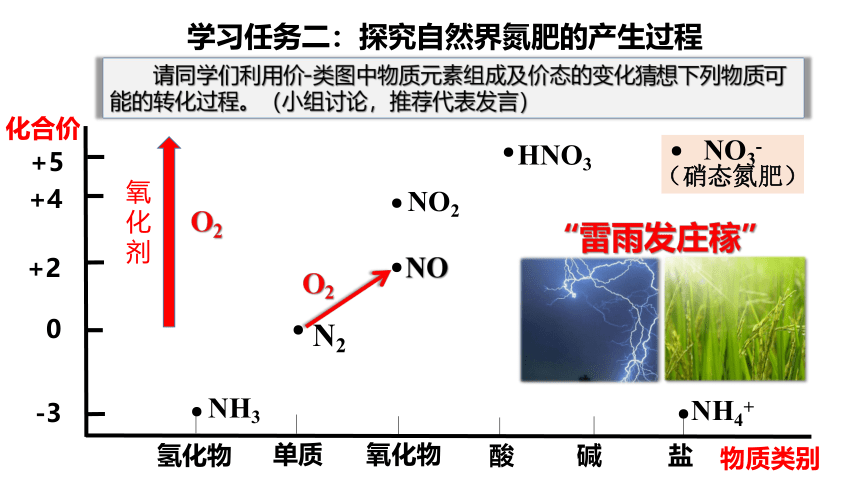
请同学们利用价-类图中物质元素组成及价态的变化猜想下列物质可能的转化过程。(小组讨论,推荐代表发言)
氢化物
单质
氧化物
酸
盐
物质类别
碱
NO3-
(硝态氮肥)
●
学习任务二:探究自然界氮肥的产生过程
“雷雨发庄稼”
学习任务二:探究自然界氮肥的产生过程
探究实验
【实验目的】探究“雷雨发庄稼”的原理
【仪器用品】电子感应圈、带阀三颈烧瓶、50mL针筒
硝酸根离子传感器、pH传感器、 蒸馏水
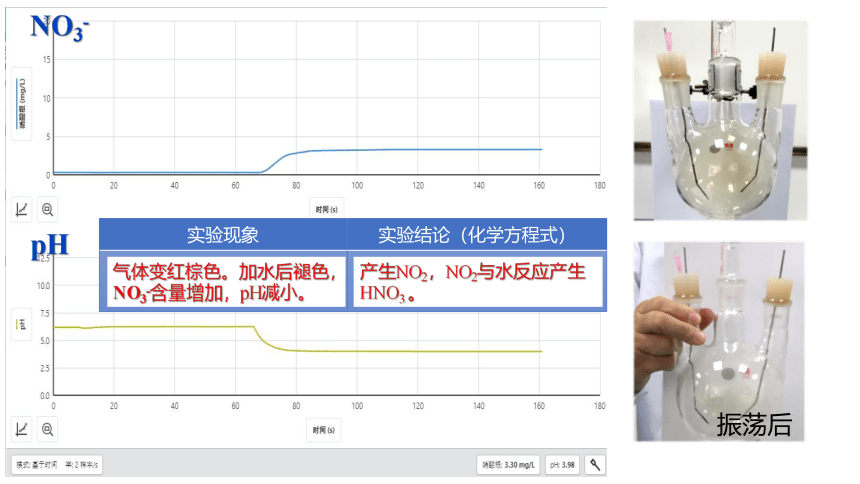
实验步骤 实验现象 结论或解释(化学方程式)
(1)接通电源。 (2)放电。 (3)停止放电,向烧瓶中注入蒸馏水,振荡后倒入插有传感器的烧杯中。
物质 NO NO2
性质 无色 微溶于水 红棕色
信息
NO3-
pH
振荡后
实验现象 实验结论(化学方程式)
产生NO2,NO2与水反应产生HNO3 。
气体变红棕色。加水后褪色,NO3-含量增加,pH减小。
实验步骤 实验现象 结论或解释(化学方程式)
预测猜想:NO2与水反应除生成HNO3 之外,有没有其他物质生成?
(1)将装有3mLNO2针筒的塞子取下,抽1mL蒸馏水,迅速塞上橡胶塞,振荡,观察变化。
(2)针头朝上抽取空气2mL,塞好塞子,观察变化。
加水振荡后,变为无色。
加入空气后,气体又变红棕色。
小组讨论,推选代表全班交流。
3NO2+H2O ═ 2HNO3+NO
2NO+O2 ═ 2NO2
质疑:怎样使NO2全部转化成HNO3?
(1)加水吸收、通入氧气,循环操作。
(2)n(NO2): n(O2)=4:1
实验探究方案设计及实施
【实验目的】验证NO2与水反应产生NO
【实验仪器及药品】 10mL针筒(配橡皮塞)、NO2、蒸馏水
NO3-
(硝态氮肥)
0
+2
-3
+4
+5
化合价
NO
●
●
●
NO2
HNO3
●
●
N2
●
NH3
NH4+
●
结合“雷雨发庄稼”的原理,完善由N2转化为HNO3的价类图。
O2
绘图方法:
1.用箭头表示转化方向
2.注明反应物
氢化物
单质
氧化物
酸
盐
物质类别
碱
金属盐、
氧化物等
H2O
O2
氮的固定
氮元素在自然界中的循环
高能
固氮
生物
固氮
人工固氮
NO
O2
●
●
●
NO2
HNO3
●
O2
H2O
NO3-
(硝态氮肥)
●
N2
氧
化
还
原
小组讨论:请结合价类图探寻由 N2 制备氮肥的其他途径 。
H2
NH4+
(铵态氮肥)
NH3
●
●
H+(酸)
金属盐、
氧化物等
0
+2
-3
+4
+5
化合价
氢化物
单质
氧化物
酸
盐
物质类别
碱
自主阅读(详见学案):“氮肥制备化学史”
写出相关反应的化学方程式:
(1)工业合成氨。
(2)氨的催化氧化。
(3)氨气制备NH4NO3。
任务三:探究人工制备氮肥的方法
合成氨工艺流程图
任务三:探究人工制备氮肥的方法
实验室
工业化
催化剂:锇
压强:1.75×107 Pa
温度:550℃
产率:8%
催化剂:铁
完善高压反应器
产率:20%
德国化学家哈伯
1918年诺贝尔化学奖
德国工业化学家博施
1931年诺贝尔化学奖
任务三:探究人工制备氮肥的方法
液氨
循环
冷却
该设备有哪些优点?
耗能降低
产率高
释放的热能和剩余的物质可以循环利用
反应放热
实验步骤 实验现象 实验结论或解释
(化学方程式)
1. 将装有浓氨水的注射器塞子拔下。 2. 推到装有4滴浓盐酸的平底烧瓶中。
探究实验
【实验目的】探究铵态氮肥的制备
【实验仪器及药品】 10mL针筒1支、50mL平底烧瓶1个、浓盐酸、浓氨水
烧瓶中出现大量白烟
NH3+HCl═NH4Cl
任务三:探究人工制备氮肥的方法
氨气和酸反应
生成铵盐
0
+2
-3
+4
+5
化合价
NO
O2
●
●
●
NO2
HNO3
●
O2
H2O
NO3-
(硝态氮肥)
●
N2
金属盐、
氧化物等
氢化物
单质
氧化物
酸
盐
物质类别
碱
小结
NH3
NH4+
(铵态氮肥)
H+(酸)
H2
●
●
氧
化
还
原
假如没有发明合成氨,以及第一、第二、第三代新农药的技术,世界粮食产量至少要减半,60亿人口中的30亿会被饿死。
——徐光宪
著名化学家、中科院资深院士
2008年国家最高科学技术奖获得者
氮肥制备探索之旅
氮肥制备探索之旅——研究前沿
合成氨的条件(中国知网):
电化学、改进催化剂、研究细菌转化、光催化……
【课后调查】
据推算 工业合成氨年耗能占全球能耗的2%左右,需消耗约25%的化石资源,并且产生大量温室气体。
如何将氮气直接、高效、温和地转化为含氮化合物。查阅资料,了解研究进展。
氮肥制备探索之旅
氮肥制备探索之旅
谈一谈氮肥制备探索之旅对你有什么启发?
氮肥制备探索之旅
苏教版 化学 必修第二册 专题七 氮与社会可持续发展
零饥饿挑战由联合国秘书长潘基文于2012年发起,旨在2030年前实现全球零饥饿的运动。
零饥饿挑战
铵态氮肥(NH4+) 硝态氮肥(NO3-)
NH4Cl (NH4)2SO4 NH4HCO3 NaNO3
Ca(NO3)2
NH4NO3
常见无机氮肥
氮肥制备探索之旅
原料
空气的成分(体积分数)
+5 +5
HNO3 NO3-
+4 +2
NO2 NO
-3 -3
NH3 NH4+
N
NO
●
●
●
NO2
HNO3
●
N2
●
●
NH3
●
氢化物
单质
氧化物
酸
盐
物质类别
0
+2
-3
+4
+5
化合价
碱
NO3-
NH4+
(硝态氮肥)
(铵态氮肥)
请在学案的价类图中标出下列含氮化合物所在的位置。
HNO3 NO3- NO2 NO NH3 NH4+
NO3-
(硝态氮肥)
NO
●
●
●
NO2
HNO3
●
N2
氧
化
剂
●
NH3
NH4+
●
O2
从化合价分析怎样使 N2 转化为NO3-?
●
氢化物
单质
氧化物
酸
盐
物质类别
0
+2
-3
+4
+5
化合价
碱
氮肥制备探索之旅
N2结构
性质
稳定
决定
加热到3000℃
只有0.1%N2离解
N
结构式
电子式
0
+2
-3
+4
+5
化合价
NO
●
●
●
NO2
HNO3
●
N2
氧
化
剂
●
NH3
NH4+
●
O2
O2
请同学们利用价-类图中物质元素组成及价态的变化猜想下列物质可能的转化过程。(小组讨论,推荐代表发言)
氢化物
单质
氧化物
酸
盐
物质类别
碱
NO3-
(硝态氮肥)
●
学习任务二:探究自然界氮肥的产生过程
“雷雨发庄稼”
学习任务二:探究自然界氮肥的产生过程
探究实验
【实验目的】探究“雷雨发庄稼”的原理
【仪器用品】电子感应圈、带阀三颈烧瓶、50mL针筒
硝酸根离子传感器、pH传感器、 蒸馏水
实验步骤 实验现象 结论或解释(化学方程式)
(1)接通电源。 (2)放电。 (3)停止放电,向烧瓶中注入蒸馏水,振荡后倒入插有传感器的烧杯中。
物质 NO NO2
性质 无色 微溶于水 红棕色
信息
NO3-
pH
振荡后
实验现象 实验结论(化学方程式)
产生NO2,NO2与水反应产生HNO3 。
气体变红棕色。加水后褪色,NO3-含量增加,pH减小。
实验步骤 实验现象 结论或解释(化学方程式)
预测猜想:NO2与水反应除生成HNO3 之外,有没有其他物质生成?
(1)将装有3mLNO2针筒的塞子取下,抽1mL蒸馏水,迅速塞上橡胶塞,振荡,观察变化。
(2)针头朝上抽取空气2mL,塞好塞子,观察变化。
加水振荡后,变为无色。
加入空气后,气体又变红棕色。
小组讨论,推选代表全班交流。
3NO2+H2O ═ 2HNO3+NO
2NO+O2 ═ 2NO2
质疑:怎样使NO2全部转化成HNO3?
(1)加水吸收、通入氧气,循环操作。
(2)n(NO2): n(O2)=4:1
实验探究方案设计及实施
【实验目的】验证NO2与水反应产生NO
【实验仪器及药品】 10mL针筒(配橡皮塞)、NO2、蒸馏水
NO3-
(硝态氮肥)
0
+2
-3
+4
+5
化合价
NO
●
●
●
NO2
HNO3
●
●
N2
●
NH3
NH4+
●
结合“雷雨发庄稼”的原理,完善由N2转化为HNO3的价类图。
O2
绘图方法:
1.用箭头表示转化方向
2.注明反应物
氢化物
单质
氧化物
酸
盐
物质类别
碱
金属盐、
氧化物等
H2O
O2
氮的固定
氮元素在自然界中的循环
高能
固氮
生物
固氮
人工固氮
NO
O2
●
●
●
NO2
HNO3
●
O2
H2O
NO3-
(硝态氮肥)
●
N2
氧
化
还
原
小组讨论:请结合价类图探寻由 N2 制备氮肥的其他途径 。
H2
NH4+
(铵态氮肥)
NH3
●
●
H+(酸)
金属盐、
氧化物等
0
+2
-3
+4
+5
化合价
氢化物
单质
氧化物
酸
盐
物质类别
碱
自主阅读(详见学案):“氮肥制备化学史”
写出相关反应的化学方程式:
(1)工业合成氨。
(2)氨的催化氧化。
(3)氨气制备NH4NO3。
任务三:探究人工制备氮肥的方法
合成氨工艺流程图
任务三:探究人工制备氮肥的方法
实验室
工业化
催化剂:锇
压强:1.75×107 Pa
温度:550℃
产率:8%
催化剂:铁
完善高压反应器
产率:20%
德国化学家哈伯
1918年诺贝尔化学奖
德国工业化学家博施
1931年诺贝尔化学奖
任务三:探究人工制备氮肥的方法
液氨
循环
冷却
该设备有哪些优点?
耗能降低
产率高
释放的热能和剩余的物质可以循环利用
反应放热
实验步骤 实验现象 实验结论或解释
(化学方程式)
1. 将装有浓氨水的注射器塞子拔下。 2. 推到装有4滴浓盐酸的平底烧瓶中。
探究实验
【实验目的】探究铵态氮肥的制备
【实验仪器及药品】 10mL针筒1支、50mL平底烧瓶1个、浓盐酸、浓氨水
烧瓶中出现大量白烟
NH3+HCl═NH4Cl
任务三:探究人工制备氮肥的方法
氨气和酸反应
生成铵盐
0
+2
-3
+4
+5
化合价
NO
O2
●
●
●
NO2
HNO3
●
O2
H2O
NO3-
(硝态氮肥)
●
N2
金属盐、
氧化物等
氢化物
单质
氧化物
酸
盐
物质类别
碱
小结
NH3
NH4+
(铵态氮肥)
H+(酸)
H2
●
●
氧
化
还
原
假如没有发明合成氨,以及第一、第二、第三代新农药的技术,世界粮食产量至少要减半,60亿人口中的30亿会被饿死。
——徐光宪
著名化学家、中科院资深院士
2008年国家最高科学技术奖获得者
氮肥制备探索之旅
氮肥制备探索之旅——研究前沿
合成氨的条件(中国知网):
电化学、改进催化剂、研究细菌转化、光催化……
【课后调查】
据推算 工业合成氨年耗能占全球能耗的2%左右,需消耗约25%的化石资源,并且产生大量温室气体。
如何将氮气直接、高效、温和地转化为含氮化合物。查阅资料,了解研究进展。
氮肥制备探索之旅
氮肥制备探索之旅
谈一谈氮肥制备探索之旅对你有什么启发?
