高中化学苏教版(2019)选择性必修1 专题三 水溶液中的离子反应 第三单元 盐类水解的应用1(25张ppt)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题三 水溶液中的离子反应 第三单元 盐类水解的应用1(25张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-01 09:09:19 | ||
图片预览








文档简介
(共25张PPT)
盐类水解的应用
绣球花绣球中有种花青素叫飞燕草素,与铝离子结合后花色就会变蓝。
Al2(SO4)3
溶液中存在哪些微粒?
微粒之间可能发生相互作用?
溶液呈现酸性的原因
Al3++3H2O Al(OH)3+3H+
Al2(SO4)3
探究1:如何证明Al3+水解?
如何比较等浓度的 ①CH3COONa ②NaClO 溶液的pH?
CH3COOH HClO
Ka 1.8×10-5 3.0×10-8
CH3COONa NaClO
Kh
5.6×10-10
3.3×10-7
盐类水解比较微弱
越弱越水解
探究2:定量解释“越弱越水解”
X - + H2O HX + OH -
Kh=
c(HX) × c(OH-)
c(X-)
=
c(HX) × c(OH-) × c(H+)
c(X-) × c(H+)
=
c(OH-) × c(H+)
c(X-) × c(H+)
c(HX)
=
Kw
Ka
② > ①
如何比较等浓度的 ①CH3COONa ②NaClO 溶液的pH?
CH3COOH HClO
Ka 1.8×10-5 3.0×10-8
CH3COONa NaClO
Kh
5.6×10-10
3.3×10-7
③Na2CO3
H2CO3
4.3×10-7 5.6×10-11
Na2CO3
CO32- + H2O HCO3- + OH -
Kh=
c(HCO3-) × c(OH-)
c(CO32-)
=
c(HCO3 -) × c(OH-) × c(H+)
c(CO32-) × c(H+)
=
c(OH-) × c(H+)
c(CO32-) × c(H+)
c(HCO3 -)
Kw
Ka2
=1.8×10-4
=
③ > ② > ①
1.8×10-4
Kw
Ka
探究2:定量解释“越弱越水解”
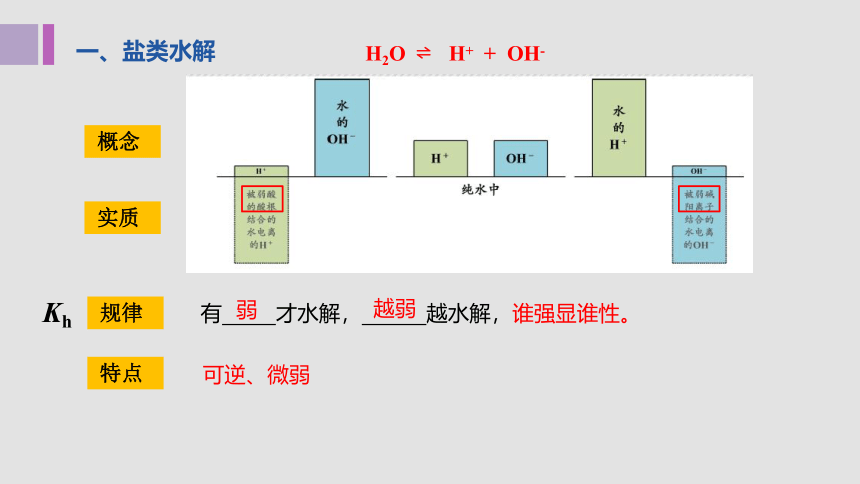
实质
概念
一、盐类水解
H2O H+ + OH-
规律
特点
有 才水解, 越水解,谁强显谁性。
弱
越弱
可逆、微弱
Kh
HCO3-的电离平衡
HCO3- H+ + CO32-
Ka2=5.6×10-11
水的电离平衡
H2O H+ + OH-
HCO3-的水解平衡
HCO3- + H2O H2CO3+ OH-
水解程度 > 电离程度
( H2CO3 Ka1= 4.3×10-7 Ka2= 5.6×10-11)
弱酸酸式盐可以通过比较水解、电离程度的大小来判断酸碱性。
等浓度的CH3COOH和CH3COONa混合溶液?( Ka= 1.8×10-5)
电离平衡
水解平衡
溶液的
酸碱性
定量比较
体系中存
在的粒子
方法导引
Kw
Ka1
=2.3×10-8
Kh=
NaHCO3
使用调蓝剂后,依然没有开出蓝色花。
Al3++3H2O Al(OH)3+3H+
思考:
花青素与铝离子结合后花色就会变蓝。
南方土壤偏酸性,怎么调出粉色花?
Al3++3H2O Al(OH)3+3H+
在花蕾形成前,每月浇灌3次
硫酸亚铁或白醋水。
二、影响盐类水解平衡的因素
温度
浓度
外加酸、碱、盐
影响
盐类
水解
的因素
外因
内因
越弱越
水解
探究3:温度对水解平衡的影响
CO32- + H2O HCO3- + OH-
Fe3+ + 3H2O Fe(OH)3 + 3H+
0.1mol/L碳酸钠溶液的pH随温度变化曲线
c(H+)=
Kw
c(OH-)
温度变化后,单以溶液pH的变化来判断碳酸钠的水解程度的变化是不科学的。
Fe2(SO4)3
加热前
加热后
探究4:蒸干氯化铁溶液得到的固体是什么?
Fe2(SO4)3
FeCl3
Fe2(SO4) 3
如何检验蒸发过程中产生的蒸汽?
0.05mol/L的Al2(SO4)3溶液pH=2.41
0.005mol/L的Al2(SO4)3溶液pH=3.05
越稀越水解
探究5:浓度对水解平衡的影响
向硫酸铝溶液中加水,Al3+ 的水解程度?溶液的pH
判断溶液酸碱性
化肥的使用
判断盐溶液蒸干产物
胶体的制取
纯碱溶液除油污
水解应用
?
三、盐类水解的应用
探究6:泡沫灭火器工作原理
Al2(SO4)3溶液和NaHCO3溶液
试剂:
反应原理:
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
内筒(塑料)
外筒(钢制)
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
思考:能否用Na2CO3溶液代替NaHCO3溶液
2Al 3+ + 3CO32– +3H2O 2Al(OH)3 + 3CO2
向两个小烧杯中分别加入10mL的碳酸钠、碳酸氢钠溶液。
同时加入3mL硫酸铝溶液。观察现象。
回顾
再上台阶
概念 实质 规律 方程式书写
影响盐类水解的主要因素
盐类水解的应用
登高远望
基础回望
判断NaHSO3溶液的酸碱性, H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
判断CH3COONH4溶液的酸碱性
已知:Ka= 1.8×10-5 Kb= 1.8×10-5
练一练
如何除去氯化镁酸性溶液中的氯化铁?
Fe3+ Fe2+ Cu2+ Mg2+
开始沉淀的pH 1.5 6.5 4.4 9.3
完全沉淀的pH 3.3 9.9 6.4 10.8
如何除去氯化铜溶液中的氯化亚铁?
可加入H2O2,把二价铁氧化成三价铁
再加入CuO或Cu (OH)2或CuCO3调节 4.4>pH>3.3
Fe3++3H2O Fe(OH)3+3H+
可加入氧化镁或氢氧化镁反应掉部分H+,促进铁离子的水解,使Fe3+转化为氢氧化铁沉淀而除去。
练一练
谢谢大家
盐类水解的应用
绣球花绣球中有种花青素叫飞燕草素,与铝离子结合后花色就会变蓝。
Al2(SO4)3
溶液中存在哪些微粒?
微粒之间可能发生相互作用?
溶液呈现酸性的原因
Al3++3H2O Al(OH)3+3H+
Al2(SO4)3
探究1:如何证明Al3+水解?
如何比较等浓度的 ①CH3COONa ②NaClO 溶液的pH?
CH3COOH HClO
Ka 1.8×10-5 3.0×10-8
CH3COONa NaClO
Kh
5.6×10-10
3.3×10-7
盐类水解比较微弱
越弱越水解
探究2:定量解释“越弱越水解”
X - + H2O HX + OH -
Kh=
c(HX) × c(OH-)
c(X-)
=
c(HX) × c(OH-) × c(H+)
c(X-) × c(H+)
=
c(OH-) × c(H+)
c(X-) × c(H+)
c(HX)
=
Kw
Ka
② > ①
如何比较等浓度的 ①CH3COONa ②NaClO 溶液的pH?
CH3COOH HClO
Ka 1.8×10-5 3.0×10-8
CH3COONa NaClO
Kh
5.6×10-10
3.3×10-7
③Na2CO3
H2CO3
4.3×10-7 5.6×10-11
Na2CO3
CO32- + H2O HCO3- + OH -
Kh=
c(HCO3-) × c(OH-)
c(CO32-)
=
c(HCO3 -) × c(OH-) × c(H+)
c(CO32-) × c(H+)
=
c(OH-) × c(H+)
c(CO32-) × c(H+)
c(HCO3 -)
Kw
Ka2
=1.8×10-4
=
③ > ② > ①
1.8×10-4
Kw
Ka
探究2:定量解释“越弱越水解”
实质
概念
一、盐类水解
H2O H+ + OH-
规律
特点
有 才水解, 越水解,谁强显谁性。
弱
越弱
可逆、微弱
Kh
HCO3-的电离平衡
HCO3- H+ + CO32-
Ka2=5.6×10-11
水的电离平衡
H2O H+ + OH-
HCO3-的水解平衡
HCO3- + H2O H2CO3+ OH-
水解程度 > 电离程度
( H2CO3 Ka1= 4.3×10-7 Ka2= 5.6×10-11)
弱酸酸式盐可以通过比较水解、电离程度的大小来判断酸碱性。
等浓度的CH3COOH和CH3COONa混合溶液?( Ka= 1.8×10-5)
电离平衡
水解平衡
溶液的
酸碱性
定量比较
体系中存
在的粒子
方法导引
Kw
Ka1
=2.3×10-8
Kh=
NaHCO3
使用调蓝剂后,依然没有开出蓝色花。
Al3++3H2O Al(OH)3+3H+
思考:
花青素与铝离子结合后花色就会变蓝。
南方土壤偏酸性,怎么调出粉色花?
Al3++3H2O Al(OH)3+3H+
在花蕾形成前,每月浇灌3次
硫酸亚铁或白醋水。
二、影响盐类水解平衡的因素
温度
浓度
外加酸、碱、盐
影响
盐类
水解
的因素
外因
内因
越弱越
水解
探究3:温度对水解平衡的影响
CO32- + H2O HCO3- + OH-
Fe3+ + 3H2O Fe(OH)3 + 3H+
0.1mol/L碳酸钠溶液的pH随温度变化曲线
c(H+)=
Kw
c(OH-)
温度变化后,单以溶液pH的变化来判断碳酸钠的水解程度的变化是不科学的。
Fe2(SO4)3
加热前
加热后
探究4:蒸干氯化铁溶液得到的固体是什么?
Fe2(SO4)3
FeCl3
Fe2(SO4) 3
如何检验蒸发过程中产生的蒸汽?
0.05mol/L的Al2(SO4)3溶液pH=2.41
0.005mol/L的Al2(SO4)3溶液pH=3.05
越稀越水解
探究5:浓度对水解平衡的影响
向硫酸铝溶液中加水,Al3+ 的水解程度?溶液的pH
判断溶液酸碱性
化肥的使用
判断盐溶液蒸干产物
胶体的制取
纯碱溶液除油污
水解应用
?
三、盐类水解的应用
探究6:泡沫灭火器工作原理
Al2(SO4)3溶液和NaHCO3溶液
试剂:
反应原理:
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
内筒(塑料)
外筒(钢制)
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
思考:能否用Na2CO3溶液代替NaHCO3溶液
2Al 3+ + 3CO32– +3H2O 2Al(OH)3 + 3CO2
向两个小烧杯中分别加入10mL的碳酸钠、碳酸氢钠溶液。
同时加入3mL硫酸铝溶液。观察现象。
回顾
再上台阶
概念 实质 规律 方程式书写
影响盐类水解的主要因素
盐类水解的应用
登高远望
基础回望
判断NaHSO3溶液的酸碱性, H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
判断CH3COONH4溶液的酸碱性
已知:Ka= 1.8×10-5 Kb= 1.8×10-5
练一练
如何除去氯化镁酸性溶液中的氯化铁?
Fe3+ Fe2+ Cu2+ Mg2+
开始沉淀的pH 1.5 6.5 4.4 9.3
完全沉淀的pH 3.3 9.9 6.4 10.8
如何除去氯化铜溶液中的氯化亚铁?
可加入H2O2,把二价铁氧化成三价铁
再加入CuO或Cu (OH)2或CuCO3调节 4.4>pH>3.3
Fe3++3H2O Fe(OH)3+3H+
可加入氧化镁或氢氧化镁反应掉部分H+,促进铁离子的水解,使Fe3+转化为氢氧化铁沉淀而除去。
练一练
谢谢大家
