高中化学苏教版(2019)选择性必修1 专题三 水溶液中的离子反应 第三单元 盐类水解的应用——从碳酸亚铁的制备看在水解平衡原理(20张ppt)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题三 水溶液中的离子反应 第三单元 盐类水解的应用——从碳酸亚铁的制备看在水解平衡原理(20张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 47.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-01 09:11:38 | ||
图片预览






文档简介
(共20张PPT)
盐类水解的应用
——从碳酸亚铁的制备
看水解平衡原理
全球贫血患病率和受影响人数
人群组 贫血患病率 受影响人群
百分比 95% Cl 数目(百万计) 95% Cl
学龄儿童 25.4 19.9-30.9 305 238-371
非孕妇 30.2 28.7-31.6 468 446-491
成年男子 12.7 8.6-16.9 260 175-345
老年人 23.9 18.3-29.4 164 126-202
全人群 24.8 22.9-26.7 1620 1500-1740
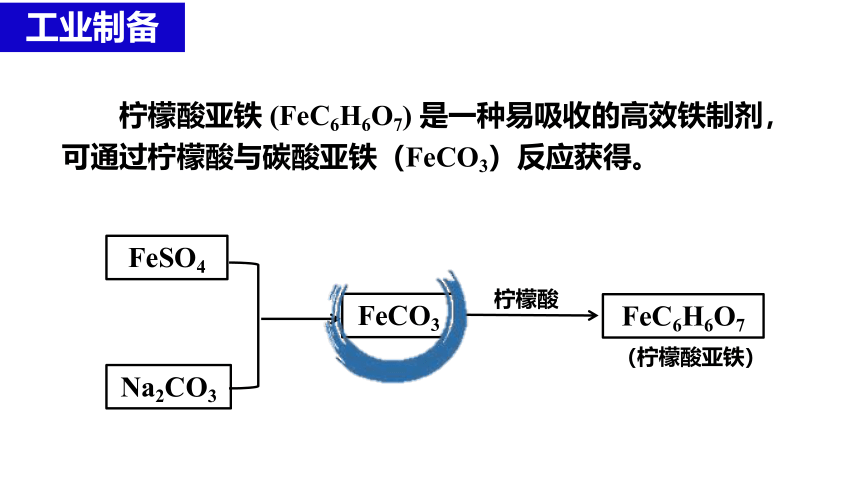
柠檬酸亚铁 (FeC6H6O7) 是一种易吸收的高效铁制剂,可通过柠檬酸与碳酸亚铁(FeCO3)反应获得。
FeSO4
Na2CO3
FeC6H6O7
FeCO3
柠檬酸
(柠檬酸亚铁)
工业制备
实质:
促进水的电离。
生成弱电解质,
一、探源盐类水解的实质
思考:从影响水的电离平衡和产物的角度分析两者的共同点。
请设计实验:从水解平衡移动的角度,证明Na2CO3 溶液显碱性是因为 离子引起的。
提醒:药品取用量不要过多,以12mL为宜。
一、探源盐类水解的实质
一、探源盐类水解的实质
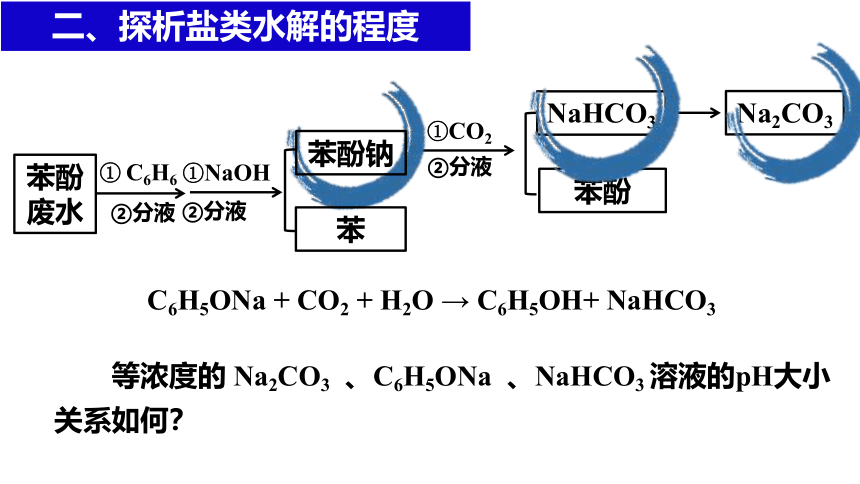
NaHCO3
②分液
①CO2
苯酚
Na2CO3
C6H5ONa + CO2 + H2O → C6H5OH+ NaHCO3
②分液
①NaOH
苯
苯酚钠
苯酚废水
① C6H6
②分液
二、探析盐类水解的程度
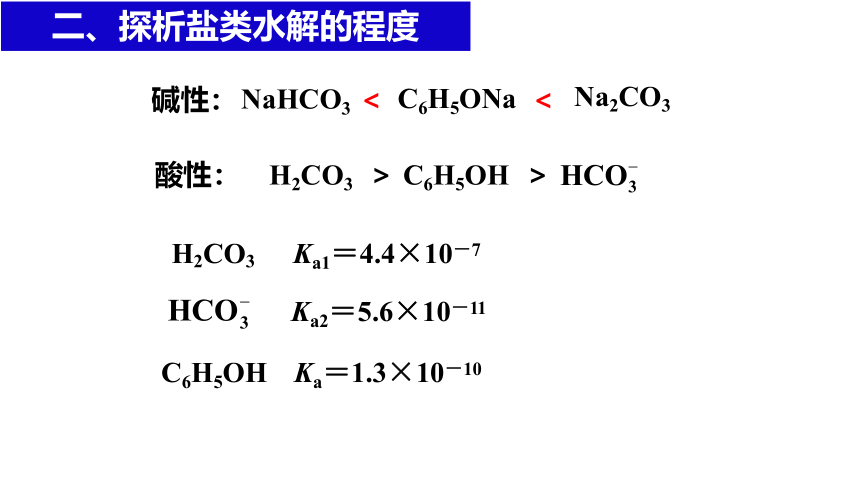
等浓度的 Na2CO3 、C6H5ONa 、NaHCO3 溶液的pH大小关系如何?
酸性: H2CO3 > C6H5OH >
碱性: < <
H2CO3
C6H5OH
Ka1=4.4×10-7
Ka2=5.6×10-11
Ka=1.3×10-10
Na2CO3
C6H5ONa
NaHCO3
二、探析盐类水解的程度
H2CO3
Ka1=4.4×10-7
Ka2=5.6×10-11
( C6H5O- 的水解平衡常数)
二、探析盐类水解的程度
1. 结合有关物质的pKa和测定得到的溶液的pH,将三种浓度均为0.1mol/L的盐溶液的对应磁吸摆放到白板中的相应位置。
2. 找出pKa与pH的一般规律。并将代表 0.1mol/L CH3COONa溶液的磁吸摆放到白板中可能的位置。
已知:pKa1(H2CO3)=6.37;pKa2 (H2CO3)= 10.25
pKa (C6H5OH)=9.98
pKa(CH3COOH)=4.75
pKa = -lgKa, pKa越大,Ka越小, 酸的酸性越弱。
二、探析盐类水解的程度
CH3COONa
三、探寻盐类水解的应用
FeSO4
FeCO3
Na2CO3
FeC6H6O7
柠檬酸
(柠檬酸亚铁)
硫铁矿烧渣
H2SO4(过量)
除杂
FeSO4
硫铁矿烧渣
H2SO4(过量)
除杂
(主要含Fe2O3、SiO2、少量 Al2O3等杂质)
2. 怎样除杂才能得到较纯净的FeSO4溶液。
1. 过量H2SO4 的作用是什么。
金属离子 沉淀开始pH 沉淀完全pH
Al3+ 3.1 5.1
Fe2+ 5.9 6.9
Fe3+ 1.2 3.2
三、探寻盐类水解的应用
加铁粉
调pH
过滤
FeSO4
Al(OH)3
Fe3+ Al3+ H+ SO4 的溶液
滤液
①调pH
②过滤
Fe(OH)3
加酸
加铁粉
FeSO4
Fe3+ Al3+ H+ SO4 的溶液
你认为两种方法哪个更合理?
路径1:
路径2:
金属离子 沉淀开始pH 沉淀完全pH
Al3+ 3.1 5.1
Fe2+ 5.9 6.9
Fe3+ 1.2 3.2
三、探寻盐类水解的应用
FeSO4
FeCO3
Na2CO3
FeC6H6O7
柠檬酸
(柠檬酸亚铁)
三、探寻盐类水解的应用
沉淀中铁元素质量分数%
碳酸亚铁的产率%
Na2CO3溶液浓度(mol/L)
Na2CO3溶液浓度对碳酸亚铁产率的影响
25
30
35
40
45
50
60
70
80
90
1.5
2
2.5
3
3.5
4
① 从沉淀可能含有的成分分析,为何沉淀中铁元素质量分数略有上升?
② Na2CO3浓度大于4mol/L时,FeCO3产率反而下降?
三、探寻盐类水解的应用
沉淀中铁元素质量分数%
碳酸亚铁的产率%
Na2CO3溶液浓度(mol/L)
Na2CO3溶液浓度对碳酸亚铁产率的影响
25
30
35
40
45
50
60
70
80
90
1.5
2
2.5
3
3.5
4
向FeSO4溶液中缓缓滴加Na2CO3溶液并不断搅拌,至产生大量白色沉淀为止。过滤,洗涤,干燥。
三、探寻盐类水解的应用
课 后 作 业
请同学们利用网络查阅盐类水解原理在工农业生产和日常生活中应用,以小组为单位,制作长约2分钟的科普小视频。
谢 谢 !
盐类水解的应用
——从碳酸亚铁的制备
看水解平衡原理
全球贫血患病率和受影响人数
人群组 贫血患病率 受影响人群
百分比 95% Cl 数目(百万计) 95% Cl
学龄儿童 25.4 19.9-30.9 305 238-371
非孕妇 30.2 28.7-31.6 468 446-491
成年男子 12.7 8.6-16.9 260 175-345
老年人 23.9 18.3-29.4 164 126-202
全人群 24.8 22.9-26.7 1620 1500-1740
柠檬酸亚铁 (FeC6H6O7) 是一种易吸收的高效铁制剂,可通过柠檬酸与碳酸亚铁(FeCO3)反应获得。
FeSO4
Na2CO3
FeC6H6O7
FeCO3
柠檬酸
(柠檬酸亚铁)
工业制备
实质:
促进水的电离。
生成弱电解质,
一、探源盐类水解的实质
思考:从影响水的电离平衡和产物的角度分析两者的共同点。
请设计实验:从水解平衡移动的角度,证明Na2CO3 溶液显碱性是因为 离子引起的。
提醒:药品取用量不要过多,以12mL为宜。
一、探源盐类水解的实质
一、探源盐类水解的实质
NaHCO3
②分液
①CO2
苯酚
Na2CO3
C6H5ONa + CO2 + H2O → C6H5OH+ NaHCO3
②分液
①NaOH
苯
苯酚钠
苯酚废水
① C6H6
②分液
二、探析盐类水解的程度
等浓度的 Na2CO3 、C6H5ONa 、NaHCO3 溶液的pH大小关系如何?
酸性: H2CO3 > C6H5OH >
碱性: < <
H2CO3
C6H5OH
Ka1=4.4×10-7
Ka2=5.6×10-11
Ka=1.3×10-10
Na2CO3
C6H5ONa
NaHCO3
二、探析盐类水解的程度
H2CO3
Ka1=4.4×10-7
Ka2=5.6×10-11
( C6H5O- 的水解平衡常数)
二、探析盐类水解的程度
1. 结合有关物质的pKa和测定得到的溶液的pH,将三种浓度均为0.1mol/L的盐溶液的对应磁吸摆放到白板中的相应位置。
2. 找出pKa与pH的一般规律。并将代表 0.1mol/L CH3COONa溶液的磁吸摆放到白板中可能的位置。
已知:pKa1(H2CO3)=6.37;pKa2 (H2CO3)= 10.25
pKa (C6H5OH)=9.98
pKa(CH3COOH)=4.75
pKa = -lgKa, pKa越大,Ka越小, 酸的酸性越弱。
二、探析盐类水解的程度
CH3COONa
三、探寻盐类水解的应用
FeSO4
FeCO3
Na2CO3
FeC6H6O7
柠檬酸
(柠檬酸亚铁)
硫铁矿烧渣
H2SO4(过量)
除杂
FeSO4
硫铁矿烧渣
H2SO4(过量)
除杂
(主要含Fe2O3、SiO2、少量 Al2O3等杂质)
2. 怎样除杂才能得到较纯净的FeSO4溶液。
1. 过量H2SO4 的作用是什么。
金属离子 沉淀开始pH 沉淀完全pH
Al3+ 3.1 5.1
Fe2+ 5.9 6.9
Fe3+ 1.2 3.2
三、探寻盐类水解的应用
加铁粉
调pH
过滤
FeSO4
Al(OH)3
Fe3+ Al3+ H+ SO4 的溶液
滤液
①调pH
②过滤
Fe(OH)3
加酸
加铁粉
FeSO4
Fe3+ Al3+ H+ SO4 的溶液
你认为两种方法哪个更合理?
路径1:
路径2:
金属离子 沉淀开始pH 沉淀完全pH
Al3+ 3.1 5.1
Fe2+ 5.9 6.9
Fe3+ 1.2 3.2
三、探寻盐类水解的应用
FeSO4
FeCO3
Na2CO3
FeC6H6O7
柠檬酸
(柠檬酸亚铁)
三、探寻盐类水解的应用
沉淀中铁元素质量分数%
碳酸亚铁的产率%
Na2CO3溶液浓度(mol/L)
Na2CO3溶液浓度对碳酸亚铁产率的影响
25
30
35
40
45
50
60
70
80
90
1.5
2
2.5
3
3.5
4
① 从沉淀可能含有的成分分析,为何沉淀中铁元素质量分数略有上升?
② Na2CO3浓度大于4mol/L时,FeCO3产率反而下降?
三、探寻盐类水解的应用
沉淀中铁元素质量分数%
碳酸亚铁的产率%
Na2CO3溶液浓度(mol/L)
Na2CO3溶液浓度对碳酸亚铁产率的影响
25
30
35
40
45
50
60
70
80
90
1.5
2
2.5
3
3.5
4
向FeSO4溶液中缓缓滴加Na2CO3溶液并不断搅拌,至产生大量白色沉淀为止。过滤,洗涤,干燥。
三、探寻盐类水解的应用
课 后 作 业
请同学们利用网络查阅盐类水解原理在工农业生产和日常生活中应用,以小组为单位,制作长约2分钟的科普小视频。
谢 谢 !
