山东省临沭县实验中学2012-2013学年高二上学期期中考试化学试题
文档属性
| 名称 | 山东省临沭县实验中学2012-2013学年高二上学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 190.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-22 19:39:34 | ||
图片预览


文档简介
高二教学阶段质量检测试题
化学
第Ⅰ卷(选择题 共51分)
一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个选项符合题意。)
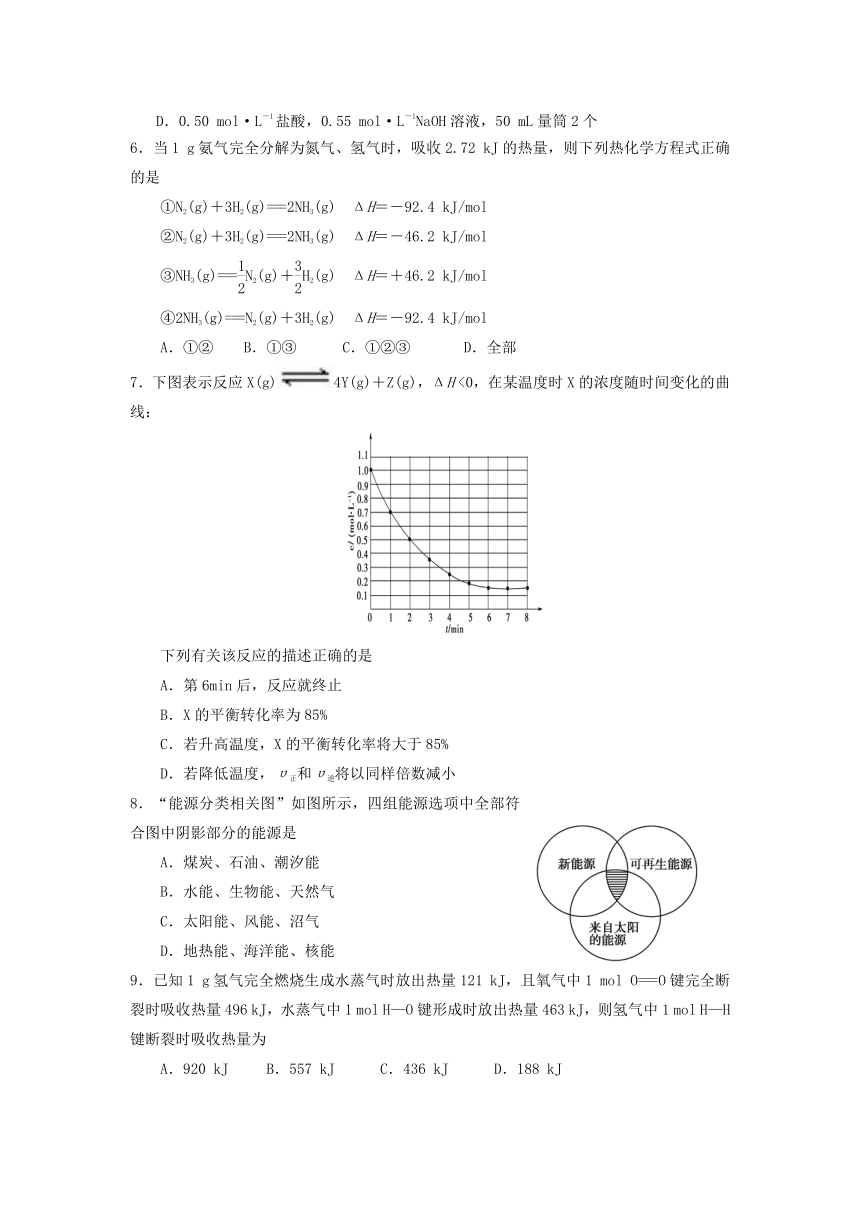
1.下列变化为放热的化学反应的是
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出862 kJ能量的化学反应
D.能量变化如右图所示的化学反应
2.下列关于反应热的说法正确的是
A.当ΔH为“-”时,表示该反应为吸热反应
B.已知C(s)+O2(g)==CO(g) ΔH=110.5 KJ/mol,说明碳的燃烧热为110.5 KJ/mol
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
3.下列是4位同学在学习“化学反应速率与化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
4.对于可逆反应4NH3(g)+5O2(g)??4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡状态时,4υ正(O2)=5υ逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态
C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系为2υ正(NH3)=3υ正(H2O)
5.实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)、温度计、环形玻璃搅拌棒、泡沫塑料盒塑料板外,还需用的其他仪器和试剂均正确的一组是
A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个
B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个
C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个
6.当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是
①N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g)===2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g)===N2(g)+H2(g) ΔH=+46.2 kJ/mol
④2NH3(g)===N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A.①② B.①③ C.①②③ D.全部
7.下图表示反应X(g)4Y(g)+Z(g),ΔH <0,在某温度时X的浓度随时间变化的曲线:
下列有关该反应的描述正确的是
A.第6min后,反应就终止
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,υ正和υ逆将以同样倍数减小
8.“能源分类相关图”如图所示,四组能源选项中全部符合图中阴影部分的能源是
A.煤炭、石油、潮汐能
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
9.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
10. 已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0kJ·mol-1
2Hg(l)+O2(g)=== 2HgO(s) ΔH=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=== ZnO(s)+ Hg(l)的ΔH为
A.+519.4kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4kJ·mol-1
11.如下图所示曲线a表示放热反应X(g)+Y(g)??Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
12.下列叙述中,不正确的是
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
13. 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力。CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
A.CO与HbO2反应的平衡常数
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
14. 一定条件下,在某密闭容器中进行如下反应:
mA(g)+nB(g)pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是
A.正反应是吸热反应 B.逆反应是放热反应
C.m+np+q
15.把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应:
3X(g)+Y(g) nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示反应的平均速率为0.01 mol/(L·min),则上述反应中Z气体的反应方程式中化学计量数n的值是
A.1 B.2 C.3 D.4
16.在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
A.25% B.50% C.75% D.80%
17.可逆反应A(g)+B C(g)+D达到平衡时,下列说法不正确的是
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B.增大压强,平衡不移动,说明B、D必是气体
C.升高温度,C的百分含量减小,说明正反应是放热反应
D.若B是气体,增大A的浓度会使B的转化率增大
高二教学阶段质量检测试题
化学
题号
第Ⅰ卷
第II卷
总分
18
19
20
21
得分
第II卷(非选择题 共49分)
二、填空题
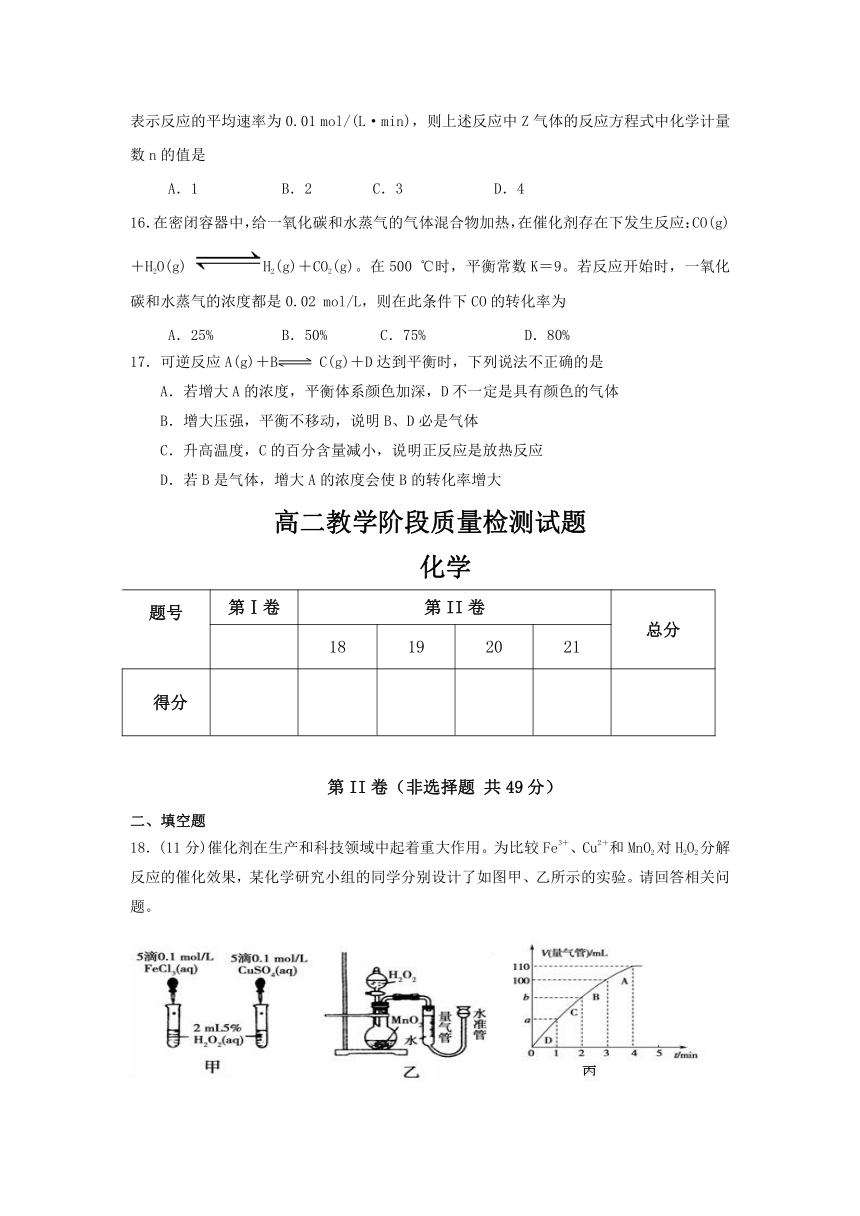
18.(11分)催化剂在生产和科技领域中起着重大作用。为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题。
(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是____________________________
__________________________________________________
(2)同学Y利用乙装置探究MnO2对H2O2分解的催化效果。将50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如丙图所示。
①b________(填“<”、“>”或“=”)90 mL,原因是________________________________
__________________________________________________
②同学Y除了探究MnO2对H2O2分解速率的影响情况,还可得出_________________对H2O2分解速率的影响情况。
(3)催化剂能加快反应速率,是因为它能改变反应的路径,使发生反应所需的活化能________(填“升高”“降低”“不变”)。
19.(12分)环境保护是目前人类面临的一项重大课题。为应对燃料使用造成的环境污染,科学家构想了利用太阳能促进燃料的循环使用,其构想可用下图表示:
其中主要的反应为:
①2CO22CO+O2
②2H2O2H2+O2
③2N2+6H2O4NH3+3O2
④2CO2+4H2O2CH3OH+3O2
⑤________+H2OCH4+________。
请你填空:
(1)请你将反应⑤补充完整: ________+H2OCH4+________
(2)过程Ⅱ中的ΔH________0(填“<”、“>”或“=”)。
(3)下列对过程Ⅰ和Ⅱ的描述中正确的是________。
a.太阳能最终转化为化学能贮存于化学物质中
b.太阳能最终主要转化为热能
c.经过上述一个循环后放出O2
d.经过上述一个循环后不会产生新物质
(4)要实现上述循环,当前需要解决的关键问题是过程________(填“Ⅰ”或“Ⅱ”),此过程的设计可参考自然界中________作用。
(5)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子的物质的量为________,试写出上述NO2转化为N2的热化学方程式: _______________________________________
20.(13分)300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数为K=_______________
已知K(300℃)”或“<”)。
(2)在2 min末时,B的平衡浓度为____________,A的平均反应速率为_____________。
(3)若温度不变,缩小容器容积,则平衡__________________ (填“向正反应方向移动”、“ 向逆反应方向移动”或“不移动”)。
(4)已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/(mol·L-1)
0.4
0.6
0.6
比较此时正、逆反应速率的大小:υ正_________υ逆(填“>”“<”或“=”),
此时CH3OH的转化率为_____________
(5) 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),能判断该反应是否达到化学平衡状态的依据是____________
A.容器中压强不变
B.混合气体中c(CO)不变
C.υ生成(H2)=υ消耗(H2)
D.c(CO2)=c(CO)
21.(13分)在一定条件下,可逆反应A+BmC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
(1)温度T1________T2(填“>”“=”或“<”)。
(2)正反应是____________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m__________ 2(填“>”“=”或“<”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强___________(填“增大”“减小”或“不变”),平衡____________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(5)已知2A (g)+B (g) 2C (g) ΔH=-a kJ·mol-1 (a>0),在一个有催化剂的固定容积的容器中加入2 mol A 和1 mol B ,在500 ℃时充分反应达平衡后C 的浓度为ω mol/L,放出热量b kJ。
① a________b(填“>”“=”或“<”)。
② 若将反应温度升高到700 ℃,该反应的平衡常数将_____________(填“增大”“减小”或“不变”)。
③ 在上述容器中为使该反应的反应速率增大,且平衡向正反应方向移动的可采取的措施是__________________________________________________________(说出一种即可)
高二化学试题参考答案
一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个选项符合题意)
1.D 2.D 3.C 4.A 5.D 6.B 7.B 8.C 9.C 10.C
11.C 12.D 13.C 14.C 15.A 16.C 17.B
二、填空题(本题包括4小题,共49分)
18.(11分)(1)不合理(1分) 阴离子种类不同(2分)(或说甲实验中由于阴离子不同,所以不能说明反应速率的不同就是由阳离子影响的) (2) ①<(2分) 由于反应物浓度减小,反应速率减小,3 min~4 min生成10 mL气体,那么2 min~3 min生成气体的体积应大于10 mL,故b小于90 mL(2分) ②反应物浓度(2分) (3)降低(2分)
19.(12分) (1)CO2+2H2OCH4+2O2 (2分) (2) < (2分) (3)bd (2分,每个1分,错答一个扣1分,扣完为止) (4)Ⅰ 光合 (2分,每个1分) (5)1.6 mol (2分)
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1 (2分,全部正确得2分,否则不得分)
20. (13分) (1)0.5(2分) >(2分) (2)0.8 mol/L(1分,无单位或者单位错误不得分) 0.3 mol/(L·min) (1分,无单位或者单位错误不得分) (3)不移动(1分) (4) > (2分) 75%(2分) (5)BC(2分,每个1分,错答一个扣1分,扣完为止)
21.(13分) (1) > (2分) (2)放热(2分) (3)> (2分) (4)增大(1分) 不(1分)
(5) > (1分) 减小(2分) 增大A2的浓度,或增大B2的浓度 或同时增大A2、B2的浓度(只要说出一种即可得2分,回答两种且有一种是错误的不得分)
化学
第Ⅰ卷(选择题 共51分)
一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个选项符合题意。)
1.下列变化为放热的化学反应的是
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出862 kJ能量的化学反应
D.能量变化如右图所示的化学反应
2.下列关于反应热的说法正确的是
A.当ΔH为“-”时,表示该反应为吸热反应
B.已知C(s)+O2(g)==CO(g) ΔH=110.5 KJ/mol,说明碳的燃烧热为110.5 KJ/mol
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
3.下列是4位同学在学习“化学反应速率与化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
4.对于可逆反应4NH3(g)+5O2(g)??4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡状态时,4υ正(O2)=5υ逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态
C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系为2υ正(NH3)=3υ正(H2O)
5.实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)、温度计、环形玻璃搅拌棒、泡沫塑料盒塑料板外,还需用的其他仪器和试剂均正确的一组是
A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个
B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个
C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个
6.当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是
①N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g)===2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g)===N2(g)+H2(g) ΔH=+46.2 kJ/mol
④2NH3(g)===N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A.①② B.①③ C.①②③ D.全部
7.下图表示反应X(g)4Y(g)+Z(g),ΔH <0,在某温度时X的浓度随时间变化的曲线:
下列有关该反应的描述正确的是
A.第6min后,反应就终止
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,υ正和υ逆将以同样倍数减小
8.“能源分类相关图”如图所示,四组能源选项中全部符合图中阴影部分的能源是
A.煤炭、石油、潮汐能
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
9.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
10. 已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0kJ·mol-1
2Hg(l)+O2(g)=== 2HgO(s) ΔH=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=== ZnO(s)+ Hg(l)的ΔH为
A.+519.4kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4kJ·mol-1
11.如下图所示曲线a表示放热反应X(g)+Y(g)??Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
12.下列叙述中,不正确的是
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
13. 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力。CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
A.CO与HbO2反应的平衡常数
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
14. 一定条件下,在某密闭容器中进行如下反应:
mA(g)+nB(g)pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是
A.正反应是吸热反应 B.逆反应是放热反应
C.m+n
15.把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应:
3X(g)+Y(g) nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示反应的平均速率为0.01 mol/(L·min),则上述反应中Z气体的反应方程式中化学计量数n的值是
A.1 B.2 C.3 D.4
16.在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
A.25% B.50% C.75% D.80%
17.可逆反应A(g)+B C(g)+D达到平衡时,下列说法不正确的是
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B.增大压强,平衡不移动,说明B、D必是气体
C.升高温度,C的百分含量减小,说明正反应是放热反应
D.若B是气体,增大A的浓度会使B的转化率增大
高二教学阶段质量检测试题
化学
题号
第Ⅰ卷
第II卷
总分
18
19
20
21
得分
第II卷(非选择题 共49分)
二、填空题
18.(11分)催化剂在生产和科技领域中起着重大作用。为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题。
(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是____________________________
__________________________________________________
(2)同学Y利用乙装置探究MnO2对H2O2分解的催化效果。将50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如丙图所示。
①b________(填“<”、“>”或“=”)90 mL,原因是________________________________
__________________________________________________
②同学Y除了探究MnO2对H2O2分解速率的影响情况,还可得出_________________对H2O2分解速率的影响情况。
(3)催化剂能加快反应速率,是因为它能改变反应的路径,使发生反应所需的活化能________(填“升高”“降低”“不变”)。
19.(12分)环境保护是目前人类面临的一项重大课题。为应对燃料使用造成的环境污染,科学家构想了利用太阳能促进燃料的循环使用,其构想可用下图表示:
其中主要的反应为:
①2CO22CO+O2
②2H2O2H2+O2
③2N2+6H2O4NH3+3O2
④2CO2+4H2O2CH3OH+3O2
⑤________+H2OCH4+________。
请你填空:
(1)请你将反应⑤补充完整: ________+H2OCH4+________
(2)过程Ⅱ中的ΔH________0(填“<”、“>”或“=”)。
(3)下列对过程Ⅰ和Ⅱ的描述中正确的是________。
a.太阳能最终转化为化学能贮存于化学物质中
b.太阳能最终主要转化为热能
c.经过上述一个循环后放出O2
d.经过上述一个循环后不会产生新物质
(4)要实现上述循环,当前需要解决的关键问题是过程________(填“Ⅰ”或“Ⅱ”),此过程的设计可参考自然界中________作用。
(5)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子的物质的量为________,试写出上述NO2转化为N2的热化学方程式: _______________________________________
20.(13分)300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数为K=_______________
已知K(300℃)
(2)在2 min末时,B的平衡浓度为____________,A的平均反应速率为_____________。
(3)若温度不变,缩小容器容积,则平衡__________________ (填“向正反应方向移动”、“ 向逆反应方向移动”或“不移动”)。
(4)已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/(mol·L-1)
0.4
0.6
0.6
比较此时正、逆反应速率的大小:υ正_________υ逆(填“>”“<”或“=”),
此时CH3OH的转化率为_____________
(5) 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),能判断该反应是否达到化学平衡状态的依据是____________
A.容器中压强不变
B.混合气体中c(CO)不变
C.υ生成(H2)=υ消耗(H2)
D.c(CO2)=c(CO)
21.(13分)在一定条件下,可逆反应A+BmC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
(1)温度T1________T2(填“>”“=”或“<”)。
(2)正反应是____________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m__________ 2(填“>”“=”或“<”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强___________(填“增大”“减小”或“不变”),平衡____________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(5)已知2A (g)+B (g) 2C (g) ΔH=-a kJ·mol-1 (a>0),在一个有催化剂的固定容积的容器中加入2 mol A 和1 mol B ,在500 ℃时充分反应达平衡后C 的浓度为ω mol/L,放出热量b kJ。
① a________b(填“>”“=”或“<”)。
② 若将反应温度升高到700 ℃,该反应的平衡常数将_____________(填“增大”“减小”或“不变”)。
③ 在上述容器中为使该反应的反应速率增大,且平衡向正反应方向移动的可采取的措施是__________________________________________________________(说出一种即可)
高二化学试题参考答案
一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个选项符合题意)
1.D 2.D 3.C 4.A 5.D 6.B 7.B 8.C 9.C 10.C
11.C 12.D 13.C 14.C 15.A 16.C 17.B
二、填空题(本题包括4小题,共49分)
18.(11分)(1)不合理(1分) 阴离子种类不同(2分)(或说甲实验中由于阴离子不同,所以不能说明反应速率的不同就是由阳离子影响的) (2) ①<(2分) 由于反应物浓度减小,反应速率减小,3 min~4 min生成10 mL气体,那么2 min~3 min生成气体的体积应大于10 mL,故b小于90 mL(2分) ②反应物浓度(2分) (3)降低(2分)
19.(12分) (1)CO2+2H2OCH4+2O2 (2分) (2) < (2分) (3)bd (2分,每个1分,错答一个扣1分,扣完为止) (4)Ⅰ 光合 (2分,每个1分) (5)1.6 mol (2分)
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1 (2分,全部正确得2分,否则不得分)
20. (13分) (1)0.5(2分) >(2分) (2)0.8 mol/L(1分,无单位或者单位错误不得分) 0.3 mol/(L·min) (1分,无单位或者单位错误不得分) (3)不移动(1分) (4) > (2分) 75%(2分) (5)BC(2分,每个1分,错答一个扣1分,扣完为止)
21.(13分) (1) > (2分) (2)放热(2分) (3)> (2分) (4)增大(1分) 不(1分)
(5) > (1分) 减小(2分) 增大A2的浓度,或增大B2的浓度 或同时增大A2、B2的浓度(只要说出一种即可得2分,回答两种且有一种是错误的不得分)
同课章节目录
