第八单元海水中的化学同步练习---2021_2022学年九年级化学鲁教版下册(word版有答案)
文档属性
| 名称 | 第八单元海水中的化学同步练习---2021_2022学年九年级化学鲁教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 71.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-30 09:16:23 | ||
图片预览

文档简介
第八单元《海水中的化学》同步练习
附相对原子质量:H-1;C-12;N-14;O-16;Cl-35.5;Ca-40
一、选择题:
1、海水中含量最高的元素是( )
A.H B.O C.Na D.Cl
2、下列关于物质用途的描述中,错误的是( )
A.熟石灰用于改良碱性土壤
B.碳酸钙做补钙剂
C.氢氧化钠做炉具清洁剂
D.食盐做调味剂
3、有关海水晒盐及粗盐提纯实验中说法正确的是( )
A.粗盐提纯时搅拌是为了增大氯化钠的溶解性
B.过滤时为加快过滤速度可以用玻璃棒搅拌
C.蒸发时需要将滤液全部蒸干后停止加热
D.海水晒盐的原理是蒸发结晶
4、t℃时,将接近饱和的硝酸钾溶液变为该温度下的饱和溶液,分析正确的是( )
A.溶质质量一定变大 B.溶质质量分数一定变大
C.溶剂质量一定变小 D.溶液质量一定变大
5、地球的淡水资源非常匮乏,水资源大多以海水的形式存在。所以海水淡化就成了我们重要的研究方向。下列原理你觉得完全不可行的是( )
A.利用太阳能将海水蒸馏
B.利用高分子膜淡化海水
C.利用过滤除去海水中的盐分
D.利用电渗析法淡化海水
6、分析如图溶解度曲线,判断下列说法正确的是( )
A.t2℃时,甲的饱和溶液中含有50g甲
B.将t2℃甲溶液、乙溶液分别降温到t1℃时,甲、乙溶液中溶质质量分数相同
C.等质量的甲、乙饱和溶液从t2℃降温至t1℃时,甲中所含的水的质量比乙少
D.甲中含有少量乙时,可以用冷却热饱和溶液的方法提纯乙
7、下列每组物质混合后能发生反应,且溶液总质量不变的是( )
A.石灰水和稀盐酸
B.氢氧化铜和稀硫酸
C.氯化钠溶液和氢氧化钾溶液
D.硝酸钡溶液和稀硫酸
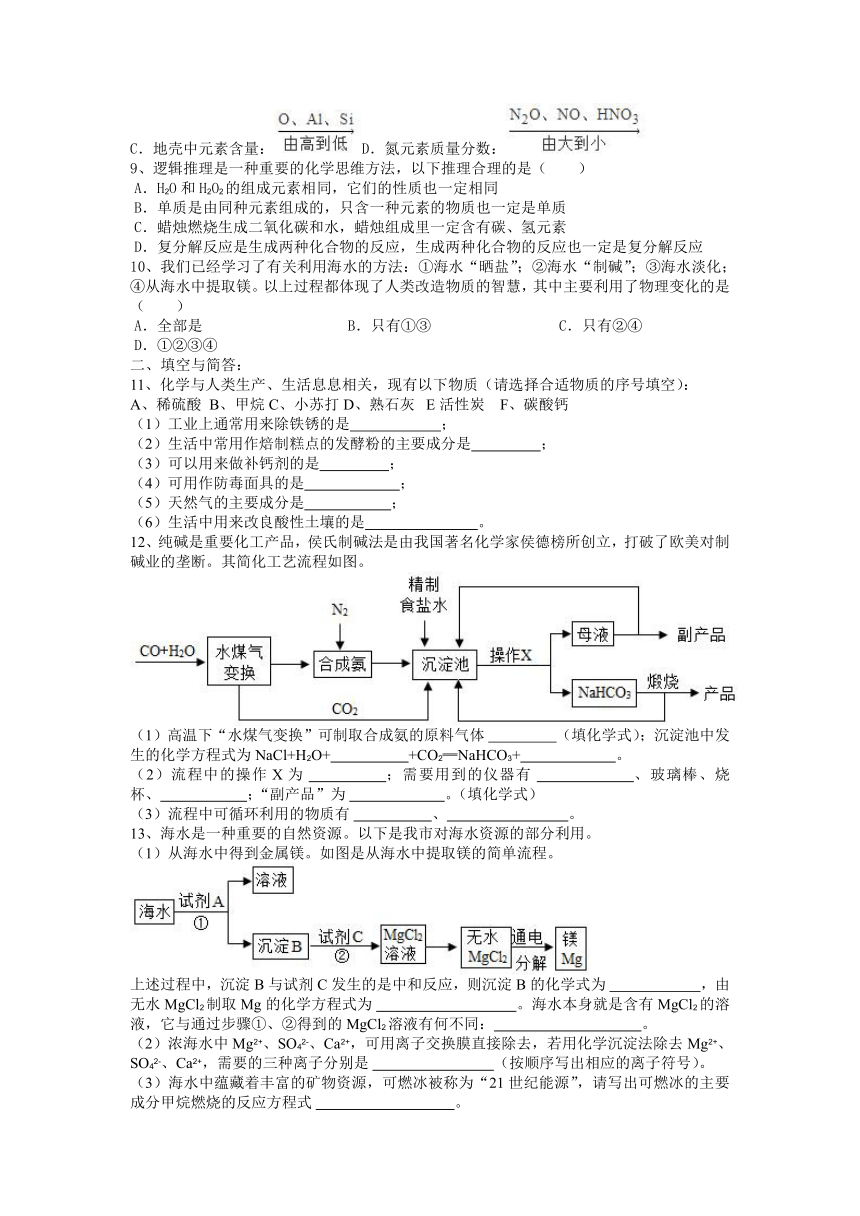
8、下列排序正确的是( )
A.氯元素的化合价:B.物质在水中溶解性:
C.地壳中元素含量:D.氮元素质量分数:
9、逻辑推理是一种重要的化学思维方法,以下推理合理的是( )
A.H2O和H2O2的组成元素相同,它们的性质也一定相同
B.单质是由同种元素组成的,只含一种元素的物质也一定是单质
C.蜡烛燃烧生成二氧化碳和水,蜡烛组成里一定含有碳、氢元素
D.复分解反应是生成两种化合物的反应,生成两种化合物的反应也一定是复分解反应
10、我们已经学习了有关利用海水的方法:①海水“晒盐”;②海水“制碱”;③海水淡化;④从海水中提取镁。以上过程都体现了人类改造物质的智慧,其中主要利用了物理变化的是( )
A.全部是 B.只有①③ C.只有②④ D.①②③④
二、填空与简答:
11、化学与人类生产、生活息息相关,现有以下物质(请选择合适物质的序号填空):
A、稀硫酸 B、甲烷 C、小苏打 D、熟石灰 E活性炭 F、碳酸钙
(1)工业上通常用来除铁锈的是 ;
(2)生活中常用作焙制糕点的发酵粉的主要成分是 ;
(3)可以用来做补钙剂的是 ;
(4)可用作防毒面具的是 ;
(5)天然气的主要成分是 ;
(6)生活中用来改良酸性土壤的是 。
12、纯碱是重要化工产品,侯氏制碱法是由我国著名化学家侯德榜所创立,打破了欧美对制碱业的垄断。其简化工艺流程如图。
(1)高温下“水煤气变换”可制取合成氨的原料气体 (填化学式);沉淀池中发生的化学方程式为NaCl+H2O+ +CO2═NaHCO3+ 。
(2)流程中的操作X为 ;需要用到的仪器有 、玻璃棒、烧杯、 ;“副产品”为 。(填化学式)
(3)流程中可循环利用的物质有 、 。
13、海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中得到金属镁。如图是从海水中提取镁的简单流程。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
(2)浓海水中Mg2+、SO42-、Ca2+,可用离子交换膜直接除去,若用化学沉淀法除去Mg2+、SO42-、Ca2+,需要的三种离子分别是 (按顺序写出相应的离子符号)。
(3)海水中蕴藏着丰富的矿物资源,可燃冰被称为“21世纪能源”,请写出可燃冰的主要成分甲烷燃烧的反应方程式 。
14、如图1是硝酸钾和氯化钠的溶解度曲线,回答下列问题。
(1)50℃时,硝酸钾的溶解度是 ;
(2)20℃时,如要提纯5g粗盐(其中氯化钠含量约为80%),量取溶解所需要的水,应选择 (填“10L”、“25mL”或“50mL”)规格的量筒最为合适;
(3)为了使氯化钠溶液中的溶质全部析出,应采用的方法是 ;
(4)50℃时,100g饱和的硝酸钾和氯化钠混合溶液中,含溶质较多的是 ;
(5)在t℃时,将mg硝酸钾和mg氯化钠分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图2所示,说法错误的是 (填字母序号)。
A.乙中的上层溶液一定是饱和溶液
B.甲中溶液的溶质质量分数一定大于乙中溶液的溶质质量分数
C.甲、乙中的溶质分别是硝酸钾和氯化钠
D.若t℃为50℃,m的值可能为85.5
三、实验与探究:
15、某科学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50克10%的氯化钠溶液。请回答下列有关问题:
实验一:如图是同学们做粗盐提纯实验的操作示意图。
(1)实验操作⑤中的错误是 ;
(2)粗盐提纯实验的操作顺序为 (填操作序号);
(3)实验二:用粗盐提纯后得到的精盐配制了50克10%氯化钠溶液,需量取水45mL,在称量食盐的操作中,应先调节天平平衡,接下来的操作是 ;
(4)配制完成后经检测,溶质质量分数偏大,其原因可能有 (填字母序号,1克以下用游码)。
A.称取固体时,砝码放在左盘
B.量取水的体积时,视线仰视
C.配制好的氯化钠溶液装瓶时,有少量溶液洒出
D.量取水的体积时,视线俯视
16、某实验小组进行如图所示实验。
(1)实验A中观察到的现象为 。
(2)实验B反应的化学方程式为 ,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是 ,反应过程中数目减少的离子是 (填离子符号)。
(3)C中最终只得到无色溶液,则溶液中溶质为 ,为进一步确定其成分需要使用的试剂为 。
四、分析与计算:
17、为测定某石灰石中碳酸钙的含量,小明同学取20g石灰石样品于锥形瓶中,将200g稀盐酸缓缓加入锥形瓶中(杂质不溶于水也不与酸反应),充分反应后,测得剩余固体质量随加入稀盐酸质量的变化曲线如图:
求:
(1)该石灰石中碳酸钙的质量分数为 。
(2)所加稀盐酸的溶质质量分数?(写出计算过程)
(3)如果要配制200g 10%的稀盐酸,则需要量取浓度为36%的浓盐酸(密度为1.18g/cm3)体积为 mL。(结果保留一位小数)
参考答案
一、选择题:
1、B 2、A 3、D 4、B 5、C 6、C 7、A 8、D 9、C 10、B
二、填空与简答:
11、答案为:(1)A;(2)C;(3)F;(4)E;(5)B;(6)D。
12、答案:(1)H2;NH3;NH4Cl;
(2)过滤;漏斗;铁架台;NH4Cl;
(3)CO2;分离出副产品后的母液(或NaCl或NaHCO3或NH4HCO3)(合理即可)。
13、答案为:
(1)Mg(OH)2;MgCl2Mg+Cl2↑;除去了海水中的其它杂质,得到的氯化镁溶液浓度大,且纯净;
(2)OH-、Ba2+、CO32-;
(3)CH4+2O2CO2+2H2O.
14、答案:(1)85.5g;
(2)25mL;
(3)蒸发结晶;
(4)硝酸钾;
(5)C。
三、实验与探究:
15、答案:(1)未用玻璃棒引流;
(2)①②③⑤④;
(3)在右盘上放5g砝码;
(4)D。
16、答案为:(1)产生白色沉淀;
(2)Ca(OH)2+2HCl=CaCl2+2H2O;无色酚酞;H+、OH-;
(3)氯化钠、氯化钙;碳酸钠溶液。
四、分析与计算:
17、解:(1)根据图象可知,样品中含有5g杂质,所以碳酸钙质量为15g,所以碳酸钙质量分数为:
(2)设150g的稀盐酸中溶质的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
15g x
x=10.95 g
该稀盐酸中溶质的质量分数为
(3)设需要取浓度为36%的浓盐酸的体积为x,根据稀释前后,溶质的质量不变,则有200g×10%=1.18g/cm3×x×36%,x≈47.1mL;
附相对原子质量:H-1;C-12;N-14;O-16;Cl-35.5;Ca-40
一、选择题:
1、海水中含量最高的元素是( )
A.H B.O C.Na D.Cl
2、下列关于物质用途的描述中,错误的是( )
A.熟石灰用于改良碱性土壤
B.碳酸钙做补钙剂
C.氢氧化钠做炉具清洁剂
D.食盐做调味剂
3、有关海水晒盐及粗盐提纯实验中说法正确的是( )
A.粗盐提纯时搅拌是为了增大氯化钠的溶解性
B.过滤时为加快过滤速度可以用玻璃棒搅拌
C.蒸发时需要将滤液全部蒸干后停止加热
D.海水晒盐的原理是蒸发结晶
4、t℃时,将接近饱和的硝酸钾溶液变为该温度下的饱和溶液,分析正确的是( )
A.溶质质量一定变大 B.溶质质量分数一定变大
C.溶剂质量一定变小 D.溶液质量一定变大
5、地球的淡水资源非常匮乏,水资源大多以海水的形式存在。所以海水淡化就成了我们重要的研究方向。下列原理你觉得完全不可行的是( )
A.利用太阳能将海水蒸馏
B.利用高分子膜淡化海水
C.利用过滤除去海水中的盐分
D.利用电渗析法淡化海水
6、分析如图溶解度曲线,判断下列说法正确的是( )
A.t2℃时,甲的饱和溶液中含有50g甲
B.将t2℃甲溶液、乙溶液分别降温到t1℃时,甲、乙溶液中溶质质量分数相同
C.等质量的甲、乙饱和溶液从t2℃降温至t1℃时,甲中所含的水的质量比乙少
D.甲中含有少量乙时,可以用冷却热饱和溶液的方法提纯乙
7、下列每组物质混合后能发生反应,且溶液总质量不变的是( )
A.石灰水和稀盐酸
B.氢氧化铜和稀硫酸
C.氯化钠溶液和氢氧化钾溶液
D.硝酸钡溶液和稀硫酸
8、下列排序正确的是( )
A.氯元素的化合价:B.物质在水中溶解性:
C.地壳中元素含量:D.氮元素质量分数:
9、逻辑推理是一种重要的化学思维方法,以下推理合理的是( )
A.H2O和H2O2的组成元素相同,它们的性质也一定相同
B.单质是由同种元素组成的,只含一种元素的物质也一定是单质
C.蜡烛燃烧生成二氧化碳和水,蜡烛组成里一定含有碳、氢元素
D.复分解反应是生成两种化合物的反应,生成两种化合物的反应也一定是复分解反应
10、我们已经学习了有关利用海水的方法:①海水“晒盐”;②海水“制碱”;③海水淡化;④从海水中提取镁。以上过程都体现了人类改造物质的智慧,其中主要利用了物理变化的是( )
A.全部是 B.只有①③ C.只有②④ D.①②③④
二、填空与简答:
11、化学与人类生产、生活息息相关,现有以下物质(请选择合适物质的序号填空):
A、稀硫酸 B、甲烷 C、小苏打 D、熟石灰 E活性炭 F、碳酸钙
(1)工业上通常用来除铁锈的是 ;
(2)生活中常用作焙制糕点的发酵粉的主要成分是 ;
(3)可以用来做补钙剂的是 ;
(4)可用作防毒面具的是 ;
(5)天然气的主要成分是 ;
(6)生活中用来改良酸性土壤的是 。
12、纯碱是重要化工产品,侯氏制碱法是由我国著名化学家侯德榜所创立,打破了欧美对制碱业的垄断。其简化工艺流程如图。
(1)高温下“水煤气变换”可制取合成氨的原料气体 (填化学式);沉淀池中发生的化学方程式为NaCl+H2O+ +CO2═NaHCO3+ 。
(2)流程中的操作X为 ;需要用到的仪器有 、玻璃棒、烧杯、 ;“副产品”为 。(填化学式)
(3)流程中可循环利用的物质有 、 。
13、海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中得到金属镁。如图是从海水中提取镁的简单流程。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
(2)浓海水中Mg2+、SO42-、Ca2+,可用离子交换膜直接除去,若用化学沉淀法除去Mg2+、SO42-、Ca2+,需要的三种离子分别是 (按顺序写出相应的离子符号)。
(3)海水中蕴藏着丰富的矿物资源,可燃冰被称为“21世纪能源”,请写出可燃冰的主要成分甲烷燃烧的反应方程式 。
14、如图1是硝酸钾和氯化钠的溶解度曲线,回答下列问题。
(1)50℃时,硝酸钾的溶解度是 ;
(2)20℃时,如要提纯5g粗盐(其中氯化钠含量约为80%),量取溶解所需要的水,应选择 (填“10L”、“25mL”或“50mL”)规格的量筒最为合适;
(3)为了使氯化钠溶液中的溶质全部析出,应采用的方法是 ;
(4)50℃时,100g饱和的硝酸钾和氯化钠混合溶液中,含溶质较多的是 ;
(5)在t℃时,将mg硝酸钾和mg氯化钠分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图2所示,说法错误的是 (填字母序号)。
A.乙中的上层溶液一定是饱和溶液
B.甲中溶液的溶质质量分数一定大于乙中溶液的溶质质量分数
C.甲、乙中的溶质分别是硝酸钾和氯化钠
D.若t℃为50℃,m的值可能为85.5
三、实验与探究:
15、某科学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50克10%的氯化钠溶液。请回答下列有关问题:
实验一:如图是同学们做粗盐提纯实验的操作示意图。
(1)实验操作⑤中的错误是 ;
(2)粗盐提纯实验的操作顺序为 (填操作序号);
(3)实验二:用粗盐提纯后得到的精盐配制了50克10%氯化钠溶液,需量取水45mL,在称量食盐的操作中,应先调节天平平衡,接下来的操作是 ;
(4)配制完成后经检测,溶质质量分数偏大,其原因可能有 (填字母序号,1克以下用游码)。
A.称取固体时,砝码放在左盘
B.量取水的体积时,视线仰视
C.配制好的氯化钠溶液装瓶时,有少量溶液洒出
D.量取水的体积时,视线俯视
16、某实验小组进行如图所示实验。
(1)实验A中观察到的现象为 。
(2)实验B反应的化学方程式为 ,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是 ,反应过程中数目减少的离子是 (填离子符号)。
(3)C中最终只得到无色溶液,则溶液中溶质为 ,为进一步确定其成分需要使用的试剂为 。
四、分析与计算:
17、为测定某石灰石中碳酸钙的含量,小明同学取20g石灰石样品于锥形瓶中,将200g稀盐酸缓缓加入锥形瓶中(杂质不溶于水也不与酸反应),充分反应后,测得剩余固体质量随加入稀盐酸质量的变化曲线如图:
求:
(1)该石灰石中碳酸钙的质量分数为 。
(2)所加稀盐酸的溶质质量分数?(写出计算过程)
(3)如果要配制200g 10%的稀盐酸,则需要量取浓度为36%的浓盐酸(密度为1.18g/cm3)体积为 mL。(结果保留一位小数)
参考答案
一、选择题:
1、B 2、A 3、D 4、B 5、C 6、C 7、A 8、D 9、C 10、B
二、填空与简答:
11、答案为:(1)A;(2)C;(3)F;(4)E;(5)B;(6)D。
12、答案:(1)H2;NH3;NH4Cl;
(2)过滤;漏斗;铁架台;NH4Cl;
(3)CO2;分离出副产品后的母液(或NaCl或NaHCO3或NH4HCO3)(合理即可)。
13、答案为:
(1)Mg(OH)2;MgCl2Mg+Cl2↑;除去了海水中的其它杂质,得到的氯化镁溶液浓度大,且纯净;
(2)OH-、Ba2+、CO32-;
(3)CH4+2O2CO2+2H2O.
14、答案:(1)85.5g;
(2)25mL;
(3)蒸发结晶;
(4)硝酸钾;
(5)C。
三、实验与探究:
15、答案:(1)未用玻璃棒引流;
(2)①②③⑤④;
(3)在右盘上放5g砝码;
(4)D。
16、答案为:(1)产生白色沉淀;
(2)Ca(OH)2+2HCl=CaCl2+2H2O;无色酚酞;H+、OH-;
(3)氯化钠、氯化钙;碳酸钠溶液。
四、分析与计算:
17、解:(1)根据图象可知,样品中含有5g杂质,所以碳酸钙质量为15g,所以碳酸钙质量分数为:
(2)设150g的稀盐酸中溶质的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
15g x
x=10.95 g
该稀盐酸中溶质的质量分数为
(3)设需要取浓度为36%的浓盐酸的体积为x,根据稀释前后,溶质的质量不变,则有200g×10%=1.18g/cm3×x×36%,x≈47.1mL;
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
