山东省聊城市某重点高中2012-2013学年高二上学期期中模块测试 化学试题
文档属性
| 名称 | 山东省聊城市某重点高中2012-2013学年高二上学期期中模块测试 化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 141.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-23 14:01:18 | ||
图片预览


文档简介
山东省聊城市某重点高中2012-2013学年上学期高二第二次模块测试化学试题
考试时间:100分钟;
题号
一
二
三
总分
得分
注意事项:21世纪教育网
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
评卷人
得分
一、选择题
1.全球变暖给我们敲响了警钟,地球正面临巨大的挑战.下列说法不正确的是( )
A.推广“低碳经济”,减少温室气体的排放
B.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能
C.推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油
D.推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展
2.醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流I随加入氨水的体积V的变化曲线图是
3.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.酸与碱恰好完全反应生成正盐的溶液D. 使石蕊试液呈紫色的溶液
4.下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体; ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①④ B.②③⑤ C.③④⑥ D.①②⑦
5.pH相同的氨水.NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X.Y.Z倍,稀释后三种溶液的pH仍然相同,则X.Y.Z的关系是( )
A. X=Y=Z B. X=Y<Z C.X<Y=Z D. X>Y=Z
6.0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
7.一种pH=3的酸溶液和一种pH=11的碱溶液等体积混合后测得溶液的pH=5.6其原因可能是:( )
A.浓的强酸和稀的弱碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
8.用水逐步稀释0.1 mol/L的氨水,若温度保持不变,则始终保持增大趋势的是 ( )
A.c(OH-) B.c(NH4+)/c(NH3·H2O) C.c(NH3·H2O) D.c(NH4+)
9.下列叙述正确的是( )
A.pH=3的酸溶液稀释100倍后,pH =5
B.在相同温度下,pH =3的溶液和pH =5的溶液相比,前者H+浓度是后者的100倍
C.相同温度,相同浓度的钾盐溶液中,酸式盐的pH 一定小于正盐的pH
D.碳酸钠溶液在室温时pH大于60℃时的pH(同一浓度的Na2CO3溶液)
10.下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:
Al3+ + 4NH3?H2O AlO2- + 4NH4+ + 2H2O
B. 澄清石灰水与少量苏打溶液混合:
Ca2+ + OH- + HCO3- CaCO3↓ + H2O
C. 氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 2Fe3+ + 2Cl-
D. 碳酸钙溶于醋酸CaCO3 + 2H+ Ca2+ + CO2↑ + H2O
11.下列叙述正确的是( )
A.在0.1mol·L-1CH3COONa溶液中,c (OH-)==c(CH3COOH)+c(H+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10
C.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
12.表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的( )
A.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
13.pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.11:1 D.1:9
14. pH、体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下放出CO2气体的体积( )
A.醋酸多 B.硫酸多 C.一样多 D.无法比较
15.要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
A.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类水解是吸热的
C.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
16..能表示人体大量喝水时,胃液的pH变化的图象是( )
17.德国哈伯发明以低成本制造大量氨的方法,流程图中为提高原料转化率而采取措施是
A.①②③ B.②④⑤C.①③⑤ D.②③④
18.对于热方程式说法正确的是:
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+ (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-121世纪教育网
B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为:
N2(g)+3H2(g) 2NH3(g)??? △H=—38.6 kJ·mol—1
C. 标准状况:H2(g)+F2(g) ===2HF(g) △H=-270kJ/mol,
D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g) △H=-1025 kJ/mol
19.说法正确的是
A.0.5molO3与11.2L NO2所含的分子数一定相等
B. 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等
C.常温Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.常温常压,7.0g乙烯与丙烯的混合物含有氢原子的数目为NA
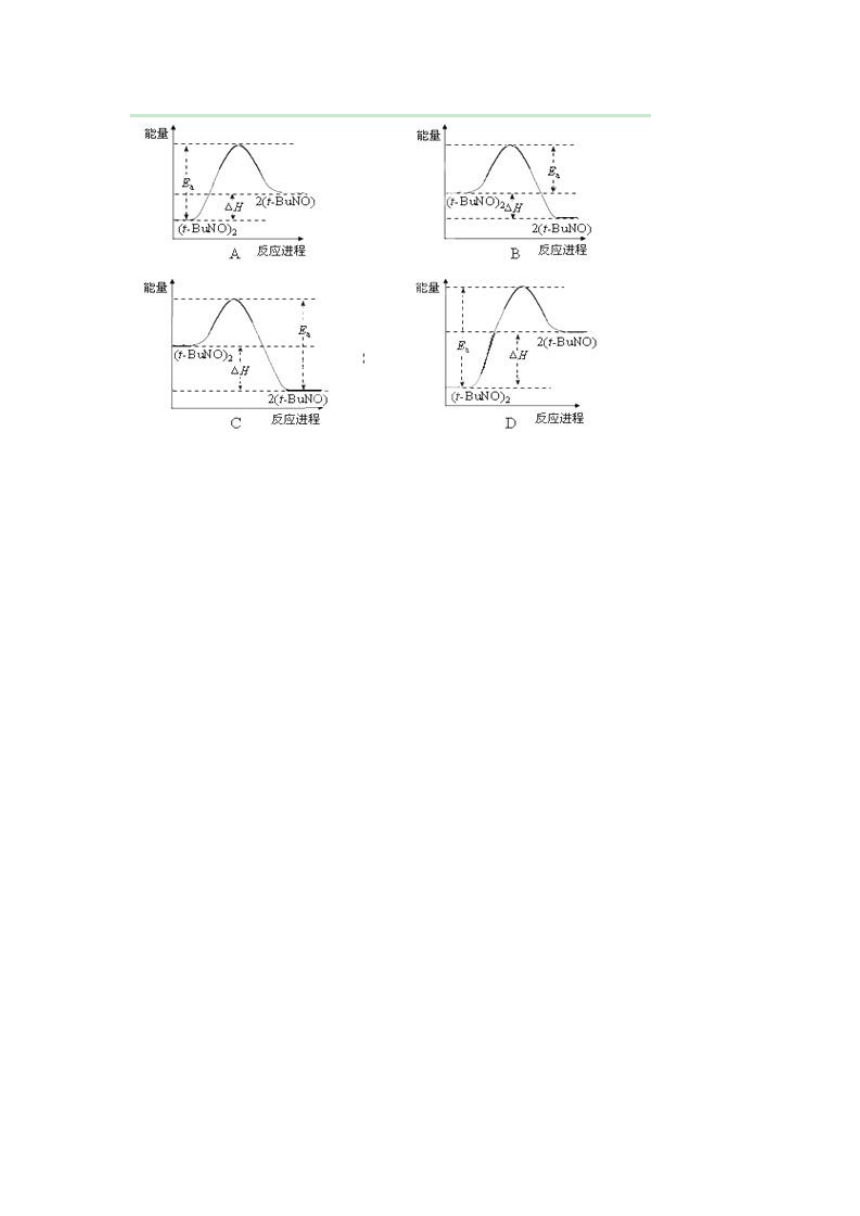
20.物质(t-BuNO)2在正庚烷溶剂中反应:(t-BuNO)2 2(t-BuNO),测得该反应的ΔH = +50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。能量关系图合理的是
第II卷(非选择题)
评卷人
得分
21世纪教育网
二、填空题
21.(8分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_ 。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
22.甲醇是一种化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g)CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
甲
乙
丙
反应物投入量
1molCO .2molH2
1mol CH3OH[来源:21世纪教育网]
2molCO、4molH2
CH3OH的浓度(mol/L)
c1
c2
c3
反应的能量变化[来源:21世纪教育网]
放出Q1 kJ
吸收Q2 kJ
放出Q3 kJ
平衡常数
K1
K2
K3
反应物转化率
α 1
α 2
α 3
①.容器内压强P:2P甲与2P乙与P丙关系是
②.变化的热量数值Q中, Q1 与Q2的和是
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
23.(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
250°C
300°C
350°C
K
2.041
0.270
0.012
①由表中数据判断△H???? ?? 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为??????? ?????? ,此时的温度为???? ?? 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a?mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K=?????? ????????(用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数??????? ????。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是??? ????? 。
A.升温?? B.加入催化剂??? C.增加CO的浓度 D.恒容充入H2?
E.恒压充入惰性气体????? F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)?????? ????? 。
???A.生成CH3OH的速率与消耗CO的速率相等??????????????
B.混合气体的密度不变
?? C.混合气体的相对平均分子质量不变?
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器
甲
乙
丙
反应物投入量
1molCO、2moL H2
1molCH3OH
2molCH3OH
平衡21世纪教育网
时的
数据
CH3OH浓度(mol/L)
c121世纪教育网
c2
c3[21世纪教育网]
反应的能量变化
akJ
bkJ
ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为 ??
A.c3>2c1????? B.c1②a、b、c的关系表达正确的为
A.c<2|△H|?? B.a+b=|△H|? ?C.c=2b??
③p1、p2、p3的关系不正确的为
A.p1=p2????? B.p22p2??
④α1、α2、α3的关系表达不正确的为
A.α1=α2?????? B.α3<α2 ??? ??C.α1+α2=1 ??
评卷人
得分
三、实验题
24.(16分)Ⅰ.下列有关实验操作中,合理的是______________(填序号) 。
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL0.1mol/L NaCl溶液
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:c (NaOH) = _____mol/L。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度______。(选“偏大”“偏小”“不变”)
III.如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用 溶液滴定 溶液;曲线b是用 溶液滴定 溶液;P点的坐标为( );盐酸的物质的量浓度为 mol/L。
25.(14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
催化剂(MnO2)
操作情况
观察结果
反应完成所需的时间
粉末状
混合不振荡
剧烈反应,使木条复燃
3.5分钟
块状
反应较慢,火星红亮但木条未复燃
30分钟
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
双氧水体积
操作情况
反应完成所需的时间
收集到气体体积
反应后液体温度
a1%的150mL
11分钟
539mL
24℃
a2%的15mL
混合不振荡
1分20秒
553mL
56℃
a3%的7.5mL
9秒
562mL
67℃
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
化学参考答案
1.D2.B3.B4.A5.D6.C7.B8.B9.B
10.C11.A12.B13.D14.A15.D16.A17.B18.D19.D20.D
21.(1)B CD (2)4 3.3 可行
22.① 2P甲等于2P乙且大于P丙 ②Q1 与Q2和是90.8
③
④ CH3OCH3 - 12e-+3H2O=2CO2+12H+
23.(每空2分,共23分)(1)① < ②80% , 250oC(1分);
(2)V2/a2, 向逆方向反应, 减小; (3)DF (4)CD (5)AC AB C A
24.
25.(每空2分,共14分)
(1)①
②催化剂的表面积(聚集状态)
(2)①溶液质量分数不同,液体温度不同
②反应放热相同,但液体的量不同
③液体的量不同,液体温度不同(影响气体在溶液中的溶解量)
(3)①H2O2HO2-+H+(H2O2HOO-+H+)
②在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对
考试时间:100分钟;
题号
一
二
三
总分
得分
注意事项:21世纪教育网
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
评卷人
得分
一、选择题
1.全球变暖给我们敲响了警钟,地球正面临巨大的挑战.下列说法不正确的是( )
A.推广“低碳经济”,减少温室气体的排放
B.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能
C.推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油
D.推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展
2.醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流I随加入氨水的体积V的变化曲线图是
3.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.酸与碱恰好完全反应生成正盐的溶液D. 使石蕊试液呈紫色的溶液
4.下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体; ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①④ B.②③⑤ C.③④⑥ D.①②⑦
5.pH相同的氨水.NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X.Y.Z倍,稀释后三种溶液的pH仍然相同,则X.Y.Z的关系是( )
A. X=Y=Z B. X=Y<Z C.X<Y=Z D. X>Y=Z
6.0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
7.一种pH=3的酸溶液和一种pH=11的碱溶液等体积混合后测得溶液的pH=5.6其原因可能是:( )
A.浓的强酸和稀的弱碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
8.用水逐步稀释0.1 mol/L的氨水,若温度保持不变,则始终保持增大趋势的是 ( )
A.c(OH-) B.c(NH4+)/c(NH3·H2O) C.c(NH3·H2O) D.c(NH4+)
9.下列叙述正确的是( )
A.pH=3的酸溶液稀释100倍后,pH =5
B.在相同温度下,pH =3的溶液和pH =5的溶液相比,前者H+浓度是后者的100倍
C.相同温度,相同浓度的钾盐溶液中,酸式盐的pH 一定小于正盐的pH
D.碳酸钠溶液在室温时pH大于60℃时的pH(同一浓度的Na2CO3溶液)
10.下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:
Al3+ + 4NH3?H2O AlO2- + 4NH4+ + 2H2O
B. 澄清石灰水与少量苏打溶液混合:
Ca2+ + OH- + HCO3- CaCO3↓ + H2O
C. 氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 2Fe3+ + 2Cl-
D. 碳酸钙溶于醋酸CaCO3 + 2H+ Ca2+ + CO2↑ + H2O
11.下列叙述正确的是( )
A.在0.1mol·L-1CH3COONa溶液中,c (OH-)==c(CH3COOH)+c(H+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10
C.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
12.表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的( )
A.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
13.pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.11:1 D.1:9
14. pH、体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下放出CO2气体的体积( )
A.醋酸多 B.硫酸多 C.一样多 D.无法比较
15.要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
A.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类水解是吸热的
C.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
16..能表示人体大量喝水时,胃液的pH变化的图象是( )
17.德国哈伯发明以低成本制造大量氨的方法,流程图中为提高原料转化率而采取措施是
A.①②③ B.②④⑤C.①③⑤ D.②③④
18.对于热方程式说法正确的是:
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+ (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-121世纪教育网
B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为:
N2(g)+3H2(g) 2NH3(g)??? △H=—38.6 kJ·mol—1
C. 标准状况:H2(g)+F2(g) ===2HF(g) △H=-270kJ/mol,
D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g) △H=-1025 kJ/mol
19.说法正确的是
A.0.5molO3与11.2L NO2所含的分子数一定相等
B. 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等
C.常温Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.常温常压,7.0g乙烯与丙烯的混合物含有氢原子的数目为NA
20.物质(t-BuNO)2在正庚烷溶剂中反应:(t-BuNO)2 2(t-BuNO),测得该反应的ΔH = +50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。能量关系图合理的是
第II卷(非选择题)
评卷人
得分
21世纪教育网
二、填空题
21.(8分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_ 。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
22.甲醇是一种化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g)CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
甲
乙
丙
反应物投入量
1molCO .2molH2
1mol CH3OH[来源:21世纪教育网]
2molCO、4molH2
CH3OH的浓度(mol/L)
c1
c2
c3
反应的能量变化[来源:21世纪教育网]
放出Q1 kJ
吸收Q2 kJ
放出Q3 kJ
平衡常数
K1
K2
K3
反应物转化率
α 1
α 2
α 3
①.容器内压强P:2P甲与2P乙与P丙关系是
②.变化的热量数值Q中, Q1 与Q2的和是
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
23.(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
250°C
300°C
350°C
K
2.041
0.270
0.012
①由表中数据判断△H???? ?? 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为??????? ?????? ,此时的温度为???? ?? 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a?mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K=?????? ????????(用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数??????? ????。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是??? ????? 。
A.升温?? B.加入催化剂??? C.增加CO的浓度 D.恒容充入H2?
E.恒压充入惰性气体????? F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)?????? ????? 。
???A.生成CH3OH的速率与消耗CO的速率相等??????????????
B.混合气体的密度不变
?? C.混合气体的相对平均分子质量不变?
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器
甲
乙
丙
反应物投入量
1molCO、2moL H2
1molCH3OH
2molCH3OH
平衡21世纪教育网
时的
数据
CH3OH浓度(mol/L)
c121世纪教育网
c2
c3[21世纪教育网]
反应的能量变化
akJ
bkJ
ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为 ??
A.c3>2c1????? B.c1
A.c<2|△H|?? B.a+b=|△H|? ?C.c=2b??
③p1、p2、p3的关系不正确的为
A.p1=p2????? B.p2
④α1、α2、α3的关系表达不正确的为
A.α1=α2?????? B.α3<α2 ??? ??C.α1+α2=1 ??
评卷人
得分
三、实验题
24.(16分)Ⅰ.下列有关实验操作中,合理的是______________(填序号) 。
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL0.1mol/L NaCl溶液
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:c (NaOH) = _____mol/L。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度______。(选“偏大”“偏小”“不变”)
III.如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用 溶液滴定 溶液;曲线b是用 溶液滴定 溶液;P点的坐标为( );盐酸的物质的量浓度为 mol/L。
25.(14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
催化剂(MnO2)
操作情况
观察结果
反应完成所需的时间
粉末状
混合不振荡
剧烈反应,使木条复燃
3.5分钟
块状
反应较慢,火星红亮但木条未复燃
30分钟
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
双氧水体积
操作情况
反应完成所需的时间
收集到气体体积
反应后液体温度
a1%的150mL
11分钟
539mL
24℃
a2%的15mL
混合不振荡
1分20秒
553mL
56℃
a3%的7.5mL
9秒
562mL
67℃
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
化学参考答案
1.D2.B3.B4.A5.D6.C7.B8.B9.B
10.C11.A12.B13.D14.A15.D16.A17.B18.D19.D20.D
21.(1)B CD (2)4 3.3 可行
22.① 2P甲等于2P乙且大于P丙 ②Q1 与Q2和是90.8
③
④ CH3OCH3 - 12e-+3H2O=2CO2+12H+
23.(每空2分,共23分)(1)① < ②80% , 250oC(1分);
(2)V2/a2, 向逆方向反应, 减小; (3)DF (4)CD (5)AC AB C A
24.
25.(每空2分,共14分)
(1)①
②催化剂的表面积(聚集状态)
(2)①溶液质量分数不同,液体温度不同
②反应放热相同,但液体的量不同
③液体的量不同,液体温度不同(影响气体在溶液中的溶解量)
(3)①H2O2HO2-+H+(H2O2HOO-+H+)
②在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对
同课章节目录
