2021-2022学年高二化学人教版(2019)选择性必修2-3.3金属晶体与离子晶体课件(32张ppt)
文档属性
| 名称 | 2021-2022学年高二化学人教版(2019)选择性必修2-3.3金属晶体与离子晶体课件(32张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1008.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-02 09:00:53 | ||
图片预览











文档简介
(共32张PPT)
第三节 金属晶体与离子晶体
第3章 晶体结构与性质
一、金属键与金属晶体
1.金属键。
(1)成键粒子: 金属阳离子 和 自由电子 。
(2)成键条件: 金属单质 或 合金 。
(3)成键本质——电子气理论:
金属原子脱落下来的 价电子 形成遍布整块晶体的“电子气”,被所有原子共用,从而把 所有的金属原子 维系在一起,形成像共价晶体一样的“巨分子”。
基础知识
(4)金属键的特征:
金属键无方向性和饱和性。金属晶体里的自由电子不专属于某几个特定的金属原子,而是几乎均匀地分布在整个晶体里,把所有金属原子维系在一起,所以金属键没有方向性和饱和性。
2.金属晶体。
(1)金属(除汞外)在常温下都是晶体,称其为金属晶体。
(2)用电子气理论解释金属的物理性质:
二、离子晶体
1.结构特点。
(1)构成粒子: 阳离子 和 阴离子 。
(2)作用力: 离子键 。
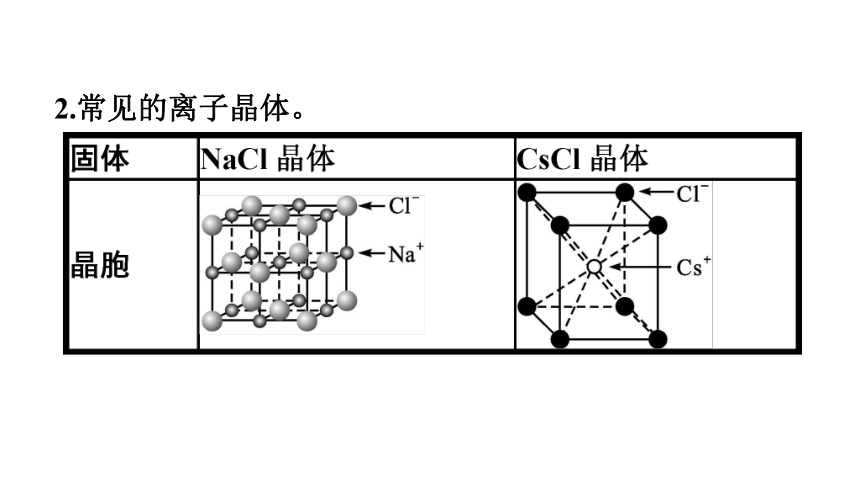
2.常见的离子晶体。
3.物理性质。
(1)硬度 较大 ,难于压缩。
(2)通常,熔点和沸点 较高 。
(3)固体不导电,但在 熔融状态或水溶液 时能导电。
4.离子液体。
(1)定义:在室温或稍高于室温时呈液态的离子化合物。
(2)组成:大多数离子液体含有体积很大的阴、阳离子。
(3)性质与用途:离子液体 难 挥发,可用作 溶剂 。
微训练1 下列关于CaF2的表述正确的是( )。
A.Ca2+与F-间仅存在静电吸引作用
B.F-的半径小于Cl-的半径,则CaF2的熔点低于CaCl2的熔点
C.阴、阳离子个数比为2∶1的物质,均与CaF2的晶体构型相同
D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
D
三、过渡晶体
1.四类典型的晶体是指 分子 晶体、 共价 晶体、 金属 晶体和 离子 晶体。
2.过渡晶体:介于典型晶体之间的晶体。
(1)几种氧化物的化学键中离子键成分的百分数:
从上表可知,表中4种氧化物晶体中的化学键既不是纯粹的离子键也不是纯粹的共价键,所以这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的 过渡晶体 。
(2)偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如 Na2O 等。同样偏向共价晶体的过渡晶体当作共价晶体来处理,如 Al2O3 、 SiO2 等。
微训练2下列关于第三周期主族元素的氧化物形成的晶体的说法正确的是( )。
A.氧元素与钠元素电负性相差很大,所以Na2O是纯粹的离子晶体
B.MgO不具有共价晶体的性质
C.SiO2是离子晶体与共价晶体之间的过渡晶体,但常看作共价晶体
D.P2O5、SO3是纯粹的分子晶体,晶体中没有离子键成分
C
四、混合型晶体
1.结构特点——层状结构。
(1)同层内碳原子采取 sp2 杂化,以共价键(σ键)结合,形成 平面六元并环结构 。
(2)层与层之间靠 范德华力 维系。
(3)石墨的二维结构内,每个碳原子的配位数为3,有一个未参与杂化的2p电子,它的原子轨道垂直于碳原子平面。
2.晶体类型:属于 混合型晶体 。
3.性质:熔点 很高 、质软、 易 导电等。
微训练3下列性质能说明石墨具有分子晶体的性质的是( )。
A.晶体能导电
B.熔点很高
C.硬度小
D.燃烧产物是CO2
C
五、纳米晶体
1.含义。
晶体颗粒尺寸在 纳米 (10-9 m)量级的晶体。
2.特性。
(1)纳米晶体在声、 光 、 电 、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
(2)当晶体颗粒小至纳米量级,熔点会 下降 。
微训练4 在纳米级的空间中,水的结冰温度是怎样的呢 为此,科学家对不同直径碳纳米管中水的结冰温度进行分析。下图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是 。
纳米管直径越小,结冰温度越高
典例剖析
1.下图是金属晶体内部电子气理论图:
重难突破
电子气理论可以用来解释金属的性质,其中正确的是( )。
A.金属能导电是因为金属阳离子在外加电场作用下定向移动
B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导
C.金属具有延展性是因为在外力的作用下,金属阳离子各层间会出现相对滑动,但自由电子可以起到润滑的作用,使金属不会断裂
D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合金的延展性比纯金属强,硬度比纯金属小
C
2.根据表中给出物质的熔点数据(AlCl3沸点为260 ℃),判断下列说法错误的是( )。
A.MgO中的离子键比NaCl中的离子键强
B.SiCl4晶体是分子晶体
C.AlCl3晶体是离子晶体
D.晶体硼是共价晶体
C
3.自然界中的晶体主要是过渡晶体,下列晶体最接近离子晶体的是( )。
A.LiCl B.NaCl
C.NaBr D.KF
D
4.石墨烯是从石墨材料中剥离出来的由碳原子组成的只有一层原子厚度的二维晶体。其结构如图:
下列有关说法正确的是( )。
A.石墨烯中碳原子的杂化方式为sp3杂化
B.石墨烯中平均每个六元碳环含有3个碳原子
C.从石墨中剥离石墨烯需要破坏化学键
D.石墨烯具有导电性
D
学以致用
1.根据下列对四种物质的有关性质的叙述,判断其中可能属于金属晶体的是( )。
A.由分子间作用力结合而成,熔点低
B.固体或熔融后易导电,熔点在1 000 ℃左右
C.具有共价键三维骨架结构,熔点高
D.固体和熔融状态不导电,但溶于水后可能导电
B
2.在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔、沸点越高。由此判断下列各组金属的熔、沸点高低顺序,其中正确的是( )。
A.Mg>Al>Ca B.Al>Na>Li
C.Al>Mg>Ca D.Mg>Ba>Al
C
3.下列性质适合于离子晶体的是( )。
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
⑤熔点-218 ℃,难溶于水
⑥熔点3 900 ℃,硬度很大,不导电
⑦难溶于水,固态时导电,升温时导电能力减弱
⑧难溶于水,熔点高,固态时不导电,熔化时导电
A.①⑧ B.②③⑥ C.①④⑦ D.②⑤
A
4.氧化钙在2 973 K时熔化,而氯化钠在1 074 K时熔化,两者的离子间距离和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是( )。
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙中氧离子与钙离子之间的作用力更强
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,熔点主要由阴、阳离子所带电荷数的多少决定
C
5.据报道,厦门大学科研人员合成了C70Cl10富勒烯足球状分子,如下图所示。它是由C70分子与Cl2发生加成反应得到的。在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形,碳均为4价。下列有关说法中不正确的是( )。
C70Cl10分子结构示意图
C
A.C70Cl10富勒烯属于过渡晶体
B.C70Cl10富勒烯的熔点比石墨的熔点低
C.C70Cl10富勒烯性质更接近于共价晶体
D.C70Cl10富勒烯性质更接近于分子晶体
6.(1)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图所示。1 mol石墨烯中含有的六元环个数为 (设NA为阿伏加德罗常数的值)。
石墨烯
0.5NA
(2)碳元素形成的单质所属晶体类型可能是 (填序号)。
①分子晶体 ②共价晶体 ③金属晶体 ④离子晶体
⑤混合型晶体
①②⑤
再 见
第三节 金属晶体与离子晶体
第3章 晶体结构与性质
一、金属键与金属晶体
1.金属键。
(1)成键粒子: 金属阳离子 和 自由电子 。
(2)成键条件: 金属单质 或 合金 。
(3)成键本质——电子气理论:
金属原子脱落下来的 价电子 形成遍布整块晶体的“电子气”,被所有原子共用,从而把 所有的金属原子 维系在一起,形成像共价晶体一样的“巨分子”。
基础知识
(4)金属键的特征:
金属键无方向性和饱和性。金属晶体里的自由电子不专属于某几个特定的金属原子,而是几乎均匀地分布在整个晶体里,把所有金属原子维系在一起,所以金属键没有方向性和饱和性。
2.金属晶体。
(1)金属(除汞外)在常温下都是晶体,称其为金属晶体。
(2)用电子气理论解释金属的物理性质:
二、离子晶体
1.结构特点。
(1)构成粒子: 阳离子 和 阴离子 。
(2)作用力: 离子键 。
2.常见的离子晶体。
3.物理性质。
(1)硬度 较大 ,难于压缩。
(2)通常,熔点和沸点 较高 。
(3)固体不导电,但在 熔融状态或水溶液 时能导电。
4.离子液体。
(1)定义:在室温或稍高于室温时呈液态的离子化合物。
(2)组成:大多数离子液体含有体积很大的阴、阳离子。
(3)性质与用途:离子液体 难 挥发,可用作 溶剂 。
微训练1 下列关于CaF2的表述正确的是( )。
A.Ca2+与F-间仅存在静电吸引作用
B.F-的半径小于Cl-的半径,则CaF2的熔点低于CaCl2的熔点
C.阴、阳离子个数比为2∶1的物质,均与CaF2的晶体构型相同
D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
D
三、过渡晶体
1.四类典型的晶体是指 分子 晶体、 共价 晶体、 金属 晶体和 离子 晶体。
2.过渡晶体:介于典型晶体之间的晶体。
(1)几种氧化物的化学键中离子键成分的百分数:
从上表可知,表中4种氧化物晶体中的化学键既不是纯粹的离子键也不是纯粹的共价键,所以这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的 过渡晶体 。
(2)偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如 Na2O 等。同样偏向共价晶体的过渡晶体当作共价晶体来处理,如 Al2O3 、 SiO2 等。
微训练2下列关于第三周期主族元素的氧化物形成的晶体的说法正确的是( )。
A.氧元素与钠元素电负性相差很大,所以Na2O是纯粹的离子晶体
B.MgO不具有共价晶体的性质
C.SiO2是离子晶体与共价晶体之间的过渡晶体,但常看作共价晶体
D.P2O5、SO3是纯粹的分子晶体,晶体中没有离子键成分
C
四、混合型晶体
1.结构特点——层状结构。
(1)同层内碳原子采取 sp2 杂化,以共价键(σ键)结合,形成 平面六元并环结构 。
(2)层与层之间靠 范德华力 维系。
(3)石墨的二维结构内,每个碳原子的配位数为3,有一个未参与杂化的2p电子,它的原子轨道垂直于碳原子平面。
2.晶体类型:属于 混合型晶体 。
3.性质:熔点 很高 、质软、 易 导电等。
微训练3下列性质能说明石墨具有分子晶体的性质的是( )。
A.晶体能导电
B.熔点很高
C.硬度小
D.燃烧产物是CO2
C
五、纳米晶体
1.含义。
晶体颗粒尺寸在 纳米 (10-9 m)量级的晶体。
2.特性。
(1)纳米晶体在声、 光 、 电 、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
(2)当晶体颗粒小至纳米量级,熔点会 下降 。
微训练4 在纳米级的空间中,水的结冰温度是怎样的呢 为此,科学家对不同直径碳纳米管中水的结冰温度进行分析。下图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是 。
纳米管直径越小,结冰温度越高
典例剖析
1.下图是金属晶体内部电子气理论图:
重难突破
电子气理论可以用来解释金属的性质,其中正确的是( )。
A.金属能导电是因为金属阳离子在外加电场作用下定向移动
B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导
C.金属具有延展性是因为在外力的作用下,金属阳离子各层间会出现相对滑动,但自由电子可以起到润滑的作用,使金属不会断裂
D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合金的延展性比纯金属强,硬度比纯金属小
C
2.根据表中给出物质的熔点数据(AlCl3沸点为260 ℃),判断下列说法错误的是( )。
A.MgO中的离子键比NaCl中的离子键强
B.SiCl4晶体是分子晶体
C.AlCl3晶体是离子晶体
D.晶体硼是共价晶体
C
3.自然界中的晶体主要是过渡晶体,下列晶体最接近离子晶体的是( )。
A.LiCl B.NaCl
C.NaBr D.KF
D
4.石墨烯是从石墨材料中剥离出来的由碳原子组成的只有一层原子厚度的二维晶体。其结构如图:
下列有关说法正确的是( )。
A.石墨烯中碳原子的杂化方式为sp3杂化
B.石墨烯中平均每个六元碳环含有3个碳原子
C.从石墨中剥离石墨烯需要破坏化学键
D.石墨烯具有导电性
D
学以致用
1.根据下列对四种物质的有关性质的叙述,判断其中可能属于金属晶体的是( )。
A.由分子间作用力结合而成,熔点低
B.固体或熔融后易导电,熔点在1 000 ℃左右
C.具有共价键三维骨架结构,熔点高
D.固体和熔融状态不导电,但溶于水后可能导电
B
2.在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔、沸点越高。由此判断下列各组金属的熔、沸点高低顺序,其中正确的是( )。
A.Mg>Al>Ca B.Al>Na>Li
C.Al>Mg>Ca D.Mg>Ba>Al
C
3.下列性质适合于离子晶体的是( )。
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
⑤熔点-218 ℃,难溶于水
⑥熔点3 900 ℃,硬度很大,不导电
⑦难溶于水,固态时导电,升温时导电能力减弱
⑧难溶于水,熔点高,固态时不导电,熔化时导电
A.①⑧ B.②③⑥ C.①④⑦ D.②⑤
A
4.氧化钙在2 973 K时熔化,而氯化钠在1 074 K时熔化,两者的离子间距离和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是( )。
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙中氧离子与钙离子之间的作用力更强
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,熔点主要由阴、阳离子所带电荷数的多少决定
C
5.据报道,厦门大学科研人员合成了C70Cl10富勒烯足球状分子,如下图所示。它是由C70分子与Cl2发生加成反应得到的。在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形,碳均为4价。下列有关说法中不正确的是( )。
C70Cl10分子结构示意图
C
A.C70Cl10富勒烯属于过渡晶体
B.C70Cl10富勒烯的熔点比石墨的熔点低
C.C70Cl10富勒烯性质更接近于共价晶体
D.C70Cl10富勒烯性质更接近于分子晶体
6.(1)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图所示。1 mol石墨烯中含有的六元环个数为 (设NA为阿伏加德罗常数的值)。
石墨烯
0.5NA
(2)碳元素形成的单质所属晶体类型可能是 (填序号)。
①分子晶体 ②共价晶体 ③金属晶体 ④离子晶体
⑤混合型晶体
①②⑤
再 见
