2021-2022学年高二化学人教版(2019)选择性必修2-3.2分子晶体与共价晶体课件(21张ppt)
文档属性
| 名称 | 2021-2022学年高二化学人教版(2019)选择性必修2-3.2分子晶体与共价晶体课件(21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 358.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-02 09:01:31 | ||
图片预览





文档简介
(共21张PPT)
第二节 分子晶体与共价晶体
第3章 晶体结构与性质
一、分子晶体
1.定义:
只含分子的晶体称为分子晶体。分子晶体中相邻的分子间靠 相互吸引。
2.物理特性:
(1)分子晶体的熔点 ,硬度 。
(2)一般是绝缘体,熔融状态也不导电。
(3)溶解性通常符合“相似相溶”规律。
基础知识
分子间作用力
较低
较小
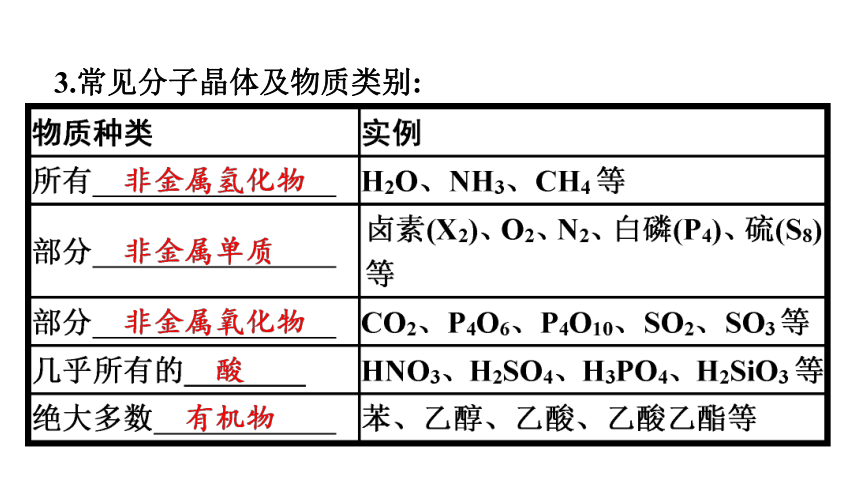
3.常见分子晶体及物质类别:
4.分子晶体的常见堆积方式:
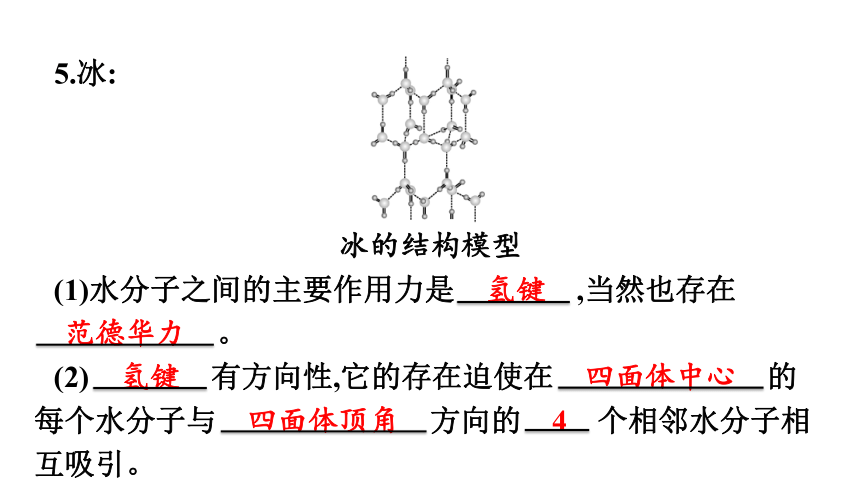
5.冰:
冰的结构模型
(1)水分子之间的主要作用力是 氢键 ,当然也存在
范德华力 。
(2) 氢键 有方向性,它的存在迫使在 四面体中心 的每个水分子与 四面体顶角 方向的 4 个相邻水分子相互吸引。
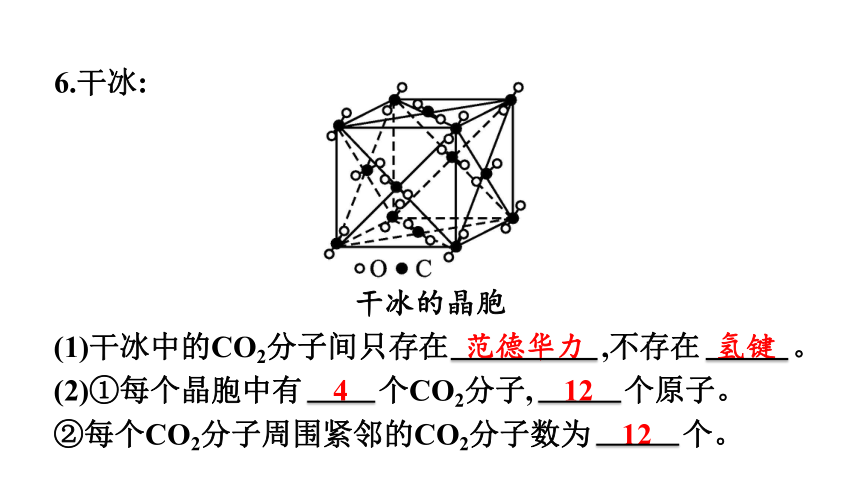
6.干冰:
干冰的晶胞
(1)干冰中的CO2分子间只存在 范德华力 ,不存在 氢键 。
(2)①每个晶胞中有 4 个CO2分子, 12 个原子。
②每个CO2分子周围紧邻的CO2分子数为 12 个。
二、共价晶体
1.金刚石。
(1)金刚石晶体中,每个碳原子采取 sp3 杂化,C—C—C夹角为 109°28' 。
(2)每个碳原子以四个共价单键对称地与相邻的4个碳原子结合形成共价键三维骨架结构。
(3)最小碳环由 6 个碳原子构成。
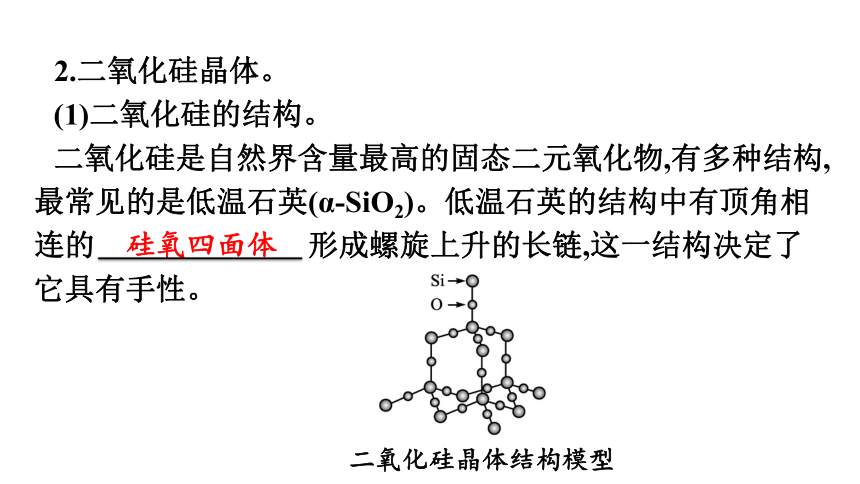
2.二氧化硅晶体。
(1)二氧化硅的结构。
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α-SiO2)。低温石英的结构中有顶角相连的 硅氧四面体 形成螺旋上升的长链,这一结构决定了它具有手性。
二氧化硅晶体结构模型
①Si原子采取 sp3 杂化,正四面体内O—Si—O键角为 109°28' 。
②每个Si原子与相邻的 4 个O原子形成 4 个共价键, Si 原子位于正四面体的中心, O 原子位于正四面体的顶角,同时每个O原子被 2 个硅氧正四面体共用;每个O原子和 2 个Si原子形成 2 个共价键,晶体中Si原子与O原子个数比为 1∶2 。
③最小环上有 12 个原子,包括 6 个O原子和 6 个Si原子。
(2)二氧化硅的用途。
二氧化硅是制造水泥、玻璃、单晶硅、硅光电池、芯片和光导纤维的原料。
3.共价晶体的结构特点。
(1)构成粒子及作用力:
(2)空间结构:整块晶体有共价键 三维骨架 结构,不存在单个的小分子。
4.共价晶体的熔点。
(1)共价晶体由于原子间以较强的共价键相结合,熔化时必须破坏共价键,而破坏它们需要很高的温度,所以共价晶体具有 很高 的熔点。
(2)一般来说,结构相似的共价晶体,原子半径越 小 ,键长越 短 ,键能越 大 ,晶体的熔点越 高 。
5.共价晶体与物质的类别。
(1)比较下列化合物的熔、沸点的高低(填“>”或“<”)。
①CO2 SO2;②NH3 PH3;
③O3 O2; ④Ne Ar;
⑤CH3CH2OH CH3OH; ⑥CO N2。
(2)已知AlCl3的熔点为190 ℃,但它在180 ℃即开始升华。
①AlCl3固体是 晶体。
②设计实验判断氯化铝是离子化合物还是共价化合物:
。
重难突破
<
<
>
>
>
>
分子
在熔融状态下,验证其是否导电,若不导电是共价化合物
学以致用
1.(2020四川邻水一中高二下月考)C60晶体的晶胞结构如图所示,下列说法正确的是( )。
A.该晶体熔化时需克服共价键
B.1个晶胞中含有8个C60分子
C.晶体中1个C60分子有12个紧邻的C60分子,属于分子密堆积类型
D.晶体中C60分子间以范德华力结合,故C60分子的热稳定性较差
C
2.(1)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于 晶体。
(2)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3,常温下它们都是易挥发的液体。ClF3的熔、沸点比BrF3的 (填“高”或“低”)。
分子
低
3.下表是某些共价晶体的熔点和硬度,分析表中的数据,判断下列叙述正确的是( )。
①构成共价晶体的原子种类越多,晶体的熔点越高
②构成共价晶体的原子间的共价键的键能越大,晶体的熔点越高
D
③构成共价晶体的原子半径越大,晶体的硬度越大
④构成共价晶体的原子半径越小,晶体的硬度越大
A.①② B.③④
C.①③ D.②④
4.下列各组晶体中,化学键类型相同,晶体类型也相同的是( )。
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2
④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
C
5.(2020江苏徐州泉山区校级月考)已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中错误的是( )。
A.C3N4晶体与金刚石同属于共价晶体
B.C3N4晶体中C—N的键长比金刚石中C—C的键长长
C.C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
D.C3N4晶体中含有极性共价键,不含非极性共价键
B
再 见
第二节 分子晶体与共价晶体
第3章 晶体结构与性质
一、分子晶体
1.定义:
只含分子的晶体称为分子晶体。分子晶体中相邻的分子间靠 相互吸引。
2.物理特性:
(1)分子晶体的熔点 ,硬度 。
(2)一般是绝缘体,熔融状态也不导电。
(3)溶解性通常符合“相似相溶”规律。
基础知识
分子间作用力
较低
较小
3.常见分子晶体及物质类别:
4.分子晶体的常见堆积方式:
5.冰:
冰的结构模型
(1)水分子之间的主要作用力是 氢键 ,当然也存在
范德华力 。
(2) 氢键 有方向性,它的存在迫使在 四面体中心 的每个水分子与 四面体顶角 方向的 4 个相邻水分子相互吸引。
6.干冰:
干冰的晶胞
(1)干冰中的CO2分子间只存在 范德华力 ,不存在 氢键 。
(2)①每个晶胞中有 4 个CO2分子, 12 个原子。
②每个CO2分子周围紧邻的CO2分子数为 12 个。
二、共价晶体
1.金刚石。
(1)金刚石晶体中,每个碳原子采取 sp3 杂化,C—C—C夹角为 109°28' 。
(2)每个碳原子以四个共价单键对称地与相邻的4个碳原子结合形成共价键三维骨架结构。
(3)最小碳环由 6 个碳原子构成。
2.二氧化硅晶体。
(1)二氧化硅的结构。
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α-SiO2)。低温石英的结构中有顶角相连的 硅氧四面体 形成螺旋上升的长链,这一结构决定了它具有手性。
二氧化硅晶体结构模型
①Si原子采取 sp3 杂化,正四面体内O—Si—O键角为 109°28' 。
②每个Si原子与相邻的 4 个O原子形成 4 个共价键, Si 原子位于正四面体的中心, O 原子位于正四面体的顶角,同时每个O原子被 2 个硅氧正四面体共用;每个O原子和 2 个Si原子形成 2 个共价键,晶体中Si原子与O原子个数比为 1∶2 。
③最小环上有 12 个原子,包括 6 个O原子和 6 个Si原子。
(2)二氧化硅的用途。
二氧化硅是制造水泥、玻璃、单晶硅、硅光电池、芯片和光导纤维的原料。
3.共价晶体的结构特点。
(1)构成粒子及作用力:
(2)空间结构:整块晶体有共价键 三维骨架 结构,不存在单个的小分子。
4.共价晶体的熔点。
(1)共价晶体由于原子间以较强的共价键相结合,熔化时必须破坏共价键,而破坏它们需要很高的温度,所以共价晶体具有 很高 的熔点。
(2)一般来说,结构相似的共价晶体,原子半径越 小 ,键长越 短 ,键能越 大 ,晶体的熔点越 高 。
5.共价晶体与物质的类别。
(1)比较下列化合物的熔、沸点的高低(填“>”或“<”)。
①CO2 SO2;②NH3 PH3;
③O3 O2; ④Ne Ar;
⑤CH3CH2OH CH3OH; ⑥CO N2。
(2)已知AlCl3的熔点为190 ℃,但它在180 ℃即开始升华。
①AlCl3固体是 晶体。
②设计实验判断氯化铝是离子化合物还是共价化合物:
。
重难突破
<
<
>
>
>
>
分子
在熔融状态下,验证其是否导电,若不导电是共价化合物
学以致用
1.(2020四川邻水一中高二下月考)C60晶体的晶胞结构如图所示,下列说法正确的是( )。
A.该晶体熔化时需克服共价键
B.1个晶胞中含有8个C60分子
C.晶体中1个C60分子有12个紧邻的C60分子,属于分子密堆积类型
D.晶体中C60分子间以范德华力结合,故C60分子的热稳定性较差
C
2.(1)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于 晶体。
(2)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3,常温下它们都是易挥发的液体。ClF3的熔、沸点比BrF3的 (填“高”或“低”)。
分子
低
3.下表是某些共价晶体的熔点和硬度,分析表中的数据,判断下列叙述正确的是( )。
①构成共价晶体的原子种类越多,晶体的熔点越高
②构成共价晶体的原子间的共价键的键能越大,晶体的熔点越高
D
③构成共价晶体的原子半径越大,晶体的硬度越大
④构成共价晶体的原子半径越小,晶体的硬度越大
A.①② B.③④
C.①③ D.②④
4.下列各组晶体中,化学键类型相同,晶体类型也相同的是( )。
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2
④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
C
5.(2020江苏徐州泉山区校级月考)已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中错误的是( )。
A.C3N4晶体与金刚石同属于共价晶体
B.C3N4晶体中C—N的键长比金刚石中C—C的键长长
C.C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
D.C3N4晶体中含有极性共价键,不含非极性共价键
B
再 见
