7.3溶液的酸碱性-2021-2022学年九年级化学鲁教版下册(word版含解析)
文档属性
| 名称 | 7.3溶液的酸碱性-2021-2022学年九年级化学鲁教版下册(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 340.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-02 21:49:06 | ||
图片预览



文档简介
7.3溶液的酸碱性
一、选择题(共16题)
1.下列实验操作不正确的是( )
A.量筒读数 B.测溶液的酸碱度
C.点燃酒精灯 D.铁丝在氧气中燃烧
2.下列实验操作正确的是
A.测定溶液pH
B.验满CO2
C.熄灭酒精灯
D.倾倒液体
3.下列实验操作中,正确的是( )
A.过滤操作 B.倾倒液体
C.验满二氧化碳 D.测定溶液的pH
4.在微酸性土壤中,不适宜种植的植物是 (括号内为植物适宜生长的pH)( )
A.花生(5.0﹣6.0) B.苹果(5.0﹣6.5)
C.西瓜(6.0﹣7.0) D.沙枣(8.0﹣8.7)
5.已知部分农作物适宜生长的pH如表所示:
农作物
油菜
水稻
茶树
甘草
适宜生长的pH
5.8﹣6.7
6.0﹣7.0
5.0﹣5.5
7.2﹣8.5
经检测,邵阳地区的土壤呈弱酸性,在邵阳地区不适宜种植的农作物是( )
A.油菜 B.水稻 C.茶树 D.甘草
6.下列溶液中酸性最强的是
A.PH=10 B.PH=7 C.PH=1 D.PH=0
7.下列实验现象的描述中,错误的是
A.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
B.木炭还原氧化铜,红色固体变黑,澄清石灰水变浑浊
C.电解水时正极和负极产生气体的体积之比为1:2
D.向石蕊溶液中滴加稀硫酸后,溶液由紫色变成红色
8.下列有关化学实验现象的描述中,不正确的是
A.将玻璃片放在蜡烛火焰稍上方,玻璃片被熏黑了
B.湿润的有酚酞的滤纸靠近浓氨水,滤纸变红了
C.铁丝在氧气中剧烈燃烧生成了四氧化三铁
D.在酒精灯上加热铝片一会儿,铝片熔而不滴
9.欲使 pH=8 的溶液变为 pH=5 的溶液,可加入的物质( )
A.蒸馏水 B.氢氧化钠 C.稀硫酸 D.氯化钠溶液
10.将下列物质加入水中,所得溶液的pH可能为8的是
A.生石灰 B.柠檬酸
C.白醋 D.食盐
11.下列排序正确的是
A.空气中气体含量:
B.常见溶液的pH:
C.氯元素的化合价:
D.氮元素的质量分数:
12.以下实验操作不正确的是
A.闻气体气味 B.稀释浓硫酸
C.测定溶液pH值 D.干燥NH3气体
13.下列实验方法无法达到实验目的的是
A.用肥皂水鉴别硬水和软水
B.用适量氯化钙溶液除去氢氧化钠中混有的少量碳酸钠
C.可用水鉴别氢氧化钠和硝酸铵两种白色固体
D.用紫色石蕊试液鉴别稀硫酸和蒸馏水
14.中考复习阶段,某同学梳理了以下知识:①纯碱属于碱;②干冰不是冰;③合金属于合成材料;④pH<7的溶液一定显酸性;⑤100g质量分数为10%的稀盐酸蒸发掉50g的水后可以得到20%的盐酸溶液;⑥浓硫酸能使纸张、木材变黑,是因为浓硫酸有吸水性。上面说法正确的是
A.①②④ B.③⑥ C.④⑥ D.②④
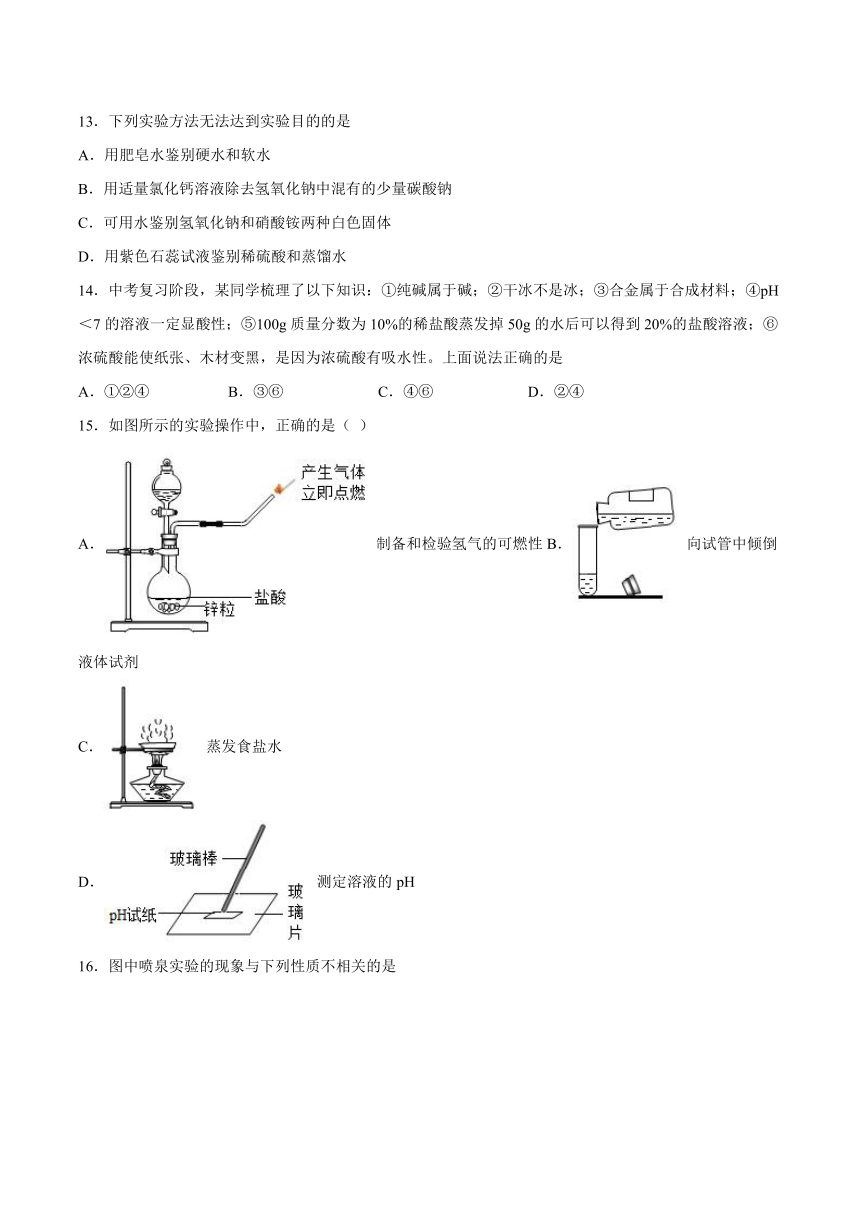
15.如图所示的实验操作中,正确的是( )
A. 制备和检验氢气的可燃性B. 向试管中倾倒液体试剂
C. 蒸发食盐水
D. 测定溶液的pH
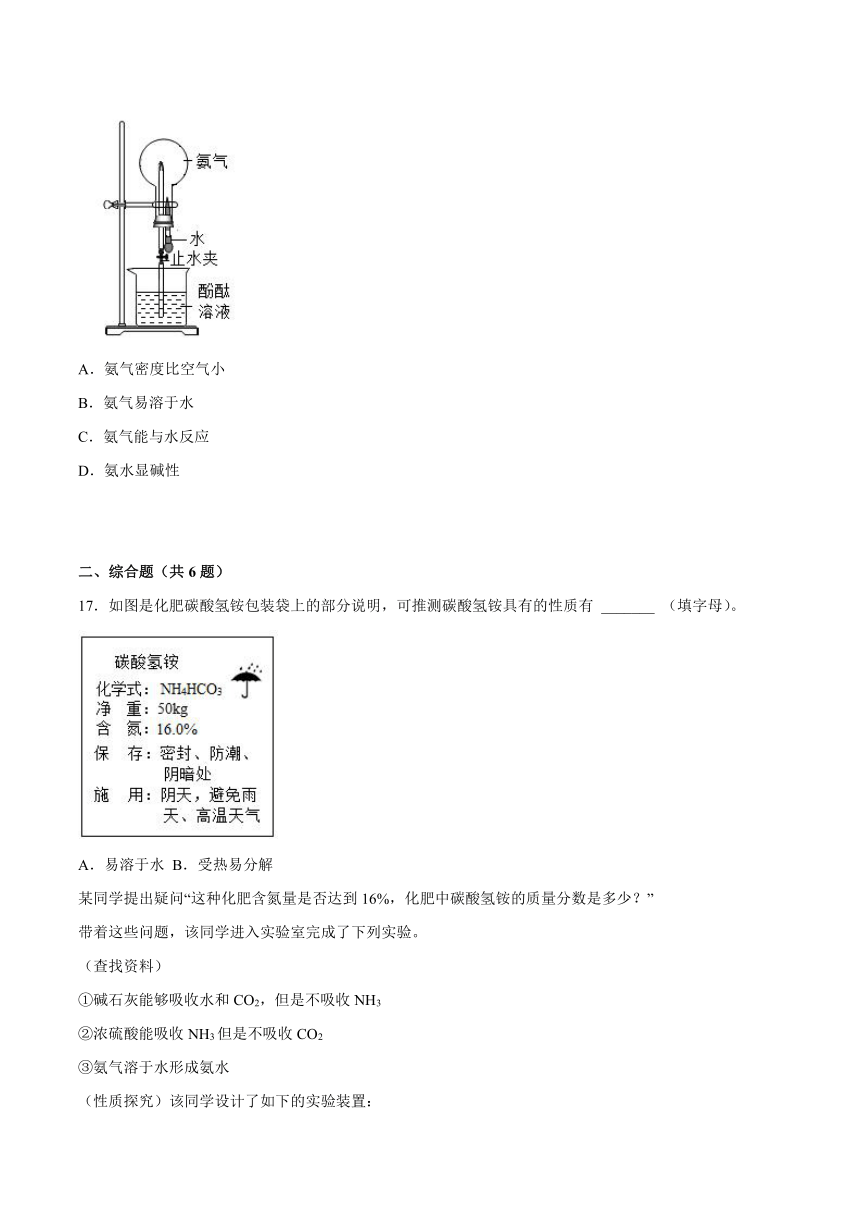
16.图中喷泉实验的现象与下列性质不相关的是
A.氨气密度比空气小
B.氨气易溶于水
C.氨气能与水反应
D.氨水显碱性
二、综合题(共6题)
17.如图是化肥碳酸氢铵包装袋上的部分说明,可推测碳酸氢铵具有的性质有 _______ (填字母)。
A.易溶于水 B.受热易分解
某同学提出疑问“这种化肥含氮量是否达到16%,化肥中碳酸氢铵的质量分数是多少?”
带着这些问题,该同学进入实验室完成了下列实验。
(查找资料)
①碱石灰能够吸收水和CO2,但是不吸收NH3
②浓硫酸能吸收NH3但是不吸收CO2
③氨气溶于水形成氨水
(性质探究)该同学设计了如下的实验装置:
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是 _____ 。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,观察到B中的现象是 ________ 。
③再取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是 __________ 。
④碳酸氢铵在受热时发生反应的化学表达式是 _______ 。
(含量分析)将装置A、C、D依次连接,加入10g化肥样品,加热至A中固体完全消失。称量装置D的质量如表 (各装置对气体吸收是完全的) :
实验前D装置的质量 150.0g
实验后D装置的质量 151.7g
⑤由此分析得知:反应中产生氨气的质量为 __________ g。
⑥通过反应的化学表达式可知:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥中氮元素的质量分数为 __________ (结果保留到0.1%)。
⑦此化肥中碳酸氢铵的质量分数为 __________ (结果保留到0.1%)。
18.化学就在我们身边
(一)在厨房里蕴藏着许多化学知识。
(1)加碘食盐中的“碘”是指______(填“元素”或“原子”)。
(2)“直饮水”机采用“活性炭+超滤层+煮沸”净水工艺,活性炭在此起______作用。
(3)多喝硬水易得白内障,生活中硬水要通过______降低硬度后才能喝。
(4)从微粒的角度分析,下列对生活中的事实解释错误的是______。
选项 事实 解释
A 食物变质 分子本身发生了变化
B CO(煤气)有毒而CO2无毒 两种物质的分子构成不同
C 温度计中的水银(汞)热胀冷缩 原子的大小发生改变
D 湿衣服晾在太阳底下干得快 分子运动速率随温度升高而增大
(二)食品中的化学
双吸剂(铁粉)在干燥食品的过程中可能会生成FeO、Fe3O4、Fe2O3。现测定了两组样品,获得了如下数据。
样品 样品质量/克 铁元素的质量/克 氧元素的质量/克
1 7.00 4.90 2.10
2 7.20 5.60 1.60
(5)样品1中铁元素的质量分数为______。
(6)样品2的化学式是_____。
(三)农业生产中的化学
有一化肥硫酸铵包装袋上标有含氮量20%的说明,同学们产生了疑问,取了化肥样品,进入实验室。
(查找资料)①碱石灰能吸收水和SO2,但不吸收NH3。浓硫酸能吸收NH3但不吸收SO2和O2。
②硫酸铵加热时生成O2和另外三种气体。
③氨气溶于水形成氨水
(性质探究)该同学设计了如下的实验装置:
(7)用A装置给硫酸铵加热,试管口有水珠。装药品前,必须进行的一步操作是____。
(8)取适量硫酸铵加入试管,连接A、C、D装置,加热,D中的现象是_____。
(9)取适量硫酸铵加入试管,连接A、B、E装置,加热,E中的现象是____。
(10)硫酸铵在受热时发生反应的化学方程式是____。
(含量分析)将装置A、B、C依次连接,加入8g化肥样品,加热至A中固体完全消失。称量装置C的质量如表:
实验前C装置的质量 125g
实验后C装置的质量 126.7g
(11)由此分析得知:反应中产生氨气的质量为____g。
(12)假设杂质中不含氮元素,请计算此化肥含氮元素质量分数为_____。
(13)请计算此化肥中硫酸铵的纯度_____。
(14)50kg该样品中的氮元素质量与______kgNH4NO3中的氮元素质量相当。
19.水是生命之源,万物之基,是人类最宝贵的自然资源。唤起人们保护水资源、节约用水的意识是十分有必要的。
(1)我国规定水质必须在感官性指标、化学指标、病理学指标等方面达标后方可成为生活饮用水。各种指标的主要要求为a. 不得呈现异色,b. 不得有异味,c. 水应澄清透明,d. 不得含有细菌的病毒。
①前两个指标可以利用_____(填物质名称)的吸附作用而达到。
②某山区自来水厂生产自来水的过程如图(1)所示。由图(1)可知净化水时,c,d两个指标可通过图中的B,C,_____过程而达到。
③化学指标中含有液体的pH和硬度两项,则a. 测定液体的pH用_____。
b. 日常生活中如何区分硬水与软水?请简述实验步骤与现象:_____。
(2)许多化学实验中都用到水,请指出图(2)所示实验中水的作用。
甲:_____;乙:_____;丙:_____;丁:_____;戊:_____。
(3)水既普通又宝贵,请你用化学方程式归纳水具有的重要的化学性质(举任意三例)。
①_____;②_____;③_____。
(4)图(3)是理想的氢元素循环示意图,下列说法不正确的是(______)
A 水的分解反应需要吸收能量
B 燃料电池将氢能转化为电能
C 制取氢能比较理想的方法是在阳光照射条件下用催化剂来分解水
D 理想的氢元素循环可以通过物理变化来实现
(5)某次奥运会上火炬使用的燃料是丙烷(C3H6)而不是氢气,其原因可能是(______)。
A 人类目前还无法制取氢气
B 氢气燃烧后的产物会污染环境
C 氢气燃烧时火焰呈淡蓝色,不易观察到明显的现象
D 氢气燃烧时一定会发生爆炸
20.化学就在我们身边,它与我们的生活息息相关。
(1)“化学——我们的生活,我们的未来”。
①我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 __________功能。
②竹子可加工成具有吸附作用的物质,其作用与____________(填物质名称)相似。
③厨房中常用的调味品,能用来除水垢的酸_________________(填化学式)。
④城市生活中常用气体燃料煤气中含有毒气体一氧化碳,其燃烧的反应的化学方程式:__________。
(2)无土栽培是利用营养液栽培作物的一种方法.以下是栽培绿叶菜营养液配方。
肥料成分 用量(毫克/升)
硝酸钙 1260
硝酸钾 255
磷酸二氢钠 350
硫酸镁 537
硫酸铵 235
①肥料成份中属于复合肥的是_____________。
②该营养液中存在的一种阳离子的符号_____。
③某硫酸铵溶液pH=4.5,则硫酸铵溶液显_________(填“酸性”、“碱性”或“中性”)。
④若在实验里配制10升该营养液,需要称取的硫酸镁的质量是____________毫克。
21.兴趣小组的同学为探究在空气中久置的某氢氧化钠样品是否变质,设计了如下图所示的A、B、C、D四组探究实验。
(查阅资料)氯化钙、氯化钡溶液都呈中性。
(实验探究)取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示:
(分析与结论)
(1)上述四组实验中不能达到实验目的的是______(填字母序号)。
(2)实验A中,观察到______的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是______。
(4)要证明该氢氧化钠部分变质,请写出实验步骤、可能的现象及相关推理________。
(5)若实验证明氢氧化钠部分变质,为测定其中氢氧化钠的质量分数,该同学采用沉淀法进行如下操作:①取15g样品于烧杯中,加入足量水配成溶液;②在样品溶液中加入足量的氯化钡溶液;③待反应完全后,过滤。有关数据如表:
反应前 反应后
烧杯和样品溶液总质量/g 加入氯化钡溶液质量/g 过滤后烧杯和溶液总质量/g(不计滤液损失)
105 65 150.3
请回答下列问题:
①原样品中氢氧化钠的质量分数是______(保留到0.1%)
②另取样品溶于水,若要除去杂质获取氢氧化钠溶液,可以向其中加入______溶液,然后______(填操作名称)即可。
22.二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O, K2MnO4易溶于水
(1)实验室加热高锰酸钾制氧气,反应的化学方程式为_____。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是____。
Ⅱ.用硫酸锰制备
(2)电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为_____,一段时间后溶液的pH将________(填“变大”、“变小”或“不变”)。
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:
请回答下列问题:
(3)“滤液”中溶质的主要成分是_________(填化学式)。
(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、_______和_________。
(5) MnO2与碳粉经下列三步反应制得纳米MnO2:
①②MnO+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有___________(填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:
(6)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式
(7) MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如上图所示。图中A点(300, 75.65)对应固体成分的化学式为____________。
参考答案
1.B
【详解】
A、量筒读数时,应平视凹液面的最低处,选项正确;
B、测溶液的酸碱度的方法:用玻璃棒蘸取或用胶头滴管吸取待测液,滴在试纸上,呈现一定的颜色,然后和标准比色卡比较,读取pH,将试纸伸入待测液中会污染试剂,选项错误;
C、点燃酒精灯,应该用火柴点燃,用燃着的酒精灯引燃另一只,易引发灯内酒精着火,甚至酒精灯爆炸,选项正确;
D、铁丝在氧气中燃烧,火星四射,放出大量的热,为避免集气瓶炸裂,常在集气瓶内放少量的水或细沙,选项正确。
故选B。
2.C
【详解】
A、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH。不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误,不符合题意;
B、检验氧气是否收集满时,应将带火星的木条放在集气瓶口,不能伸入瓶中,图中所示操作错误,不符合题意;
C、使用酒精灯时要注意“两查、两禁、一不可”,熄灭酒精灯时,不能用嘴吹灭酒精灯,应用灯帽盖灭,图中所示操作正确,符合题意;
D、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中瓶口没有紧挨、瓶塞没有倒放、标签没有向着手心,所示操作错误,不符合题意。
故选:C。
3.A
【详解】
A、过滤操作,一贴、二低、三靠,操作正确;
B、倾倒液体时瓶口要紧挨试管口,试管要倾斜,瓶塞要倒放,操作错误;
C、验满时要把木条放在瓶口,不能伸入瓶内,操作错误;
D、pH试纸不能伸入待测液中,操作错误。
故选A 。
4.D
【详解】
A、花生最适宜的土壤为微酸性,适宜该地区的种植;选项A不正确;
B、苹果最适宜的土壤为酸性,适宜该地区的种植;选项B不正确;
C、西瓜最适宜的土壤为微酸性,适宜该地区的种植;选项C不正确;
D、沙枣最适宜的土壤为弱碱性,不适宜该地区的种植;选项D正确;
故选D。
5.D
【详解】
油菜、水稻、茶树等适宜在pH小于7,即显酸性的土壤中生长;甘草适宜在pH大于7,即显碱性的土壤中生长。邵阳地区土壤呈弱酸性,最不适宜种植的农作物是甘草。故选D。
6.D
【详解】
常见溶液的pH范围为0~14,酸性溶液的pH<7,pH越小酸性越强,其中D选项的pH最小,酸性最强。
故选:D。
7.B
【详解】
A、铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故A正确;
B、木炭还原氧化铜生成铜和二氧化碳,则黑色固体变红,澄清石灰水变浑浊,故B不正确;
C、电解水时,可观察到:与电源正极相连的试管内产生的气体体积少,与电源负极相连的试管内的气体体积多;且两者的体积之比大约是1:2,故C正确;
D、向石蕊溶液中滴加稀硫酸后,稀硫酸显酸性,溶液由紫色变成红色,故D正确。故选B。
8.C
【详解】
试题分析∶A.将玻璃片放在蜡烛火焰稍上方,玻璃片被熏黑了。故A正确。B.湿润的有酚酞的滤纸靠近浓氨水,滤纸变红了。故B正确。C.铁丝在氧气中剧烈燃烧生成了黑色固体。故C错误。D.在酒精灯上加热铝片一会儿,铝片熔而不滴。故D正确。
9.C
【详解】
A、pH=8的溶液显碱性,加入蒸馏水, pH会逐渐减小至无限接近于7,但是不会小于7,不符合题意;
B、pH=8的溶液显碱性,加入氢氧化钠,pH还是大于7,不符合题意;
C、pH=8的溶液显碱性,加入稀硫酸,能使溶液变为pH=5,符合题意;
D、pH=8的溶液显碱性,氯化钠溶液显中性,加入氯化钠溶液,能使pH减小,但是不会小于7,不符合题意。
故选C。
10.A
【详解】
试题分析:A、生石灰与水反应生成氢氧化钙,氢氧化钙的水溶液显碱性,pH大于7,所得溶液pH可能为8,故选项正确.B、柠檬酸显酸性,pH小于7,所得溶液pH不可能为8,故选项错误.C、白醋显酸性,pH小于7,所得溶液pH不可能为8,故选项错误.D、食盐的水溶液显中性,pH等于7,所得溶液pH不可能为8,故选项错误.故选A
11.C
【详解】
A、空气中物质含量的多少为氮气>氧气>二氧化碳,与数轴关系不一致,因此表示的关系是错误的;
B、肥皂水呈碱性,pH>7;蒸馏水呈中性,pH=7;柠檬水呈酸性,pH<7,与数轴关系不一致,因此表示的关系是错误的;
C、利用单质中元素化合价为零,化合物中化合价代数和为零的原则,根据钠元素为+1价、氧元素为-2价,可得氯气中氯元素化合价为零,次氯酸钠中氯元素为-+1价,氯化钠中氯元素为-1价,与数轴关系一致,因此表示的关系是正确的;
D、NO可看做,可看做,则氮元素的质量分数:,因此表示的关系是错误的;
故选:C。
12.D
【详解】
A、闻气体气味,应用手在瓶口轻轻扇动,使少量气味飘进鼻孔中,不能凑到瓶口去闻,图中操作正确,不符合题意;
B、稀释浓硫酸:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌,使热量尽快散发出去,图中操作正确,不符合题意;
C、测定溶液的pH值:用洁净、干燥的玻璃棒蘸取待测液点在pH试纸上,观察颜色的变化,然后与标准比色卡对照,图中操作正确,不符合题意;
D、浓硫酸具有吸水性,但是浓硫酸能与氨气发生反应,不能用浓硫酸干燥氨气,符合题意。
故选D。
13.B
【解析】
试题分析:A、用肥皂水鉴别硬水和软水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水,可以达到目的,B、除杂质要注意不能引入新的杂质,用适量氯化钙溶液除去氢氧化钠中混有的少量碳酸钠,发生反应:CaCl2+Na2CO3==CaCO3↓+2NaCl,形成新的杂质NaCl,错误,C、氢氧化钠溶于水放热,使温度升高,硝酸铵溶于水吸热,使温度降低,故可可用水鉴别氢氧化钠和硝酸铵两种白色固体,D、紫色石蕊试液遇酸变红,遇碱变蓝,在中性溶液中不变色,所以可用紫色石蕊试液鉴别稀硫酸和蒸馏水,故选B
14.D
【详解】
①纯碱是碳酸钠,是由金属阳离子和酸根阴离子构成的化合物,属于盐,错误;
②干冰不是冰是二氧化碳,正确;
③合金和纯金属都属于金属材料,错误;
④pH>7显碱性,pH=7显中性,pH<7显酸性,正确;
⑤盐酸具有挥发性,100g质量分数为10%的稀盐酸蒸发掉50g的水后,溶质氯化氢也会挥发,故不可以得到20%的盐酸溶液,错误;
⑥浓硫酸能使纸张、木材变黑,是因为浓硫酸有脱水性,错误。
故选D。
15.D
【解析】
试题分析:A、点燃H2前必须验纯,以防爆炸,故错误;B、往试管内倾倒液体时,试管要略微倾斜,瓶口紧挨着试管口倾倒,避免液体溅出。故错误;C、蒸发时为防止局部过热造成液滴飞溅,要用玻璃棒搅拌,故错误;D、pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值,故正确。答案:D。
16.A
【详解】
A、氨气溶解于水的喷泉实验无法证明氨气的密度与空气的关系,因此,该性质与喷泉实验无关,故符合题意;
B、因氨气极易溶解于水,烧瓶内压强减小,烧杯中水面上升形成喷泉,因此,该性质与喷泉实验有关,故不符合题意;
C、氨气能与水反应生成氨水,氨水显碱性,滴有酚酞的水溶液会变红色,因此,该性质与喷泉实验有关,故不符合题意;
D、氨水显碱性,滴有酚酞的水溶液会变红色,因此,该性质与喷泉实验有关,故不符合题意,故选A。
17.AB 检查装置气密性 变浑浊 变红 NH4HCO3 NH3 +H2O+CO2 1.7 14.0% 79.0%
【详解】
根据包装袋上的部分说明“防潮防晒”可知,碳酸氢铵易溶于水,受热易分解,故选AB;
①为防止装置漏气,用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是:检查装置的气密性;
②碳酸氢铵受热分解生成氨气、二氧化碳和水,二氧化碳能使澄清石灰水变浑浊, B中的现象是澄清石灰水变浑浊;
③碳酸氢铵受热分解生成氨气、二氧化碳和水,无色酚酞遇碱变红色。取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是无色酚酞试液变红;
④碳酸氢铵受热分解生成氨气、二氧化碳和水,发生反应的化学表达式是NH4HCO3 NH3 +H2O+CO2;
⑤碱石灰能吸收水和二氧化碳,浓硫酸和氨气反应生成硫酸铵,所以实验后D装置增加的质量就是氨气的质量,所以氨气的质量为151.7g-150g=1.7g;
⑥化肥含氮元素质量分数=;
⑦10g样品中氮元素的质量=10g×14%=1.4g,碳酸氢铵质量=;此化肥中碳酸氢铵的质量分数=。
18.元素 吸附 煮沸 C 70% FeO 检验装置气密性 溶液紫色褪去,同时有气泡产生 溶液由无色变为红色,同时有气泡产生 1.7 17.5% 82.5% 25
【详解】
(1)生活出现常用化学物质通常是宏观概念,这里碘就是指碘元素;
故答案为:元素。
(2)活性炭具有良好吸附性,可以去除色素和异味;
故答案为:吸附。
(3)可溶性的钙、镁化合物,可以在高温条件反应生成难溶性的钙、镁化合物析出,从而使水的硬度降低,因此可以通过煮沸的方法降低水的硬度;
故答案为:煮沸。
(4)A、食物变质,说明内部发生了化学反应,生成了新物质,化学反应实质是分子发生变化重新结合生成新的分子,选项A正确;
B、物质不同是因为其分子构成不同,分子是保持物质化学性质最小微粒,所以一氧化碳有毒而二氧化碳无毒,说明其分子构成不同,选项B正确;
C、水银受热膨胀,主要使内部原子间隔变大,不是原子大小发生变化,选项C错误;
D、温度升高,分子运动速率加快,水分子加快挥发,所以太阳底下温度,衣服干的快,选项D正确;
故答案为:C。
(5)铁元素质量分数=;
故答案为:70%。
(6)铁原子个数:氧原子个数=;所以物质化学式为FeO;
故答案为:FeO。
(7)反应过程中有有气体生成,为了避免气体泄漏,必须检验装置气密性;
故答案为:检验装置气密性。
(8)气体经过浓硫酸后水蒸气和氨气被吸收,二氧化硫和氧气进入高锰酸钾中,此时溶液为中性,二氧化硫与高锰酸钾反应,则高锰酸钾被消耗,溶液紫色褪去,另外氧气不溶于水,形成气泡,所以可看到溶液紫色褪去,同时有气泡产生;
故答案为:溶液紫色褪去,同时有气泡产生。
(9)气体经过B水和二氧化硫被吸收,然后氨气和氧气进入E中,氨气溶于水形成氨水,溶液显碱性,在酚酞溶液中遇到碱性溶液,溶液变为红色,氧气不易溶于水,会形成气泡逸出,因此还会看到气泡;
故答案为:溶液由无色变为红色,同时有气泡产生。
(10)根据实验现象可知,硫酸铵加热反应生成了水、氨气、二氧化硫和氧气,书写化学方程式需要配平及气体符号,所以该反应化学方程式为;
故答案为:。
(11)根据质量守恒定律,C吸收只有氨气质量,所以此时氨气质量=126.7g-125g=1.7g;
故答案为:1.7。
(12)氨气中氮元素质量就是化肥中氮元素质量,氮元素质量=1.7g=1.4g,所以化肥中氮元素质量分数=;
故答案为:17.5%。
(13)设硫酸铵质量为m,
m=6.6g;
所以化肥中硫酸铵纯度=;
故答案为:82.5%。
(14)根据质量守恒定律,化肥中氮元素质量=50kg×17.5%=8.75kg,所以硝酸铵中氮元素质量也为8.75kg,设硝酸铵质量为x,
x=8.75kg
x=25kg
故答案为:25。
19.活性炭 D pH试纸(或pH计) 在水中加入肥皂水,搅拌,如泡沫较少(或没有)、浮渍较多则为硬水,否则为软水 水是溶剂 水将集气瓶内的空气排净,便于观察氢气何时收集满 吸收生成二氧化硫 防止溅落的熔化物炸裂瓶底 提供热量,隔绝氧气 D C
【详解】
(1)①活性炭可以吸附色素和异味,故填:活性炭。
②水应澄清透明,不得含有细菌的病毒。可通过粗砂过滤、细沙过滤、加入消毒剂三个过程而达到。故填:D。
③a.、测定液体的pH用pH试纸(或pH计),故填:pH试纸(或pH计)。
b、在水中加入肥皂水,搅拌,如泡沫较少(或没有)、浮渍较多则为硬水,否则为软水。
(2)根据图示,水的作用分别是:
甲:水是溶剂;乙:水将集气瓶内的空气排净,便于观察氢气何时收集满;丙:吸收生成二氧化硫;丁:防止溅落的熔化物炸裂瓶底;戊:提供热量,隔绝氧气。
(3)水具有的重要的化学性质,其化学方程式为:
①;②;③。
(4)
A、水的分解反应需要吸收能量如电能,故正确;
B、燃料电池将氢能转化为电能,故正确;
C、制取氢能比较理想的方法是在阳光照射条件下用催化剂来分解水,故正确;
D、理想的氢元素循环可以通过化学变化来实现,故不正确。
故选D
(5)
A、人类目前已经可以制取氢气,但氢气没有广泛利用;
B、氢气燃烧后的产物是水,不会污染环境;
C、氢气燃烧时火焰呈淡蓝色,不易观察到明显的现象;
D、氢气燃烧时不一定会发生爆炸。
故选C
20.乳化 活性炭 CH3COOH 2CO + O2 2CO2 硝酸钾 Ca2+ 酸性 5370
【详解】
(1)①洗涤剂清洗餐具上的油污是将油污分解成小的油滴,被水冲走,利用了乳化原理,所以说明洗涤剂具有乳化的功能;
②竹子可加工成具有吸附作用的物质,其作用与实验室中常用的活性炭相似,可用于填充防毒面具,吸附空气中的有毒气体;
③厨房中常用的调味品,能用来除水垢的酸是醋酸,化学式为:CH3COOH;
④一氧化碳和氧气点燃生成二氧化碳,化学反应方程式为:2CO + O2 2CO2;
(2)①含有氮、磷、钾三种营养元素中的两种或两种以上的化学肥料称为复合肥料,硝酸钾中含有氮元素、钾元素两种营养元素,属于复合肥料;
②该营养液中存在的一种金属离子有钙离子、钾离子和镁离子;根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略所以钙离子表示为:Ca2+;
③PH<7,显酸性,故某硫酸铵溶液pH=4.5,则硫酸铵溶液显酸性;
④配制10升该营养液,需要硫酸钾的质量为:537毫克×10=5370毫克。
21.
(1)B
(2)有气泡产生
(3)
(4)取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质
(5) 29.3% 氢氧化钙 过滤
【分析】
证明氢氧化钠变质,实质是考查碳酸钠的化学性质,可以选择足量酸、氢氧化钙(或者氢氧化钡)、氯化钙(或者硝酸钙、硝酸钡、氯化钡),分别会生成气体、产生沉淀、产生沉淀,但不能根据酸碱性来验证氢氧化钠是否变质;但要检验碳酸钠、氢氧化钠同时存在时,则要先选择足量的钙盐溶液或者钡盐溶液验证并除尽碳酸钠,再用酚酞来检验氢氧化钠。
(1)
氢氧化钠变质,是氢氧化钠与二氧化碳反应生成碳酸钠和水,氢氧化钠溶液、碳酸钠溶液都显碱性,都可以使酚酞试液变红,故B不能达到实验目的;
(2)
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,故实验A中,观察到有气泡产生则说明氢氧化钠已变质;
(3)
实验D中若生成白色沉淀则能证明氢氧化钠变质,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,化学方程式为:;
(4)
要证明该氢氧化钠部分变质,取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质;
(5)
①根据质量守恒定律可得,生成的碳酸钡的质量为105g+65g-150. 3g=19. 7g;设样品中碳酸钠的质量为x
解得x=10. 6g
样品中氢氧化钠的质量为15g-10. 6g=4. 4g
样品中氢氧化钠的质量分数为:;
②氢氧化钠变质生成碳酸钠,除去碳酸根离子可以用钙离子,不能引入新的杂质,所以应该选用氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以可以将样品溶于水后滴加适量的氢氧化钙溶液,充分反应后过滤。
22.2KMnO4△K2MnO4+MnO2+O2↑ 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰; 变小 NaAlO2 漏斗和玻璃棒 ①③ MnO2
【详解】
(1)根据高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气解答;根据稀硫酸能与锰酸钾反应生成二氧化锰解答;(2)根据硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰解答;(3)根据题中信息分析解答;(4)根据过滤操作需要用到的仪器解答;(5)根据反应的化学方程式分析解答;(6)根据氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰解答;(7)根据图中信息计算解答。(1)高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;根据信息提示“3K2MnO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+H2O”,将反应后的固体剩余物(锰酸钾和二氧化锰的混合物)用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,使锰酸钾转化得到二氧化锰,获得更多的二氧化锰,所以用稀硫酸而不用水浸取;;(2)硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰,反应的化学方程式为2H2O+MnSO4H2↑+H2SO4+MnO2↓,由于水越来越少,硫酸越来越多,也就是酸的质量分数变大,所以酸性越来越强,而pH越来越小,所以一段时间后溶液的pH将变小;(3)滤液中存在可溶性物质,而废旧锂电池正极材料和氢氧化钠溶液反应,根据信息“2Al+2NaOH+2H2O═2NaAlO2+3H2↑”,可知生成了偏铝酸钠,所以溶质的主要成分是NaAlO2;(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和玻璃棒;(5)MnO2与碳粉经下列三步反应制得纳米MnO2:①2MnO2+C2MnO+CO2↑,有单质参与反应,所以有化合价改变;②MnO+H2SO4═MnSO4+H2O,为复分解反应,无化合价改变;③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4,硫酸锰中的锰元素有+2变化+4价,而高锰酸钾中的锰元素由+7价变为+4价,所以有化合价的改变,故选①③;(6)氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰,反应的化学方程式为 O2+2MnCO32CO2+2MnO2;(7)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示,样品100g在图中A点对应固体的质量为75.65g,而过程中锰元素的质量不变,100g碳酸锰中锰元素的质量为100g×,则A点物质含氧元素的质量为75.65g-100g×,在固体中锰原子和氧原子个数比为:=1:2则固体成分的化学式为MnO2。
一、选择题(共16题)
1.下列实验操作不正确的是( )
A.量筒读数 B.测溶液的酸碱度
C.点燃酒精灯 D.铁丝在氧气中燃烧
2.下列实验操作正确的是
A.测定溶液pH
B.验满CO2
C.熄灭酒精灯
D.倾倒液体
3.下列实验操作中,正确的是( )
A.过滤操作 B.倾倒液体
C.验满二氧化碳 D.测定溶液的pH
4.在微酸性土壤中,不适宜种植的植物是 (括号内为植物适宜生长的pH)( )
A.花生(5.0﹣6.0) B.苹果(5.0﹣6.5)
C.西瓜(6.0﹣7.0) D.沙枣(8.0﹣8.7)
5.已知部分农作物适宜生长的pH如表所示:
农作物
油菜
水稻
茶树
甘草
适宜生长的pH
5.8﹣6.7
6.0﹣7.0
5.0﹣5.5
7.2﹣8.5
经检测,邵阳地区的土壤呈弱酸性,在邵阳地区不适宜种植的农作物是( )
A.油菜 B.水稻 C.茶树 D.甘草
6.下列溶液中酸性最强的是
A.PH=10 B.PH=7 C.PH=1 D.PH=0
7.下列实验现象的描述中,错误的是
A.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
B.木炭还原氧化铜,红色固体变黑,澄清石灰水变浑浊
C.电解水时正极和负极产生气体的体积之比为1:2
D.向石蕊溶液中滴加稀硫酸后,溶液由紫色变成红色
8.下列有关化学实验现象的描述中,不正确的是
A.将玻璃片放在蜡烛火焰稍上方,玻璃片被熏黑了
B.湿润的有酚酞的滤纸靠近浓氨水,滤纸变红了
C.铁丝在氧气中剧烈燃烧生成了四氧化三铁
D.在酒精灯上加热铝片一会儿,铝片熔而不滴
9.欲使 pH=8 的溶液变为 pH=5 的溶液,可加入的物质( )
A.蒸馏水 B.氢氧化钠 C.稀硫酸 D.氯化钠溶液
10.将下列物质加入水中,所得溶液的pH可能为8的是
A.生石灰 B.柠檬酸
C.白醋 D.食盐
11.下列排序正确的是
A.空气中气体含量:
B.常见溶液的pH:
C.氯元素的化合价:
D.氮元素的质量分数:
12.以下实验操作不正确的是
A.闻气体气味 B.稀释浓硫酸
C.测定溶液pH值 D.干燥NH3气体
13.下列实验方法无法达到实验目的的是
A.用肥皂水鉴别硬水和软水
B.用适量氯化钙溶液除去氢氧化钠中混有的少量碳酸钠
C.可用水鉴别氢氧化钠和硝酸铵两种白色固体
D.用紫色石蕊试液鉴别稀硫酸和蒸馏水
14.中考复习阶段,某同学梳理了以下知识:①纯碱属于碱;②干冰不是冰;③合金属于合成材料;④pH<7的溶液一定显酸性;⑤100g质量分数为10%的稀盐酸蒸发掉50g的水后可以得到20%的盐酸溶液;⑥浓硫酸能使纸张、木材变黑,是因为浓硫酸有吸水性。上面说法正确的是
A.①②④ B.③⑥ C.④⑥ D.②④
15.如图所示的实验操作中,正确的是( )
A. 制备和检验氢气的可燃性B. 向试管中倾倒液体试剂
C. 蒸发食盐水
D. 测定溶液的pH
16.图中喷泉实验的现象与下列性质不相关的是
A.氨气密度比空气小
B.氨气易溶于水
C.氨气能与水反应
D.氨水显碱性
二、综合题(共6题)
17.如图是化肥碳酸氢铵包装袋上的部分说明,可推测碳酸氢铵具有的性质有 _______ (填字母)。
A.易溶于水 B.受热易分解
某同学提出疑问“这种化肥含氮量是否达到16%,化肥中碳酸氢铵的质量分数是多少?”
带着这些问题,该同学进入实验室完成了下列实验。
(查找资料)
①碱石灰能够吸收水和CO2,但是不吸收NH3
②浓硫酸能吸收NH3但是不吸收CO2
③氨气溶于水形成氨水
(性质探究)该同学设计了如下的实验装置:
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是 _____ 。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,观察到B中的现象是 ________ 。
③再取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是 __________ 。
④碳酸氢铵在受热时发生反应的化学表达式是 _______ 。
(含量分析)将装置A、C、D依次连接,加入10g化肥样品,加热至A中固体完全消失。称量装置D的质量如表 (各装置对气体吸收是完全的) :
实验前D装置的质量 150.0g
实验后D装置的质量 151.7g
⑤由此分析得知:反应中产生氨气的质量为 __________ g。
⑥通过反应的化学表达式可知:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥中氮元素的质量分数为 __________ (结果保留到0.1%)。
⑦此化肥中碳酸氢铵的质量分数为 __________ (结果保留到0.1%)。
18.化学就在我们身边
(一)在厨房里蕴藏着许多化学知识。
(1)加碘食盐中的“碘”是指______(填“元素”或“原子”)。
(2)“直饮水”机采用“活性炭+超滤层+煮沸”净水工艺,活性炭在此起______作用。
(3)多喝硬水易得白内障,生活中硬水要通过______降低硬度后才能喝。
(4)从微粒的角度分析,下列对生活中的事实解释错误的是______。
选项 事实 解释
A 食物变质 分子本身发生了变化
B CO(煤气)有毒而CO2无毒 两种物质的分子构成不同
C 温度计中的水银(汞)热胀冷缩 原子的大小发生改变
D 湿衣服晾在太阳底下干得快 分子运动速率随温度升高而增大
(二)食品中的化学
双吸剂(铁粉)在干燥食品的过程中可能会生成FeO、Fe3O4、Fe2O3。现测定了两组样品,获得了如下数据。
样品 样品质量/克 铁元素的质量/克 氧元素的质量/克
1 7.00 4.90 2.10
2 7.20 5.60 1.60
(5)样品1中铁元素的质量分数为______。
(6)样品2的化学式是_____。
(三)农业生产中的化学
有一化肥硫酸铵包装袋上标有含氮量20%的说明,同学们产生了疑问,取了化肥样品,进入实验室。
(查找资料)①碱石灰能吸收水和SO2,但不吸收NH3。浓硫酸能吸收NH3但不吸收SO2和O2。
②硫酸铵加热时生成O2和另外三种气体。
③氨气溶于水形成氨水
(性质探究)该同学设计了如下的实验装置:
(7)用A装置给硫酸铵加热,试管口有水珠。装药品前,必须进行的一步操作是____。
(8)取适量硫酸铵加入试管,连接A、C、D装置,加热,D中的现象是_____。
(9)取适量硫酸铵加入试管,连接A、B、E装置,加热,E中的现象是____。
(10)硫酸铵在受热时发生反应的化学方程式是____。
(含量分析)将装置A、B、C依次连接,加入8g化肥样品,加热至A中固体完全消失。称量装置C的质量如表:
实验前C装置的质量 125g
实验后C装置的质量 126.7g
(11)由此分析得知:反应中产生氨气的质量为____g。
(12)假设杂质中不含氮元素,请计算此化肥含氮元素质量分数为_____。
(13)请计算此化肥中硫酸铵的纯度_____。
(14)50kg该样品中的氮元素质量与______kgNH4NO3中的氮元素质量相当。
19.水是生命之源,万物之基,是人类最宝贵的自然资源。唤起人们保护水资源、节约用水的意识是十分有必要的。
(1)我国规定水质必须在感官性指标、化学指标、病理学指标等方面达标后方可成为生活饮用水。各种指标的主要要求为a. 不得呈现异色,b. 不得有异味,c. 水应澄清透明,d. 不得含有细菌的病毒。
①前两个指标可以利用_____(填物质名称)的吸附作用而达到。
②某山区自来水厂生产自来水的过程如图(1)所示。由图(1)可知净化水时,c,d两个指标可通过图中的B,C,_____过程而达到。
③化学指标中含有液体的pH和硬度两项,则a. 测定液体的pH用_____。
b. 日常生活中如何区分硬水与软水?请简述实验步骤与现象:_____。
(2)许多化学实验中都用到水,请指出图(2)所示实验中水的作用。
甲:_____;乙:_____;丙:_____;丁:_____;戊:_____。
(3)水既普通又宝贵,请你用化学方程式归纳水具有的重要的化学性质(举任意三例)。
①_____;②_____;③_____。
(4)图(3)是理想的氢元素循环示意图,下列说法不正确的是(______)
A 水的分解反应需要吸收能量
B 燃料电池将氢能转化为电能
C 制取氢能比较理想的方法是在阳光照射条件下用催化剂来分解水
D 理想的氢元素循环可以通过物理变化来实现
(5)某次奥运会上火炬使用的燃料是丙烷(C3H6)而不是氢气,其原因可能是(______)。
A 人类目前还无法制取氢气
B 氢气燃烧后的产物会污染环境
C 氢气燃烧时火焰呈淡蓝色,不易观察到明显的现象
D 氢气燃烧时一定会发生爆炸
20.化学就在我们身边,它与我们的生活息息相关。
(1)“化学——我们的生活,我们的未来”。
①我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 __________功能。
②竹子可加工成具有吸附作用的物质,其作用与____________(填物质名称)相似。
③厨房中常用的调味品,能用来除水垢的酸_________________(填化学式)。
④城市生活中常用气体燃料煤气中含有毒气体一氧化碳,其燃烧的反应的化学方程式:__________。
(2)无土栽培是利用营养液栽培作物的一种方法.以下是栽培绿叶菜营养液配方。
肥料成分 用量(毫克/升)
硝酸钙 1260
硝酸钾 255
磷酸二氢钠 350
硫酸镁 537
硫酸铵 235
①肥料成份中属于复合肥的是_____________。
②该营养液中存在的一种阳离子的符号_____。
③某硫酸铵溶液pH=4.5,则硫酸铵溶液显_________(填“酸性”、“碱性”或“中性”)。
④若在实验里配制10升该营养液,需要称取的硫酸镁的质量是____________毫克。
21.兴趣小组的同学为探究在空气中久置的某氢氧化钠样品是否变质,设计了如下图所示的A、B、C、D四组探究实验。
(查阅资料)氯化钙、氯化钡溶液都呈中性。
(实验探究)取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示:
(分析与结论)
(1)上述四组实验中不能达到实验目的的是______(填字母序号)。
(2)实验A中,观察到______的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是______。
(4)要证明该氢氧化钠部分变质,请写出实验步骤、可能的现象及相关推理________。
(5)若实验证明氢氧化钠部分变质,为测定其中氢氧化钠的质量分数,该同学采用沉淀法进行如下操作:①取15g样品于烧杯中,加入足量水配成溶液;②在样品溶液中加入足量的氯化钡溶液;③待反应完全后,过滤。有关数据如表:
反应前 反应后
烧杯和样品溶液总质量/g 加入氯化钡溶液质量/g 过滤后烧杯和溶液总质量/g(不计滤液损失)
105 65 150.3
请回答下列问题:
①原样品中氢氧化钠的质量分数是______(保留到0.1%)
②另取样品溶于水,若要除去杂质获取氢氧化钠溶液,可以向其中加入______溶液,然后______(填操作名称)即可。
22.二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O, K2MnO4易溶于水
(1)实验室加热高锰酸钾制氧气,反应的化学方程式为_____。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是____。
Ⅱ.用硫酸锰制备
(2)电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为_____,一段时间后溶液的pH将________(填“变大”、“变小”或“不变”)。
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:
请回答下列问题:
(3)“滤液”中溶质的主要成分是_________(填化学式)。
(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、_______和_________。
(5) MnO2与碳粉经下列三步反应制得纳米MnO2:
①②MnO+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有___________(填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:
(6)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式
(7) MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如上图所示。图中A点(300, 75.65)对应固体成分的化学式为____________。
参考答案
1.B
【详解】
A、量筒读数时,应平视凹液面的最低处,选项正确;
B、测溶液的酸碱度的方法:用玻璃棒蘸取或用胶头滴管吸取待测液,滴在试纸上,呈现一定的颜色,然后和标准比色卡比较,读取pH,将试纸伸入待测液中会污染试剂,选项错误;
C、点燃酒精灯,应该用火柴点燃,用燃着的酒精灯引燃另一只,易引发灯内酒精着火,甚至酒精灯爆炸,选项正确;
D、铁丝在氧气中燃烧,火星四射,放出大量的热,为避免集气瓶炸裂,常在集气瓶内放少量的水或细沙,选项正确。
故选B。
2.C
【详解】
A、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH。不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误,不符合题意;
B、检验氧气是否收集满时,应将带火星的木条放在集气瓶口,不能伸入瓶中,图中所示操作错误,不符合题意;
C、使用酒精灯时要注意“两查、两禁、一不可”,熄灭酒精灯时,不能用嘴吹灭酒精灯,应用灯帽盖灭,图中所示操作正确,符合题意;
D、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中瓶口没有紧挨、瓶塞没有倒放、标签没有向着手心,所示操作错误,不符合题意。
故选:C。
3.A
【详解】
A、过滤操作,一贴、二低、三靠,操作正确;
B、倾倒液体时瓶口要紧挨试管口,试管要倾斜,瓶塞要倒放,操作错误;
C、验满时要把木条放在瓶口,不能伸入瓶内,操作错误;
D、pH试纸不能伸入待测液中,操作错误。
故选A 。
4.D
【详解】
A、花生最适宜的土壤为微酸性,适宜该地区的种植;选项A不正确;
B、苹果最适宜的土壤为酸性,适宜该地区的种植;选项B不正确;
C、西瓜最适宜的土壤为微酸性,适宜该地区的种植;选项C不正确;
D、沙枣最适宜的土壤为弱碱性,不适宜该地区的种植;选项D正确;
故选D。
5.D
【详解】
油菜、水稻、茶树等适宜在pH小于7,即显酸性的土壤中生长;甘草适宜在pH大于7,即显碱性的土壤中生长。邵阳地区土壤呈弱酸性,最不适宜种植的农作物是甘草。故选D。
6.D
【详解】
常见溶液的pH范围为0~14,酸性溶液的pH<7,pH越小酸性越强,其中D选项的pH最小,酸性最强。
故选:D。
7.B
【详解】
A、铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故A正确;
B、木炭还原氧化铜生成铜和二氧化碳,则黑色固体变红,澄清石灰水变浑浊,故B不正确;
C、电解水时,可观察到:与电源正极相连的试管内产生的气体体积少,与电源负极相连的试管内的气体体积多;且两者的体积之比大约是1:2,故C正确;
D、向石蕊溶液中滴加稀硫酸后,稀硫酸显酸性,溶液由紫色变成红色,故D正确。故选B。
8.C
【详解】
试题分析∶A.将玻璃片放在蜡烛火焰稍上方,玻璃片被熏黑了。故A正确。B.湿润的有酚酞的滤纸靠近浓氨水,滤纸变红了。故B正确。C.铁丝在氧气中剧烈燃烧生成了黑色固体。故C错误。D.在酒精灯上加热铝片一会儿,铝片熔而不滴。故D正确。
9.C
【详解】
A、pH=8的溶液显碱性,加入蒸馏水, pH会逐渐减小至无限接近于7,但是不会小于7,不符合题意;
B、pH=8的溶液显碱性,加入氢氧化钠,pH还是大于7,不符合题意;
C、pH=8的溶液显碱性,加入稀硫酸,能使溶液变为pH=5,符合题意;
D、pH=8的溶液显碱性,氯化钠溶液显中性,加入氯化钠溶液,能使pH减小,但是不会小于7,不符合题意。
故选C。
10.A
【详解】
试题分析:A、生石灰与水反应生成氢氧化钙,氢氧化钙的水溶液显碱性,pH大于7,所得溶液pH可能为8,故选项正确.B、柠檬酸显酸性,pH小于7,所得溶液pH不可能为8,故选项错误.C、白醋显酸性,pH小于7,所得溶液pH不可能为8,故选项错误.D、食盐的水溶液显中性,pH等于7,所得溶液pH不可能为8,故选项错误.故选A
11.C
【详解】
A、空气中物质含量的多少为氮气>氧气>二氧化碳,与数轴关系不一致,因此表示的关系是错误的;
B、肥皂水呈碱性,pH>7;蒸馏水呈中性,pH=7;柠檬水呈酸性,pH<7,与数轴关系不一致,因此表示的关系是错误的;
C、利用单质中元素化合价为零,化合物中化合价代数和为零的原则,根据钠元素为+1价、氧元素为-2价,可得氯气中氯元素化合价为零,次氯酸钠中氯元素为-+1价,氯化钠中氯元素为-1价,与数轴关系一致,因此表示的关系是正确的;
D、NO可看做,可看做,则氮元素的质量分数:,因此表示的关系是错误的;
故选:C。
12.D
【详解】
A、闻气体气味,应用手在瓶口轻轻扇动,使少量气味飘进鼻孔中,不能凑到瓶口去闻,图中操作正确,不符合题意;
B、稀释浓硫酸:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌,使热量尽快散发出去,图中操作正确,不符合题意;
C、测定溶液的pH值:用洁净、干燥的玻璃棒蘸取待测液点在pH试纸上,观察颜色的变化,然后与标准比色卡对照,图中操作正确,不符合题意;
D、浓硫酸具有吸水性,但是浓硫酸能与氨气发生反应,不能用浓硫酸干燥氨气,符合题意。
故选D。
13.B
【解析】
试题分析:A、用肥皂水鉴别硬水和软水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水,可以达到目的,B、除杂质要注意不能引入新的杂质,用适量氯化钙溶液除去氢氧化钠中混有的少量碳酸钠,发生反应:CaCl2+Na2CO3==CaCO3↓+2NaCl,形成新的杂质NaCl,错误,C、氢氧化钠溶于水放热,使温度升高,硝酸铵溶于水吸热,使温度降低,故可可用水鉴别氢氧化钠和硝酸铵两种白色固体,D、紫色石蕊试液遇酸变红,遇碱变蓝,在中性溶液中不变色,所以可用紫色石蕊试液鉴别稀硫酸和蒸馏水,故选B
14.D
【详解】
①纯碱是碳酸钠,是由金属阳离子和酸根阴离子构成的化合物,属于盐,错误;
②干冰不是冰是二氧化碳,正确;
③合金和纯金属都属于金属材料,错误;
④pH>7显碱性,pH=7显中性,pH<7显酸性,正确;
⑤盐酸具有挥发性,100g质量分数为10%的稀盐酸蒸发掉50g的水后,溶质氯化氢也会挥发,故不可以得到20%的盐酸溶液,错误;
⑥浓硫酸能使纸张、木材变黑,是因为浓硫酸有脱水性,错误。
故选D。
15.D
【解析】
试题分析:A、点燃H2前必须验纯,以防爆炸,故错误;B、往试管内倾倒液体时,试管要略微倾斜,瓶口紧挨着试管口倾倒,避免液体溅出。故错误;C、蒸发时为防止局部过热造成液滴飞溅,要用玻璃棒搅拌,故错误;D、pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值,故正确。答案:D。
16.A
【详解】
A、氨气溶解于水的喷泉实验无法证明氨气的密度与空气的关系,因此,该性质与喷泉实验无关,故符合题意;
B、因氨气极易溶解于水,烧瓶内压强减小,烧杯中水面上升形成喷泉,因此,该性质与喷泉实验有关,故不符合题意;
C、氨气能与水反应生成氨水,氨水显碱性,滴有酚酞的水溶液会变红色,因此,该性质与喷泉实验有关,故不符合题意;
D、氨水显碱性,滴有酚酞的水溶液会变红色,因此,该性质与喷泉实验有关,故不符合题意,故选A。
17.AB 检查装置气密性 变浑浊 变红 NH4HCO3 NH3 +H2O+CO2 1.7 14.0% 79.0%
【详解】
根据包装袋上的部分说明“防潮防晒”可知,碳酸氢铵易溶于水,受热易分解,故选AB;
①为防止装置漏气,用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是:检查装置的气密性;
②碳酸氢铵受热分解生成氨气、二氧化碳和水,二氧化碳能使澄清石灰水变浑浊, B中的现象是澄清石灰水变浑浊;
③碳酸氢铵受热分解生成氨气、二氧化碳和水,无色酚酞遇碱变红色。取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是无色酚酞试液变红;
④碳酸氢铵受热分解生成氨气、二氧化碳和水,发生反应的化学表达式是NH4HCO3 NH3 +H2O+CO2;
⑤碱石灰能吸收水和二氧化碳,浓硫酸和氨气反应生成硫酸铵,所以实验后D装置增加的质量就是氨气的质量,所以氨气的质量为151.7g-150g=1.7g;
⑥化肥含氮元素质量分数=;
⑦10g样品中氮元素的质量=10g×14%=1.4g,碳酸氢铵质量=;此化肥中碳酸氢铵的质量分数=。
18.元素 吸附 煮沸 C 70% FeO 检验装置气密性 溶液紫色褪去,同时有气泡产生 溶液由无色变为红色,同时有气泡产生 1.7 17.5% 82.5% 25
【详解】
(1)生活出现常用化学物质通常是宏观概念,这里碘就是指碘元素;
故答案为:元素。
(2)活性炭具有良好吸附性,可以去除色素和异味;
故答案为:吸附。
(3)可溶性的钙、镁化合物,可以在高温条件反应生成难溶性的钙、镁化合物析出,从而使水的硬度降低,因此可以通过煮沸的方法降低水的硬度;
故答案为:煮沸。
(4)A、食物变质,说明内部发生了化学反应,生成了新物质,化学反应实质是分子发生变化重新结合生成新的分子,选项A正确;
B、物质不同是因为其分子构成不同,分子是保持物质化学性质最小微粒,所以一氧化碳有毒而二氧化碳无毒,说明其分子构成不同,选项B正确;
C、水银受热膨胀,主要使内部原子间隔变大,不是原子大小发生变化,选项C错误;
D、温度升高,分子运动速率加快,水分子加快挥发,所以太阳底下温度,衣服干的快,选项D正确;
故答案为:C。
(5)铁元素质量分数=;
故答案为:70%。
(6)铁原子个数:氧原子个数=;所以物质化学式为FeO;
故答案为:FeO。
(7)反应过程中有有气体生成,为了避免气体泄漏,必须检验装置气密性;
故答案为:检验装置气密性。
(8)气体经过浓硫酸后水蒸气和氨气被吸收,二氧化硫和氧气进入高锰酸钾中,此时溶液为中性,二氧化硫与高锰酸钾反应,则高锰酸钾被消耗,溶液紫色褪去,另外氧气不溶于水,形成气泡,所以可看到溶液紫色褪去,同时有气泡产生;
故答案为:溶液紫色褪去,同时有气泡产生。
(9)气体经过B水和二氧化硫被吸收,然后氨气和氧气进入E中,氨气溶于水形成氨水,溶液显碱性,在酚酞溶液中遇到碱性溶液,溶液变为红色,氧气不易溶于水,会形成气泡逸出,因此还会看到气泡;
故答案为:溶液由无色变为红色,同时有气泡产生。
(10)根据实验现象可知,硫酸铵加热反应生成了水、氨气、二氧化硫和氧气,书写化学方程式需要配平及气体符号,所以该反应化学方程式为;
故答案为:。
(11)根据质量守恒定律,C吸收只有氨气质量,所以此时氨气质量=126.7g-125g=1.7g;
故答案为:1.7。
(12)氨气中氮元素质量就是化肥中氮元素质量,氮元素质量=1.7g=1.4g,所以化肥中氮元素质量分数=;
故答案为:17.5%。
(13)设硫酸铵质量为m,
m=6.6g;
所以化肥中硫酸铵纯度=;
故答案为:82.5%。
(14)根据质量守恒定律,化肥中氮元素质量=50kg×17.5%=8.75kg,所以硝酸铵中氮元素质量也为8.75kg,设硝酸铵质量为x,
x=8.75kg
x=25kg
故答案为:25。
19.活性炭 D pH试纸(或pH计) 在水中加入肥皂水,搅拌,如泡沫较少(或没有)、浮渍较多则为硬水,否则为软水 水是溶剂 水将集气瓶内的空气排净,便于观察氢气何时收集满 吸收生成二氧化硫 防止溅落的熔化物炸裂瓶底 提供热量,隔绝氧气 D C
【详解】
(1)①活性炭可以吸附色素和异味,故填:活性炭。
②水应澄清透明,不得含有细菌的病毒。可通过粗砂过滤、细沙过滤、加入消毒剂三个过程而达到。故填:D。
③a.、测定液体的pH用pH试纸(或pH计),故填:pH试纸(或pH计)。
b、在水中加入肥皂水,搅拌,如泡沫较少(或没有)、浮渍较多则为硬水,否则为软水。
(2)根据图示,水的作用分别是:
甲:水是溶剂;乙:水将集气瓶内的空气排净,便于观察氢气何时收集满;丙:吸收生成二氧化硫;丁:防止溅落的熔化物炸裂瓶底;戊:提供热量,隔绝氧气。
(3)水具有的重要的化学性质,其化学方程式为:
①;②;③。
(4)
A、水的分解反应需要吸收能量如电能,故正确;
B、燃料电池将氢能转化为电能,故正确;
C、制取氢能比较理想的方法是在阳光照射条件下用催化剂来分解水,故正确;
D、理想的氢元素循环可以通过化学变化来实现,故不正确。
故选D
(5)
A、人类目前已经可以制取氢气,但氢气没有广泛利用;
B、氢气燃烧后的产物是水,不会污染环境;
C、氢气燃烧时火焰呈淡蓝色,不易观察到明显的现象;
D、氢气燃烧时不一定会发生爆炸。
故选C
20.乳化 活性炭 CH3COOH 2CO + O2 2CO2 硝酸钾 Ca2+ 酸性 5370
【详解】
(1)①洗涤剂清洗餐具上的油污是将油污分解成小的油滴,被水冲走,利用了乳化原理,所以说明洗涤剂具有乳化的功能;
②竹子可加工成具有吸附作用的物质,其作用与实验室中常用的活性炭相似,可用于填充防毒面具,吸附空气中的有毒气体;
③厨房中常用的调味品,能用来除水垢的酸是醋酸,化学式为:CH3COOH;
④一氧化碳和氧气点燃生成二氧化碳,化学反应方程式为:2CO + O2 2CO2;
(2)①含有氮、磷、钾三种营养元素中的两种或两种以上的化学肥料称为复合肥料,硝酸钾中含有氮元素、钾元素两种营养元素,属于复合肥料;
②该营养液中存在的一种金属离子有钙离子、钾离子和镁离子;根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略所以钙离子表示为:Ca2+;
③PH<7,显酸性,故某硫酸铵溶液pH=4.5,则硫酸铵溶液显酸性;
④配制10升该营养液,需要硫酸钾的质量为:537毫克×10=5370毫克。
21.
(1)B
(2)有气泡产生
(3)
(4)取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质
(5) 29.3% 氢氧化钙 过滤
【分析】
证明氢氧化钠变质,实质是考查碳酸钠的化学性质,可以选择足量酸、氢氧化钙(或者氢氧化钡)、氯化钙(或者硝酸钙、硝酸钡、氯化钡),分别会生成气体、产生沉淀、产生沉淀,但不能根据酸碱性来验证氢氧化钠是否变质;但要检验碳酸钠、氢氧化钠同时存在时,则要先选择足量的钙盐溶液或者钡盐溶液验证并除尽碳酸钠,再用酚酞来检验氢氧化钠。
(1)
氢氧化钠变质,是氢氧化钠与二氧化碳反应生成碳酸钠和水,氢氧化钠溶液、碳酸钠溶液都显碱性,都可以使酚酞试液变红,故B不能达到实验目的;
(2)
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,故实验A中,观察到有气泡产生则说明氢氧化钠已变质;
(3)
实验D中若生成白色沉淀则能证明氢氧化钠变质,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,化学方程式为:;
(4)
要证明该氢氧化钠部分变质,取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质;
(5)
①根据质量守恒定律可得,生成的碳酸钡的质量为105g+65g-150. 3g=19. 7g;设样品中碳酸钠的质量为x
解得x=10. 6g
样品中氢氧化钠的质量为15g-10. 6g=4. 4g
样品中氢氧化钠的质量分数为:;
②氢氧化钠变质生成碳酸钠,除去碳酸根离子可以用钙离子,不能引入新的杂质,所以应该选用氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以可以将样品溶于水后滴加适量的氢氧化钙溶液,充分反应后过滤。
22.2KMnO4△K2MnO4+MnO2+O2↑ 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰; 变小 NaAlO2 漏斗和玻璃棒 ①③ MnO2
【详解】
(1)根据高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气解答;根据稀硫酸能与锰酸钾反应生成二氧化锰解答;(2)根据硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰解答;(3)根据题中信息分析解答;(4)根据过滤操作需要用到的仪器解答;(5)根据反应的化学方程式分析解答;(6)根据氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰解答;(7)根据图中信息计算解答。(1)高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;根据信息提示“3K2MnO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+H2O”,将反应后的固体剩余物(锰酸钾和二氧化锰的混合物)用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,使锰酸钾转化得到二氧化锰,获得更多的二氧化锰,所以用稀硫酸而不用水浸取;;(2)硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰,反应的化学方程式为2H2O+MnSO4H2↑+H2SO4+MnO2↓,由于水越来越少,硫酸越来越多,也就是酸的质量分数变大,所以酸性越来越强,而pH越来越小,所以一段时间后溶液的pH将变小;(3)滤液中存在可溶性物质,而废旧锂电池正极材料和氢氧化钠溶液反应,根据信息“2Al+2NaOH+2H2O═2NaAlO2+3H2↑”,可知生成了偏铝酸钠,所以溶质的主要成分是NaAlO2;(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和玻璃棒;(5)MnO2与碳粉经下列三步反应制得纳米MnO2:①2MnO2+C2MnO+CO2↑,有单质参与反应,所以有化合价改变;②MnO+H2SO4═MnSO4+H2O,为复分解反应,无化合价改变;③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4,硫酸锰中的锰元素有+2变化+4价,而高锰酸钾中的锰元素由+7价变为+4价,所以有化合价的改变,故选①③;(6)氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰,反应的化学方程式为 O2+2MnCO32CO2+2MnO2;(7)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示,样品100g在图中A点对应固体的质量为75.65g,而过程中锰元素的质量不变,100g碳酸锰中锰元素的质量为100g×,则A点物质含氧元素的质量为75.65g-100g×,在固体中锰原子和氧原子个数比为:=1:2则固体成分的化学式为MnO2。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
