9.3钢铁的锈蚀与防护-2021-2022学年九年级化学鲁教版下册(word版含解析)
文档属性
| 名称 | 9.3钢铁的锈蚀与防护-2021-2022学年九年级化学鲁教版下册(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 266.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-02 22:18:35 | ||
图片预览




文档简介
9.3钢铁的锈蚀与防护
一、选择题(共16题)
1.马踏飞燕——中国青铜艺术奇葩,青铜乃铜锡合金,《天工开物》曾记载下列炼锡方法:SnO2 + 2C Sn + 2CO↑。上述变化属于
A.化合反应 B.置换反应
C.分解反应 D.物理变化
2.下列措施不能在一定程度上防止金属生锈的是( )
A.在金属表面涂油或刷漆
B.用砂纸擦去铝制品表面的氧化膜
C.制成耐腐蚀的合金
D.在金属表面镀上一层耐腐蚀的铬
3.下列关于资源的叙述不正确的是( )
A.地球上的金属资源中除金、银等有单质形式存在外,其余都以化合物形式存在
B.海水中含有80多种元素,是巨大的资源宝库
C.世界上铜的年产量已超过了铝,位于铁之后,居第二位
D.回收废电池既能节约金属资源,还能减少对环境的污染
4.下列属于厨余垃圾的是
A.旧电池 B.水果皮 C.旧书刊 D.易拉罐
5.能源和资源是人类生存和发展的基本条件,下列说法不正确的是
A.空气是一种宝贵的自然资源,其中氮气的体积分数约为
B.金属资源的回收利用不仅可以节约金属资源,还能减少对环境的污染
C.将煤隔绝空气加强热,可以得到焦炭、煤焦油、汽油等
D.因制取成本高和贮存困难,氢气作为燃料还未被广泛应用
6.等质量的氧化铁分别和碳和一氧化碳充分反应后,所得铁的质量为
A.一样多 B.CO还原出来的多
C.碳还原出来的多 D.不能确定
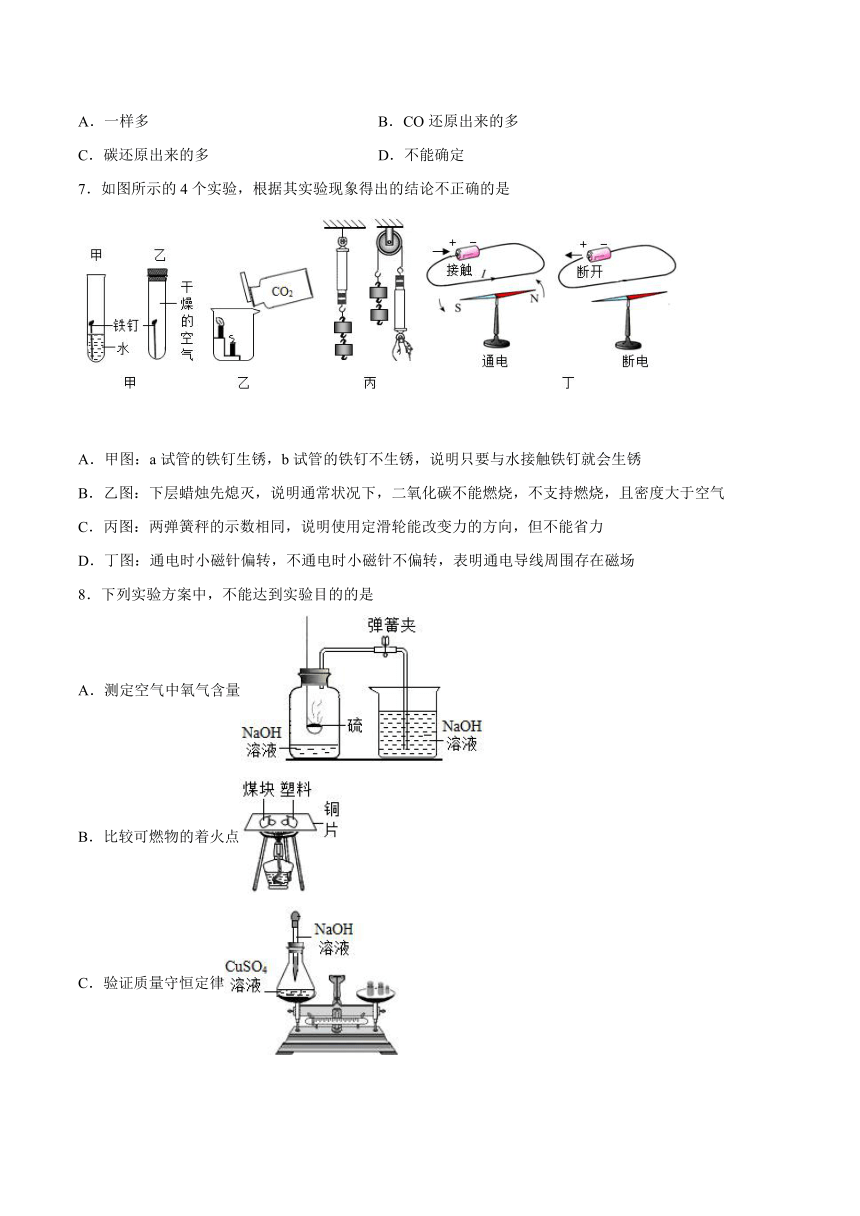
7.如图所示的4个实验,根据其实验现象得出的结论不正确的是
A.甲图:a试管的铁钉生锈,b试管的铁钉不生锈,说明只要与水接触铁钉就会生锈
B.乙图:下层蜡烛先熄灭,说明通常状况下,二氧化碳不能燃烧,不支持燃烧,且密度大于空气
C.丙图:两弹簧秤的示数相同,说明使用定滑轮能改变力的方向,但不能省力
D.丁图:通电时小磁针偏转,不通电时小磁针不偏转,表明通电导线周围存在磁场
8.下列实验方案中,不能达到实验目的的是
A.测定空气中氧气含量
B.比较可燃物的着火点
C.验证质量守恒定律
D.证明铁生锈是水和氧气共同作用的结果
9.在给定条件下,下列物质间的转化不能实现的是( )
A.KClO3O2 B.FeFe2O3
C.CuCl2FeCl3 D.CO2O2
10.下列物质用途主要体现物质化学性质的是( )
A.干冰用于人工降雨 B.氦气用于填充探空气球
C.铜丝用作导线 D.铁粉用作食品保鲜剂
11.下列关于O2、CO2的叙述,正确的是
A.O2的主要来源是植物的呼吸作用 B.O2、CO2中都含有氧分子
C.O2的存在能使自然界中的钢铁生锈 D.CO2能使干燥的蓝色石蕊试纸变红色
12.下列有关媒体的报道与化学知识不相违背的是( )
A.回收处理废旧电池,既可节约资源又可减少环境污染
B.某品牌饮品为绿色食品,不含任何化学物质
C.科研人员发明了一种特殊催化剂,可以将水变为汽油
D.有关部门利用明矾对饮用水进行消毒杀菌,从而解决灾民饮水难的问题
13.下列说法正确的是( )
A.硬水经过过滤后一定变成软水
B.构成物质的分子、原子和离子一定在不停的运动
C.化学反应中一定只有燃烧才能放出热量
D.铁制品与氧气或水接触一定会生锈
14.化学与生产、生活息息相关。下列说法正确的是
A.简易净水器净水过程中涉及化学变化
B.食盐可以作调味品,不可作食品防腐剂
C.我国矿产资源丰富,不需要回收利用废旧金属
D.氮气、生石灰在食品包装中均可防止食品变质
15.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
16.下列说法中正确的有
①单质由一种元素组成,由一种元素组成的纯净物一定是单质
②利用图1实验探究铁生锈的条件时,对比实验ac可证明铁生锈与水有关
③质量相同的金属A、B分别与相同质量、等质量分数的稀硫酸充分反应,生成氢气的质量与时间的关系如图2所示,当反应结束后,金属A和金属B至少有一种有剩余
④4.6g某有机物在氧气中充分燃烧,生成8.8 g二氧化碳和5.4 g水,则该有机物由碳元素和氢元素组成
A.1条 B.2条 C.3条 D.4条
二、综合题(共6题)
17.回答下列问题。
(1)下列物品中属于金属材料的是___________;(填序号)
A玻璃钢 B炒菜的铁锅 C 24K金项链 D塑料格尺 E金刚石
(2)波尔多也是农业上常用的杀菌剂,由硫酸铜、生石灰和水配制而成,用铁制容器配制波尔多液的过程中,没有涉及到的化学基本反应类型是___________;
(3)防止金属锈蚀是保护金属资源的有效途径之一、铁钉在下列情况下易生锈的是________。
A.在干燥的空气中
B.在潮湿的空气中
C.浸没在植物油中
D.浸入食盐水中
18.工业炼制是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来。
(1)通入空气使固态的焦炭转化为具有还原性的气态物质,转化过程中涉及的反应的化学方程式是①______________________________;②______________________________。
(2)赤铁矿(主要成分为Fe2O3)在高炉里反应生成单质铁的化学方程式是______________。
(3)某钢铁厂每天需消耗5000t含Fe2O3 80%的赤铁矿,该厂理论上可日产含铁98%的生铁的质量是__________t。(结果保留整数)
19.人类文明与社会进步同金属材料关系密切。
(一)金属的广泛应用
(1)连淮扬镇全线已开通,其高铁的机身采用铝合金材料,下列不属于该合金性质的是___________(填字母)。
A.熔点高 B.耐腐蚀 C.硬度大
(2)高铁机身通过受电弓滑板与沿线架设的3万伏高压输电线相连,这是利用了受电弓滑板的___________性(填“导电”或“导热”)。
(二)金属的锈蚀及防护
(3)“帘外芭蕉惹骤雨,门环惹铜绿。”铜绿是铜发生一系列复杂反应的产物,铜绿的主要成分的化学式是___________,空气中参与铜锈蚀反应过程的物质有___________(填化学式)。
(三)金属的冶炼
(4)工业炼铁的设备为___________,原料除了铁矿石、焦炭、空气外,还有___________;其中焦炭的作用是___________、___________。
(5)工业炼铁得到的产品是生铁,将生铁炼成钢的化学方程式为___________。
(6)化学兴趣小组的同学模仿工业炼铁的原理,在如图1所示装置中用CO还原CuO制取金属Cu。
①装置中气球的作用是___________。
②实验开始前,需要先通一段时间CO,然后开始加热,这样操作的目的是___________
③实验开始后现象是___________
④为确定反应的最佳温度,兴趣小组利用原位X射线粉末衍射仪来测定不同温度下反应4小时后的固体物质成分,实验结果如图2所示(该图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同),据图回答下列问题:
a、400℃时,反应的固体产物中含有Cu和___________。
b、500℃时,该反应的化学方程式为___________。
c、用CO还原CuO制取纯净的Cu,反应温度至少要控制在___________℃以上。
(7)取纯净的氧化铜160g放在玻璃管中,控制温度在上面③中所选的温度下实验,最终可制得铜的质量是___________(写出计算过程)
20.金属材料在生产、生活中的应用非常广泛,根据所学知识完成相关内容。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的_______(填字母)。
A.导电性 B.导热性 C.延展性
(2)金属锈蚀造成浪费。铁制品锈蚀的过程,实际上是铁与空气中的氧气、水发生化学反应的过程,写出一种防锈措施______________。
(3)目前世界上已有50%以上的废钢铁得到回收利用,其意义有__________(填字母)。
A.节约金属资源 B.合理开采矿物 C.减少废金属对环境的污染
(4)等质量的X、Y两种金属粉末分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示.下列说法中不正确的是_______(填字母)。
A.t1时,生成氢气的质量:X>Y
B.t2时,消耗金属的质量:X>Y
C.t3时,消耗盐酸的质量:X=Y
D.t3时,消耗金属的质量:X=Y
(5)某学习小组对过量炭粉与氧化铁反应后的气体产物成分进行研究。
(提出问题)学完完全燃烧与不完全燃烧后,知道碳在质量不同的氧气中燃烧可以生成二氧化碳或一氧化碳,那过量的炭粉与氧化铁反应后的气体产物有哪些可能呢?
(提出假设)假设1:只有二氧化碳;
假设2:_________________;
假设3:二氧化碳和一氧化碳的混合气体。
(设计方案)如下图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(查阅资料)氮气不与碳、氧化铁发生反应。实验室可以用氯化铵(NH4Cl)溶液和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气,同时生成氯化钠和一种常见的液体。请写出该反应的化学方程式:_______________。
(实验操作及实验现象)
①按上图连接装置(未装药品),并检查装置的气密性,方法是先夹紧弹簧夹,在右侧导管处连接一注射器,将注射器活塞往里推一段距离,松手后观察到 __________现象,说明装置气密性良好。
②称取3.20g氧化铁和2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
③加热前,先通一段时间纯净干燥的氮气,目的是_______________。
④停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊,该现象说明______。
⑤待反应结束,应先___________,再_______________(填“熄灭酒精喷灯”或“打开弹簧夹、继续通氮气”),冷却至室温后停止通入氮气,称得硬质玻璃管和固体总质量为52.24g。(已知氧化铁被完全还原成铁单质)。
(数据处理)经计算,参加反应的碳元素质量为0.48g,生成的气体中碳元素与氧元素的质量比为___________(写出计算过程)。
(得出结论)根据数据处理结果判断,得出假设___________成立。
(实验反思)有同学认为也可以将上图中虚线内B装置换成以下装置,下列装置中你认为最为合理的是_________。
21.大自然向人类提供了丰富的金属资源。
(1)探究铁钉锈蚀条件的实验如图所示。
①蒸馏水经过了煮沸,目的是_____;氯化钙的作用是________。
②对比试管_____(填字母,下同)和试管_____,可知铁钉锈蚀需要与水直接接触。
(2)钛铁矿(主要成分为FeTiO3)可用来提取钛,工业流程如下图所示。
①氯化过程发生反应的化学方程式为2FeTiO3+6C+7Cl22TiCl4+2X+6CO,X的化学式为_________。
②高温冶炼过程发生的反应属于基本反应类型中的_________。
③合成过程得到的产物甲醇(CH3OH)是一种重要的燃料,甲醇充分燃烧的化学方程式为____________。
(3)下列途径能有效保护金属资源的是___(填字母)。
a.防止金属腐蚀 b.回收利用废旧金属
c.合理有效地开采矿物 d.寻找金属的代用品
22.人类文明与社会进步同金属材料关系密切。
(一)铁的广泛应用
(1)人体缺铁会造成贫血,这里的铁是指_____。 (选填序号)
A.单质 B.元素 C.原子
(2)双吸剂的主要成分是铁粉,其原理是铁锈蚀,在过程中吸收______ 和 _______。
(3)暖宝宝的主要成分是铁粉、氯化钠等,原理也是铁锈蚀,锈蚀过程中发生______。
A.剧烈氧化 B.缓慢氧化
(4)西汉时期有“曾青得铁则化为铜”之说,用化学方程式表示其原理________。
(二)铁的锈蚀
(1)下列情况下铁制品最易生锈的是_____ (填序号)。
a.潮湿空气中 b.部分浸入食盐水中 c.干燥空气中
(2)铁生锈的主要过程为:写出转化①的化学方程式_______。
(3)铁锈中一定含Fe2O3 nH2O,可能含FeCO3 (FeCO3和稀盐酸的反应与CaCO3相似),在某铁锈样品中加稀盐酸,_______ (填现象),证明不含FeCO3。
(三)铁的冶炼
取24.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
资料:NaOH溶液能很好地吸收CO2,碱石灰可吸收H2O和CO2。
(1)连接装置,先______,再装入药品。
(2)实验时先通入CO,目的是_________,反应后还要继续通CO目的是______。
(3)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
①通过测定装置B的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是_______。
②现直接测得装置A中剩余固体质量为19.2g。则装置B应增重_______g。
(4)请指出上述实验装置的一个明显缺陷_______。
参考答案
1.B
【详解】
由SnO2 + 2C Sn + 2CO↑可知,反应物和生成物都是一种单质和一种化合物,属于置换反应。故选B。
2.B
【详解】
A、金属锈蚀与氧气和水有关,在金属表面刷漆或是涂油能防止金属与氧气或水接触,可以防锈,不符合题意;
B、用砂纸擦去铝制品表面的氧化膜,则破坏了保护层,使内部的铝易被腐蚀,不能防锈,符合题意;
C、制成耐腐蚀的合金,改变了金属的内部结构,有利于防锈,不符合题意;
D、在金属表面镀上一层耐腐蚀的铬能使金属与氧气或水隔绝,能防止生锈,不符合题意。故选B。
3.C
【详解】
A、地球上金属资源除少量很不活泼的金属,如金、银等有单质形式存在外,其余都以化合物形式存在,故A正确;
B、海洋是地球上巨大的资源宝库,海水中含的物质种类很多,故B正确;
C、目前世界上年产量最高的金属是铁;现在铝的年产量已经超过了铜,位居世界第二位,故错误;
D、回收废电池既能节约金属资源,还能减少对环境的污染,故D正确;故选:C。
4.B
【详解】
A、旧电池中含有重金属,有毒,属于有害垃圾,故A错误;
B、水果皮不能回收,属于厨余垃圾,故B正确;
C、旧书刊属于可回收物,属于可回收垃圾,故C错误;
D、易拉罐属于可回收物,属于可回收垃圾,故D错误。
故选B。
5.C
【解析】
【详解】
空气是一种宝贵的自然资源,其中含量最高的氮气体积分数约为,故A正确;
B、金属资源的回收利用不仅可以节约金属资源,还能减少对环境的污染,故B 正确;
C、将煤隔绝空气加强热,可以得到焦炭、煤焦油、焦炉煤气等,汽油是石油分馏的产物,故C错误;
D、因制取成本高和贮存困难,氢气作为燃料还未被广泛应用,故D正确。故选C。
6.A
【详解】
等质量的氧化铁分别和碳和一氧化碳充分反应,根据质量守恒定律,最终都是把氧化铁中的铁完全还原出来,因此得到的铁的质量一样.故选A.
7.A
【详解】
A、甲图:a试管的铁钉与氧气和水接触生锈,b试管的铁钉与氧气接触,不与水接触不生锈,说明铁钉生锈需要与水接触,不是只要与水接触铁钉就会生锈,根据其实验现象得出的结论不正确,符合题意;
B、乙图:下层蜡烛先熄灭,说明通常状况下,二氧化碳不能燃烧,不支持燃烧,且密度大于空气,根据其实验现象得出的结论正确,不符合题意;
C、丙图:两弹簧秤的示数相同,说明使用定滑轮能改变力的方向,但不能省力,根据其实验现象得出的结论正确,不符合题意;
D、丁图:通电时小磁针偏转,不通电时小磁针不偏转,表明通电导线周围存在磁场,根据其实验现象得出的结论正确,不符合题意。故选A。
8.D
【详解】
A、硫在空气中燃烧生成二氧化硫,二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,能形成明显压强差,可通过液体进入集气瓶的体积测定空气中氧气的含量,故A正确;
B、由于可燃物都与氧气接触,控制的变量只是可燃物不同,所以观察燃烧先后顺序,能比较可燃物的着火点高低,故B正确;
C、硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,图中观察天平反应前后是否平衡,可以验证质量守恒定律,故C正确;
D、铁生锈是铁与水、氧气共同作用的结果,图示实验只能说明铁在水中不易生锈,应补充一个铁钉不与水接触的实验即在干燥的空气中,故D错误。故选D。
9.C
【详解】
A.氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,故A不符合题意;
B.铁、氧气、水反应会发生锈蚀生成氧化铁,故B不符合题意;
C.氯化铜和铁反应生成氯化亚铁和铜,不会生成氯化铁,故C符合题意;
D.二氧化碳和水通过光合作用生成葡萄糖和氧气,故D不符合题意。
答案选C。
10.D
【详解】
A、干冰升华吸热,可用于人工降雨,没有生成新物质,发生物理变化,体现物理性质,A不符合题意。
B、氦气密度比空气小,可以用于填充探空气球,没有发生化学变化,体现物理性质,B不符合题意。
C、铜丝导电性好,可用作导线,没有发生化学变化,体现物理性质,C不符合题意。
D、铁粉和氧气和水反应,去除食品中氧气和水,用作食品保鲜剂,发生化学变化,体现化学性质,D符合题意。
故选:D。
11.C
【详解】
A、O2的主要来源是植物的光合作用,吸收二氧化碳,释放氧气;故选项错误;
B、CO2中都含有氧原子,不含有氧分子;故选项错误;
C、钢铁容易与空气中的水和氧气反应产生铁锈;故选项正确;
D、CO2没有酸性,不能使干燥的蓝色石蕊试纸变红色;故选项错误;
故选:C。
12.A
【详解】
A. 回收处理废旧电池,既可节约资源又可减少金属对环境污染,选项正确;
B. 饮品中的各成分均属于化学物质,选项错误;
C. 水中只含有氢元素与氧元素,不含石油的组成成分碳元素,且催化剂只改变反应的速率,不改变化学变化中的元素种类,选项错误;
D.明矾溶于水形成胶体状物质,能吸附水中的悬浮的难溶性杂质促进其沉降,没有消毒杀菌的作用,选项错误,故选A。
13.B
【详解】
A、硬水中含有可溶性杂质,过滤只能除去水中难溶性的杂质,因此硬水经过过滤后不能变成软水,故选项错误;
B、构成物质的分子、原子和离子都在进行不停的运动,故选项正确;
C、化学反应中不只有燃烧才能放出热量,例如缓慢氧化也放热,故选项错误;
D、铁制品与氧气和水同时接触才会生锈,故选项错误。故选B。
14.D
【详解】
A、简易净水器中净水过程只涉及沉降、过滤、吸附等物理变化,不涉及化学变化。故A错误。
B、食盐具有咸味,可作为调味剂,同时大量食盐也可使细菌脱水死亡,从而达到抑制细菌生长,即防腐的作用。故B错误。
C、我国矿产资源丰富,但也需要回收利用废旧金属,保护资源。故C错误。
D、氮气可使食品隔绝氧气,生石灰可吸收包装中的水,二者均可防止食品变质。故D正确。
故选D。
15.B
【详解】
铁生锈是铁与氧气、水共同作用的结果,氧气与水和铁接触的越充分,生锈越严重,所以一段时间后,水面处铁丝锈蚀严重,水面上部的和下部的铁丝锈蚀不明显;铁生锈消耗氧气使瓶内气体减少,压强变小,塑料瓶会变瘪,故B选项符合题意。
16.C
【详解】
单质由一种元素组成,由一种元素组成的纯净物一定是单质,①正确;
图1中对比实验ab可证明铁生锈与氧气有关,对比实验ac可证明铁生锈与水有关,②正确;
根据反应的图像可知,A、B两种金属与相同质量、等质量分数的稀硫酸充分反应,最终生成氢气的质量相等,可能是酸不足,两种金属均剩余,也可能是其中一种金属恰好完全反应,另一种金属剩余,③正确;
4.6 g某有机物在氧气中充分燃烧,生成8.8g二氧化碳和5.4 g水,计算出二氧化碳中碳元素的质量为8.8g××100%=2.4g ,水中氢元素的质量为5.4g××100%=0.6g ,由于反应前后元素的质量不变,二氧化碳中碳元素的质量即为有机物中碳元素的质量,水中氢元素的质量即为有机物中氢元素的质量,即MC+MH=3g<4.6g ,因此,该有机物中还含有氧元素,④不正确。
故选:C。
17.
(1)BC
(2)分解反应
(3)BD
【分析】
(1)
A、玻璃钢是由塑料与玻璃纤维制成的,属于复合材料;
B、炒菜的铁锅是铁的合金,属于金属材料;
C、24K金项链是黄金,属于金属材料;
D、塑料格尺属于有机合成材料;
E、金刚石属于天然材料;
故选BC;
(2)
由多种物质发生反应生成一种物质的反应是化合反应;由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应是置换反应;由一种物质发生反应生成两种或两种以上物质的反应是分解反应;由两种化合物互相交换成分,生成另外两种化合物的反应是复分解反应。
生石灰和水反应生成氢氧化钙是化合反应;硫酸铜和氢氧化钙反应产生氢氧化铜沉淀和硫酸钙是复分解反应;硫酸铜和铁反应产生铜和硫酸亚铁是置换反应;故没有涉及分解反应。
(3)
铁生锈的条件是能与水、氧气接触,洁净的铁钉在潮湿的空气中容易生锈,在酸或盐的环境中铁会加速生锈;故填:BD。
18., , ; 2857。
【解析】
(1)焦炭在空气为燃烧生成二氧化碳,生成的二氧化碳在高温条件下与焦炭发生反应,生成具有还原性的气体一氧化碳,C+O2CO2,CO2+C2CO;(2)在高温条件下,一氧化碳还原氧化铁得到单质铁和二氧化碳,Fe2O3+3CO2Fe+3CO2;(3)5000t含氧化铁80%的赤铁矿中,氧化铁的质量=5000t×80%=4000t,5000t赤铁矿中含铁元素的质量=4000t××100%=2800t,理论上可炼得含铁98%的生铁的质量=。
19.
(1)A
(2)导电
(3) Cu2(OH)2CO3
O2、CO2、H2O
(4) 高炉 石灰石 提供热量 生成一氧化碳的原料
(5)
(6) 收集尾气,防止污染空气 排净空气,防止一氧化碳与空气混合发生爆炸 玻璃管中的固体变为红色,澄清石灰水变浑浊 CuO、Cu2O
500
(7)解:设最终可制得铜的质量是x
答:最终可制得铜的质量是128g。
【分析】
(1)
合金一般比组成它的金属的熔点低,耐腐蚀性强,硬度大。故选A。
(2)
受电弓滑板与高压输电线相连,所以利用的是其导电性。
(3)
铜绿主要成份碱式碳酸铜,化学式Cu2(OH)2CO3,铜生锈与空气中的氧气、二氧化碳、水有关,化学式分别为O2、CO2、H2O。
(4)
工业炼铁的设备为高炉,原料除了铁矿石、焦炭、空气外,还有石灰石。焦炭燃烧放热,和二氧化碳在高温下反应生成一氧化碳用于还原氧化铁。所以焦炭的作用是提供热量,生成一氧化碳的原料。
(5)
生铁的含碳量高于钢,所以将生铁炼成钢即降低生铁中的碳含量。碳和氧气反应生成二氧化碳,从而降低碳含量,化学方程式为。
(6)
①一氧化碳在反应中不会被完全消耗,且是一种污染气体,所以气球的作用是收集尾气,防止污染空气。
②一氧化碳是可燃性气体,与空气混合受热可能发生爆炸,所以先通一段时间CO,然后开始加热,这样操作的目的是排净空气,防止一氧化碳与空气混合发生爆炸。
③一氧化碳和氧化铜在高温下反应生成铜和二氧化碳。二氧化碳能使澄清石灰水变浑浊。所以看到的现象是玻璃管中的固体变为红色,澄清石灰水变浑浊。
④a、从图2可知,400℃时,反应的固体产物中含有3种物质,是Cu、CuO和Cu2O。
b、500℃时,产物只有铜,化学方程式为。
c、从图2可知,400℃含有铜以外的其他物质,500℃只有铜。所以反应温度至少要控制在500℃以上。
(7)
见答案。
20.B 刷漆 AC C 只有一氧化碳 NH4Cl +NaNO2 =N2↑+ NaCl + 2H2O 注射器又回到原来的刻度 排净装置中的空气,防止装置中空气里的氧气与碳反应 有二氧化碳生成假设2错误 熄灭酒精喷灯 继续通氮气 1:2 3 丙
【详解】
本题考查了(1)金属的有关性质(2)根据实验现象和数据推断物质的组成,可根据质量守恒定律进行分析,实验操作部分可参考炼铁原理的操作。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的导热性,故选B;
(2)金属铁锈蚀造成浪费,隔绝氧气或隔绝水或隔绝水和氧气可防止铁锈蚀,例如刷漆等;
(3)废钢铁得到回收利用,其意义有节约金属资源、减少废金属对环境的污染,故选AC;
(4) A、根据图示可知,t1时,产生气体的质量是X>Y,正确;
B、t2时,X已反应结束,Y没有反应结束,消耗金属的质量:X>Y,正确;
C、t3时,产生气体的质量是X>Y,所以消耗盐酸的质量应该是X>Y,错误;
D、金属的质量相等,且盐酸是足量的,所以最后金属全部反应完。图示中t3 时刻两者的气体质量不再变化,说明金属已经完全反应,又金属的质量相等,所以消耗金属的质量X=Y,正确。故选C。
(5) 根据题中提供的信息和质量守恒定律可知:假设2:只有一氧化碳
【查阅资料】氮气不与碳、氧化铁发生反应。实验室可以用氯化铵(NH4Cl)溶液和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气,同时生成氯化钠和一种常见的液体,根据质量守恒定律可知液体为水,该反应的化学方程式NH4Cl +NaNO2 ===== N2↑+ NaCl + 2H2O;
【实验操作及实验现象】
①先夹紧弹簧夹,在右侧导管处连接一注射器,将注射器活塞往里推一段距离,注射器中气体被压缩,压强增大,松手后观察到注射器又回到原来的刻度现象,说明装置气密性良好;
③加热前,先通一段时间纯净干燥的氮气,目的是排净装置中的空气,防止装置中空气里的氧气与碳反应;
④停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊,二氧化碳能使澄清石灰水变浑浊,该现象说明有二氧化碳生成假设2错误。
⑤待反应结束,应先熄灭酒精喷灯,再继续通氮气,以防止温度下降后硬质玻璃管中压强减小,石灰水倒流引起玻璃管炸裂,
【数据处理】在反应前后玻璃管中质量减少了48.48g+3.2g+2g-52.24g=1.44g,根据质量守恒定律可知,减少质量为参加反应的碳元素和氧元素的质量,参加反应的碳元素质量为0.48g,则参加反应的氧元素质量为1.44g-0.48g=0.96g,生成的气体中碳元素与氧元素的质量比为0.48g:0.96g=1:2;
【得出结论】在本实验中碳氧两元素的质量比为0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的质量比为12:(16×2)═3:8,故不是纯的二氧化碳气体,假设1不成立,一氧化碳中碳氧元素的质量比为12: 16)═3:4,当气体产物为一氧化碳和二氧化碳混合物时,碳与氧的质量比应在3:4和3:8之间,1:2在3:4和3:8之间,所以气体产物为一氧化碳和二氧化碳,假设3成立;
【实验反思】上图中虚线内B装置作用是检验二氧化碳并能收集尾气,甲装置只能检验二氧化碳,尾气直接排放到空气中,乙装置中气体不能与澄清石灰水充分接触,当气体通入乙装置时,液体不能排出,所以不能收集尾气,当气体通入丙装置时,气体与澄清石灰水充分接触能检验二氧化碳,液体能排到烧杯中,尾气收集在瓶中,故选丙。
21.尽可能除去蒸馏水中溶解的氧气 尽可能除去空气中的水蒸气 A C FeCl3 置换反应 ABCD
【详解】
(1)①蒸馏水经过了煮沸,目的是尽可能除去蒸馏水中溶解的氧气;
氯化钙的作用是:尽可能除去空气中的水蒸气;
②A中铁钉与水接触,C中铁钉与水不接触,故对比试管A和试管C,可知铁钉锈蚀需要与水直接接触;
(2)①根据质量守恒定律,化学反应前后,原子的种类和数目不变,结合化学方程式:,X的化学式为:FeCl3;
②由图可知,高温冶炼过程发生的反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应;
③甲醇充分燃烧生成二氧化碳和水,该反应的化学方程式为:;
(3)保护金属资源的途径有:防止金属的腐蚀;金属的回收利用;有计划、合理地开采矿物,寻找金属的替代品等。故选ABCD。
22.B 水 氧气 B Fe +CuSO4=FeSO4+Cu b 2Fe+2H2O+O2=2Fe(OH)2 无气泡产生 检查装置气密性 排尽装置中的空气,防止加热时发生爆炸 防止液体倒吸(或:使反应产生的CO2被B装置完全吸收) 防止空气中的CO2进入装置B 13.2 没有尾气处理装置
【详解】
(一) (1)人体缺铁会造成贫血,这里的铁是指元素;故选B
(2)双吸剂的主要成分是铁粉,其原理是铁锈蚀,在过程中吸收氧气和 水;
(3)暖宝宝的主要成分是铁粉、氯化钠等,原理也是铁锈蚀,锈蚀过程中发生缓慢氧化,故选B;
(4)西汉时期有“曾青得铁则化为铜”之说,是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe +CuSO4===FeSO4+Cu;
(二) (1) 铁生锈是铁与氧气、水共同作用的结果,盐的存在会加速锈蚀,将铁部分浸入食盐水中情况下铁制品最易生锈选b ;
(2)铁生锈的主要过程为:转化①是铁和氧气、水反应生成氢氧化亚铁,化学方程式为2Fe+2H2O+O2=2Fe(OH)2;
(3) FeCO3和稀盐酸的反应与CaCO3相似,所以能与盐酸反应生成二氧化碳气体,在某铁锈样品中加稀盐酸,无气泡产生,证明不含FeCO3;
(三) (1)连接装置,先检查装置的气密性,再装入药品。
(2)实验时先通入CO,目的是排尽装置内的空气,防止加热时发生爆炸,反应后还要继续通CO目的是防止液体倒吸(或:使反应产生的CO2被B装置完全吸收);
(3)①通过测定装置B的质量变化,可准确求得装置A中剩余固体质量。碱石灰中的二氧化钠能与二氧化碳法宁,装置C的作用是防止空气中的CO2进入装置B;
②反应前有24.0g Fe2O3,现直接测得装置A中剩余固体质量为19.2g。则减少的氧元素的质量为4.8g,则生成二氧化碳的质量为4.8g×2÷(32÷44×100%)= 13.2g,生成的二氧化碳被氢氧化钠溶液吸收,则装置B应增重13.2g。
(4)上述实验装置的一个明显缺陷是没有尾气处理装置,会导致一氧化碳逸散到空气中,污染空气。
一、选择题(共16题)
1.马踏飞燕——中国青铜艺术奇葩,青铜乃铜锡合金,《天工开物》曾记载下列炼锡方法:SnO2 + 2C Sn + 2CO↑。上述变化属于
A.化合反应 B.置换反应
C.分解反应 D.物理变化
2.下列措施不能在一定程度上防止金属生锈的是( )
A.在金属表面涂油或刷漆
B.用砂纸擦去铝制品表面的氧化膜
C.制成耐腐蚀的合金
D.在金属表面镀上一层耐腐蚀的铬
3.下列关于资源的叙述不正确的是( )
A.地球上的金属资源中除金、银等有单质形式存在外,其余都以化合物形式存在
B.海水中含有80多种元素,是巨大的资源宝库
C.世界上铜的年产量已超过了铝,位于铁之后,居第二位
D.回收废电池既能节约金属资源,还能减少对环境的污染
4.下列属于厨余垃圾的是
A.旧电池 B.水果皮 C.旧书刊 D.易拉罐
5.能源和资源是人类生存和发展的基本条件,下列说法不正确的是
A.空气是一种宝贵的自然资源,其中氮气的体积分数约为
B.金属资源的回收利用不仅可以节约金属资源,还能减少对环境的污染
C.将煤隔绝空气加强热,可以得到焦炭、煤焦油、汽油等
D.因制取成本高和贮存困难,氢气作为燃料还未被广泛应用
6.等质量的氧化铁分别和碳和一氧化碳充分反应后,所得铁的质量为
A.一样多 B.CO还原出来的多
C.碳还原出来的多 D.不能确定
7.如图所示的4个实验,根据其实验现象得出的结论不正确的是
A.甲图:a试管的铁钉生锈,b试管的铁钉不生锈,说明只要与水接触铁钉就会生锈
B.乙图:下层蜡烛先熄灭,说明通常状况下,二氧化碳不能燃烧,不支持燃烧,且密度大于空气
C.丙图:两弹簧秤的示数相同,说明使用定滑轮能改变力的方向,但不能省力
D.丁图:通电时小磁针偏转,不通电时小磁针不偏转,表明通电导线周围存在磁场
8.下列实验方案中,不能达到实验目的的是
A.测定空气中氧气含量
B.比较可燃物的着火点
C.验证质量守恒定律
D.证明铁生锈是水和氧气共同作用的结果
9.在给定条件下,下列物质间的转化不能实现的是( )
A.KClO3O2 B.FeFe2O3
C.CuCl2FeCl3 D.CO2O2
10.下列物质用途主要体现物质化学性质的是( )
A.干冰用于人工降雨 B.氦气用于填充探空气球
C.铜丝用作导线 D.铁粉用作食品保鲜剂
11.下列关于O2、CO2的叙述,正确的是
A.O2的主要来源是植物的呼吸作用 B.O2、CO2中都含有氧分子
C.O2的存在能使自然界中的钢铁生锈 D.CO2能使干燥的蓝色石蕊试纸变红色
12.下列有关媒体的报道与化学知识不相违背的是( )
A.回收处理废旧电池,既可节约资源又可减少环境污染
B.某品牌饮品为绿色食品,不含任何化学物质
C.科研人员发明了一种特殊催化剂,可以将水变为汽油
D.有关部门利用明矾对饮用水进行消毒杀菌,从而解决灾民饮水难的问题
13.下列说法正确的是( )
A.硬水经过过滤后一定变成软水
B.构成物质的分子、原子和离子一定在不停的运动
C.化学反应中一定只有燃烧才能放出热量
D.铁制品与氧气或水接触一定会生锈
14.化学与生产、生活息息相关。下列说法正确的是
A.简易净水器净水过程中涉及化学变化
B.食盐可以作调味品,不可作食品防腐剂
C.我国矿产资源丰富,不需要回收利用废旧金属
D.氮气、生石灰在食品包装中均可防止食品变质
15.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
16.下列说法中正确的有
①单质由一种元素组成,由一种元素组成的纯净物一定是单质
②利用图1实验探究铁生锈的条件时,对比实验ac可证明铁生锈与水有关
③质量相同的金属A、B分别与相同质量、等质量分数的稀硫酸充分反应,生成氢气的质量与时间的关系如图2所示,当反应结束后,金属A和金属B至少有一种有剩余
④4.6g某有机物在氧气中充分燃烧,生成8.8 g二氧化碳和5.4 g水,则该有机物由碳元素和氢元素组成
A.1条 B.2条 C.3条 D.4条
二、综合题(共6题)
17.回答下列问题。
(1)下列物品中属于金属材料的是___________;(填序号)
A玻璃钢 B炒菜的铁锅 C 24K金项链 D塑料格尺 E金刚石
(2)波尔多也是农业上常用的杀菌剂,由硫酸铜、生石灰和水配制而成,用铁制容器配制波尔多液的过程中,没有涉及到的化学基本反应类型是___________;
(3)防止金属锈蚀是保护金属资源的有效途径之一、铁钉在下列情况下易生锈的是________。
A.在干燥的空气中
B.在潮湿的空气中
C.浸没在植物油中
D.浸入食盐水中
18.工业炼制是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来。
(1)通入空气使固态的焦炭转化为具有还原性的气态物质,转化过程中涉及的反应的化学方程式是①______________________________;②______________________________。
(2)赤铁矿(主要成分为Fe2O3)在高炉里反应生成单质铁的化学方程式是______________。
(3)某钢铁厂每天需消耗5000t含Fe2O3 80%的赤铁矿,该厂理论上可日产含铁98%的生铁的质量是__________t。(结果保留整数)
19.人类文明与社会进步同金属材料关系密切。
(一)金属的广泛应用
(1)连淮扬镇全线已开通,其高铁的机身采用铝合金材料,下列不属于该合金性质的是___________(填字母)。
A.熔点高 B.耐腐蚀 C.硬度大
(2)高铁机身通过受电弓滑板与沿线架设的3万伏高压输电线相连,这是利用了受电弓滑板的___________性(填“导电”或“导热”)。
(二)金属的锈蚀及防护
(3)“帘外芭蕉惹骤雨,门环惹铜绿。”铜绿是铜发生一系列复杂反应的产物,铜绿的主要成分的化学式是___________,空气中参与铜锈蚀反应过程的物质有___________(填化学式)。
(三)金属的冶炼
(4)工业炼铁的设备为___________,原料除了铁矿石、焦炭、空气外,还有___________;其中焦炭的作用是___________、___________。
(5)工业炼铁得到的产品是生铁,将生铁炼成钢的化学方程式为___________。
(6)化学兴趣小组的同学模仿工业炼铁的原理,在如图1所示装置中用CO还原CuO制取金属Cu。
①装置中气球的作用是___________。
②实验开始前,需要先通一段时间CO,然后开始加热,这样操作的目的是___________
③实验开始后现象是___________
④为确定反应的最佳温度,兴趣小组利用原位X射线粉末衍射仪来测定不同温度下反应4小时后的固体物质成分,实验结果如图2所示(该图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同),据图回答下列问题:
a、400℃时,反应的固体产物中含有Cu和___________。
b、500℃时,该反应的化学方程式为___________。
c、用CO还原CuO制取纯净的Cu,反应温度至少要控制在___________℃以上。
(7)取纯净的氧化铜160g放在玻璃管中,控制温度在上面③中所选的温度下实验,最终可制得铜的质量是___________(写出计算过程)
20.金属材料在生产、生活中的应用非常广泛,根据所学知识完成相关内容。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的_______(填字母)。
A.导电性 B.导热性 C.延展性
(2)金属锈蚀造成浪费。铁制品锈蚀的过程,实际上是铁与空气中的氧气、水发生化学反应的过程,写出一种防锈措施______________。
(3)目前世界上已有50%以上的废钢铁得到回收利用,其意义有__________(填字母)。
A.节约金属资源 B.合理开采矿物 C.减少废金属对环境的污染
(4)等质量的X、Y两种金属粉末分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示.下列说法中不正确的是_______(填字母)。
A.t1时,生成氢气的质量:X>Y
B.t2时,消耗金属的质量:X>Y
C.t3时,消耗盐酸的质量:X=Y
D.t3时,消耗金属的质量:X=Y
(5)某学习小组对过量炭粉与氧化铁反应后的气体产物成分进行研究。
(提出问题)学完完全燃烧与不完全燃烧后,知道碳在质量不同的氧气中燃烧可以生成二氧化碳或一氧化碳,那过量的炭粉与氧化铁反应后的气体产物有哪些可能呢?
(提出假设)假设1:只有二氧化碳;
假设2:_________________;
假设3:二氧化碳和一氧化碳的混合气体。
(设计方案)如下图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(查阅资料)氮气不与碳、氧化铁发生反应。实验室可以用氯化铵(NH4Cl)溶液和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气,同时生成氯化钠和一种常见的液体。请写出该反应的化学方程式:_______________。
(实验操作及实验现象)
①按上图连接装置(未装药品),并检查装置的气密性,方法是先夹紧弹簧夹,在右侧导管处连接一注射器,将注射器活塞往里推一段距离,松手后观察到 __________现象,说明装置气密性良好。
②称取3.20g氧化铁和2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
③加热前,先通一段时间纯净干燥的氮气,目的是_______________。
④停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊,该现象说明______。
⑤待反应结束,应先___________,再_______________(填“熄灭酒精喷灯”或“打开弹簧夹、继续通氮气”),冷却至室温后停止通入氮气,称得硬质玻璃管和固体总质量为52.24g。(已知氧化铁被完全还原成铁单质)。
(数据处理)经计算,参加反应的碳元素质量为0.48g,生成的气体中碳元素与氧元素的质量比为___________(写出计算过程)。
(得出结论)根据数据处理结果判断,得出假设___________成立。
(实验反思)有同学认为也可以将上图中虚线内B装置换成以下装置,下列装置中你认为最为合理的是_________。
21.大自然向人类提供了丰富的金属资源。
(1)探究铁钉锈蚀条件的实验如图所示。
①蒸馏水经过了煮沸,目的是_____;氯化钙的作用是________。
②对比试管_____(填字母,下同)和试管_____,可知铁钉锈蚀需要与水直接接触。
(2)钛铁矿(主要成分为FeTiO3)可用来提取钛,工业流程如下图所示。
①氯化过程发生反应的化学方程式为2FeTiO3+6C+7Cl22TiCl4+2X+6CO,X的化学式为_________。
②高温冶炼过程发生的反应属于基本反应类型中的_________。
③合成过程得到的产物甲醇(CH3OH)是一种重要的燃料,甲醇充分燃烧的化学方程式为____________。
(3)下列途径能有效保护金属资源的是___(填字母)。
a.防止金属腐蚀 b.回收利用废旧金属
c.合理有效地开采矿物 d.寻找金属的代用品
22.人类文明与社会进步同金属材料关系密切。
(一)铁的广泛应用
(1)人体缺铁会造成贫血,这里的铁是指_____。 (选填序号)
A.单质 B.元素 C.原子
(2)双吸剂的主要成分是铁粉,其原理是铁锈蚀,在过程中吸收______ 和 _______。
(3)暖宝宝的主要成分是铁粉、氯化钠等,原理也是铁锈蚀,锈蚀过程中发生______。
A.剧烈氧化 B.缓慢氧化
(4)西汉时期有“曾青得铁则化为铜”之说,用化学方程式表示其原理________。
(二)铁的锈蚀
(1)下列情况下铁制品最易生锈的是_____ (填序号)。
a.潮湿空气中 b.部分浸入食盐水中 c.干燥空气中
(2)铁生锈的主要过程为:写出转化①的化学方程式_______。
(3)铁锈中一定含Fe2O3 nH2O,可能含FeCO3 (FeCO3和稀盐酸的反应与CaCO3相似),在某铁锈样品中加稀盐酸,_______ (填现象),证明不含FeCO3。
(三)铁的冶炼
取24.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
资料:NaOH溶液能很好地吸收CO2,碱石灰可吸收H2O和CO2。
(1)连接装置,先______,再装入药品。
(2)实验时先通入CO,目的是_________,反应后还要继续通CO目的是______。
(3)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
①通过测定装置B的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是_______。
②现直接测得装置A中剩余固体质量为19.2g。则装置B应增重_______g。
(4)请指出上述实验装置的一个明显缺陷_______。
参考答案
1.B
【详解】
由SnO2 + 2C Sn + 2CO↑可知,反应物和生成物都是一种单质和一种化合物,属于置换反应。故选B。
2.B
【详解】
A、金属锈蚀与氧气和水有关,在金属表面刷漆或是涂油能防止金属与氧气或水接触,可以防锈,不符合题意;
B、用砂纸擦去铝制品表面的氧化膜,则破坏了保护层,使内部的铝易被腐蚀,不能防锈,符合题意;
C、制成耐腐蚀的合金,改变了金属的内部结构,有利于防锈,不符合题意;
D、在金属表面镀上一层耐腐蚀的铬能使金属与氧气或水隔绝,能防止生锈,不符合题意。故选B。
3.C
【详解】
A、地球上金属资源除少量很不活泼的金属,如金、银等有单质形式存在外,其余都以化合物形式存在,故A正确;
B、海洋是地球上巨大的资源宝库,海水中含的物质种类很多,故B正确;
C、目前世界上年产量最高的金属是铁;现在铝的年产量已经超过了铜,位居世界第二位,故错误;
D、回收废电池既能节约金属资源,还能减少对环境的污染,故D正确;故选:C。
4.B
【详解】
A、旧电池中含有重金属,有毒,属于有害垃圾,故A错误;
B、水果皮不能回收,属于厨余垃圾,故B正确;
C、旧书刊属于可回收物,属于可回收垃圾,故C错误;
D、易拉罐属于可回收物,属于可回收垃圾,故D错误。
故选B。
5.C
【解析】
【详解】
空气是一种宝贵的自然资源,其中含量最高的氮气体积分数约为,故A正确;
B、金属资源的回收利用不仅可以节约金属资源,还能减少对环境的污染,故B 正确;
C、将煤隔绝空气加强热,可以得到焦炭、煤焦油、焦炉煤气等,汽油是石油分馏的产物,故C错误;
D、因制取成本高和贮存困难,氢气作为燃料还未被广泛应用,故D正确。故选C。
6.A
【详解】
等质量的氧化铁分别和碳和一氧化碳充分反应,根据质量守恒定律,最终都是把氧化铁中的铁完全还原出来,因此得到的铁的质量一样.故选A.
7.A
【详解】
A、甲图:a试管的铁钉与氧气和水接触生锈,b试管的铁钉与氧气接触,不与水接触不生锈,说明铁钉生锈需要与水接触,不是只要与水接触铁钉就会生锈,根据其实验现象得出的结论不正确,符合题意;
B、乙图:下层蜡烛先熄灭,说明通常状况下,二氧化碳不能燃烧,不支持燃烧,且密度大于空气,根据其实验现象得出的结论正确,不符合题意;
C、丙图:两弹簧秤的示数相同,说明使用定滑轮能改变力的方向,但不能省力,根据其实验现象得出的结论正确,不符合题意;
D、丁图:通电时小磁针偏转,不通电时小磁针不偏转,表明通电导线周围存在磁场,根据其实验现象得出的结论正确,不符合题意。故选A。
8.D
【详解】
A、硫在空气中燃烧生成二氧化硫,二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,能形成明显压强差,可通过液体进入集气瓶的体积测定空气中氧气的含量,故A正确;
B、由于可燃物都与氧气接触,控制的变量只是可燃物不同,所以观察燃烧先后顺序,能比较可燃物的着火点高低,故B正确;
C、硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,图中观察天平反应前后是否平衡,可以验证质量守恒定律,故C正确;
D、铁生锈是铁与水、氧气共同作用的结果,图示实验只能说明铁在水中不易生锈,应补充一个铁钉不与水接触的实验即在干燥的空气中,故D错误。故选D。
9.C
【详解】
A.氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,故A不符合题意;
B.铁、氧气、水反应会发生锈蚀生成氧化铁,故B不符合题意;
C.氯化铜和铁反应生成氯化亚铁和铜,不会生成氯化铁,故C符合题意;
D.二氧化碳和水通过光合作用生成葡萄糖和氧气,故D不符合题意。
答案选C。
10.D
【详解】
A、干冰升华吸热,可用于人工降雨,没有生成新物质,发生物理变化,体现物理性质,A不符合题意。
B、氦气密度比空气小,可以用于填充探空气球,没有发生化学变化,体现物理性质,B不符合题意。
C、铜丝导电性好,可用作导线,没有发生化学变化,体现物理性质,C不符合题意。
D、铁粉和氧气和水反应,去除食品中氧气和水,用作食品保鲜剂,发生化学变化,体现化学性质,D符合题意。
故选:D。
11.C
【详解】
A、O2的主要来源是植物的光合作用,吸收二氧化碳,释放氧气;故选项错误;
B、CO2中都含有氧原子,不含有氧分子;故选项错误;
C、钢铁容易与空气中的水和氧气反应产生铁锈;故选项正确;
D、CO2没有酸性,不能使干燥的蓝色石蕊试纸变红色;故选项错误;
故选:C。
12.A
【详解】
A. 回收处理废旧电池,既可节约资源又可减少金属对环境污染,选项正确;
B. 饮品中的各成分均属于化学物质,选项错误;
C. 水中只含有氢元素与氧元素,不含石油的组成成分碳元素,且催化剂只改变反应的速率,不改变化学变化中的元素种类,选项错误;
D.明矾溶于水形成胶体状物质,能吸附水中的悬浮的难溶性杂质促进其沉降,没有消毒杀菌的作用,选项错误,故选A。
13.B
【详解】
A、硬水中含有可溶性杂质,过滤只能除去水中难溶性的杂质,因此硬水经过过滤后不能变成软水,故选项错误;
B、构成物质的分子、原子和离子都在进行不停的运动,故选项正确;
C、化学反应中不只有燃烧才能放出热量,例如缓慢氧化也放热,故选项错误;
D、铁制品与氧气和水同时接触才会生锈,故选项错误。故选B。
14.D
【详解】
A、简易净水器中净水过程只涉及沉降、过滤、吸附等物理变化,不涉及化学变化。故A错误。
B、食盐具有咸味,可作为调味剂,同时大量食盐也可使细菌脱水死亡,从而达到抑制细菌生长,即防腐的作用。故B错误。
C、我国矿产资源丰富,但也需要回收利用废旧金属,保护资源。故C错误。
D、氮气可使食品隔绝氧气,生石灰可吸收包装中的水,二者均可防止食品变质。故D正确。
故选D。
15.B
【详解】
铁生锈是铁与氧气、水共同作用的结果,氧气与水和铁接触的越充分,生锈越严重,所以一段时间后,水面处铁丝锈蚀严重,水面上部的和下部的铁丝锈蚀不明显;铁生锈消耗氧气使瓶内气体减少,压强变小,塑料瓶会变瘪,故B选项符合题意。
16.C
【详解】
单质由一种元素组成,由一种元素组成的纯净物一定是单质,①正确;
图1中对比实验ab可证明铁生锈与氧气有关,对比实验ac可证明铁生锈与水有关,②正确;
根据反应的图像可知,A、B两种金属与相同质量、等质量分数的稀硫酸充分反应,最终生成氢气的质量相等,可能是酸不足,两种金属均剩余,也可能是其中一种金属恰好完全反应,另一种金属剩余,③正确;
4.6 g某有机物在氧气中充分燃烧,生成8.8g二氧化碳和5.4 g水,计算出二氧化碳中碳元素的质量为8.8g××100%=2.4g ,水中氢元素的质量为5.4g××100%=0.6g ,由于反应前后元素的质量不变,二氧化碳中碳元素的质量即为有机物中碳元素的质量,水中氢元素的质量即为有机物中氢元素的质量,即MC+MH=3g<4.6g ,因此,该有机物中还含有氧元素,④不正确。
故选:C。
17.
(1)BC
(2)分解反应
(3)BD
【分析】
(1)
A、玻璃钢是由塑料与玻璃纤维制成的,属于复合材料;
B、炒菜的铁锅是铁的合金,属于金属材料;
C、24K金项链是黄金,属于金属材料;
D、塑料格尺属于有机合成材料;
E、金刚石属于天然材料;
故选BC;
(2)
由多种物质发生反应生成一种物质的反应是化合反应;由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应是置换反应;由一种物质发生反应生成两种或两种以上物质的反应是分解反应;由两种化合物互相交换成分,生成另外两种化合物的反应是复分解反应。
生石灰和水反应生成氢氧化钙是化合反应;硫酸铜和氢氧化钙反应产生氢氧化铜沉淀和硫酸钙是复分解反应;硫酸铜和铁反应产生铜和硫酸亚铁是置换反应;故没有涉及分解反应。
(3)
铁生锈的条件是能与水、氧气接触,洁净的铁钉在潮湿的空气中容易生锈,在酸或盐的环境中铁会加速生锈;故填:BD。
18., , ; 2857。
【解析】
(1)焦炭在空气为燃烧生成二氧化碳,生成的二氧化碳在高温条件下与焦炭发生反应,生成具有还原性的气体一氧化碳,C+O2CO2,CO2+C2CO;(2)在高温条件下,一氧化碳还原氧化铁得到单质铁和二氧化碳,Fe2O3+3CO2Fe+3CO2;(3)5000t含氧化铁80%的赤铁矿中,氧化铁的质量=5000t×80%=4000t,5000t赤铁矿中含铁元素的质量=4000t××100%=2800t,理论上可炼得含铁98%的生铁的质量=。
19.
(1)A
(2)导电
(3) Cu2(OH)2CO3
O2、CO2、H2O
(4) 高炉 石灰石 提供热量 生成一氧化碳的原料
(5)
(6) 收集尾气,防止污染空气 排净空气,防止一氧化碳与空气混合发生爆炸 玻璃管中的固体变为红色,澄清石灰水变浑浊 CuO、Cu2O
500
(7)解:设最终可制得铜的质量是x
答:最终可制得铜的质量是128g。
【分析】
(1)
合金一般比组成它的金属的熔点低,耐腐蚀性强,硬度大。故选A。
(2)
受电弓滑板与高压输电线相连,所以利用的是其导电性。
(3)
铜绿主要成份碱式碳酸铜,化学式Cu2(OH)2CO3,铜生锈与空气中的氧气、二氧化碳、水有关,化学式分别为O2、CO2、H2O。
(4)
工业炼铁的设备为高炉,原料除了铁矿石、焦炭、空气外,还有石灰石。焦炭燃烧放热,和二氧化碳在高温下反应生成一氧化碳用于还原氧化铁。所以焦炭的作用是提供热量,生成一氧化碳的原料。
(5)
生铁的含碳量高于钢,所以将生铁炼成钢即降低生铁中的碳含量。碳和氧气反应生成二氧化碳,从而降低碳含量,化学方程式为。
(6)
①一氧化碳在反应中不会被完全消耗,且是一种污染气体,所以气球的作用是收集尾气,防止污染空气。
②一氧化碳是可燃性气体,与空气混合受热可能发生爆炸,所以先通一段时间CO,然后开始加热,这样操作的目的是排净空气,防止一氧化碳与空气混合发生爆炸。
③一氧化碳和氧化铜在高温下反应生成铜和二氧化碳。二氧化碳能使澄清石灰水变浑浊。所以看到的现象是玻璃管中的固体变为红色,澄清石灰水变浑浊。
④a、从图2可知,400℃时,反应的固体产物中含有3种物质,是Cu、CuO和Cu2O。
b、500℃时,产物只有铜,化学方程式为。
c、从图2可知,400℃含有铜以外的其他物质,500℃只有铜。所以反应温度至少要控制在500℃以上。
(7)
见答案。
20.B 刷漆 AC C 只有一氧化碳 NH4Cl +NaNO2 =N2↑+ NaCl + 2H2O 注射器又回到原来的刻度 排净装置中的空气,防止装置中空气里的氧气与碳反应 有二氧化碳生成假设2错误 熄灭酒精喷灯 继续通氮气 1:2 3 丙
【详解】
本题考查了(1)金属的有关性质(2)根据实验现象和数据推断物质的组成,可根据质量守恒定律进行分析,实验操作部分可参考炼铁原理的操作。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的导热性,故选B;
(2)金属铁锈蚀造成浪费,隔绝氧气或隔绝水或隔绝水和氧气可防止铁锈蚀,例如刷漆等;
(3)废钢铁得到回收利用,其意义有节约金属资源、减少废金属对环境的污染,故选AC;
(4) A、根据图示可知,t1时,产生气体的质量是X>Y,正确;
B、t2时,X已反应结束,Y没有反应结束,消耗金属的质量:X>Y,正确;
C、t3时,产生气体的质量是X>Y,所以消耗盐酸的质量应该是X>Y,错误;
D、金属的质量相等,且盐酸是足量的,所以最后金属全部反应完。图示中t3 时刻两者的气体质量不再变化,说明金属已经完全反应,又金属的质量相等,所以消耗金属的质量X=Y,正确。故选C。
(5) 根据题中提供的信息和质量守恒定律可知:假设2:只有一氧化碳
【查阅资料】氮气不与碳、氧化铁发生反应。实验室可以用氯化铵(NH4Cl)溶液和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气,同时生成氯化钠和一种常见的液体,根据质量守恒定律可知液体为水,该反应的化学方程式NH4Cl +NaNO2 ===== N2↑+ NaCl + 2H2O;
【实验操作及实验现象】
①先夹紧弹簧夹,在右侧导管处连接一注射器,将注射器活塞往里推一段距离,注射器中气体被压缩,压强增大,松手后观察到注射器又回到原来的刻度现象,说明装置气密性良好;
③加热前,先通一段时间纯净干燥的氮气,目的是排净装置中的空气,防止装置中空气里的氧气与碳反应;
④停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊,二氧化碳能使澄清石灰水变浑浊,该现象说明有二氧化碳生成假设2错误。
⑤待反应结束,应先熄灭酒精喷灯,再继续通氮气,以防止温度下降后硬质玻璃管中压强减小,石灰水倒流引起玻璃管炸裂,
【数据处理】在反应前后玻璃管中质量减少了48.48g+3.2g+2g-52.24g=1.44g,根据质量守恒定律可知,减少质量为参加反应的碳元素和氧元素的质量,参加反应的碳元素质量为0.48g,则参加反应的氧元素质量为1.44g-0.48g=0.96g,生成的气体中碳元素与氧元素的质量比为0.48g:0.96g=1:2;
【得出结论】在本实验中碳氧两元素的质量比为0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的质量比为12:(16×2)═3:8,故不是纯的二氧化碳气体,假设1不成立,一氧化碳中碳氧元素的质量比为12: 16)═3:4,当气体产物为一氧化碳和二氧化碳混合物时,碳与氧的质量比应在3:4和3:8之间,1:2在3:4和3:8之间,所以气体产物为一氧化碳和二氧化碳,假设3成立;
【实验反思】上图中虚线内B装置作用是检验二氧化碳并能收集尾气,甲装置只能检验二氧化碳,尾气直接排放到空气中,乙装置中气体不能与澄清石灰水充分接触,当气体通入乙装置时,液体不能排出,所以不能收集尾气,当气体通入丙装置时,气体与澄清石灰水充分接触能检验二氧化碳,液体能排到烧杯中,尾气收集在瓶中,故选丙。
21.尽可能除去蒸馏水中溶解的氧气 尽可能除去空气中的水蒸气 A C FeCl3 置换反应 ABCD
【详解】
(1)①蒸馏水经过了煮沸,目的是尽可能除去蒸馏水中溶解的氧气;
氯化钙的作用是:尽可能除去空气中的水蒸气;
②A中铁钉与水接触,C中铁钉与水不接触,故对比试管A和试管C,可知铁钉锈蚀需要与水直接接触;
(2)①根据质量守恒定律,化学反应前后,原子的种类和数目不变,结合化学方程式:,X的化学式为:FeCl3;
②由图可知,高温冶炼过程发生的反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应;
③甲醇充分燃烧生成二氧化碳和水,该反应的化学方程式为:;
(3)保护金属资源的途径有:防止金属的腐蚀;金属的回收利用;有计划、合理地开采矿物,寻找金属的替代品等。故选ABCD。
22.B 水 氧气 B Fe +CuSO4=FeSO4+Cu b 2Fe+2H2O+O2=2Fe(OH)2 无气泡产生 检查装置气密性 排尽装置中的空气,防止加热时发生爆炸 防止液体倒吸(或:使反应产生的CO2被B装置完全吸收) 防止空气中的CO2进入装置B 13.2 没有尾气处理装置
【详解】
(一) (1)人体缺铁会造成贫血,这里的铁是指元素;故选B
(2)双吸剂的主要成分是铁粉,其原理是铁锈蚀,在过程中吸收氧气和 水;
(3)暖宝宝的主要成分是铁粉、氯化钠等,原理也是铁锈蚀,锈蚀过程中发生缓慢氧化,故选B;
(4)西汉时期有“曾青得铁则化为铜”之说,是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe +CuSO4===FeSO4+Cu;
(二) (1) 铁生锈是铁与氧气、水共同作用的结果,盐的存在会加速锈蚀,将铁部分浸入食盐水中情况下铁制品最易生锈选b ;
(2)铁生锈的主要过程为:转化①是铁和氧气、水反应生成氢氧化亚铁,化学方程式为2Fe+2H2O+O2=2Fe(OH)2;
(3) FeCO3和稀盐酸的反应与CaCO3相似,所以能与盐酸反应生成二氧化碳气体,在某铁锈样品中加稀盐酸,无气泡产生,证明不含FeCO3;
(三) (1)连接装置,先检查装置的气密性,再装入药品。
(2)实验时先通入CO,目的是排尽装置内的空气,防止加热时发生爆炸,反应后还要继续通CO目的是防止液体倒吸(或:使反应产生的CO2被B装置完全吸收);
(3)①通过测定装置B的质量变化,可准确求得装置A中剩余固体质量。碱石灰中的二氧化钠能与二氧化碳法宁,装置C的作用是防止空气中的CO2进入装置B;
②反应前有24.0g Fe2O3,现直接测得装置A中剩余固体质量为19.2g。则减少的氧元素的质量为4.8g,则生成二氧化碳的质量为4.8g×2÷(32÷44×100%)= 13.2g,生成的二氧化碳被氢氧化钠溶液吸收,则装置B应增重13.2g。
(4)上述实验装置的一个明显缺陷是没有尾气处理装置,会导致一氧化碳逸散到空气中,污染空气。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
