11.1化学与能源开发-2021-2022学年九年级化学鲁教版下册(word版含解析)
文档属性
| 名称 | 11.1化学与能源开发-2021-2022学年九年级化学鲁教版下册(word版含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 390.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-02 22:39:46 | ||
图片预览



文档简介
11.1化学与能源开发
一、选择题(共16题)
1.厄尔尼诺的原因之一是大气中CO2剧增,为减缓之,最理想燃料是( )
A.优质煤 B.天然气 C.汽油 D.氢气
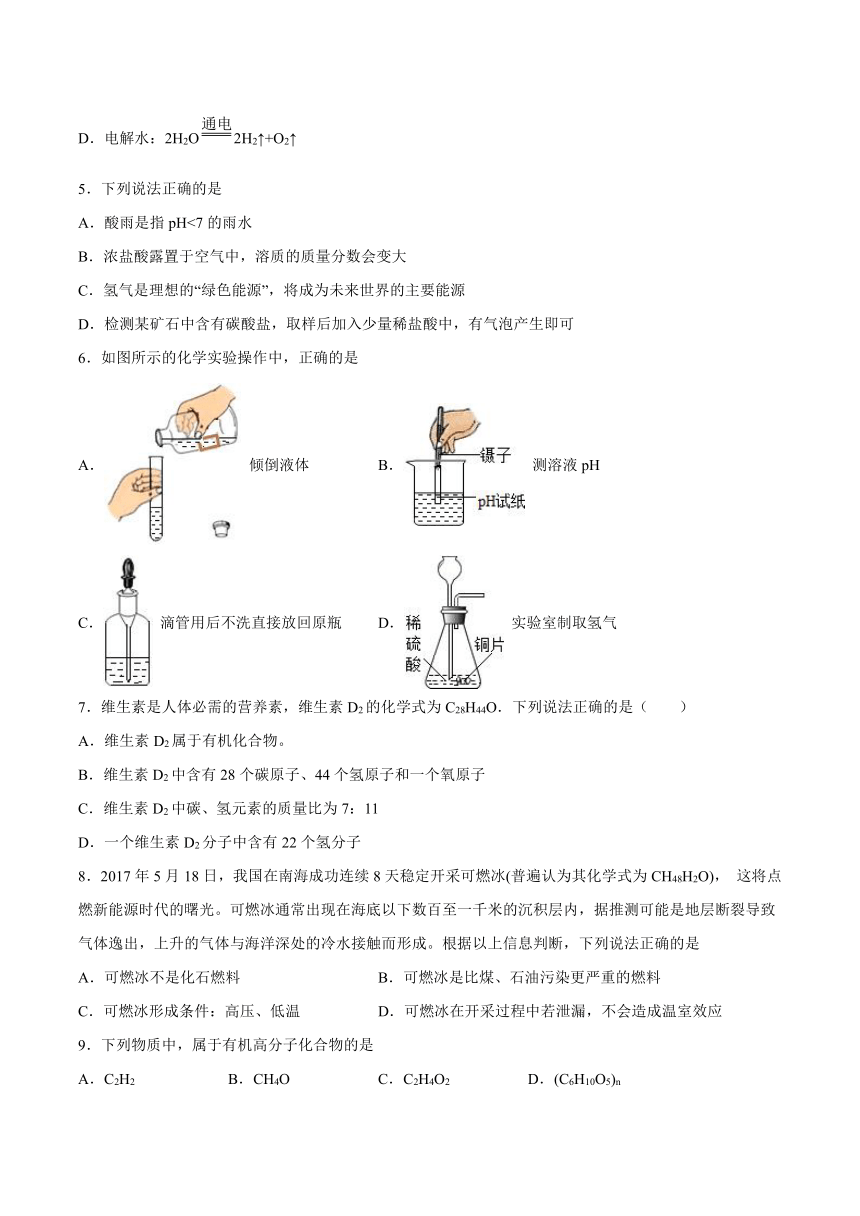
2.下列简易装置不能用于制取氢气的是( )
A. B.
C. D.
3.生活处处有化学,安全时刻记心中。下列做法不合理的是()
A.加油站、加气站附近严禁烟火
B.炒菜时油锅着火,立即倒水浇灭
C.冬季燃煤取暖时,保持有效的通风
D.乘坐公共交通工具,严禁携带易燃易爆品
4.我国“十二五”规划对“低碳经济”给予政策支持,实现“低碳经济”的一种策略是节能。下列制备氢气的方法最节能的是
A.Zn+H2SO4(稀)=ZnSO4+H2↑
B.焦炭与水蒸气反应:C+H2O(气)H2+CO
C.太阳光分解水:2H2O2H2↑+O2↑
D.电解水:2H2O2H2↑+O2↑
5.下列说法正确的是
A.酸雨是指pH<7的雨水
B.浓盐酸露置于空气中,溶质的质量分数会变大
C.氢气是理想的“绿色能源”,将成为未来世界的主要能源
D.检测某矿石中含有碳酸盐,取样后加入少量稀盐酸中,有气泡产生即可
6.如图所示的化学实验操作中,正确的是
A. 倾倒液体 B. 测溶液pH
C. 滴管用后不洗直接放回原瓶 D. 实验室制取氢气
7.维生素是人体必需的营养素,维生素D2的化学式为C28H44O.下列说法正确的是( )
A.维生素D2属于有机化合物。
B.维生素D2中含有28个碳原子、44个氢原子和一个氧原子
C.维生素D2中碳、氢元素的质量比为7:11
D.一个维生素D2分子中含有22个氢分子
8.2017年5月18日,我国在南海成功连续8天稳定开采可燃冰(普遍认为其化学式为CH48H2O), 这将点燃新能源时代的曙光。可燃冰通常出现在海底以下数百至一千米的沉积层内,据推测可能是地层断裂导致气体逸出,上升的气体与海洋深处的冷水接触而形成。根据以上信息判断,下列说法正确的是
A.可燃冰不是化石燃料 B.可燃冰是比煤、石油污染更严重的燃料
C.可燃冰形成条件:高压、低温 D.可燃冰在开采过程中若泄漏,不会造成温室效应
9.下列物质中,属于有机高分子化合物的是
A.C2H2 B.CH4O C.C2H4O2 D.(C6H10O5)n
10.我市频临渤海,蕴藏丰富的海洋资源。下列对海洋化学资源利用的有关叙述错误的是
A.利用多级闪急蒸馏法淡化海水
B.利用蒸发结晶的方法从海水中提取食盐
C.利用向海水或卤水中加入石灰乳的方法将海水中的Mg2+富集沉淀出来
D.利用海底蕴藏的大量“可燃冰”作燃料,以它为燃料不会加剧温室效应
11.2020年10月,我国建成全球首套千吨级液态太阳燃料合成示范装置,其原理是:①利用太阳能光伏发电,②电解水获得H2,③H2与CO2反应合成绿色液态燃料CH3OH。下列有关说法错误的是
A.太阳能是不可再生能源 B.H2是理想的清洁、高能燃料
C.电解水反应属于分解反应 D.该装置能捕获并资源化利用CO2
12.善于梳理化学知识,能使你头脑更加聪明。以下归纳完全正确的一项是
A对化学资源的认识 B对化学元素的认识
①工厂产生的废水应净化后再利用 ②合成橡胶、碳纤维都属于合成材料 ③可燃冰是未来能源,是可再生能源 ①人体中含量最多的金属元素是钙 ②目前使用最多的金属是铁 ③稀土资源是不可再生的重要战略资源,应合理利用与保护
C化学中常见的“三” D化学与人体健康
①煤、石油、氢气——三大化石燃料 ②CO2、SO2、NO2——三种污 染性气体 ③原子、中子、电子——构成物质的三种粒子 ①可燃性气体泄漏先打开排气扇 ②缺铁会引起贫血症 ③甲醛水溶液浸泡过的海产品不能食用
A.A B.B C.C D.D
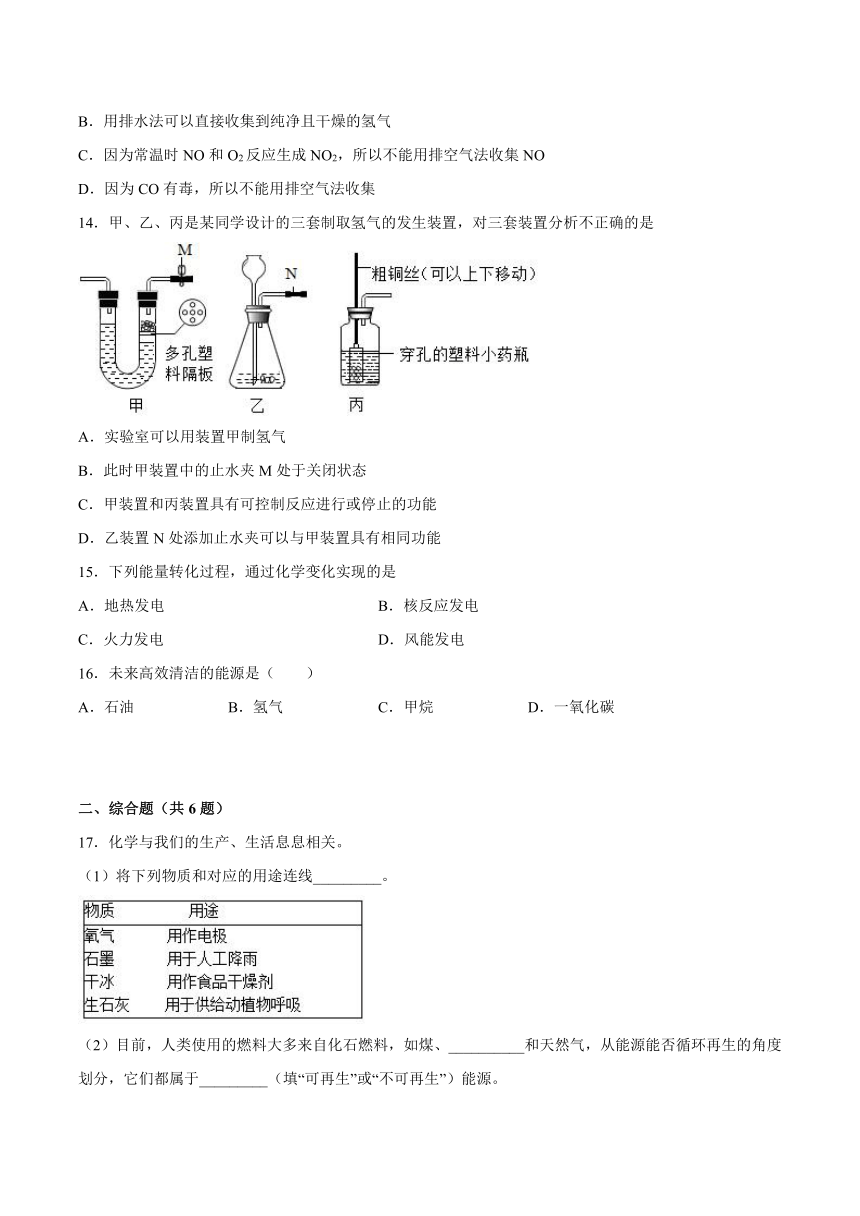
13.下列关于气体的收集方法说法正确的是
A.因为CO2能溶于水,所以不能用排水法收集
B.用排水法可以直接收集到纯净且干燥的氢气
C.因为常温时NO和O2反应生成NO2,所以不能用排空气法收集NO
D.因为CO有毒,所以不能用排空气法收集
14.甲、乙、丙是某同学设计的三套制取氢气的发生装置,对三套装置分析不正确的是
A.实验室可以用装置甲制氢气
B.此时甲装置中的止水夹M处于关闭状态
C.甲装置和丙装置具有可控制反应进行或停止的功能
D.乙装置N处添加止水夹可以与甲装置具有相同功能
15.下列能量转化过程,通过化学变化实现的是
A.地热发电 B.核反应发电
C.火力发电 D.风能发电
16.未来高效清洁的能源是( )
A.石油 B.氢气 C.甲烷 D.一氧化碳
二、综合题(共6题)
17.化学与我们的生产、生活息息相关。
(1)将下列物质和对应的用途连线_________。
(2)目前,人类使用的燃料大多来自化石燃料,如煤、__________和天然气,从能源能否循环再生的角度划分,它们都属于_________(填“可再生”或“不可再生”)能源。
(3)埋藏于海底,将来可能会替代化石燃料的新能源是_________(填字母序号)。
A.氢气 B.乙醇 C.汽油 D.可燃冰
18.能源和资源对我们非常重要,请回答下列问题。
(1)下列说法中正确的是_______________。
A人类利用的能量都是通过化学反应获得的
B化学反应中只有燃烧才能放出热量
C燃料都是不可再生能源
D增大燃料与氧气的接触面积有利于燃料充分燃烧
(2)氢气是当前最理想的燃料,它的优点之一是_________。若在实验室制取氢气,反应的化学方程式为____________。请将如图方框中实验室制取氢气的发生装置补画完整_________,(使用试管和带导管的单孔塞)
(3)水蒸气通过灼热的煤可生产水煤气,其主要成分是CO、H2还含有少量的CO2和水蒸气,请用下图所示装置设计一个实验,以证明上述混合气中含有CO和H2。(提示:白色硫酸铜固体遇水变蓝)
①装置导管的连接顺序依次是(填字母)混合气接_____________接尾气处理装置。
②证明混合气中含有CO的现象是______________。
(4)煤加工后得到的焦炭是工业上冶铁的原料之一,它在冶铁过程中的作用是_________。某炼铁厂每天消耗含氧化铁80%的赤铁矿200t,则该厂每周能产出含杂质20%的生铁多少吨________?
19.碳元素是组成许多物质的元素。
(1)下列含碳元素的物质中,属于可再生能源的是______填字母序号)。
A 、碳酸钙 B 、乙醇 C 、二氧化碳 D、 碳酸
(2)化石燃料主要包括煤、_____、天然气,它们都含有碳元素,其中天然气的主要 成分是_____填化学式)。
(3)打火机中的燃料中有一种成分可表示为 C4H10,请写出 C4H10 完全燃烧的化学方程式:_______。
20.自然界中的二氧化碳处于不停的循环过程中。
(1)下图是大自然中碳循环的局部示意图。
①上图中,消耗二氧化碳的途径是_____(填序号);
②海水能够吸收大量的二氧化碳,吸收过程中发生的反应之一是_______(用化学方程式表示)
(2)科学家设想利用太阳能加热器“捕捉”空气中过多的二氧化碳,然后再释放出来并加以利用,工作原理如下图:
①写出步骤2中反应的化学方程式_________
②下列有关这种设想的说法不正确的是______
A.充分利用太阳能 B.不需要能源 C.原理易得且可循环利用 D.可全天候使用
21.在实验室里可用下列装置完成气体的制备和性质实验,分析回答下列问题。
(1)标号①的仪器名称是 ________ ;
(2)与B相比C的优点是 __________________________________ ;根据C的优点,可用C装置完成下列实验中的 ______ ;
A.实验室制CO2 B.用过氧化氢溶液和二氧化锰制氧气
C.实验室用氯酸钾制氧气 D.实验室用锌粒和稀硫酸制氢气
(3)回答有关实验室制取二氧化碳的相关问题:
①实验室用 ________ 和稀盐酸来制取二氧化碳;
②写出实验室制取 CO2的化学反应方程式 __________________________________ ;
(4)长期使用的水壶内层会形成水垢,其主要成分是碳酸钙,用盐酸可将其除去,现取水垢2.5 g与足量的稀盐酸充分反应,水垢全部溶解,测得生成CO2的质量为0.88 g,试计算:水垢中碳酸钙的质量分数为 ____________ 。
(5)由图E所示实验现象,得出CO2的一种用途是 _____________ 。
22.实验小组同学用下面仪器完成如下实验,根据下图回答问题。
(1)用A制二氧化碳,需要的药品是大理石和_____。反应一段时间后夹紧弹簧夹,A中现象是_____。实验室用稀盐酸制氢气的化学方程式为_____。
(2)制氧气时,将B与_____(选填“C”或“D” )连接组成发生装置。排水法收集满氧气后,用玻璃片_____(选填“磨砂”或“光滑”)的一面盖住集气瓶口。
(3)A与E相连,制备二氧化碳并用镊子夹持一块蓝色石蕊试纸(如图F),证明二氧化碳密度比空气密度大且能与水反应生成酸,其操作步骤为_____。
(4)7.9克高锰酸钾完全反应时,所得氧气在标准状况下的体积是多少L?_____(标准状况下,氧气密度是1.43g/L)
参考答案
1.D
【详解】
煤、天然气、汽油等物质燃烧时都能生成大量的二氧化碳,容易造成温室效应和厄尔尼诺现象,而氢气燃烧只生成水,不污染环境.故选D.
2.D
【详解】
试题分析:根据实验室制氢气的发生装置来判断。
A、装置中试管用于药品的反应,导管用于排出产生的气体,可用于制取氢气;
B、试管中放入固体锌粒,稀硫酸从长颈漏斗中加入,产生的气体可从导管中排出,所以可以用于制取氢气;
C、锌粒放在多孔塑料片上,稀硫酸从长颈漏斗中加入,产生的气体从带弹簧夹的导管中排出,所以可以用于制取氢气;
D、因导气管下端在液面以下,所以产生的气体,不能排出,所以此装置不能完成氢气的制取。故选D
3.B
【详解】
A、加油站、加气站附近空气中含有一定量的汽油或燃气,如果在爆炸极限内,遇到明火就可能引起爆炸,所以加油站、加气站附近严禁烟火,选项A正确;
B、油难溶于水,炒菜时油锅着火,如果立即倒水浇灭,会造成高温油溅出油锅,造成人员烫伤,应该用锅盖盖灭,选项B错误;
C、冬季燃煤取暖时,可能产生一氧化碳等有毒气体,所以需要保持有效的通风,选项C正确;
D、乘坐公共交通工具,如果携带易燃易爆品,一旦发生火灾或爆炸会造成大量人员伤亡,所以乘坐公共交通工具,要严禁携带易燃易爆品,选项D正确。故选B。
4.C
【详解】
A.用锌和稀硫酸制取氢气,消耗化学药品,既不经济又不节能。故A不正确;
B.焦炭与水蒸气反应需要高温,故不节约能源。故B不正确;
C.太阳光分解水不需要消耗地球能源,只需太阳光和催化剂即可,是最节约能源的方案。故C正确;
D.电解水需要消耗电能,故不是最节能的方案。故D不正确;
故选:C。
5.C
【详解】
A、酸雨是指pH<5.6的雨水,不符合题意;
B、浓盐酸具有挥发性,露置于空气中,会挥发出氯化氢,使溶质的质量减少,溶质质量分数变小,不符合题意;
C、氢气本身无毒,完全燃烧放出的热量约为同质量甲烷的两倍多,且燃烧后的产物是水,不污染空气,是理想的“绿色能源”,符合题意;
D、检测某矿石中含有碳酸盐,取样后加入少量稀盐酸中,有气泡产生,还需将生成的气体通入澄清石灰水中,澄清石灰水变浑浊,说明生成的气体是二氧化碳,才能证明矿石中含碳酸盐,因为活泼金属也能与稀盐酸反应生成气体,有气泡产生,不符合题意。
故选C。
6.C
【详解】
A、倾倒液体时,瓶塞要倒放在桌面上,标签向着手心,瓶口紧挨试管口,试管要略微倾斜,故A错误;
B、测定溶液pH的正确操作方法为:将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较,故B错误;
C、滴瓶中胶头滴管不需要清洗,直接放回原瓶即可,故C正确;
D、实验室制取氢气,普通漏斗颈比较短,没有能伸入液面以下,造成气体从漏斗逸出,应该用长颈漏斗,且长颈漏斗末端应该浸没在液面以下;故D错误.
故选C.
7.A
【详解】
A、维生素D2属是含碳元素的化合物,属于有机化合物,故正确;B、维生素D2是由分子构成的,而不是由原子直接构成的,故错误;C、维生素D2中碳、氢元素的质量比为(12×28):(1×44)=84:11,故错误;D、分子是由原子构成的,一个维生素D2分子中含有44个氢原子,故错误。故选A。
8.C
【详解】
A、可燃冰属于化石燃料,故A错误;
B、可燃冰的主要成分是CH4 8H2O,燃烧的主要产物是二氧化碳和水,所以比煤、石油污染要轻得多,故B错误;
C、可燃冰通常出现在海底以下数百至一千米的沉积岩内,所以可燃冰形成条件:高压、低温,故C正确;
D、甲烷是造成温室效应的主要气体之一,所以可燃冰在开采过程中若泄露,会造成温室效应,故D错误。
故选C。
9.D
【详解】
A、C2H2的相对分子质量为26,不属于有机高分子化合物,故错误;
B、CH4O的相对分子质量为32,不属于有机高分子化合物,故错误;
C、C2H4O2的相对分子质量为60,不属于有机高分子化合物,故错误;
D、淀粉的相对分子质量 (12×6+1×10+16×5)×n=162n,由于n不确定,有可能达几万至几十万,属于有机高分子化合物,故正确;故选D.
10.D
【详解】
试题分析:A、利用多级闪急蒸馏法淡化海水,正确,B、由于氯化钠的溶解度随温度的升高而变化不大,故利用蒸发结晶的方法从海水中提取食盐,正确,C、利用向海水或卤水中加入石灰乳的方法将海水中的Mg2+富集沉淀出来,正确,D、引起温室效应的主要气体是二氧化碳,利用海底蕴藏的大量“可燃冰”作燃料,会生成二氧化碳,故以它为燃料会加剧温室效应,错误,故选D
11.A
【详解】
A、太阳能是可再生能源,A错误。
B、H2燃烧生成水热值高、无污染,是理想的清洁、高能燃料,B正确。
C、电解水生成氢气和氧气,一变多属于分解反应,C正确。
D、该装置能捕获并资源化利用CO2,生成CH3OH,D正确。
故选:A。
12.B
【详解】
A、①工厂产生的废水应净化后再利用,正确;
②合成橡胶属于合成材料,碳纤维属于复合材料,错误;
③可燃冰是未来能源,不是可再生能源,错误;
故A说法不完全正确;
B、①人体中含量最多的金属元素是钙元素,正确;
②目前使用最多的金属是铁,正确;
③稀土资源是不可再生的重要战略资源,应合理利用与保护,正确;
故B说法完全正确;
C、①煤、石油、天然气是三大化石燃料,氢气不是,错误;
②CO2、SO2、NO2中,二氧化碳不是污染性气体,错误;
③原子、分子和离子是构成物质的三种粒子,错误;
故C说法全部错误;
D、①可燃性气体泄漏不能先打开排气扇,错误;
②缺铁会引起贫血症,正确;
③甲醛水溶液浸泡过的海产品不能食用,正确;
故D说法不完全正确;
故选:B。
13.A
【解析】
试题分析:A选项因为CO2能溶于水,所以不能用排水法收集,是正确的叙述;B选项是错误的叙述,用排水法可以直接收集到纯净的氢气;C选项是错误的叙述,因为一氧化氮的密度比空气的接近且与空气中氧气反应,故不能用排空气法收集NO;D选项是错误的叙述,因为CO的密度比空气的接近,所以不能用排空气法收集;故答案选择A
14.D
【详解】
A、实验室用锌和稀硫酸制取氢气,不需要加热。甲是固液不加热型装置,可用于制取氢气。正确。
B、甲两侧液面不相平,说明止水夹M处于关闭状态,正确。
C、装置甲可以通过活塞控制固体与液体的接触与分离,丙可以通过上下移动铜丝控制固体与液体的接触与分离,都能控制反应的发生和停止,正确。
D、乙装置关闭N,能将液体压入长颈漏斗,但无法全部压入。无法使固体与液体分离,无法具有与甲装置相同的功能。错误。
故选D。
15.C
【解析】
分析:化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.
解:A、利用地热发电的过程中没有新物质生成,属于物理变化;
B、利用核反应发电的过程中没有新物质生成,是原子核内部的变化,不属于化学变化研究范畴;
C、利用火力发电的过程中需要燃烧煤等物质,煤燃烧能生成二氧化碳等物质,属于化学变化;
D、利用风能发电的过程中没有新物质生成,属于物理变化.
故选C.
16.B
【详解】
A、石油在燃烧时能产生二氧化硫、一氧化碳、烟尘等空气污染物,故选项不符合题题意;
B、氢气的燃烧产物是水,无污染,放热量高,属于未来高效清洁的能源,故选项符合题题意;
C、甲烷燃烧生成二氧化碳和水,虽然比较洁净,但燃烧时产生的二氧化碳排放过多会造成温室效应,故选项不符合题题意;
D、一氧化碳燃烧生成二氧化碳,燃烧时产生的二氧化碳排放过多会造成温室效应,故选项不符合题题意。
故选:B
17.
(1)
(2) 石油 不可再生
(3)D
【分析】
(1)
氧气具有氧化性,可用于供给动植物呼吸;石墨具有导电性,可用于电极;干冰用于人工降雨是利用干冰升华吸热,使周围温度降低,水蒸气冷凝成水滴;生石灰是氧化钙,氧化钙会与水反应生成氢氧化钙,可用于食品的干燥剂,所以物质与对应的用途连线为:。
(2)
目前,人类使用的燃料大多来自化石燃料,如煤、石油和天然气,从能源能否循环再生的角度划分,在短期内得不到补充,所以均属于不可再生能源,故填:石油;不可再生。
(3)
埋藏于海底,将来可能会替代化石燃料的新能源是可燃冰,可燃冰是固态甲烷水合物,可以作为燃料,故将来可能会替代化石燃料,故填:D。
18.D 清洁无污染(热值高) EFDCABJIHG 丁中澄清石灰水变浑浊 提供热量,制还原剂CO 980
【详解】
(1)A、人类利用的能量也是可以通过物理反应获得的,如风力发电,不符合题意;
B、化学反应中不是只有燃烧才能放出热量,如中和反应放出热量,不符合题意;
C、燃料不都是不可再生能源,如乙醇属于可再生能源,不符合题意;
D、增大燃料与氧气的接触面积,可以使其反应更充分,有利于燃料充分燃烧,符合题意;
故选D;
(2)氢气是当前最理想的燃料,它的优点之一是:燃烧产物只有水,比较环保、热值比较高;
实验室通常用锌与稀硫酸反应制取氢气,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:;
实验室通常用锌与稀硫酸反应制取氢气,该反应属于固液不加热反应,故发生装置补画完整 ;
(3)①要想证明上述混合气中含有CO和H2,可使其通过灼热的氧化铜,一氧化碳与氧化铜在加热的条件下反应生成铜和二氧化碳,氢气与氧化铜在加热的条件下反应生成铜和水,然后验证生成了水和二氧化碳即可,由于混合气体中含有二氧化碳和水蒸气,故要先除杂,防止其对一氧化碳和氢气的验证产生干扰,二氧化碳能与氢氧化钠反应,可用氢氧化钠除去二氧化碳,浓硫酸具有吸水性,可用浓硫酸除去水蒸气,洗气应“长进短出”,且应先除杂再干燥,二氧化碳能使澄清石灰水变浑浊,可用澄清石灰水验证反应生成的二氧化碳,无水硫酸铜遇水变蓝,可用无水硫酸铜验证反应生成的水,洗气应“长进短出”,干燥管应“大口进、小口处”,应先检验水,再检验二氧化碳,故连接顺序为:EFDCABJIHG;
②一氧化碳、氢气都能与氧化铜反应生成铜和二氧化碳,故甲中黑色固体变红,不能证明含有一氧化碳,一氧化碳与氧化铜反应生成的二氧化碳能使澄清石灰水变浑浊,故证明混合气中含有CO的现象是:丁中澄清石灰水变浑浊;
(4)在工业炼铁中,焦炭能与氧气反应生成二氧化碳,该反应放出热量,故可提供热量,二氧化碳与碳在高温下反应生成一氧化碳,还可提供还原剂CO,故填:提供热量,制还原剂CO;
解:设该厂每天能产出铁的质量是x
x=112t
则该厂每周能产出含杂质20%的生铁的质量为:。
19.B 石油 CH4 2C4H10+13O2 8CO2+10H2O
【详解】
(1)乙醇属于可再生能源;(2)化石燃料主要包括煤、石油、天然气,它们都含有碳元素,其中天然气的主要 成分是甲烷,化学式为:CH4;(3)打火机中的燃料中有一种成分可表示为 C4H10,丁烷完全燃烧生成水和二氧化碳,化学方程式为:2C4H10+13O28CO2+10H2O。
20.③⑤ CO2+H2O=H2CO3 CaCO3 CaO+CO2↑ BD
【详解】
(1)①图中,消耗二氧化碳的途径是光合作用和海水的吸收;故填:③⑤;
②二氧化碳与水反应生成碳酸;故填:CO2+H2O=H2CO3;
(2)①步骤2中反应是碳酸钙在高温的条件下分解为氧化钙和二氧化碳气体;故填:CaCO3 CaO+CO2↑;
②该设想充分利用太阳能,原理易得且可循环利用;故填:BD。
21.长颈漏斗 可以控制反应的发生和停止 AD 大理石或石灰石 CaCO3+2HCl=CaCl2+H2O+CO2↑ 80% 灭火
【详解】
(1)据图可知仪器①是长颈漏斗;
(2)与B相比C的优点是:可以控制反应的发生和停止;根据C的优点,可用C装置完成:实验室制二氧化碳,实验室用锌粒和稀硫酸制氢气;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)设水垢中碳酸钙的质量分数为x;
所以x=80%
(5)由图E所示实验现象,得出CO2的一种用途是灭火。
22.稀盐酸 试管中液面下降,长颈漏斗中液面上升,固体和液体分离,反应停止 Zn+2HCl═ZnCl2+H2↑ D 磨砂 把两条蓝色石蕊试纸同时放在a、b处,b、a处先后变红色 0.56L
解:设高锰酸钾生成氧气质量为x
氧气体积为。
【详解】
(1)①)用A制二氧化碳,需要的药品是大理石和稀盐酸,反应一段时间后夹紧弹簧夹,A中现象是:试管中液面下降,长颈漏斗中液面上升,固体和液体分离,反应停止。实验室用稀盐酸制氢气,稀盐酸和锌反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑。
(2)实验时制取氧气时,导管不能伸入太长,所以制氧气时,将B与D连接组成发生装置,排水法收集满氧气后,用玻璃片磨砂的一面盖住集气瓶口。
(3)证明二氧化碳密度比空气密度大且能与水反应生成酸,操作步骤为:把两条蓝色石蕊试纸同时放在a、b处,b、a处先后变红色,说明二氧化碳密度比空气大,二氧化碳和水反应生成碳酸,从而使石蕊变红色。。
(4)见答案。
一、选择题(共16题)
1.厄尔尼诺的原因之一是大气中CO2剧增,为减缓之,最理想燃料是( )
A.优质煤 B.天然气 C.汽油 D.氢气
2.下列简易装置不能用于制取氢气的是( )
A. B.
C. D.
3.生活处处有化学,安全时刻记心中。下列做法不合理的是()
A.加油站、加气站附近严禁烟火
B.炒菜时油锅着火,立即倒水浇灭
C.冬季燃煤取暖时,保持有效的通风
D.乘坐公共交通工具,严禁携带易燃易爆品
4.我国“十二五”规划对“低碳经济”给予政策支持,实现“低碳经济”的一种策略是节能。下列制备氢气的方法最节能的是
A.Zn+H2SO4(稀)=ZnSO4+H2↑
B.焦炭与水蒸气反应:C+H2O(气)H2+CO
C.太阳光分解水:2H2O2H2↑+O2↑
D.电解水:2H2O2H2↑+O2↑
5.下列说法正确的是
A.酸雨是指pH<7的雨水
B.浓盐酸露置于空气中,溶质的质量分数会变大
C.氢气是理想的“绿色能源”,将成为未来世界的主要能源
D.检测某矿石中含有碳酸盐,取样后加入少量稀盐酸中,有气泡产生即可
6.如图所示的化学实验操作中,正确的是
A. 倾倒液体 B. 测溶液pH
C. 滴管用后不洗直接放回原瓶 D. 实验室制取氢气
7.维生素是人体必需的营养素,维生素D2的化学式为C28H44O.下列说法正确的是( )
A.维生素D2属于有机化合物。
B.维生素D2中含有28个碳原子、44个氢原子和一个氧原子
C.维生素D2中碳、氢元素的质量比为7:11
D.一个维生素D2分子中含有22个氢分子
8.2017年5月18日,我国在南海成功连续8天稳定开采可燃冰(普遍认为其化学式为CH48H2O), 这将点燃新能源时代的曙光。可燃冰通常出现在海底以下数百至一千米的沉积层内,据推测可能是地层断裂导致气体逸出,上升的气体与海洋深处的冷水接触而形成。根据以上信息判断,下列说法正确的是
A.可燃冰不是化石燃料 B.可燃冰是比煤、石油污染更严重的燃料
C.可燃冰形成条件:高压、低温 D.可燃冰在开采过程中若泄漏,不会造成温室效应
9.下列物质中,属于有机高分子化合物的是
A.C2H2 B.CH4O C.C2H4O2 D.(C6H10O5)n
10.我市频临渤海,蕴藏丰富的海洋资源。下列对海洋化学资源利用的有关叙述错误的是
A.利用多级闪急蒸馏法淡化海水
B.利用蒸发结晶的方法从海水中提取食盐
C.利用向海水或卤水中加入石灰乳的方法将海水中的Mg2+富集沉淀出来
D.利用海底蕴藏的大量“可燃冰”作燃料,以它为燃料不会加剧温室效应
11.2020年10月,我国建成全球首套千吨级液态太阳燃料合成示范装置,其原理是:①利用太阳能光伏发电,②电解水获得H2,③H2与CO2反应合成绿色液态燃料CH3OH。下列有关说法错误的是
A.太阳能是不可再生能源 B.H2是理想的清洁、高能燃料
C.电解水反应属于分解反应 D.该装置能捕获并资源化利用CO2
12.善于梳理化学知识,能使你头脑更加聪明。以下归纳完全正确的一项是
A对化学资源的认识 B对化学元素的认识
①工厂产生的废水应净化后再利用 ②合成橡胶、碳纤维都属于合成材料 ③可燃冰是未来能源,是可再生能源 ①人体中含量最多的金属元素是钙 ②目前使用最多的金属是铁 ③稀土资源是不可再生的重要战略资源,应合理利用与保护
C化学中常见的“三” D化学与人体健康
①煤、石油、氢气——三大化石燃料 ②CO2、SO2、NO2——三种污 染性气体 ③原子、中子、电子——构成物质的三种粒子 ①可燃性气体泄漏先打开排气扇 ②缺铁会引起贫血症 ③甲醛水溶液浸泡过的海产品不能食用
A.A B.B C.C D.D
13.下列关于气体的收集方法说法正确的是
A.因为CO2能溶于水,所以不能用排水法收集
B.用排水法可以直接收集到纯净且干燥的氢气
C.因为常温时NO和O2反应生成NO2,所以不能用排空气法收集NO
D.因为CO有毒,所以不能用排空气法收集
14.甲、乙、丙是某同学设计的三套制取氢气的发生装置,对三套装置分析不正确的是
A.实验室可以用装置甲制氢气
B.此时甲装置中的止水夹M处于关闭状态
C.甲装置和丙装置具有可控制反应进行或停止的功能
D.乙装置N处添加止水夹可以与甲装置具有相同功能
15.下列能量转化过程,通过化学变化实现的是
A.地热发电 B.核反应发电
C.火力发电 D.风能发电
16.未来高效清洁的能源是( )
A.石油 B.氢气 C.甲烷 D.一氧化碳
二、综合题(共6题)
17.化学与我们的生产、生活息息相关。
(1)将下列物质和对应的用途连线_________。
(2)目前,人类使用的燃料大多来自化石燃料,如煤、__________和天然气,从能源能否循环再生的角度划分,它们都属于_________(填“可再生”或“不可再生”)能源。
(3)埋藏于海底,将来可能会替代化石燃料的新能源是_________(填字母序号)。
A.氢气 B.乙醇 C.汽油 D.可燃冰
18.能源和资源对我们非常重要,请回答下列问题。
(1)下列说法中正确的是_______________。
A人类利用的能量都是通过化学反应获得的
B化学反应中只有燃烧才能放出热量
C燃料都是不可再生能源
D增大燃料与氧气的接触面积有利于燃料充分燃烧
(2)氢气是当前最理想的燃料,它的优点之一是_________。若在实验室制取氢气,反应的化学方程式为____________。请将如图方框中实验室制取氢气的发生装置补画完整_________,(使用试管和带导管的单孔塞)
(3)水蒸气通过灼热的煤可生产水煤气,其主要成分是CO、H2还含有少量的CO2和水蒸气,请用下图所示装置设计一个实验,以证明上述混合气中含有CO和H2。(提示:白色硫酸铜固体遇水变蓝)
①装置导管的连接顺序依次是(填字母)混合气接_____________接尾气处理装置。
②证明混合气中含有CO的现象是______________。
(4)煤加工后得到的焦炭是工业上冶铁的原料之一,它在冶铁过程中的作用是_________。某炼铁厂每天消耗含氧化铁80%的赤铁矿200t,则该厂每周能产出含杂质20%的生铁多少吨________?
19.碳元素是组成许多物质的元素。
(1)下列含碳元素的物质中,属于可再生能源的是______填字母序号)。
A 、碳酸钙 B 、乙醇 C 、二氧化碳 D、 碳酸
(2)化石燃料主要包括煤、_____、天然气,它们都含有碳元素,其中天然气的主要 成分是_____填化学式)。
(3)打火机中的燃料中有一种成分可表示为 C4H10,请写出 C4H10 完全燃烧的化学方程式:_______。
20.自然界中的二氧化碳处于不停的循环过程中。
(1)下图是大自然中碳循环的局部示意图。
①上图中,消耗二氧化碳的途径是_____(填序号);
②海水能够吸收大量的二氧化碳,吸收过程中发生的反应之一是_______(用化学方程式表示)
(2)科学家设想利用太阳能加热器“捕捉”空气中过多的二氧化碳,然后再释放出来并加以利用,工作原理如下图:
①写出步骤2中反应的化学方程式_________
②下列有关这种设想的说法不正确的是______
A.充分利用太阳能 B.不需要能源 C.原理易得且可循环利用 D.可全天候使用
21.在实验室里可用下列装置完成气体的制备和性质实验,分析回答下列问题。
(1)标号①的仪器名称是 ________ ;
(2)与B相比C的优点是 __________________________________ ;根据C的优点,可用C装置完成下列实验中的 ______ ;
A.实验室制CO2 B.用过氧化氢溶液和二氧化锰制氧气
C.实验室用氯酸钾制氧气 D.实验室用锌粒和稀硫酸制氢气
(3)回答有关实验室制取二氧化碳的相关问题:
①实验室用 ________ 和稀盐酸来制取二氧化碳;
②写出实验室制取 CO2的化学反应方程式 __________________________________ ;
(4)长期使用的水壶内层会形成水垢,其主要成分是碳酸钙,用盐酸可将其除去,现取水垢2.5 g与足量的稀盐酸充分反应,水垢全部溶解,测得生成CO2的质量为0.88 g,试计算:水垢中碳酸钙的质量分数为 ____________ 。
(5)由图E所示实验现象,得出CO2的一种用途是 _____________ 。
22.实验小组同学用下面仪器完成如下实验,根据下图回答问题。
(1)用A制二氧化碳,需要的药品是大理石和_____。反应一段时间后夹紧弹簧夹,A中现象是_____。实验室用稀盐酸制氢气的化学方程式为_____。
(2)制氧气时,将B与_____(选填“C”或“D” )连接组成发生装置。排水法收集满氧气后,用玻璃片_____(选填“磨砂”或“光滑”)的一面盖住集气瓶口。
(3)A与E相连,制备二氧化碳并用镊子夹持一块蓝色石蕊试纸(如图F),证明二氧化碳密度比空气密度大且能与水反应生成酸,其操作步骤为_____。
(4)7.9克高锰酸钾完全反应时,所得氧气在标准状况下的体积是多少L?_____(标准状况下,氧气密度是1.43g/L)
参考答案
1.D
【详解】
煤、天然气、汽油等物质燃烧时都能生成大量的二氧化碳,容易造成温室效应和厄尔尼诺现象,而氢气燃烧只生成水,不污染环境.故选D.
2.D
【详解】
试题分析:根据实验室制氢气的发生装置来判断。
A、装置中试管用于药品的反应,导管用于排出产生的气体,可用于制取氢气;
B、试管中放入固体锌粒,稀硫酸从长颈漏斗中加入,产生的气体可从导管中排出,所以可以用于制取氢气;
C、锌粒放在多孔塑料片上,稀硫酸从长颈漏斗中加入,产生的气体从带弹簧夹的导管中排出,所以可以用于制取氢气;
D、因导气管下端在液面以下,所以产生的气体,不能排出,所以此装置不能完成氢气的制取。故选D
3.B
【详解】
A、加油站、加气站附近空气中含有一定量的汽油或燃气,如果在爆炸极限内,遇到明火就可能引起爆炸,所以加油站、加气站附近严禁烟火,选项A正确;
B、油难溶于水,炒菜时油锅着火,如果立即倒水浇灭,会造成高温油溅出油锅,造成人员烫伤,应该用锅盖盖灭,选项B错误;
C、冬季燃煤取暖时,可能产生一氧化碳等有毒气体,所以需要保持有效的通风,选项C正确;
D、乘坐公共交通工具,如果携带易燃易爆品,一旦发生火灾或爆炸会造成大量人员伤亡,所以乘坐公共交通工具,要严禁携带易燃易爆品,选项D正确。故选B。
4.C
【详解】
A.用锌和稀硫酸制取氢气,消耗化学药品,既不经济又不节能。故A不正确;
B.焦炭与水蒸气反应需要高温,故不节约能源。故B不正确;
C.太阳光分解水不需要消耗地球能源,只需太阳光和催化剂即可,是最节约能源的方案。故C正确;
D.电解水需要消耗电能,故不是最节能的方案。故D不正确;
故选:C。
5.C
【详解】
A、酸雨是指pH<5.6的雨水,不符合题意;
B、浓盐酸具有挥发性,露置于空气中,会挥发出氯化氢,使溶质的质量减少,溶质质量分数变小,不符合题意;
C、氢气本身无毒,完全燃烧放出的热量约为同质量甲烷的两倍多,且燃烧后的产物是水,不污染空气,是理想的“绿色能源”,符合题意;
D、检测某矿石中含有碳酸盐,取样后加入少量稀盐酸中,有气泡产生,还需将生成的气体通入澄清石灰水中,澄清石灰水变浑浊,说明生成的气体是二氧化碳,才能证明矿石中含碳酸盐,因为活泼金属也能与稀盐酸反应生成气体,有气泡产生,不符合题意。
故选C。
6.C
【详解】
A、倾倒液体时,瓶塞要倒放在桌面上,标签向着手心,瓶口紧挨试管口,试管要略微倾斜,故A错误;
B、测定溶液pH的正确操作方法为:将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较,故B错误;
C、滴瓶中胶头滴管不需要清洗,直接放回原瓶即可,故C正确;
D、实验室制取氢气,普通漏斗颈比较短,没有能伸入液面以下,造成气体从漏斗逸出,应该用长颈漏斗,且长颈漏斗末端应该浸没在液面以下;故D错误.
故选C.
7.A
【详解】
A、维生素D2属是含碳元素的化合物,属于有机化合物,故正确;B、维生素D2是由分子构成的,而不是由原子直接构成的,故错误;C、维生素D2中碳、氢元素的质量比为(12×28):(1×44)=84:11,故错误;D、分子是由原子构成的,一个维生素D2分子中含有44个氢原子,故错误。故选A。
8.C
【详解】
A、可燃冰属于化石燃料,故A错误;
B、可燃冰的主要成分是CH4 8H2O,燃烧的主要产物是二氧化碳和水,所以比煤、石油污染要轻得多,故B错误;
C、可燃冰通常出现在海底以下数百至一千米的沉积岩内,所以可燃冰形成条件:高压、低温,故C正确;
D、甲烷是造成温室效应的主要气体之一,所以可燃冰在开采过程中若泄露,会造成温室效应,故D错误。
故选C。
9.D
【详解】
A、C2H2的相对分子质量为26,不属于有机高分子化合物,故错误;
B、CH4O的相对分子质量为32,不属于有机高分子化合物,故错误;
C、C2H4O2的相对分子质量为60,不属于有机高分子化合物,故错误;
D、淀粉的相对分子质量 (12×6+1×10+16×5)×n=162n,由于n不确定,有可能达几万至几十万,属于有机高分子化合物,故正确;故选D.
10.D
【详解】
试题分析:A、利用多级闪急蒸馏法淡化海水,正确,B、由于氯化钠的溶解度随温度的升高而变化不大,故利用蒸发结晶的方法从海水中提取食盐,正确,C、利用向海水或卤水中加入石灰乳的方法将海水中的Mg2+富集沉淀出来,正确,D、引起温室效应的主要气体是二氧化碳,利用海底蕴藏的大量“可燃冰”作燃料,会生成二氧化碳,故以它为燃料会加剧温室效应,错误,故选D
11.A
【详解】
A、太阳能是可再生能源,A错误。
B、H2燃烧生成水热值高、无污染,是理想的清洁、高能燃料,B正确。
C、电解水生成氢气和氧气,一变多属于分解反应,C正确。
D、该装置能捕获并资源化利用CO2,生成CH3OH,D正确。
故选:A。
12.B
【详解】
A、①工厂产生的废水应净化后再利用,正确;
②合成橡胶属于合成材料,碳纤维属于复合材料,错误;
③可燃冰是未来能源,不是可再生能源,错误;
故A说法不完全正确;
B、①人体中含量最多的金属元素是钙元素,正确;
②目前使用最多的金属是铁,正确;
③稀土资源是不可再生的重要战略资源,应合理利用与保护,正确;
故B说法完全正确;
C、①煤、石油、天然气是三大化石燃料,氢气不是,错误;
②CO2、SO2、NO2中,二氧化碳不是污染性气体,错误;
③原子、分子和离子是构成物质的三种粒子,错误;
故C说法全部错误;
D、①可燃性气体泄漏不能先打开排气扇,错误;
②缺铁会引起贫血症,正确;
③甲醛水溶液浸泡过的海产品不能食用,正确;
故D说法不完全正确;
故选:B。
13.A
【解析】
试题分析:A选项因为CO2能溶于水,所以不能用排水法收集,是正确的叙述;B选项是错误的叙述,用排水法可以直接收集到纯净的氢气;C选项是错误的叙述,因为一氧化氮的密度比空气的接近且与空气中氧气反应,故不能用排空气法收集NO;D选项是错误的叙述,因为CO的密度比空气的接近,所以不能用排空气法收集;故答案选择A
14.D
【详解】
A、实验室用锌和稀硫酸制取氢气,不需要加热。甲是固液不加热型装置,可用于制取氢气。正确。
B、甲两侧液面不相平,说明止水夹M处于关闭状态,正确。
C、装置甲可以通过活塞控制固体与液体的接触与分离,丙可以通过上下移动铜丝控制固体与液体的接触与分离,都能控制反应的发生和停止,正确。
D、乙装置关闭N,能将液体压入长颈漏斗,但无法全部压入。无法使固体与液体分离,无法具有与甲装置相同的功能。错误。
故选D。
15.C
【解析】
分析:化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.
解:A、利用地热发电的过程中没有新物质生成,属于物理变化;
B、利用核反应发电的过程中没有新物质生成,是原子核内部的变化,不属于化学变化研究范畴;
C、利用火力发电的过程中需要燃烧煤等物质,煤燃烧能生成二氧化碳等物质,属于化学变化;
D、利用风能发电的过程中没有新物质生成,属于物理变化.
故选C.
16.B
【详解】
A、石油在燃烧时能产生二氧化硫、一氧化碳、烟尘等空气污染物,故选项不符合题题意;
B、氢气的燃烧产物是水,无污染,放热量高,属于未来高效清洁的能源,故选项符合题题意;
C、甲烷燃烧生成二氧化碳和水,虽然比较洁净,但燃烧时产生的二氧化碳排放过多会造成温室效应,故选项不符合题题意;
D、一氧化碳燃烧生成二氧化碳,燃烧时产生的二氧化碳排放过多会造成温室效应,故选项不符合题题意。
故选:B
17.
(1)
(2) 石油 不可再生
(3)D
【分析】
(1)
氧气具有氧化性,可用于供给动植物呼吸;石墨具有导电性,可用于电极;干冰用于人工降雨是利用干冰升华吸热,使周围温度降低,水蒸气冷凝成水滴;生石灰是氧化钙,氧化钙会与水反应生成氢氧化钙,可用于食品的干燥剂,所以物质与对应的用途连线为:。
(2)
目前,人类使用的燃料大多来自化石燃料,如煤、石油和天然气,从能源能否循环再生的角度划分,在短期内得不到补充,所以均属于不可再生能源,故填:石油;不可再生。
(3)
埋藏于海底,将来可能会替代化石燃料的新能源是可燃冰,可燃冰是固态甲烷水合物,可以作为燃料,故将来可能会替代化石燃料,故填:D。
18.D 清洁无污染(热值高) EFDCABJIHG 丁中澄清石灰水变浑浊 提供热量,制还原剂CO 980
【详解】
(1)A、人类利用的能量也是可以通过物理反应获得的,如风力发电,不符合题意;
B、化学反应中不是只有燃烧才能放出热量,如中和反应放出热量,不符合题意;
C、燃料不都是不可再生能源,如乙醇属于可再生能源,不符合题意;
D、增大燃料与氧气的接触面积,可以使其反应更充分,有利于燃料充分燃烧,符合题意;
故选D;
(2)氢气是当前最理想的燃料,它的优点之一是:燃烧产物只有水,比较环保、热值比较高;
实验室通常用锌与稀硫酸反应制取氢气,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:;
实验室通常用锌与稀硫酸反应制取氢气,该反应属于固液不加热反应,故发生装置补画完整 ;
(3)①要想证明上述混合气中含有CO和H2,可使其通过灼热的氧化铜,一氧化碳与氧化铜在加热的条件下反应生成铜和二氧化碳,氢气与氧化铜在加热的条件下反应生成铜和水,然后验证生成了水和二氧化碳即可,由于混合气体中含有二氧化碳和水蒸气,故要先除杂,防止其对一氧化碳和氢气的验证产生干扰,二氧化碳能与氢氧化钠反应,可用氢氧化钠除去二氧化碳,浓硫酸具有吸水性,可用浓硫酸除去水蒸气,洗气应“长进短出”,且应先除杂再干燥,二氧化碳能使澄清石灰水变浑浊,可用澄清石灰水验证反应生成的二氧化碳,无水硫酸铜遇水变蓝,可用无水硫酸铜验证反应生成的水,洗气应“长进短出”,干燥管应“大口进、小口处”,应先检验水,再检验二氧化碳,故连接顺序为:EFDCABJIHG;
②一氧化碳、氢气都能与氧化铜反应生成铜和二氧化碳,故甲中黑色固体变红,不能证明含有一氧化碳,一氧化碳与氧化铜反应生成的二氧化碳能使澄清石灰水变浑浊,故证明混合气中含有CO的现象是:丁中澄清石灰水变浑浊;
(4)在工业炼铁中,焦炭能与氧气反应生成二氧化碳,该反应放出热量,故可提供热量,二氧化碳与碳在高温下反应生成一氧化碳,还可提供还原剂CO,故填:提供热量,制还原剂CO;
解:设该厂每天能产出铁的质量是x
x=112t
则该厂每周能产出含杂质20%的生铁的质量为:。
19.B 石油 CH4 2C4H10+13O2 8CO2+10H2O
【详解】
(1)乙醇属于可再生能源;(2)化石燃料主要包括煤、石油、天然气,它们都含有碳元素,其中天然气的主要 成分是甲烷,化学式为:CH4;(3)打火机中的燃料中有一种成分可表示为 C4H10,丁烷完全燃烧生成水和二氧化碳,化学方程式为:2C4H10+13O28CO2+10H2O。
20.③⑤ CO2+H2O=H2CO3 CaCO3 CaO+CO2↑ BD
【详解】
(1)①图中,消耗二氧化碳的途径是光合作用和海水的吸收;故填:③⑤;
②二氧化碳与水反应生成碳酸;故填:CO2+H2O=H2CO3;
(2)①步骤2中反应是碳酸钙在高温的条件下分解为氧化钙和二氧化碳气体;故填:CaCO3 CaO+CO2↑;
②该设想充分利用太阳能,原理易得且可循环利用;故填:BD。
21.长颈漏斗 可以控制反应的发生和停止 AD 大理石或石灰石 CaCO3+2HCl=CaCl2+H2O+CO2↑ 80% 灭火
【详解】
(1)据图可知仪器①是长颈漏斗;
(2)与B相比C的优点是:可以控制反应的发生和停止;根据C的优点,可用C装置完成:实验室制二氧化碳,实验室用锌粒和稀硫酸制氢气;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)设水垢中碳酸钙的质量分数为x;
所以x=80%
(5)由图E所示实验现象,得出CO2的一种用途是灭火。
22.稀盐酸 试管中液面下降,长颈漏斗中液面上升,固体和液体分离,反应停止 Zn+2HCl═ZnCl2+H2↑ D 磨砂 把两条蓝色石蕊试纸同时放在a、b处,b、a处先后变红色 0.56L
解:设高锰酸钾生成氧气质量为x
氧气体积为。
【详解】
(1)①)用A制二氧化碳,需要的药品是大理石和稀盐酸,反应一段时间后夹紧弹簧夹,A中现象是:试管中液面下降,长颈漏斗中液面上升,固体和液体分离,反应停止。实验室用稀盐酸制氢气,稀盐酸和锌反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑。
(2)实验时制取氧气时,导管不能伸入太长,所以制氧气时,将B与D连接组成发生装置,排水法收集满氧气后,用玻璃片磨砂的一面盖住集气瓶口。
(3)证明二氧化碳密度比空气密度大且能与水反应生成酸,操作步骤为:把两条蓝色石蕊试纸同时放在a、b处,b、a处先后变红色,说明二氧化碳密度比空气大,二氧化碳和水反应生成碳酸,从而使石蕊变红色。。
(4)见答案。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
