2022年浙江省中考科学专题练习:溶液(含解析)
文档属性
| 名称 | 2022年浙江省中考科学专题练习:溶液(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 311.7KB | ||
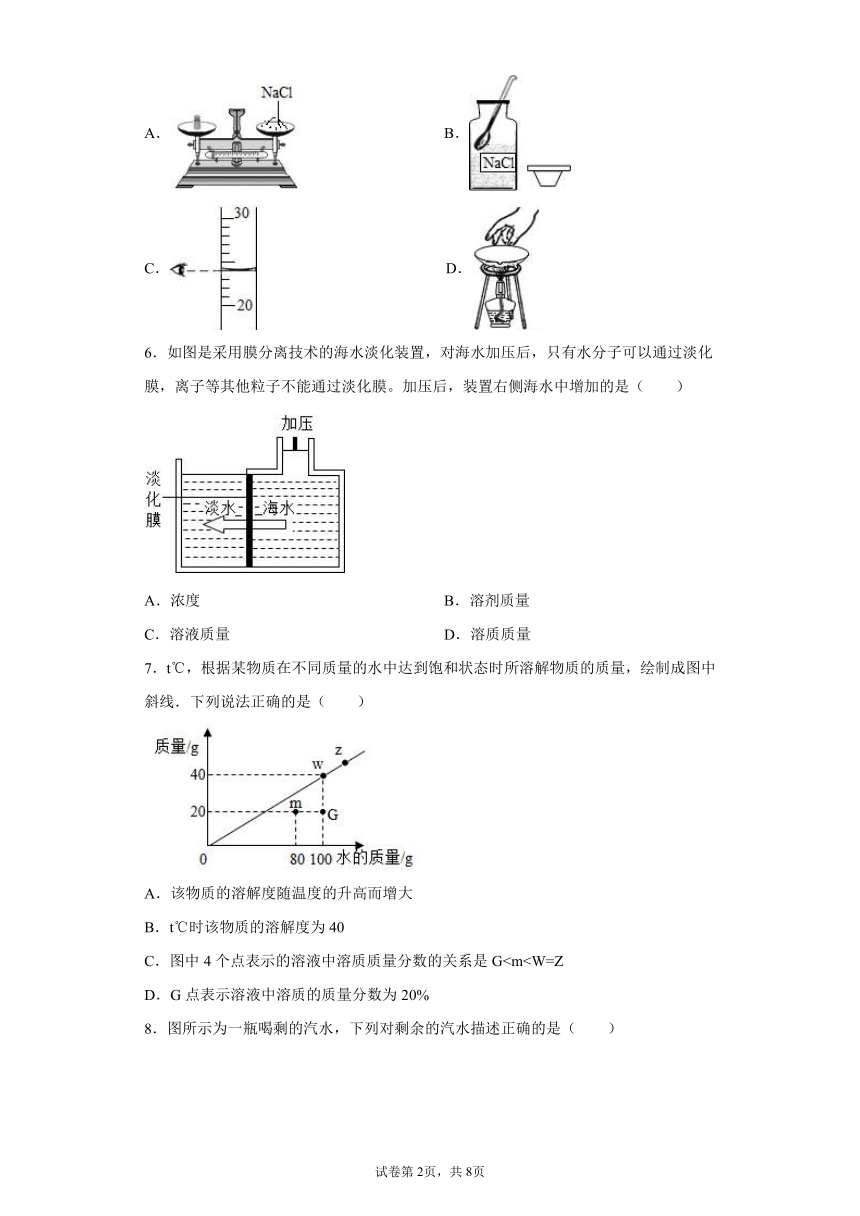
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-02-03 19:20:40 | ||
图片预览


文档简介
溶液
一、选择题
1.可以证明20℃时某硝酸钾溶液是饱和溶液的是( )
A.降温到10℃时,有硝酸钾晶体析出
B.蒸发掉10g水,有硝酸钾晶体析出
C.20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的质量分数不变
D.加热到30℃后,再加入硝酸钾晶体能继续溶解
2.60℃时,硝酸钾溶解于水的实验数据如下表,则下列叙述正确的是( )
实验序号 水的质量/g 加入氯化钠的质量/g 溶液的质量/g
① 10 9 19
② 10 10 20
③ 10 11 21
④ 10 12 21
A.②中所得溶液是饱和溶液
B.60℃时10g水最多能溶解12g硝酸钾
C.③④溶液的溶质质量分数相等
D.①所得溶液的溶质质量分数为90%
3.t℃时,向100g 30% 硝酸钾溶液中加入40g 固体硝酸钾时正好饱和,该温度下硝酸钾的溶解度为( )
A.100g B.30g C.40g D.47g
4.下列关于溶液的说法正确的是( )
A.溶液一定是无色透明的混合物
B.饱和溶液一定比不饱和溶液要浓
C.溶质可以是固体,也可以是液体或气体
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
5.粗盐提纯实验和配制一定溶质质量分数的氯化钠溶液实验中,下列操作正确的是( )
A. B.
C. D.
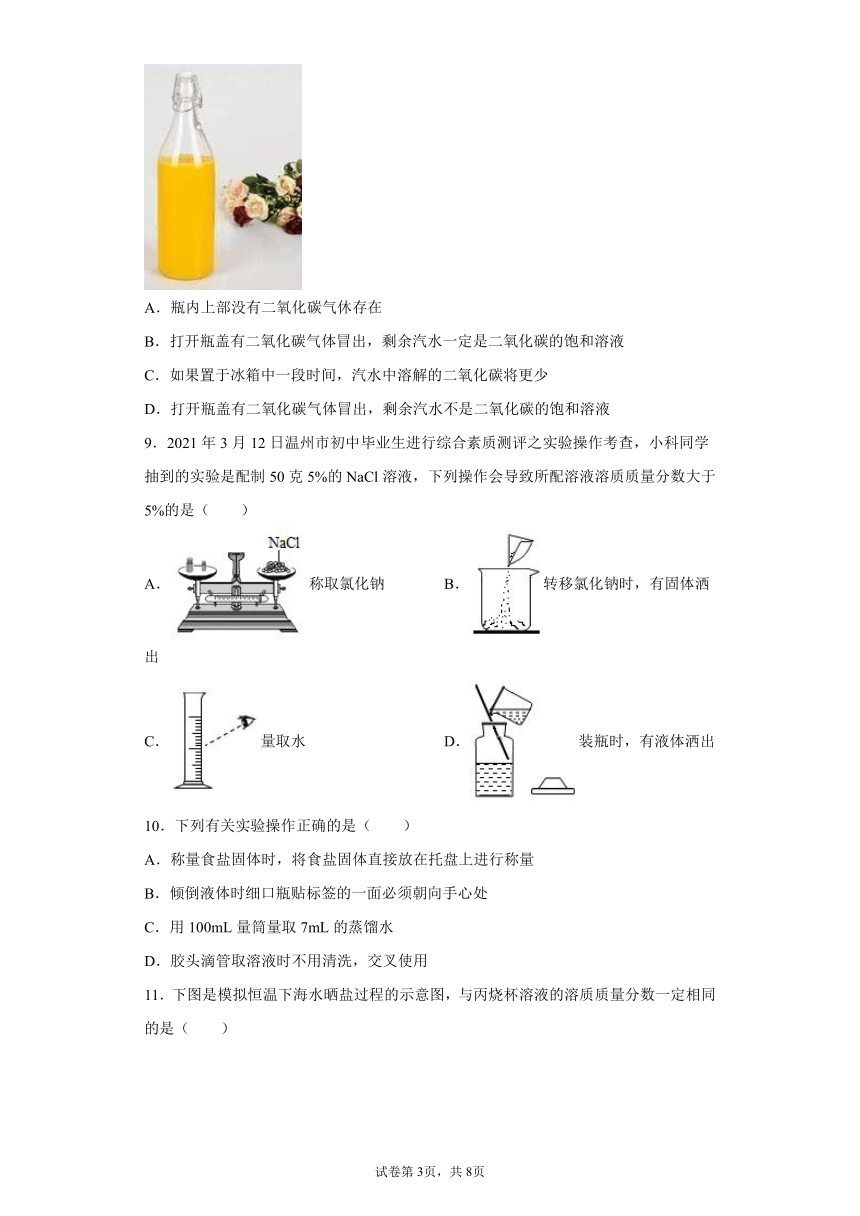
6.如图是采用膜分离技术的海水淡化装置,对海水加压后,只有水分子可以通过淡化膜,离子等其他粒子不能通过淡化膜。加压后,装置右侧海水中增加的是( )
A.浓度 B.溶剂质量
C.溶液质量 D.溶质质量
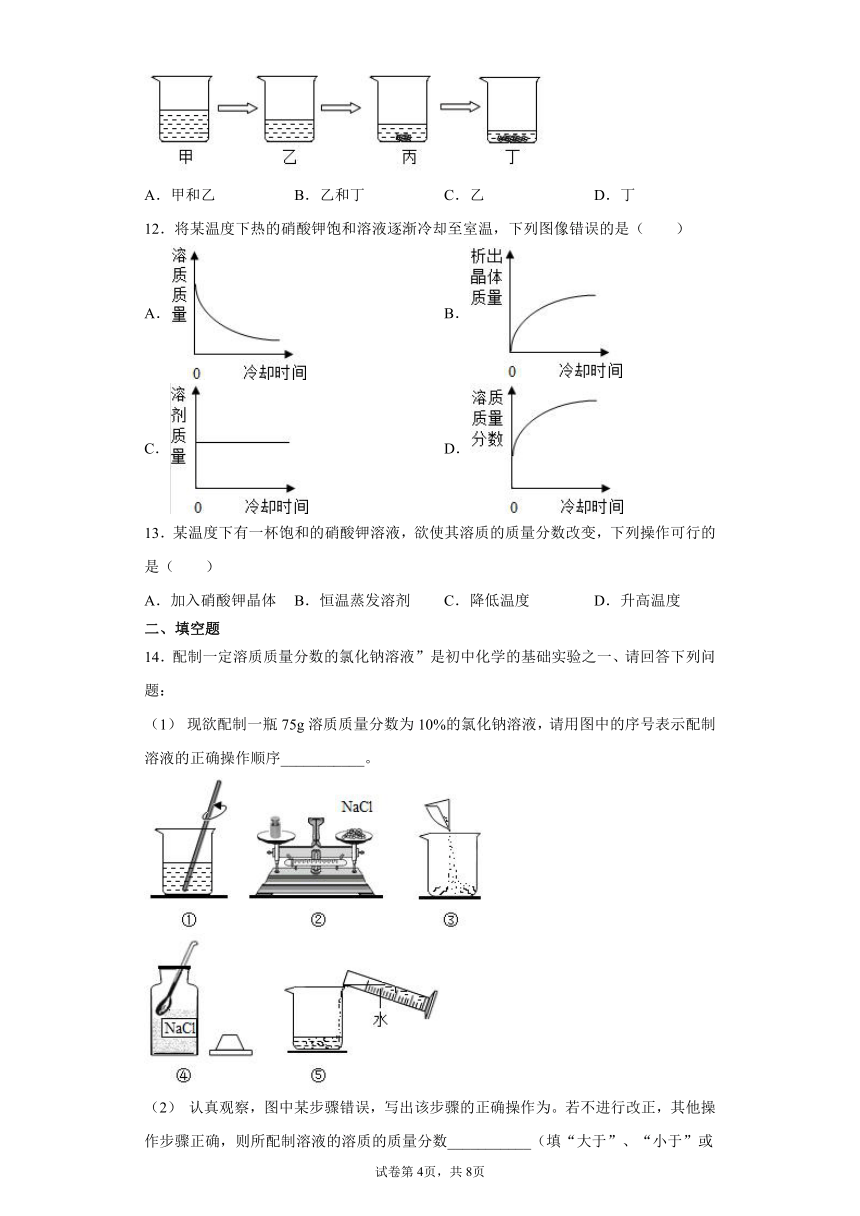
7.t℃,根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成图中斜线.下列说法正确的是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.图中4个点表示的溶液中溶质质量分数的关系是GD.G点表示溶液中溶质的质量分数为20%
8.图所示为一瓶喝剩的汽水,下列对剩余的汽水描述正确的是( )
A.瓶内上部没有二氧化碳气休存在
B.打开瓶盖有二氧化碳气体冒出,剩余汽水一定是二氧化碳的饱和溶液
C.如果置于冰箱中一段时间,汽水中溶解的二氧化碳将更少
D.打开瓶盖有二氧化碳气体冒出,剩余汽水不是二氧化碳的饱和溶液
9.2021年3月12日温州市初中毕业生进行综合素质测评之实验操作考查,小科同学抽到的实验是配制50克5%的NaCl溶液,下列操作会导致所配溶液溶质质量分数大于5%的是( )
A.称取氯化钠 B.转移氯化钠时,有固体洒出
C.量取水 D.装瓶时,有液体洒出
10.下列有关实验操作正确的是( )
A.称量食盐固体时,将食盐固体直接放在托盘上进行称量
B.倾倒液体时细口瓶贴标签的一面必须朝向手心处
C.用100mL量筒量取7mL的蒸馏水
D.胶头滴管取溶液时不用清洗,交叉使用
11.下图是模拟恒温下海水晒盐过程的示意图,与丙烧杯溶液的溶质质量分数一定相同的是( )
A.甲和乙 B.乙和丁 C.乙 D.丁
12.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列图像错误的是( )
A. B.
C. D.
13.某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数改变,下列操作可行的是( )
A.加入硝酸钾晶体 B.恒温蒸发溶剂 C.降低温度 D.升高温度
二、填空题
14.配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一、请回答下列问题:
(1) 现欲配制一瓶75g溶质质量分数为10%的氯化钠溶液,请用图中的序号表示配制溶液的正确操作顺序___________。
(2) 认真观察,图中某步骤错误,写出该步骤的正确操作为。若不进行改正,其他操作步骤正确,则所配制溶液的溶质的质量分数___________(填“大于”、“小于”或“等于”)10%。
(3) 实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,问需要15%的氯化钠溶液___________克才可配得120克5%的氯化钠溶液。
(4) t℃时某氯化钠溶液400克,在温度不变的情况下,第一次蒸发20克水,析出晶体4克;第二次又蒸发20克水,析出晶体6克。则t℃时硝酸钠的溶解度为___________克。
15.现有一木块漂浮于40℃的硝酸钾饱和溶液中,当温度改变时(不考虑由此引起的木块和溶液的体积变化),木块排开液体的体积V排随时间t发生了如图所示的变化。
(1)在温度改变的过程中,图中A、B两点对应的木块受到的浮力大小关系为FA___________FB(填“>”“<”或“=”)。
(2)由此推断出温度的改变方式是___________(填“升温”或“降温”),同时观察到烧杯底部硝酸钾晶体___________(填“增多”或“减少”)。
16.实验室有一瓶无色液体,如图所示,已知可能是氯化钠或氢氧化钠中的一种,因保存不当,其残缺的标签中只剩下“钠”和“30%”字样。
小科查阅了室温时两种物质的溶解度数据如表。
物质 氯化钠 氢氧化钠
溶解度(g) 36 109
(1)根据标签信息,结合查阅的资料,小科判断该瓶试剂不可能是___________,请说明理由:___________。
(2)小科从此瓶试剂中量取30g该溶液,需要加水多少克后将其稀释成10%的溶液___________。
17.利用如国所示的仪器和药品,测量一定质量食盐晶体的体积。同学们展开了讨论。(不考虑杂质对实验的影响)
(1)小柯提出。利用图1仪器和药品,在量简内倒入一定量的水,然后加入一定质量的食盐品体,通过观察液面的变化来测量食盐的体职。但他的想法马上遭到大家的否定,同学们讨论后提出,只要将量筒内的水换成另种液体,实验就使取得成功,该液体是___________。
(2)若在10克水中加入5克氯化钠,模拟海水晒盐的过程(如图2),则乙烧杯中的溶液___________(选填“是”、“不是”或“可能是”)氯化钠饱和溶液。
三、探究题
18.在一定温度下,向100 g水中依次加入一定质量的氯化钾固体,充分溶解。加入氯化钾的质量与得到相应溶液质量的关系如图所示:
(1) 实验③的溶液是否为饱和溶液?_____(填“是”“不是”或“无法判断”)。
(2) 实验①②③的溶液,溶质的质量分数分别为a、b、c,则它们的大小关系是___________________(用“>”“<”或“=”表示出来)。
(3)保持温度不变,将实验②的溶液露置空气一段时间后,会有少量固体析出,在这一过程中变小的量是____________。(填字母)
A.溶剂的质量B.溶质的溶解度C.溶液的质量分数
19.某实验小组为探究酸的化学性质,由甲、乙同学设计并完成了如图所示的实验.
(1)甲同学实验中所发生的化学方程式为_________ .
(查阅资料)CaCl2、NaCl的溶液呈中性,Na2CO3溶液呈________(填“酸”或“碱”)性.
(实验探究一)确定甲、乙同学上述实验后所得溶液中的溶质.
(2)取甲所得溶液少许,加入石蕊试液,溶液显红色,甲所得溶液中一定含有的溶质是________ (写化学式).
(3)取乙所得溶液少许,加入酚酞试液,溶液显红色,乙所得溶液中一定含有的溶质是________ (写化学式).
(实验探究二)
(4)甲、乙同学把上述实验所得溶液倒入同一废液缸中,观察到废液缸中产生少量气泡,最终有白色沉淀生成,该白色沉淀是________ (写化学式).
(讨论交流)丙同学提出:若将上述废缸中物质取出,过滤,所得滤液中含有哪些物质呢?经过讨论大家一致认为:一定含有NaCl,可能含有CaCl2、盐酸和Na2CO3中的部分物质.
(实验探究三)取少量滤液于试管中,滴加过量的稀硝酸,可观察到有大量气泡产生.
(归纳总结)该滤液中含有的溶质是氯化钠和________ (写化学式).
(5)(探索与拓展)有一份由Na2SO4、NaCl两种物质组成的固体样品.为确定其组成,上述小组同学将样品全部溶于蒸馏水中制成119.3g溶液,再往其中加入104gBaCl2溶液,两者恰好完全反应.过滤,得到23.3g白色沉淀和一定质量的滤液.经测定,该滤液中溶质质量分数为9%.试计算:(均需计算过程)所用BaCl2的溶液中溶质的质量分数.所用样品的质量.________
四、简答题
20.过氧乙酸是一种常用的消毒剂。现有一过氧乙酸溶液,其溶质的质量分数为10%,求:
(1)200g过氧乙酸溶液中含溶质为多少?
(2)向200g该溶液中加入200g水,所得溶液的溶质的质量分数为多少?
(3)5%的过氧乙酸溶液是由15%的过氧乙酸溶液稀释而成的,那么要配制180g该溶液,需要15%的过氧乙酸溶液多少克?需要加水多少毫升?
21.松材线虫病是危害松属植物的一种毁灭性流行病。目前,防治松材线虫主要措施是给松树“注射”一种有效成份是苦参碱的免疫激活剂。注药方法是在松树树干基部斜钻出一个小孔,在小孔上插入药剂瓶(如图),依靠树体自身的输导功能将药液运输到树体各个部位,达到防治松材线虫病的目的。已知每瓶药剂的质量是50克,苦参碱的质量分数为0.3%。求:
(1)每瓶药剂中苦参碱的质量是多少?
(2)现有10千克质量分数15%的苦参碱原液,可配成这样的免疫激活剂多少瓶?需要蒸馏水多少升?
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.C
【详解】
饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液。
A、降温到10℃时,有硝酸钾晶体析出,由于降低温度后溶解度已经变小,并不能说明降温前的溶液是否饱和,故选项错误。
B、蒸发掉10g水,有硝酸钾晶体析出,原溶液可能是饱和溶液,也可能是接近饱和的溶液,不能说明是某温度下的饱和溶液,故选项错误。
C、20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的溶质的质量分数不变,说明加入的硝酸钾没有溶解,原溶液为某温度下的饱和溶液,故选项正确。
D、加热到30℃后,再加入硝酸钾晶体能继续溶解,是因为硝酸钾升温溶解度增大,但是不能说明20℃时其溶液是饱和的,故选项错误。
故选C。
2.C
【详解】
A、对比②④可见,60℃时,10g水中达到饱和,可以溶解11g硝酸钾,②实验只溶解了10g硝酸钾,达不到饱和,故A错误。
B、由④可知,60℃时10g水最多能溶解11g硝酸钾,故B错误。
C、③④溶液中溶液中同为10g水中溶解了11g硝酸钾,所以溶液的溶质质量分数相等,故C正确。
D、①所得溶液是10g水中溶解了9g硝酸钾,溶质质量分数为,故D错误。
故选C。
3.A
【详解】
t℃时,所得饱和溶液中水的质量为:,饱和溶液中硝酸钾的质量为: ,该温度下硝酸钾的溶解度;
故选A。
4.C
【详解】
A、溶液是均一、稳定的混合物,溶液可以有颜色,例如硫酸铜溶液是蓝色的,故A错误。
B、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故B错误。
C、溶质可以是固体,也可以是液体或气体,故C正确。
D、不饱和溶液变成饱和溶液可以选择加入溶质,蒸发溶剂和改变温度,故D错误。
故选C。
5.C
【详解】
A、使用托盘天平称量时应左物右码,图示物品和砝码放颠倒了,操作错误。
B、取用药品时,试剂瓶塞应倒放,防止污染试剂,图示操作错误。
C、使用量筒量取液体时,读数时视线应和凹液面的最低处水平,图示操作正确。
D、不能用手拿热的坩埚,以免烫伤,应用坩埚钳夹取,图示操作错误。
故选C。
【点睛】
在使用固体溶解配制溶液时,操作步骤为计算-称量-溶解,其中称量包括称取溶质质量和量取溶剂体积,两个操作应先称取溶质再量取溶剂。
6.A
【详解】
A、溶质的质量不变,溶液的质量减小,故质量分数是增大的,故该选项正确;
B、水通过淡化膜向左侧移动了,所以溶剂的质量减小了,故该选项错误;
C、溶剂质量减小,溶液的质量就减小了,故该选项错误;
D、溶质不能通过淡化膜,所以其质量是不变的,故该选项错误。
故选A。
7.C
【详解】
A、根据图示,不能看出物质的溶解度随温度的升高而增大,故错误;
B、根据图示,在100g水中达到饱和状态溶解物质质量为40g,故t℃时该物质的溶解度为40g,但选项中没有带单位,故错误;
C、溶质越多,溶剂越少,溶质质量分数越大,图中4个点表示的溶液中溶质质量分数的关系是G<m<W=Z,故正确;
D, G点表示溶液中溶质的质量分数=×100%=16.7%,故错误。
故选D。
8.B
【详解】
A、因空气中含有二氧化碳,故瓶内上部没有液体的地方会有二氧化碳存在,故说法错误。
B、喝剩的汽水,二氧化碳的溶解度随压强的减小而减小,打开汽水瓶盖,压强减小,二氧化碳的溶解度也减小,但剩余饮料一定是二氧化碳的饱和溶液,故说法正确。
C、如果置于冰箱中一段时间,由于气体的溶解度随温度的降低而增大,故饮料中溶解的二氧化碳不会减少,故说法错误。
D、打开瓶盖有二氧化碳气体冒出,打开汽水瓶盖,压强减小,二氧化碳的溶解度也减小,但剩余饮料一定是二氧化碳的饱和溶液,故D说法错误。
故选B。
9.C
【详解】
A.称取氯化钠时,将氯化钠放在左盘,砝码放在右盘 ,根据“砝码质量=氯化钠质量+游码质量”可知,此时得到氯化钠的质量偏小,故A不合题意。
B.转移氯化钠时,有固体洒出,则溶质氯化钠的质量偏小,故B不合题意。
C.量取水时俯视读数,根据“俯视大仰视小”的规律可知,此时读出的示数偏大,而实际得到水的质量偏小,会导致所配溶液溶质质量分数大于5%,故C符合题意。
D.装瓶时,有液体洒出,因为溶液具有均一性,所以不会影响溶液的溶质质量分数,故D不合题意。
故选C.
10.B
【详解】
A、不能把氯化钠固体直接放在天平的托盘上称量,应放在纸片上称量,故选项说法错误。
B、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,以防止腐蚀标签,故选项说法正确。
C、量筒量程选择的依据有两点:一是保证量取一次,二是量程与液体的取用量最接近,应用10mL量筒量取7mL的水,故选项说法错误。
D、用未经洗净的滴管不能直接再吸取别的试剂,否则会污染试剂,故选项说法错误。
故选B。
11.D
【详解】
甲烧杯中溶液蒸发水分得到乙烧杯中的溶液,过程中溶剂减小,溶质不变,所以溶液的溶质质量分数甲小于乙,乙烧杯中的溶液可能不饱和,也可能刚好饱和;继续蒸发水分,相继得到丙、丁中的溶液,丙、丁中有固体析出,都是该温度下的饱和溶液,二者溶质的质量分数相同,都比甲的溶液中溶质的质量分数大,与乙的可能相同。故选D。
12.D
【分析】
硝酸钾的溶解度随着温度的升高而增大,随着温度的降低而减小,将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出。
【详解】
A、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,故A正确。
B、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,应该从零开始,故B正确。
C、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,故C正确。
D、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,溶质质量分数逐渐减小,故D错误。
故选D。
13.C
【详解】
A、某温度下,硝酸钾饱和溶液是不能再溶解硝酸钾固体,所以加入硝酸钾晶体,溶质质量不变,溶剂质量不变,溶质质量分数不变,不符合题意;
B、恒温蒸发溶剂,析出硝酸钾晶体,溶液还是饱和溶液,溶解度不变,溶质质量分数不变,不符合题意;
C、硝酸钾溶解度随温度的升高而增大,降低温度,析出硝酸钾晶体,溶质质量变小,溶剂质量不变,溶解度变小,溶质质量分数变小,符合题意;
D、升高温度,没有晶体析出,溶质质量和溶剂质量都不变,溶质质量分数不变,不符合题意。
故选C。
14.④②③⑤① 小于 40 30
【详解】
(1)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量,所以图中正确顺序是:④②③⑤①。
(2)配制一瓶75g溶质质量分数为10%的氯化钠溶液,需要氯化钠质量为:75g×10%=7.5g,则在用天平称量过程中需要移动游码。由图示可知,图中称量药品时药品和砝码放颠倒了,正确的操作是:称量时应该把药品放在左盘,把砝码放在右盘。若不进行改正,实际称量食盐的质量少了,其他操作步骤正确,则所配制溶液的溶质的质量分数小10%。
(3)设配制120克5%的氯化钠溶液需要15%的氯化钠溶液的质量为x,根据溶液稀释前后,溶质质量不变,可得
120×5%=x×15%
解得:x=40g。
(4)根据题意,“蒸发20克水后析出4克晶体”,“再蒸发20克水后,又析出6克晶体”,说明原溶液为不饱和溶液,不然第一次蒸发20克水后应该析出4克晶体。
因此,从“再蒸发20克水后,又析出6克晶体”,表明6克晶体溶解在20克水中形成的是饱和溶液。根据溶解度的定义,在一定温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,设t℃时某物质的溶解度为S
解得S=30g。
15.= 升温 减少
【详解】
(1)在温度改变的过程中,木块始终处于漂浮状态,图中 A、B 两点对应的木块受到的浮力大小关系为 FA=FB。
(2)由G=F浮=ρgV排和图像可知,木块排开液体的体积减小,说明液体的密度变大,溶解的溶质减增加;硝酸钾的溶解度随温度的升高而增大,可采取升温的方法,升温后硝酸钾饱和溶液继续溶解硝酸钾,烧杯底部硝酸钾晶体减少,溶解的溶质增加,溶液的密度增大,可使木块排开液体的体积变小。
16.氯化钠溶液 室温下氯化钠溶液中溶质的质量分数达不到30% 60g
【详解】
(1)室温下,氯化钠的溶解度为36g,即在该温度下,氯化钠的饱和溶液中,溶质的质量分数为:,所以这瓶试剂不可能是氯化钠溶液。
(2)加水稀释过程中,溶质的质量不变。设需要加水的质量为x,则
30g×30%=(30g+x)×10%
x=60g。
17.食盐饱和溶液 可能是
【详解】
(1)因为食盐易溶于水,所以不能将一定质量的食盐晶体放入盛有一定量的水的量筒内,来测量食盐的体积。将食盐晶体放入盛有饱和食盐水中,食盐不会溶解,所以读取液面刻度的变化值可知食盐晶体的体积。
(2)由海水晒盐的过程可知,甲的溶液通过蒸发溶剂形成了乙的溶液,乙溶液中没有晶体析出故可能是饱和也可能不饱和。
18.是 b=c>a A
【分析】
(1)先求溶解度,可知实验③的溶液状态;
(2)由溶质质量分数=,可分析;
(3)注意同一温度、同一溶质和溶剂,溶质的溶解度不变,饱和溶液的溶质质量分数也不变。
【详解】
(1)根据图示可知100g水中加入60g氯化钾所得溶液质量为140g,说明只溶解了40g,所以该温度下的溶解度是40g,说明实验③的溶液是饱和溶液;
(2)实验①中只溶解了20g氯化钾,实验②、③中都溶解了40g氯化钾,溶剂都是100g,所以①质量分数最小,实验②③质量分数相等,故b=c>a;
(3)A.溶剂蒸发了,导致溶剂的质量减小,故A正确;
B.保持温度不变,溶质的溶解度也不变,故B错误;
C.同一温度、同一溶质和溶剂,饱和溶液的溶质质量分数不变,故C错误;
答案选A。
19.Ca(OH)2+2HCl=CaCl2+2H2O 碱 CaCl2和HCl NaCl和Na2CO3 CaCO3 ; Na2CO3 20%;20.5g
【解析】
试题分析:
(1)甲同学实验是氢氧化钙与稀盐酸的反应;Na2CO3溶液显碱性;
(2)取甲所得溶液少许,加入石蕊试液,溶液显红色,说明溶液显酸性,所以甲所得溶液中一定含有的溶质CaCl2和 HCl;
(3)取乙所得溶液少许,加入酚酞试液,溶液显红色,说明溶液显碱性,所以乙所得溶液中一定含有的溶质NaCl 和 Na2CO3;
(4)甲、乙同学把上述实验所得溶液倒入同一废液缸中,发生的化学反应是Na2CO3+2HCl=2NaCl+H2O+CO2↑,Na2CO3+CaCl2=CaCO3↓+2NaCl,所以白色沉淀是CaCO3;
【归纳总结】取少量滤液于试管中,滴加过量的稀硝酸,可观察到有大量气泡产生,说明有碳酸钠,该滤液中含有的溶质是氯化钠和碳酸钠.解:设所用BaCl2的溶液中溶质的质量为x,设原混合物中硫酸钠的质量为z,生成氯化钠的质量为y.Na2SO4+BaCl2=BaSO4↓+2NaCl
142 208 233 117
z x 23.3g y
x=20.8g
y=11.7g
z=14.2g
(5)所用BaCl2的溶液中溶质的质量分数=20%;
(6)假设样品的质量为W,则×100%=9%
所以W=18.25g
故答案:Ca(OH)2+2HCl=CaCl2+2H2O;碱性;CaCl2和 HCl;NaCl 和 Na2CO3;CaCO3;Na2CO3;20%;18.25g
考点:探究酸碱的主要性质;有关溶质质量分数的简单计算;酸的化学性质;碱的化学性质;盐的化学性质;根据化学反应方程式的计算
20.(1)20g;(2)5%;(3)60克,120毫升
【详解】
(1)200g过氧乙酸溶液中含溶质为200g×10%=20g;
(2)向200g该溶液中加入200g水,所得溶液的溶质的质量分数为 ;
(3)5%的过氧乙酸溶液是由15%的过氧乙酸溶液稀释而成的,设要配制180g该溶液,需要15%的过氧乙酸溶液的质量为x,根据稀释前后溶质的质量不变,可得:180g×5%=15% x,x=60g,需要加水的质量:180g-60g=120g,折合120毫升。
21.(1)解:每瓶药剂中苦参碱的质量=50克×0.3%=0.15克
答:每瓶药剂中苦参碱的质量是0.15克。
(2)解:设克配制0.3%的药剂的质量为x
10kg×15%=x×0.3%
x=500kg
可配制试剂的瓶数=500kg÷50g/瓶=10000瓶
需要蒸馏水的质量=500kg 10kg=490kg
蒸馏水的体积=490kg÷1kg/L=490L
答:可配成这样的免疫激活剂10000瓶,需要蒸馏水的体积为490L。
【详解】
(1)见答案
(2)见答案答案第1页,共2页
答案第1页,共2页
一、选择题
1.可以证明20℃时某硝酸钾溶液是饱和溶液的是( )
A.降温到10℃时,有硝酸钾晶体析出
B.蒸发掉10g水,有硝酸钾晶体析出
C.20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的质量分数不变
D.加热到30℃后,再加入硝酸钾晶体能继续溶解
2.60℃时,硝酸钾溶解于水的实验数据如下表,则下列叙述正确的是( )
实验序号 水的质量/g 加入氯化钠的质量/g 溶液的质量/g
① 10 9 19
② 10 10 20
③ 10 11 21
④ 10 12 21
A.②中所得溶液是饱和溶液
B.60℃时10g水最多能溶解12g硝酸钾
C.③④溶液的溶质质量分数相等
D.①所得溶液的溶质质量分数为90%
3.t℃时,向100g 30% 硝酸钾溶液中加入40g 固体硝酸钾时正好饱和,该温度下硝酸钾的溶解度为( )
A.100g B.30g C.40g D.47g
4.下列关于溶液的说法正确的是( )
A.溶液一定是无色透明的混合物
B.饱和溶液一定比不饱和溶液要浓
C.溶质可以是固体,也可以是液体或气体
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
5.粗盐提纯实验和配制一定溶质质量分数的氯化钠溶液实验中,下列操作正确的是( )
A. B.
C. D.
6.如图是采用膜分离技术的海水淡化装置,对海水加压后,只有水分子可以通过淡化膜,离子等其他粒子不能通过淡化膜。加压后,装置右侧海水中增加的是( )
A.浓度 B.溶剂质量
C.溶液质量 D.溶质质量
7.t℃,根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成图中斜线.下列说法正确的是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.图中4个点表示的溶液中溶质质量分数的关系是G
8.图所示为一瓶喝剩的汽水,下列对剩余的汽水描述正确的是( )
A.瓶内上部没有二氧化碳气休存在
B.打开瓶盖有二氧化碳气体冒出,剩余汽水一定是二氧化碳的饱和溶液
C.如果置于冰箱中一段时间,汽水中溶解的二氧化碳将更少
D.打开瓶盖有二氧化碳气体冒出,剩余汽水不是二氧化碳的饱和溶液
9.2021年3月12日温州市初中毕业生进行综合素质测评之实验操作考查,小科同学抽到的实验是配制50克5%的NaCl溶液,下列操作会导致所配溶液溶质质量分数大于5%的是( )
A.称取氯化钠 B.转移氯化钠时,有固体洒出
C.量取水 D.装瓶时,有液体洒出
10.下列有关实验操作正确的是( )
A.称量食盐固体时,将食盐固体直接放在托盘上进行称量
B.倾倒液体时细口瓶贴标签的一面必须朝向手心处
C.用100mL量筒量取7mL的蒸馏水
D.胶头滴管取溶液时不用清洗,交叉使用
11.下图是模拟恒温下海水晒盐过程的示意图,与丙烧杯溶液的溶质质量分数一定相同的是( )
A.甲和乙 B.乙和丁 C.乙 D.丁
12.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列图像错误的是( )
A. B.
C. D.
13.某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数改变,下列操作可行的是( )
A.加入硝酸钾晶体 B.恒温蒸发溶剂 C.降低温度 D.升高温度
二、填空题
14.配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一、请回答下列问题:
(1) 现欲配制一瓶75g溶质质量分数为10%的氯化钠溶液,请用图中的序号表示配制溶液的正确操作顺序___________。
(2) 认真观察,图中某步骤错误,写出该步骤的正确操作为。若不进行改正,其他操作步骤正确,则所配制溶液的溶质的质量分数___________(填“大于”、“小于”或“等于”)10%。
(3) 实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,问需要15%的氯化钠溶液___________克才可配得120克5%的氯化钠溶液。
(4) t℃时某氯化钠溶液400克,在温度不变的情况下,第一次蒸发20克水,析出晶体4克;第二次又蒸发20克水,析出晶体6克。则t℃时硝酸钠的溶解度为___________克。
15.现有一木块漂浮于40℃的硝酸钾饱和溶液中,当温度改变时(不考虑由此引起的木块和溶液的体积变化),木块排开液体的体积V排随时间t发生了如图所示的变化。
(1)在温度改变的过程中,图中A、B两点对应的木块受到的浮力大小关系为FA___________FB(填“>”“<”或“=”)。
(2)由此推断出温度的改变方式是___________(填“升温”或“降温”),同时观察到烧杯底部硝酸钾晶体___________(填“增多”或“减少”)。
16.实验室有一瓶无色液体,如图所示,已知可能是氯化钠或氢氧化钠中的一种,因保存不当,其残缺的标签中只剩下“钠”和“30%”字样。
小科查阅了室温时两种物质的溶解度数据如表。
物质 氯化钠 氢氧化钠
溶解度(g) 36 109
(1)根据标签信息,结合查阅的资料,小科判断该瓶试剂不可能是___________,请说明理由:___________。
(2)小科从此瓶试剂中量取30g该溶液,需要加水多少克后将其稀释成10%的溶液___________。
17.利用如国所示的仪器和药品,测量一定质量食盐晶体的体积。同学们展开了讨论。(不考虑杂质对实验的影响)
(1)小柯提出。利用图1仪器和药品,在量简内倒入一定量的水,然后加入一定质量的食盐品体,通过观察液面的变化来测量食盐的体职。但他的想法马上遭到大家的否定,同学们讨论后提出,只要将量筒内的水换成另种液体,实验就使取得成功,该液体是___________。
(2)若在10克水中加入5克氯化钠,模拟海水晒盐的过程(如图2),则乙烧杯中的溶液___________(选填“是”、“不是”或“可能是”)氯化钠饱和溶液。
三、探究题
18.在一定温度下,向100 g水中依次加入一定质量的氯化钾固体,充分溶解。加入氯化钾的质量与得到相应溶液质量的关系如图所示:
(1) 实验③的溶液是否为饱和溶液?_____(填“是”“不是”或“无法判断”)。
(2) 实验①②③的溶液,溶质的质量分数分别为a、b、c,则它们的大小关系是___________________(用“>”“<”或“=”表示出来)。
(3)保持温度不变,将实验②的溶液露置空气一段时间后,会有少量固体析出,在这一过程中变小的量是____________。(填字母)
A.溶剂的质量B.溶质的溶解度C.溶液的质量分数
19.某实验小组为探究酸的化学性质,由甲、乙同学设计并完成了如图所示的实验.
(1)甲同学实验中所发生的化学方程式为_________ .
(查阅资料)CaCl2、NaCl的溶液呈中性,Na2CO3溶液呈________(填“酸”或“碱”)性.
(实验探究一)确定甲、乙同学上述实验后所得溶液中的溶质.
(2)取甲所得溶液少许,加入石蕊试液,溶液显红色,甲所得溶液中一定含有的溶质是________ (写化学式).
(3)取乙所得溶液少许,加入酚酞试液,溶液显红色,乙所得溶液中一定含有的溶质是________ (写化学式).
(实验探究二)
(4)甲、乙同学把上述实验所得溶液倒入同一废液缸中,观察到废液缸中产生少量气泡,最终有白色沉淀生成,该白色沉淀是________ (写化学式).
(讨论交流)丙同学提出:若将上述废缸中物质取出,过滤,所得滤液中含有哪些物质呢?经过讨论大家一致认为:一定含有NaCl,可能含有CaCl2、盐酸和Na2CO3中的部分物质.
(实验探究三)取少量滤液于试管中,滴加过量的稀硝酸,可观察到有大量气泡产生.
(归纳总结)该滤液中含有的溶质是氯化钠和________ (写化学式).
(5)(探索与拓展)有一份由Na2SO4、NaCl两种物质组成的固体样品.为确定其组成,上述小组同学将样品全部溶于蒸馏水中制成119.3g溶液,再往其中加入104gBaCl2溶液,两者恰好完全反应.过滤,得到23.3g白色沉淀和一定质量的滤液.经测定,该滤液中溶质质量分数为9%.试计算:(均需计算过程)所用BaCl2的溶液中溶质的质量分数.所用样品的质量.________
四、简答题
20.过氧乙酸是一种常用的消毒剂。现有一过氧乙酸溶液,其溶质的质量分数为10%,求:
(1)200g过氧乙酸溶液中含溶质为多少?
(2)向200g该溶液中加入200g水,所得溶液的溶质的质量分数为多少?
(3)5%的过氧乙酸溶液是由15%的过氧乙酸溶液稀释而成的,那么要配制180g该溶液,需要15%的过氧乙酸溶液多少克?需要加水多少毫升?
21.松材线虫病是危害松属植物的一种毁灭性流行病。目前,防治松材线虫主要措施是给松树“注射”一种有效成份是苦参碱的免疫激活剂。注药方法是在松树树干基部斜钻出一个小孔,在小孔上插入药剂瓶(如图),依靠树体自身的输导功能将药液运输到树体各个部位,达到防治松材线虫病的目的。已知每瓶药剂的质量是50克,苦参碱的质量分数为0.3%。求:
(1)每瓶药剂中苦参碱的质量是多少?
(2)现有10千克质量分数15%的苦参碱原液,可配成这样的免疫激活剂多少瓶?需要蒸馏水多少升?
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.C
【详解】
饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液。
A、降温到10℃时,有硝酸钾晶体析出,由于降低温度后溶解度已经变小,并不能说明降温前的溶液是否饱和,故选项错误。
B、蒸发掉10g水,有硝酸钾晶体析出,原溶液可能是饱和溶液,也可能是接近饱和的溶液,不能说明是某温度下的饱和溶液,故选项错误。
C、20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的溶质的质量分数不变,说明加入的硝酸钾没有溶解,原溶液为某温度下的饱和溶液,故选项正确。
D、加热到30℃后,再加入硝酸钾晶体能继续溶解,是因为硝酸钾升温溶解度增大,但是不能说明20℃时其溶液是饱和的,故选项错误。
故选C。
2.C
【详解】
A、对比②④可见,60℃时,10g水中达到饱和,可以溶解11g硝酸钾,②实验只溶解了10g硝酸钾,达不到饱和,故A错误。
B、由④可知,60℃时10g水最多能溶解11g硝酸钾,故B错误。
C、③④溶液中溶液中同为10g水中溶解了11g硝酸钾,所以溶液的溶质质量分数相等,故C正确。
D、①所得溶液是10g水中溶解了9g硝酸钾,溶质质量分数为,故D错误。
故选C。
3.A
【详解】
t℃时,所得饱和溶液中水的质量为:,饱和溶液中硝酸钾的质量为: ,该温度下硝酸钾的溶解度;
故选A。
4.C
【详解】
A、溶液是均一、稳定的混合物,溶液可以有颜色,例如硫酸铜溶液是蓝色的,故A错误。
B、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故B错误。
C、溶质可以是固体,也可以是液体或气体,故C正确。
D、不饱和溶液变成饱和溶液可以选择加入溶质,蒸发溶剂和改变温度,故D错误。
故选C。
5.C
【详解】
A、使用托盘天平称量时应左物右码,图示物品和砝码放颠倒了,操作错误。
B、取用药品时,试剂瓶塞应倒放,防止污染试剂,图示操作错误。
C、使用量筒量取液体时,读数时视线应和凹液面的最低处水平,图示操作正确。
D、不能用手拿热的坩埚,以免烫伤,应用坩埚钳夹取,图示操作错误。
故选C。
【点睛】
在使用固体溶解配制溶液时,操作步骤为计算-称量-溶解,其中称量包括称取溶质质量和量取溶剂体积,两个操作应先称取溶质再量取溶剂。
6.A
【详解】
A、溶质的质量不变,溶液的质量减小,故质量分数是增大的,故该选项正确;
B、水通过淡化膜向左侧移动了,所以溶剂的质量减小了,故该选项错误;
C、溶剂质量减小,溶液的质量就减小了,故该选项错误;
D、溶质不能通过淡化膜,所以其质量是不变的,故该选项错误。
故选A。
7.C
【详解】
A、根据图示,不能看出物质的溶解度随温度的升高而增大,故错误;
B、根据图示,在100g水中达到饱和状态溶解物质质量为40g,故t℃时该物质的溶解度为40g,但选项中没有带单位,故错误;
C、溶质越多,溶剂越少,溶质质量分数越大,图中4个点表示的溶液中溶质质量分数的关系是G<m<W=Z,故正确;
D, G点表示溶液中溶质的质量分数=×100%=16.7%,故错误。
故选D。
8.B
【详解】
A、因空气中含有二氧化碳,故瓶内上部没有液体的地方会有二氧化碳存在,故说法错误。
B、喝剩的汽水,二氧化碳的溶解度随压强的减小而减小,打开汽水瓶盖,压强减小,二氧化碳的溶解度也减小,但剩余饮料一定是二氧化碳的饱和溶液,故说法正确。
C、如果置于冰箱中一段时间,由于气体的溶解度随温度的降低而增大,故饮料中溶解的二氧化碳不会减少,故说法错误。
D、打开瓶盖有二氧化碳气体冒出,打开汽水瓶盖,压强减小,二氧化碳的溶解度也减小,但剩余饮料一定是二氧化碳的饱和溶液,故D说法错误。
故选B。
9.C
【详解】
A.称取氯化钠时,将氯化钠放在左盘,砝码放在右盘 ,根据“砝码质量=氯化钠质量+游码质量”可知,此时得到氯化钠的质量偏小,故A不合题意。
B.转移氯化钠时,有固体洒出,则溶质氯化钠的质量偏小,故B不合题意。
C.量取水时俯视读数,根据“俯视大仰视小”的规律可知,此时读出的示数偏大,而实际得到水的质量偏小,会导致所配溶液溶质质量分数大于5%,故C符合题意。
D.装瓶时,有液体洒出,因为溶液具有均一性,所以不会影响溶液的溶质质量分数,故D不合题意。
故选C.
10.B
【详解】
A、不能把氯化钠固体直接放在天平的托盘上称量,应放在纸片上称量,故选项说法错误。
B、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,以防止腐蚀标签,故选项说法正确。
C、量筒量程选择的依据有两点:一是保证量取一次,二是量程与液体的取用量最接近,应用10mL量筒量取7mL的水,故选项说法错误。
D、用未经洗净的滴管不能直接再吸取别的试剂,否则会污染试剂,故选项说法错误。
故选B。
11.D
【详解】
甲烧杯中溶液蒸发水分得到乙烧杯中的溶液,过程中溶剂减小,溶质不变,所以溶液的溶质质量分数甲小于乙,乙烧杯中的溶液可能不饱和,也可能刚好饱和;继续蒸发水分,相继得到丙、丁中的溶液,丙、丁中有固体析出,都是该温度下的饱和溶液,二者溶质的质量分数相同,都比甲的溶液中溶质的质量分数大,与乙的可能相同。故选D。
12.D
【分析】
硝酸钾的溶解度随着温度的升高而增大,随着温度的降低而减小,将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出。
【详解】
A、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,故A正确。
B、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,应该从零开始,故B正确。
C、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,故C正确。
D、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,溶质质量分数逐渐减小,故D错误。
故选D。
13.C
【详解】
A、某温度下,硝酸钾饱和溶液是不能再溶解硝酸钾固体,所以加入硝酸钾晶体,溶质质量不变,溶剂质量不变,溶质质量分数不变,不符合题意;
B、恒温蒸发溶剂,析出硝酸钾晶体,溶液还是饱和溶液,溶解度不变,溶质质量分数不变,不符合题意;
C、硝酸钾溶解度随温度的升高而增大,降低温度,析出硝酸钾晶体,溶质质量变小,溶剂质量不变,溶解度变小,溶质质量分数变小,符合题意;
D、升高温度,没有晶体析出,溶质质量和溶剂质量都不变,溶质质量分数不变,不符合题意。
故选C。
14.④②③⑤① 小于 40 30
【详解】
(1)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量,所以图中正确顺序是:④②③⑤①。
(2)配制一瓶75g溶质质量分数为10%的氯化钠溶液,需要氯化钠质量为:75g×10%=7.5g,则在用天平称量过程中需要移动游码。由图示可知,图中称量药品时药品和砝码放颠倒了,正确的操作是:称量时应该把药品放在左盘,把砝码放在右盘。若不进行改正,实际称量食盐的质量少了,其他操作步骤正确,则所配制溶液的溶质的质量分数小10%。
(3)设配制120克5%的氯化钠溶液需要15%的氯化钠溶液的质量为x,根据溶液稀释前后,溶质质量不变,可得
120×5%=x×15%
解得:x=40g。
(4)根据题意,“蒸发20克水后析出4克晶体”,“再蒸发20克水后,又析出6克晶体”,说明原溶液为不饱和溶液,不然第一次蒸发20克水后应该析出4克晶体。
因此,从“再蒸发20克水后,又析出6克晶体”,表明6克晶体溶解在20克水中形成的是饱和溶液。根据溶解度的定义,在一定温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,设t℃时某物质的溶解度为S
解得S=30g。
15.= 升温 减少
【详解】
(1)在温度改变的过程中,木块始终处于漂浮状态,图中 A、B 两点对应的木块受到的浮力大小关系为 FA=FB。
(2)由G=F浮=ρgV排和图像可知,木块排开液体的体积减小,说明液体的密度变大,溶解的溶质减增加;硝酸钾的溶解度随温度的升高而增大,可采取升温的方法,升温后硝酸钾饱和溶液继续溶解硝酸钾,烧杯底部硝酸钾晶体减少,溶解的溶质增加,溶液的密度增大,可使木块排开液体的体积变小。
16.氯化钠溶液 室温下氯化钠溶液中溶质的质量分数达不到30% 60g
【详解】
(1)室温下,氯化钠的溶解度为36g,即在该温度下,氯化钠的饱和溶液中,溶质的质量分数为:,所以这瓶试剂不可能是氯化钠溶液。
(2)加水稀释过程中,溶质的质量不变。设需要加水的质量为x,则
30g×30%=(30g+x)×10%
x=60g。
17.食盐饱和溶液 可能是
【详解】
(1)因为食盐易溶于水,所以不能将一定质量的食盐晶体放入盛有一定量的水的量筒内,来测量食盐的体积。将食盐晶体放入盛有饱和食盐水中,食盐不会溶解,所以读取液面刻度的变化值可知食盐晶体的体积。
(2)由海水晒盐的过程可知,甲的溶液通过蒸发溶剂形成了乙的溶液,乙溶液中没有晶体析出故可能是饱和也可能不饱和。
18.是 b=c>a A
【分析】
(1)先求溶解度,可知实验③的溶液状态;
(2)由溶质质量分数=,可分析;
(3)注意同一温度、同一溶质和溶剂,溶质的溶解度不变,饱和溶液的溶质质量分数也不变。
【详解】
(1)根据图示可知100g水中加入60g氯化钾所得溶液质量为140g,说明只溶解了40g,所以该温度下的溶解度是40g,说明实验③的溶液是饱和溶液;
(2)实验①中只溶解了20g氯化钾,实验②、③中都溶解了40g氯化钾,溶剂都是100g,所以①质量分数最小,实验②③质量分数相等,故b=c>a;
(3)A.溶剂蒸发了,导致溶剂的质量减小,故A正确;
B.保持温度不变,溶质的溶解度也不变,故B错误;
C.同一温度、同一溶质和溶剂,饱和溶液的溶质质量分数不变,故C错误;
答案选A。
19.Ca(OH)2+2HCl=CaCl2+2H2O 碱 CaCl2和HCl NaCl和Na2CO3 CaCO3 ; Na2CO3 20%;20.5g
【解析】
试题分析:
(1)甲同学实验是氢氧化钙与稀盐酸的反应;Na2CO3溶液显碱性;
(2)取甲所得溶液少许,加入石蕊试液,溶液显红色,说明溶液显酸性,所以甲所得溶液中一定含有的溶质CaCl2和 HCl;
(3)取乙所得溶液少许,加入酚酞试液,溶液显红色,说明溶液显碱性,所以乙所得溶液中一定含有的溶质NaCl 和 Na2CO3;
(4)甲、乙同学把上述实验所得溶液倒入同一废液缸中,发生的化学反应是Na2CO3+2HCl=2NaCl+H2O+CO2↑,Na2CO3+CaCl2=CaCO3↓+2NaCl,所以白色沉淀是CaCO3;
【归纳总结】取少量滤液于试管中,滴加过量的稀硝酸,可观察到有大量气泡产生,说明有碳酸钠,该滤液中含有的溶质是氯化钠和碳酸钠.解:设所用BaCl2的溶液中溶质的质量为x,设原混合物中硫酸钠的质量为z,生成氯化钠的质量为y.Na2SO4+BaCl2=BaSO4↓+2NaCl
142 208 233 117
z x 23.3g y
x=20.8g
y=11.7g
z=14.2g
(5)所用BaCl2的溶液中溶质的质量分数=20%;
(6)假设样品的质量为W,则×100%=9%
所以W=18.25g
故答案:Ca(OH)2+2HCl=CaCl2+2H2O;碱性;CaCl2和 HCl;NaCl 和 Na2CO3;CaCO3;Na2CO3;20%;18.25g
考点:探究酸碱的主要性质;有关溶质质量分数的简单计算;酸的化学性质;碱的化学性质;盐的化学性质;根据化学反应方程式的计算
20.(1)20g;(2)5%;(3)60克,120毫升
【详解】
(1)200g过氧乙酸溶液中含溶质为200g×10%=20g;
(2)向200g该溶液中加入200g水,所得溶液的溶质的质量分数为 ;
(3)5%的过氧乙酸溶液是由15%的过氧乙酸溶液稀释而成的,设要配制180g该溶液,需要15%的过氧乙酸溶液的质量为x,根据稀释前后溶质的质量不变,可得:180g×5%=15% x,x=60g,需要加水的质量:180g-60g=120g,折合120毫升。
21.(1)解:每瓶药剂中苦参碱的质量=50克×0.3%=0.15克
答:每瓶药剂中苦参碱的质量是0.15克。
(2)解:设克配制0.3%的药剂的质量为x
10kg×15%=x×0.3%
x=500kg
可配制试剂的瓶数=500kg÷50g/瓶=10000瓶
需要蒸馏水的质量=500kg 10kg=490kg
蒸馏水的体积=490kg÷1kg/L=490L
答:可配成这样的免疫激活剂10000瓶,需要蒸馏水的体积为490L。
【详解】
(1)见答案
(2)见答案答案第1页,共2页
答案第1页,共2页
