河北省保定市祖冲之中学2012-2013学年高二上学期期中联考化学试题
文档属性
| 名称 | 河北省保定市祖冲之中学2012-2013学年高二上学期期中联考化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 170.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-23 23:30:25 | ||
图片预览



文档简介
祖冲之中学2012-2013学年高二上学期期中联考化学试题
注意:1. 本试卷分为第Ⅰ卷和第Ⅱ卷,请将第Ⅰ卷的答案填涂在机读卡上,将第II卷答案写在答题纸上。
2.可能用到的相对原子质量:H—1 N—14 O—16 Na—23
Ⅰ卷(选择题,共48分)
一、单项选择题(12小题,每题2分,共24分)
1.下列物质分类组合正确的是( )
A
B
C
D
强电解质
HBr
FeCl3
H2SO4
Ca(OH)2
弱电解质
HF
HCOOH
BaSO4
HI
非电解质
NH3
Cu
H2O
C2H5OH
2.下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.弱酸的电离过程一般要放出热量
3.下列各项中,电离方程式正确的是( )
A.HCO3—+H2OH2CO3+OH—
B.HCO3— +OH—H2O+CO32—
C.NaHCO3Na++HCO3—
D.NH3·H2ONH4++OH—
4.反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为( )
A.0.1s B.2.5s C.5s D.10s
5.反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是 ( )
A.低温下自发进行,高温下非自发进行 B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D.任何温度下均为自发进行
6.对于反应4A(s)+2B(g)3C(g),下列说法正确的是( )
A.体积不变充入惰性气体,反应速率增大
B.其他条件不变,降低温度,反应速率减慢
C.其他条件不变时,增大压强,活化分子百分数增大,化学反应速率加快
D.若增加或减少A物质的量,反应速率一定会发生明显的变化
7.常温下柠檬水溶液的pH是3,其中的c(OH-)是( )
A.0.1mol/L B.1×10-3 mol·L-1
C.1×10-7 mol·L-1 D.1×10-11 mol·L-1
8.向CH3COOH CH3COO- + H+ 的平衡体系中,加入少量下列物质能使醋酸的电离程度和溶液的pH都变小的是( )
A .H2O B. CH3COONa C. NH3·H2O D. H2SO4
9.一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
10. 将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大,pH变小,呈酸性
B.水的离子积不变,pH不变,呈中性
C.水的离子积变小,pH变大,呈碱性
D.水的离子积变大,pH变小,呈中性
11.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,正确的是( )
A.此过程中铜被腐蚀
B.此过程中电子从Fe移向Cu
C.正极电极反应式为:2H++2e-===H2↑
D.铁钉表面发生的反应为Fe-3e-===Fe3+
12.已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是( )
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
二、单项选择题(8小题,每题3分,共24分)
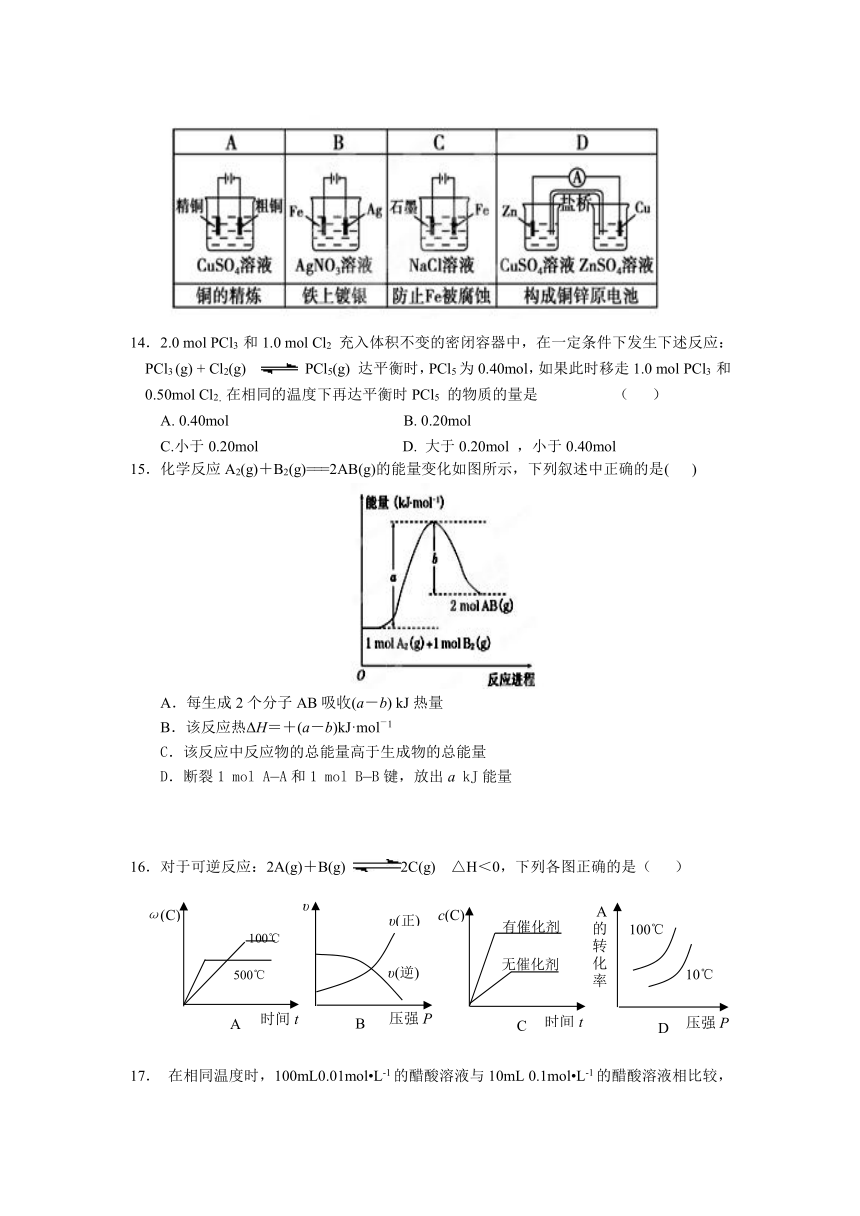
13.下列有关电化学装置完全正确的是( )
14.2.0 mol PCl3 和1.0 mol Cl2 充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3 (g) + Cl2(g) PCl5(g) 达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3 和0.50mol Cl2,在相同的温度下再达平衡时PCl5 的物质的量是 ( )
A. 0.40mol B. 0.20mol
C.小于0.20mol D. 大于0.20mol ,小于0.40mol
15.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,下列叙述中正确的是( )
A.每生成2个分子AB吸收(a-b) kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
16.对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图正确的是( )
17. 在相同温度时,100mL0.01mol?L-1的醋酸溶液与10mL 0.1mol?L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A. H+的物质的量 B. 醋酸的电离常数
C. 中和时所需NaOH的量 D. 加足量锌粉产生氢气的量
18.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断以下说明不正确的是( )
A.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为:H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
19.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
20.下图为对15 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,根据图像推出X (mol/L)和Y (mol/L)的物质的量浓度是下表内各组中的( )
选项
A
B
C
D
c(X)/mol·L-1
0.035
0.070
0.03
0.06
c(Y)/mol·L-1
0.070
0.035
0.06
0.03
Ⅱ卷(非选择题,共52分)
三、填空题(共3小题,24分)
21.(8分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得常温常压下,1g H2完全燃烧生成液态水,放出142.9 kJ热量,则表示H2的标准燃烧热的热化学方程式为:
______________________________________________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。用氢氧燃料电池进行下图所示实验(其中下图中电极均为惰性电极):该氢氧燃料电池中,b极的电极反应式为 ;d极的电极反应式为_________________________;若标准状况下氧气消耗为5.6 L,则导线中转移的电子的物质的量为_______________。
22.(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表,回答下列问题:
T℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
(1)该反应正向为ΔH 0;若该反应符合右图所示的关系,则在图中,Y轴是指 。 (答出一种即可)
(2)能判断该反应达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2) 正=v (H2O) 逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),容器内混合气体的平均相对分子质量 (填“增大”、“减小”或“不变”)。
23.(8分)现有室温的①HCl、②H2SO4、③CH3COOH三种溶液。
⑴若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是_________________(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是________。
⑵若三种酸均为0.1mol·L-1的溶液,它们的pH由大到小的顺序是________________,完全中和物质的量均相同的三份NaOH溶液时,需三种酸的体积大小关系是 。
四、实验题(2小题,共20分)
24.(7分)某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
t/min
CO/mol
H2/mol
Z/mol
0
1.00
1.00
0.00
1
0.90
0.80
0.10
3
0.75
0.50
0.25
5
0.65
0.30
0.35
7
0.55
0.10
0.45
9
0.55
0.10
0.45
10
0.55
0.10
0.45
(1)根据上表中数据,在下图中画出CO、Z的物质的量的浓度(c)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是 。
(3)在3—5 min时间内产物Z的平均反应速率: 。
25.(13分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.10mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
实验编号
NaOH溶液的浓度
(mol/L)
滴定完成时,消耗NaOH溶液的体积(mL)
待测盐酸溶液的体积(mL)
1
0.10
20.02
20.00
2
0.10
20.00
20.00
3
0.10
19.00
20.00
4
0.10
19.98
20.00
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有_________________________________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是________________。滴定达到终点的现象是____________________________________________________________________。
(3)根据上述数据,可计算出该盐酸的浓度为 。
(4)排去滴定管中气泡的方法应采用下图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有 (多选扣分):
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
五、计算题(8分)
26.(8分)在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)平衡常数K。
2012—2013学年第一学期期中考试
高二化学参考答案
(2)CO+2H2 CH3OH(2分)
(3)0.025 mol/(L·min)(2分)
25.(13分)
0g(1分);250mL容量瓶,胶头滴管(各1分,容量瓶没有规格不得分)
(2)酸式滴定管(1分);最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色(3分,每一点1分)
(3)(6分)0.10mol/L (2分) (4)丙 (1分)(5)ADE(3分)
五、计算题(8分)
26.(8分)
解:10L密闭容器在10min内各物质浓度发生的变化如下:
2SO2 + O2 2SO3………………………(1分)
起始浓度(mol/L) 0.50 0.45 0
变化浓度(mol/L) 0.30 0.15 0.30
平衡浓度(mol/L) 0.20 0.30 0.30 ……………………(2分)
注意:1. 本试卷分为第Ⅰ卷和第Ⅱ卷,请将第Ⅰ卷的答案填涂在机读卡上,将第II卷答案写在答题纸上。
2.可能用到的相对原子质量:H—1 N—14 O—16 Na—23
Ⅰ卷(选择题,共48分)
一、单项选择题(12小题,每题2分,共24分)
1.下列物质分类组合正确的是( )
A
B
C
D
强电解质
HBr
FeCl3
H2SO4
Ca(OH)2
弱电解质
HF
HCOOH
BaSO4
HI
非电解质
NH3
Cu
H2O
C2H5OH
2.下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.弱酸的电离过程一般要放出热量
3.下列各项中,电离方程式正确的是( )
A.HCO3—+H2OH2CO3+OH—
B.HCO3— +OH—H2O+CO32—
C.NaHCO3Na++HCO3—
D.NH3·H2ONH4++OH—
4.反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为( )
A.0.1s B.2.5s C.5s D.10s
5.反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是 ( )
A.低温下自发进行,高温下非自发进行 B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D.任何温度下均为自发进行
6.对于反应4A(s)+2B(g)3C(g),下列说法正确的是( )
A.体积不变充入惰性气体,反应速率增大
B.其他条件不变,降低温度,反应速率减慢
C.其他条件不变时,增大压强,活化分子百分数增大,化学反应速率加快
D.若增加或减少A物质的量,反应速率一定会发生明显的变化
7.常温下柠檬水溶液的pH是3,其中的c(OH-)是( )
A.0.1mol/L B.1×10-3 mol·L-1
C.1×10-7 mol·L-1 D.1×10-11 mol·L-1
8.向CH3COOH CH3COO- + H+ 的平衡体系中,加入少量下列物质能使醋酸的电离程度和溶液的pH都变小的是( )
A .H2O B. CH3COONa C. NH3·H2O D. H2SO4
9.一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
10. 将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大,pH变小,呈酸性
B.水的离子积不变,pH不变,呈中性
C.水的离子积变小,pH变大,呈碱性
D.水的离子积变大,pH变小,呈中性
11.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,正确的是( )
A.此过程中铜被腐蚀
B.此过程中电子从Fe移向Cu
C.正极电极反应式为:2H++2e-===H2↑
D.铁钉表面发生的反应为Fe-3e-===Fe3+
12.已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是( )
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
二、单项选择题(8小题,每题3分,共24分)
13.下列有关电化学装置完全正确的是( )
14.2.0 mol PCl3 和1.0 mol Cl2 充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3 (g) + Cl2(g) PCl5(g) 达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3 和0.50mol Cl2,在相同的温度下再达平衡时PCl5 的物质的量是 ( )
A. 0.40mol B. 0.20mol
C.小于0.20mol D. 大于0.20mol ,小于0.40mol
15.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,下列叙述中正确的是( )
A.每生成2个分子AB吸收(a-b) kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
16.对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图正确的是( )
17. 在相同温度时,100mL0.01mol?L-1的醋酸溶液与10mL 0.1mol?L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A. H+的物质的量 B. 醋酸的电离常数
C. 中和时所需NaOH的量 D. 加足量锌粉产生氢气的量
18.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断以下说明不正确的是( )
A.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为:H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
19.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
20.下图为对15 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,根据图像推出X (mol/L)和Y (mol/L)的物质的量浓度是下表内各组中的( )
选项
A
B
C
D
c(X)/mol·L-1
0.035
0.070
0.03
0.06
c(Y)/mol·L-1
0.070
0.035
0.06
0.03
Ⅱ卷(非选择题,共52分)
三、填空题(共3小题,24分)
21.(8分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得常温常压下,1g H2完全燃烧生成液态水,放出142.9 kJ热量,则表示H2的标准燃烧热的热化学方程式为:
______________________________________________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。用氢氧燃料电池进行下图所示实验(其中下图中电极均为惰性电极):该氢氧燃料电池中,b极的电极反应式为 ;d极的电极反应式为_________________________;若标准状况下氧气消耗为5.6 L,则导线中转移的电子的物质的量为_______________。
22.(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表,回答下列问题:
T℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
(1)该反应正向为ΔH 0;若该反应符合右图所示的关系,则在图中,Y轴是指 。 (答出一种即可)
(2)能判断该反应达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2) 正=v (H2O) 逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),容器内混合气体的平均相对分子质量 (填“增大”、“减小”或“不变”)。
23.(8分)现有室温的①HCl、②H2SO4、③CH3COOH三种溶液。
⑴若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是_________________(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是________。
⑵若三种酸均为0.1mol·L-1的溶液,它们的pH由大到小的顺序是________________,完全中和物质的量均相同的三份NaOH溶液时,需三种酸的体积大小关系是 。
四、实验题(2小题,共20分)
24.(7分)某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
t/min
CO/mol
H2/mol
Z/mol
0
1.00
1.00
0.00
1
0.90
0.80
0.10
3
0.75
0.50
0.25
5
0.65
0.30
0.35
7
0.55
0.10
0.45
9
0.55
0.10
0.45
10
0.55
0.10
0.45
(1)根据上表中数据,在下图中画出CO、Z的物质的量的浓度(c)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是 。
(3)在3—5 min时间内产物Z的平均反应速率: 。
25.(13分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.10mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
实验编号
NaOH溶液的浓度
(mol/L)
滴定完成时,消耗NaOH溶液的体积(mL)
待测盐酸溶液的体积(mL)
1
0.10
20.02
20.00
2
0.10
20.00
20.00
3
0.10
19.00
20.00
4
0.10
19.98
20.00
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有_________________________________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是________________。滴定达到终点的现象是____________________________________________________________________。
(3)根据上述数据,可计算出该盐酸的浓度为 。
(4)排去滴定管中气泡的方法应采用下图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有 (多选扣分):
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
五、计算题(8分)
26.(8分)在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)平衡常数K。
2012—2013学年第一学期期中考试
高二化学参考答案
(2)CO+2H2 CH3OH(2分)
(3)0.025 mol/(L·min)(2分)
25.(13分)
0g(1分);250mL容量瓶,胶头滴管(各1分,容量瓶没有规格不得分)
(2)酸式滴定管(1分);最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色(3分,每一点1分)
(3)(6分)0.10mol/L (2分) (4)丙 (1分)(5)ADE(3分)
五、计算题(8分)
26.(8分)
解:10L密闭容器在10min内各物质浓度发生的变化如下:
2SO2 + O2 2SO3………………………(1分)
起始浓度(mol/L) 0.50 0.45 0
变化浓度(mol/L) 0.30 0.15 0.30
平衡浓度(mol/L) 0.20 0.30 0.30 ……………………(2分)
同课章节目录
