7.2物质溶解的量-2021-2022学年九年级化学科粤版(2012)下册(word版含解析)
文档属性
| 名称 | 7.2物质溶解的量-2021-2022学年九年级化学科粤版(2012)下册(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 219.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-04 23:11:46 | ||
图片预览


文档简介
7.2物质溶解的量
一、选择题(共16题)
1.下列关于溶液的叙述正确的是
A.任何溶液中只可能含有一种溶质
B.溶液一定是均一、稳定、澄清、透明的
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.一定温度下,物质的溶解度随溶剂的量的变化而变化
2.溶液对人类的生产和生活都有很重要的意义。下列关于溶液的说法正确的是
A.溶液组成中一定含有水
B.凡是均一、稳定的液体一定是溶液
C.溶液中各部分性质相同
D.饱和溶液就是不能再溶解任何物质的溶液
3.木糖醇是目前市场上一种常见的蔗糖替代品,如图所示为木糖醇溶解度曲线.据此判断,下列说法正确的是
A.木糖醇的溶解度随温度降低而增大
B.木糖醇溶液从30℃升温到50℃,溶液的组成不变
C.木糖醇溶液从50℃降温到30℃,一定没有晶体析出
D.30℃时,75克木糖醇可以完全溶解在100克水中
4.下图是甲乙两物质的溶解度曲线,下列说法中错误的是
A.t1℃时,甲的溶解度小于乙的溶解度
B.t2℃时,等质量甲和乙的饱和溶液中含有溶质的质量相等
C.将t3℃的甲乙两物质的溶液降温到t2℃时都会析出晶体
D.当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲
5.将60℃时的硝酸钠饱和溶液冷却到20℃,下列说法正确的是
A.溶液的溶质质量分数不变 B.溶液变成不饱和溶液
C.溶液质量增加 D.溶液中溶质的溶解度减少
6.室温时将下列各物质加入到一定量的水中不能形成饱和溶液的是
A.KNO3晶体 B.CO2气体 C.NaCl晶体 D.C2H5OH(酒精)
7.下图是甲、乙两种固体(不含结晶水)的溶解度曲线。t℃时,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液, 分别恒温蒸发等质量的水(未蒸干),正确的说法是
A.蒸发前,甲、乙溶液质量的大小关系为:甲>乙
B.蒸发后,所得甲溶液依然饱和,乙溶液不饱和
C.蒸发后,所得溶液中溶剂质量的大小关系为:甲<乙
D.蒸发后,析出固体质量的大小关系为:甲<乙
8.下列实验方案中不正确的是( )
A.鉴别食盐水和蒸馏水,可分别取少量做蒸发操作,蒸干后有固体留下的是食盐水
B.可以通过升高温度,将接近饱和的硝酸钾溶液转变成饱和溶液
C.鉴别空气、氧气、氮气三瓶无色气体,可以用燃着的木条进行鉴别
D.检验石蜡中是否含有氢元素,在其燃烧火焰上方罩上干冷的烧杯,观察烧杯内壁有无水雾
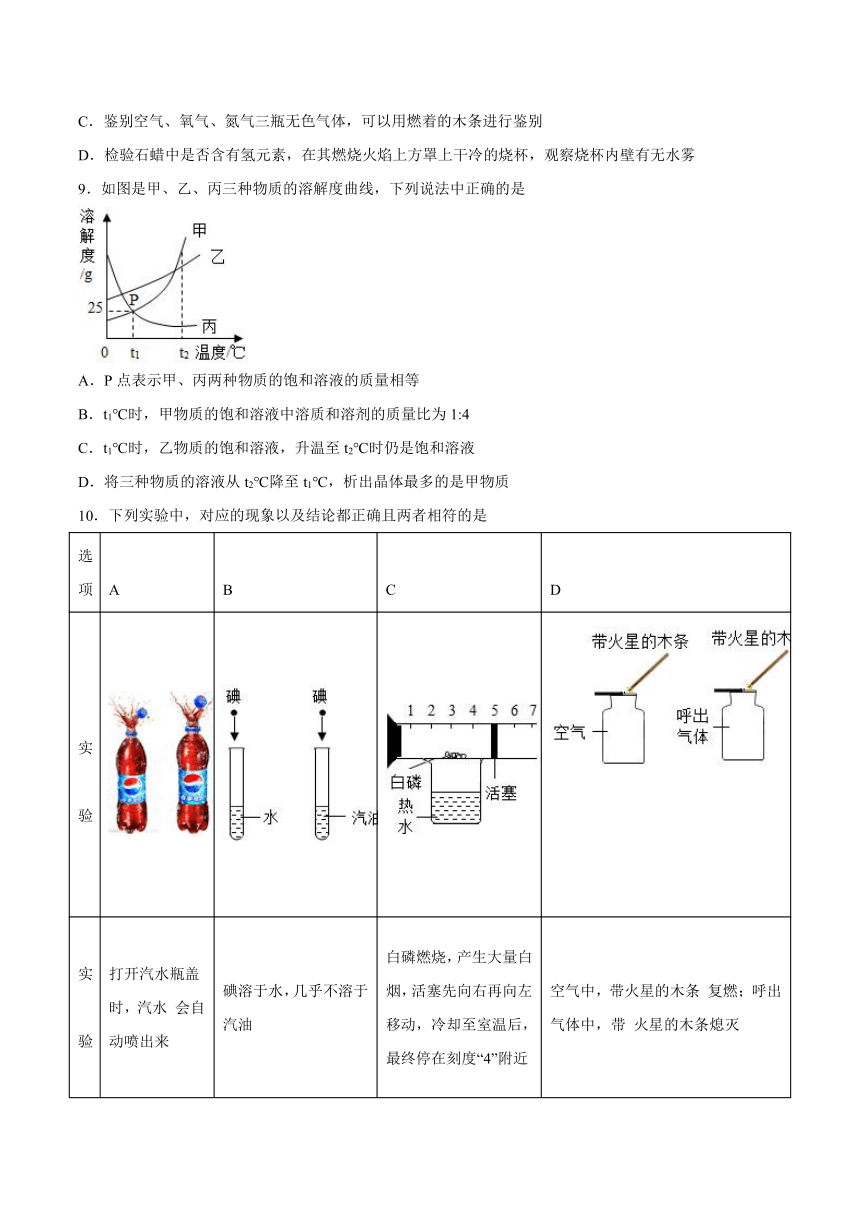
9.如图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是
A.P点表示甲、丙两种物质的饱和溶液的质量相等
B.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4
C.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液
D.将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质
10.下列实验中,对应的现象以及结论都正确且两者相符的是
选 项 A B C D
实 验
实 验 现 象 打开汽水瓶盖时,汽水 会自动喷出来 碘溶于水,几乎不溶于 汽油 白磷燃烧,产生大量白 烟,活塞先向右再向左移动,冷却至室温后, 最终停在刻度“4”附近 空气中,带火星的木条 复燃;呼出气体中,带 火星的木条熄灭
实 验 结 论 说明气体在水中的溶 解度随压强的增大而 减小 说明物质的溶解性与 溶剂的种类有关 氧气约占空气体积的 五分之一 空气中的氧气比呼出 气体中氧气多
A.A B.B C.C D.D
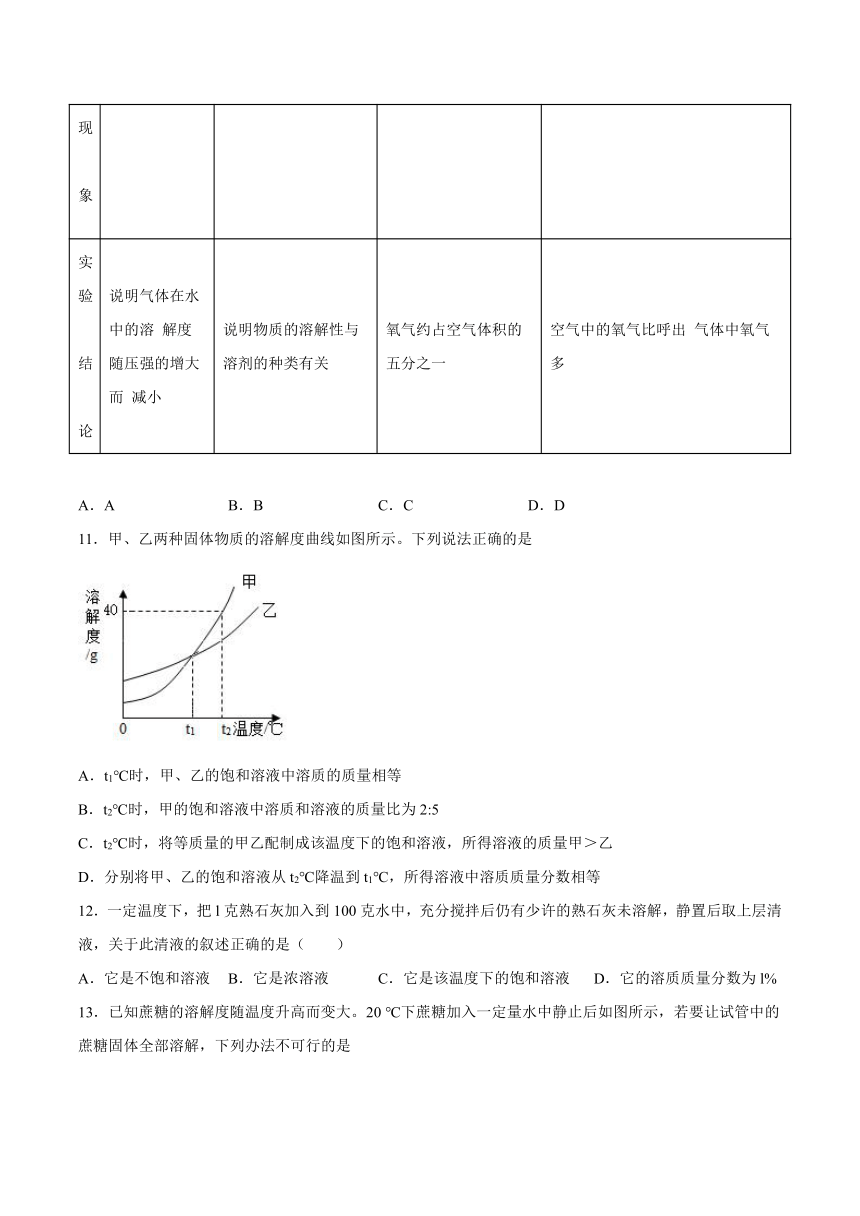
11.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.t1℃时,甲、乙的饱和溶液中溶质的质量相等
B.t2℃时,甲的饱和溶液中溶质和溶液的质量比为2:5
C.t2℃时,将等质量的甲乙配制成该温度下的饱和溶液,所得溶液的质量甲>乙
D.分别将甲、乙的饱和溶液从t2℃降温到t1℃,所得溶液中溶质质量分数相等
12.一定温度下,把l克熟石灰加入到100克水中,充分搅拌后仍有少许的熟石灰未溶解,静置后取上层清液,关于此清液的叙述正确的是( )
A.它是不饱和溶液 B.它是浓溶液 C.它是该温度下的饱和溶液 D.它的溶质质量分数为l%
13.已知蔗糖的溶解度随温度升高而变大。20 ℃下蔗糖加入一定量水中静止后如图所示,若要让试管中的蔗糖固体全部溶解,下列办法不可行的是
A.试管内加入适量水
B.烧杯内加入适量氢氧化钠固体
C.烧杯内加入适量生石灰
D.烧杯内加入适量硝酸铵固体
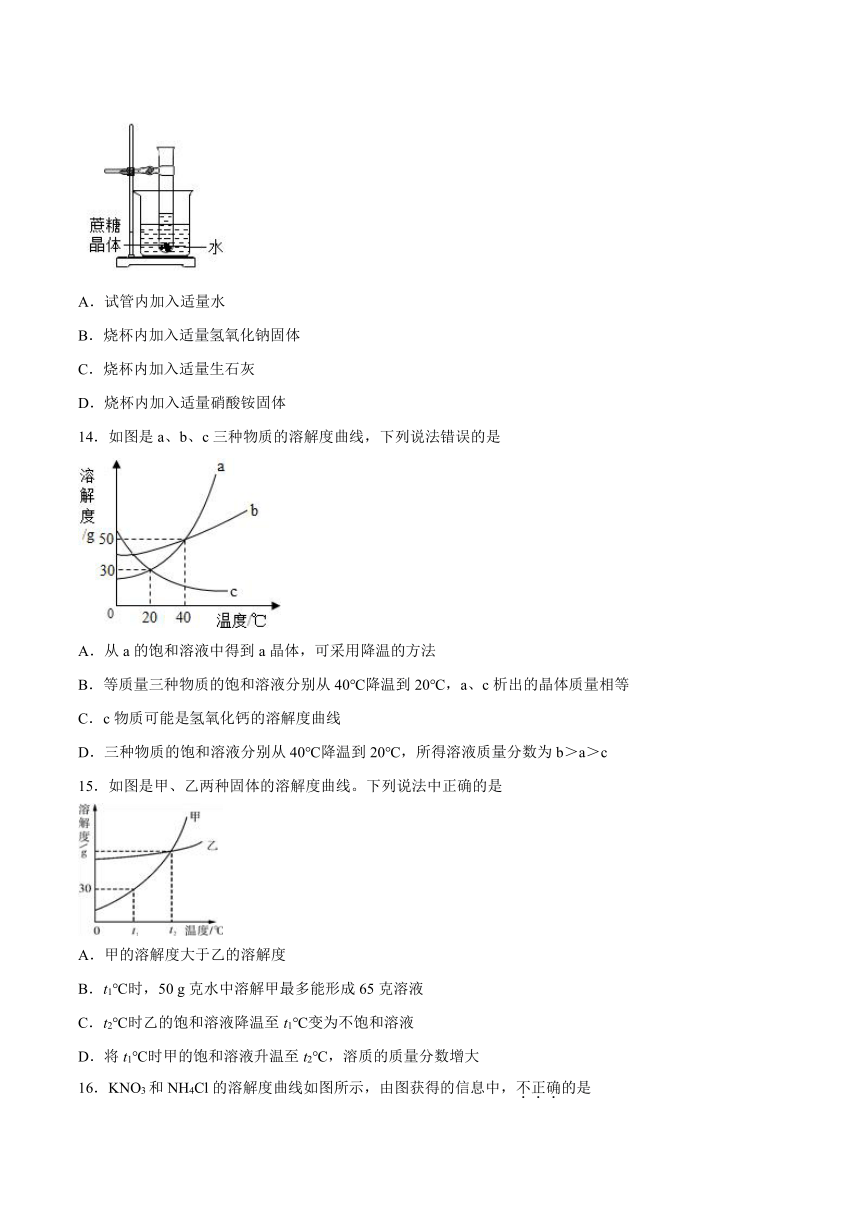
14.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
A.从a的饱和溶液中得到a晶体,可采用降温的方法
B.等质量三种物质的饱和溶液分别从40℃降温到20℃,a、c析出的晶体质量相等
C.c物质可能是氢氧化钙的溶解度曲线
D.三种物质的饱和溶液分别从40℃降温到20℃,所得溶液质量分数为b>a>c
15.如图是甲、乙两种固体的溶解度曲线。下列说法中正确的是
A.甲的溶解度大于乙的溶解度
B.t1℃时,50 g克水中溶解甲最多能形成65克溶液
C.t2℃时乙的饱和溶液降温至t1℃变为不饱和溶液
D.将t1℃时甲的饱和溶液升温至t2℃,溶质的质量分数增大
16.KNO3和NH4Cl的溶解度曲线如图所示,由图获得的信息中,不正确的是
A.两种物质的溶解度均随温度的升高而增大
B.t1℃时,NH4Cl饱和溶液中溶质与溶液的质量比为2:5
C.t2℃时,KNO3饱和溶液比NH4Cl饱和溶液的溶质质量分数大
D.t1℃时,KNO3溶解度大于NH4Cl溶解度
二、综合题(共6题)
17.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
18.根据下面的溶解度表与溶解度曲线回答下列问题。
(1)B是________的溶解度曲线。
(2)40 ℃时,氯化钠的溶解度________(填“大于”“小于”或“等于”)硝酸钾的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是________。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是________________。
(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是______(填字母)。
A.反应消耗水,氢氧化钙析出
B.反应放热,温度升高,氢氧化钙溶解度降低
C.生石灰与水反应生成的氢氧化钙不再溶解
19.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
20.(1)在H、C、O、Na、Fe、Cl几种元素中,选择适当元素组成符合下列要求的物质,将其化学式填在下面相应横线上.
①遇到干旱时节,可用于人工降雨的干冰___;
②厨房中常备,可用作调味剂的是____;
③天然气的主要成分_____;
④可用来冶炼铁的赤铁矿的主要成分是________.
(2)学好化学,必须要熟悉物质的组成与分类.图中“”和“”分别表示质子数不同的两种原子,则下列图中表示化合物的是______.(填字母)
(3)随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所关注.图1是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.
由此可知,下列说法错误的是______.(填字母)
A.碘原子的核电荷数为53
B.碘原子核外有五个电子层,在化学反应中容易失去电子
C.碘属于非金属元素
D.碘的相对原子质量为126.9
(4)甲、乙两固体物质的溶解度曲线如图2所示,下列说法正确的是____.(填字母,可能有多个选项)
A.随着温度的升高,甲的溶解度增大,乙的溶解度减小
B.t1℃时,30g甲加入到50g水中最多可得80g溶液
C.t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲<乙
D.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙.
21.水、溶液与生活息息相关。
(1)现有六个常见化学名词:乳化、溶解、煮沸、蒸馏、降温结晶、蒸发结晶。请选择适合的词填在后面的横线上。
①用洗洁精洗去衣服上的油污_____;
②生活中常用来降低水的硬度_____;
③海水晒盐的原理是_____。
(2)如图是A、B、C三种物质的溶解度曲线,回答下列问题:
①A、B两种物质在_____℃时溶解度相同。
②t2℃时,三种物质的溶解度由大到小的顺序是_____;
③t2℃时,将三种物质各ag分别加入到100g水中,充分溶解后,若只有一种物质能形成饱和溶液,则a的取值范围是_____。
22.(1)小明取串场河的河水,按下列流程进行实验,制取蒸馏水。请回答下列问题:
①滤液中有难闻的异味,可添加__________除去,
②生活中常用_____________来比较所取水样与制得的蒸馏水的硬度。
③经过净化后的水,在生活中通过__________方法,降低水的硬度并杀菌;
④消毒剂为高铁酸钾(K2FeO4)。高铁酸钾中铁元素的化合价为____________。
(2)如图是A、B、C三种物质的溶解度曲线,请回答:
①在t2℃时,将30gA物质充分溶解在盛有50g水的烧杯中,所得溶液的质量为_________g;若将烧杯内物质降温至t1℃(不考虑水蒸发),溶液中变化的是_____________(填字母序号)。
a 溶剂的质量 b 溶液的质量 c 溶质的质量分数
②当A物质中混有少量B、C两种物质时,采用_____________的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,所得溶液的溶质质量分数由大到小的顺序是____________。
(3)实验室用质量分数为 6%的氯化钠溶液(密度为1.04g/cm3)配制 50g 质量分数为3%的氯化钠溶液。
①经计算,所需 6%的氯化钠的体积为________mL;加水_______克
②若量取水时,采取仰视读数,其它操作均正确,则配制得到的稀溶液中溶质质量分数_______3% (填“>”“<”或“ = ”)。
③向该49g20%的稀硫酸中,加入7.3g已部分氧化的锌粉,恰好完全反应。则所得溶液中溶质的质量为 ___(填字母序号)
A 15.5g B 16.1g C 18.1g
参考答案
1.B
【详解】
A、溶液是指一种或几种物质分散到另一种物质中形成均一稳定的混合物,所以溶质可以是一种或多种,故错误;
B、溶液的特点:均一性、稳定性、属于混合物,故正确;
C、溶液的饱和与浓稀没有关系,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故错误;
D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,溶解度不受溶剂质量、溶液质量多少的影响,故错误。
故选B。
2.C
【详解】
A. 溶液组成中不一定含有水,如碘酒是酒精与碘组成的溶液,溶剂为酒精,选项错误;
B. 均一、稳定的液体不一定是溶液,如水也具有均一、稳定的性质,但不是溶液,选项错误;
C. 溶液具有均一性,所以溶液中各部分性质相同,选项正确;
D. 饱和溶液就是不能再溶解某种或某些物质的溶液,而不是不能溶解所有物质,选项错误,故选C。
3.B
【详解】
A、木糖醇的溶解度随温度降低而减小,故错误;
B、木糖醇的溶解度随温度的升高而增大,所以木糖醇溶液从30℃升温到50℃,不会析出晶体,溶质的质量不变,溶剂的质量不变,所以溶液的组成不变,正确;
C、不知溶液的状态,无法判断降温是否有晶体析出,故错误;
D、30℃时木糖醇的溶解度是60g,即100g水中最多溶解60g木糖醇,故75克木糖醇不能完全溶解在100克水中,最多溶解60g,故错误;
故选B.
4.C
【解析】A、根据溶解度曲线可知,t1℃时,甲的溶解度小于乙的溶解度,正确;B、t2℃时甲和乙的溶解度相等,在相同质量的饱和溶液中含溶质质量相同,正确;C、没有确定降温前溶液的状态,无法判断降温是否会析出晶体,若降温后仍然是不饱和溶液,则无晶体析出,错误;D、甲的溶解度受温度影响较大,当甲中混有少量的乙时,可采用冷却热饱和溶液的方法提纯甲,正确。故选C。
5.D
【解析】
试题分析:A、因硝酸钠的溶解度随温度的升高而增大,降温至20℃时,溶解度变小且仍为饱和溶液,则溶质质量分数减小,错误;B、溶液仍然为饱和溶液,错误;C、因溶解度减小,溶解溶质质量减小,则溶液质量减小,错误;D、溶液中荣知道溶解度减少,正确。故选D
6.D
【详解】
A. KNO3晶体易溶于水,和水能形成饱和溶液,此选项不符合题意;B. CO2气体易溶于水,和水能形成饱和溶液,此选项不符合题意;C. NaCl晶体易溶于水,和水能形成饱和溶液,此选项不符合题意;D. C2H5OH(酒精)能与水以任意比例互溶,不能形成饱和溶液,此选项符合题意。故选D。
7.C
【详解】
A、t℃时,甲物质的溶解度大于乙物质的溶解度,所以蒸发前,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液,甲、乙溶液质量的大小关系为:甲<乙,故A错误;
B、恒温蒸发等质量的水,温度不变,溶解度不变,所以析出晶体后的溶液仍然是饱和溶液,故B错误;
C、t℃时,甲物质的溶解度大于乙物质的溶解度,所以蒸发前,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液,蒸发前,甲溶液中的溶剂质量小于乙物质,恒温蒸发等质量的水,所以蒸发后,所得溶液中溶剂质量的大小关系为:甲<乙,故C正确;
D、t℃时,甲物质的溶解度大于乙物质的溶解度,所以恒温蒸发等质量的水,析出固体质量的大小关系为:甲>乙,故D错误。
故选C。
8.B
【详解】
A. 鉴别食盐水和蒸馏水,可分别取少量做蒸发操作,食盐水加热蒸发会有晶体析出,所以可用加热蒸发的方法鉴别食盐水和蒸馏水,方案正确;
B. 硝酸钾溶解度随温度升高而变大,不可以通过升高温度将接近饱和的硝酸钾溶液转变成饱和溶液,方案错误;
C. 鉴别空气、氧气、氮气三瓶无色气体,可以用燃着的木条进行鉴别,无明显变化的是空气,燃烧更旺的的氧气,熄灭的是氮气,方案正确;
D. 根据质量守恒定律,若证明石蜡燃烧生成水,则证明石蜡中含有氢元素,方案正确。
故选:B。
9.B
【详解】
A、P点表示t1℃甲、丙两种物质溶解度相等,不能说明它们饱和溶液的质量相等,说法错误;
B、t1℃时,甲的溶解度为25g,故甲物质的饱和溶液中溶质和溶剂的质量比为25g:100g=1:4,说法正确;
C、乙物质溶解度随温度升高而增大,t1℃时,乙物质的饱和溶液,升温至t2℃时不再是饱和溶液,说法错误;
D、将三种物质的饱和溶液从t2℃降至t1℃,但选项没有提及溶液的状态和质量,不能直接比较,说法错误;
故选:B。
10.C
【详解】
A、打开汽水瓶盖时,汽水会自动喷出来,说明气体在水中的溶解度随压强的减少而减小,结论错误;B、碘几乎不溶于水,能溶于汽油,溶质相同,溶剂不同,溶解性不同,说明物质的溶解性与溶剂的种类有关,现象错误;C、白磷燃烧,产生大量白烟,活塞先向右再向左移动,冷却至室温后, 最终停在刻度“4”附近,白磷燃烧消耗了空气中的氧气,氧气约占空气体积的五分之一,现象与结论都正确;D、空气中,带火星的木条不能复燃;呼出气体中,带火星的木条熄灭,现象错误。故选C。
11.D
【详解】
A、t1℃时,甲、乙两种物质的溶解度相同,则它们饱和溶液中溶质的质量分数相等,选项中没有说明甲、乙溶液质量是否相等,所以无法判断溶质质量是否相等,故错误;
B、t2℃时,甲物质的溶解度是40g,所以甲的饱和溶液中溶质和溶剂的质量之比为:40g:140g=2:7,故错误;
C、t2℃时,甲的溶解度大于乙,将等质量的甲乙配制成该温度下的饱和溶液,甲需要的水较少,所得溶液的质量甲<乙,故错误;
D、降低温度,甲、乙物质的溶解度都减小,都会有晶体析出, t1℃时甲乙的溶解度相等,根据饱和溶液质量分数= ,所以分别将甲、乙的饱和溶液从t2℃降温到t1℃,所得溶液中溶质质量分数相等,故正确。
故选:D。
12.C
【详解】
充分搅拌后仍有少许的熟石灰未溶解,因此所得的溶液为该温度下饱和溶液,A选项错误;溶液的浓稀是相比较而言的,只有一种溶液,无法判断溶液的浓稀,B选项错误;在该温度下,不能再溶解熟石灰了,因此所得的溶液是该温度下的饱和溶液,C选项错误;由于l克熟石灰未完全溶解,无法计算溶质质量分数,D选项错误。故选择C项。
13.D
【详解】
A选项,加入溶剂可以溶解更多的蔗糖
B选项,加入氢氧化钠固体放热,溶液温度升高,蔗糖溶解度升高,可以溶解更多的蔗糖
C选项,加入适量的生石灰放热,溶液温度升高,蔗糖溶解度升高,可以溶解更多的蔗糖
D选项,加入适量的硝酸铵固体吸热,溶液温度降低,蔗糖溶解度降低,不能溶解更多的蔗糖,故选D。
14.B
【详解】
A.由溶解度曲线可知,a物质的溶解度随温度的升高而明显增大,所以a的饱和溶液中得到a晶体,可以采用降温的方法,说法A不符合题意;
B.由溶解度曲线可知,c物质的溶解度随温度的降低而增大,所以c物质的饱和溶液40℃降温到20℃时,变成了不饱和溶液,没有晶体析出,说法B符合题意;
C.由溶解度曲线可知,c物质的溶解度随着温度的升高而减小,氢氧化钙的溶解度随着温度的升高而减小,所以c物质可能是氢氧化钙,说法C不符合题意;
D.将40℃时,a、b、c三种物质的饱和溶液降温至20℃,a和b的溶解度都变小,析出晶体,都仍然是饱和溶液,降温到20℃,谁的溶解度大,谁的溶质质量分数大,所以降温后,b物质的溶质质量分数大于a物质的溶质质量分数;c物质降温后,溶解度变大,变成不饱和溶液,溶质质量分数不变,溶质质量分数按照40℃时c物质的溶解度计算,因为20℃,a物质的溶解度大于40℃时物质的溶解度,所以降温后,a物质的溶质质量分数大于c物质的溶质质量分数,所以20℃时溶液质量分数为b>a>c;
故选B。
15.B
【详解】
A.溶解度受温度影响,不指名温度,无法比较溶解的大小;B. t1℃时,甲的溶解度等于30g,50 g克水中溶解甲最多能溶解的溶质为15g,形成等于65克溶液;C. t2℃时乙的饱和溶液降温至t1℃时,溶解度变小,溶质析出,得到的仍是饱和溶液;D. 将t1℃时甲的饱和溶液升温至t2℃,溶解度变大,溶质的质量不变,溶质的质量分数不变。
16.B
【详解】
A、根据图象可以看出,两种物质的溶解度均随温度的升高而增大,故正确;
B、t1℃时,NH4Cl的溶解度为40g,饱和溶液中溶质与溶液的质量比为40g:140g=2:7,故错误;
C、t2℃时,KNO3的溶解度大于NH4Cl的溶解度,故KNO3饱和溶液比NH4Cl饱和溶液的溶质质量分数大,故正确;
D、t1℃时,KNO3溶解度大于NH4Cl溶解度,故正确。
故选B。
17.
(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
【分析】
(1)
大气中二氧化碳的含量过高会加剧温室效应,所以控制CO2的排放,是为了减缓温室效应,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度增大;
(2)
石灰石的主要成分是碳酸钙,在高温的条件下,碳酸钙分解为氧化钙和二氧化碳,反应的符号表达式 为:,生成的CaO疏松多孔,结构与活性炭相似,其在捕集过程中对CO2具有良好的吸附性;
(3)
对CO2气体加压、降温,可获得干冰,从构成物质的微粒视角分析,该过程主要改变的是分子间隔,干冰升华吸收热量,所以干冰能用于人工降雨;
(4)
①气体中CO2体积分数增大时,pH变小,溶液的酸性增强,即溶液中碳酸的浓度增大;故填:H2CO3;
②酸溶液能使紫色的石蕊试液变红色,所以可使用石蕊试液;
(5)
①由如图可推测,影响公园中植物与大气碳交换的因素有气温、光照强度;
②水是植物光合作用的原料之一,所以为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天水分含量的变化。
18.NaCl 小于 (重)结晶 加KNO3 (固体)(或蒸发水分,或降低温度) B
【解析】
(1)根据溶解度表与溶解度曲线可知:B是NaCl(或食盐)的溶解度曲线;(2)由溶解度表格中的数据可知,40℃时,氯化钠的溶解度小于硝酸钾的溶解度;(3)根据溶解度曲线可知:硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是(重)结晶;(4)因为硝酸钾的溶解度受温度的影响较大,故可知欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是加KNO3 (固体)(或蒸发水分,或降低温度);(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,而氢氧化钙的溶解度随温度的升高而降低;向烧杯B中加入生石灰后,生石灰溶于水放热,溶液的温度升高,氢氧化钙溶解度降低,有晶体析出。故选B。
19.吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
【详解】
(1)活性炭具有吸附性,加入活性炭的作用是吸附水中的色素和异味。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+和一个Mg2+均带两个单位的正电荷,由图可知,一个Ca2+和一个Mg2+可交换出个4Na+,所以一个Ca2+可以交换出2个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。阳离子交换柱中Na+含量较高,属于硬水。则利用生活中常见物质检验阳离子交换柱已失效的方法是:取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开后,瓶内压强变小,所以CO2的溶解度变化如图中的a点变化到c点。
(4)①t1℃时,甲的溶解度是20g,则该饱和溶液中溶质与溶液的质量比为:20g:(20g+100g)=1:6。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,甲、乙的溶解度减小,溶质质量分数变小,丙的溶解度增大,变为不饱和溶液,溶质质量分数不变,由于t1℃时,乙的溶解度大于甲的溶解度,t1℃时,甲的溶解度大于t2℃时丙的溶解度,所以所得溶液中溶质质量分数的大小关系为:乙>甲>丙。
(5)解:设这一定量石油产品中含硫酸的质量是x。
,
x=9.8g
20.CO2 NaCl CH4 Fe2O3 A B ACD
【解析】
试题分析:(1)①干冰是固态的二氧化碳,其化学式是CO2;
②厨房中常备,可用作调味剂的是氯化钠,其化学式是NaCl;
③天然气的主要成分是甲烷,其化学式为CH4;
④赤铁矿的主要成分是氧化铁,其化学式是Fe2O3;
故答案为(1)①CO2;②NaCl;③CH4;④Fe2O3;
(2)A、图中四个分子构成相同,为同种物质的分子,该图所示物质为纯净物;每个分子由不同种原子构成,为化合物的分子;故A图所示物质为化合物;故A正确;
B、图中四个分子构成相同,为同种物质的分子,图所示物质为纯净物;而每个分子是由同种原子构成的单质分子,则该图所示物质为单质;故B不正确;
C、图中四种分子其中有两个分子构成相同,而其余两个分子构成不同,图中共有三种分子,图所示物质为混合物;故C不正确;
D、图中四个分子为两种构成不同的分子,为两种物质的分子,图示物质为化合物的混合物;故D不正确;
故选A;
(3)A、由元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,可知碘的原子序数是53,因此核电荷数是53,故说法正确;
B、由碘原子的结构示意图,碘原子核外有五个电子层,最外层有7个电子,在化学反应中容易得到电子,故说法错误;
C、由汉语名称“碘”,可知其为非金属元素,故说法正确;
D、由元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,可知碘的相对原子质量为126.9,故说法正确.
故选B;
(4)A、根据甲、乙两固体物质的溶解度曲线图可知,随着温度的升高,甲的溶解度增大,乙的溶解度减小,说法正确;
B、根据甲、乙两固体物质的溶解度曲线图可知,t1℃时,甲的溶解度是20g,即100g水中最多溶解20g甲,因此30g甲加入到50g水中最多溶解10g,可得60g溶液,故说法错误;
C、降低温度甲的溶解度减小析出晶体,乙的溶解度增大,不会析出晶体,所以t2℃时等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲<乙,说法正确;
D、t2℃时,将甲、乙两物质的溶解度甲大于乙,所以该温度下甲乙的饱和溶液溶质质量分数也是甲大于乙;降低温度甲的溶解度减小析出晶体,溶质质量分数减小,乙的溶解度增大,但不会析出晶体所以溶液的溶质质量分数不变;降温到t1℃甲仍是饱和溶液,溶质质量分数=×100%;温度从t2℃降温到t1℃时乙不饱和,溶质质量分数小于×100%,t1℃时甲乙的溶解度相等,所以得出该温度时所得溶液溶质质量分数甲大于乙,故说法正确.
故选ACD.
21.乳化 煮沸 蒸发结晶 t1 A>B>C 20≤a<40
【详解】
(1)①洗洁精具有乳化功能,所以用洗洁精洗去衣服上的油污是乳化;
②生活中常用来降低水的硬度是煮沸;
③氯化钠的溶解度受温度变化影响较小,所以海水晒盐的原理是蒸发结晶。
(2)①通过分析溶解度曲线可知,A、B两种物质溶解度曲线在t1℃相交,说明A、B两种物质在t1℃时溶解度相同;
②t2℃时,三种物质的溶解度由大到小的顺序是A>B>C;
③t2℃时,A物质的溶解度是60g,B物质的溶解度是40g,C物质的溶解度是20g,所以将三种物质各ag分别加入到100g水中,充分溶解后,若只有一种物质能形成饱和溶液,则这种物质只能是C,则a的取值范围是20≤a<40。
22.活性炭 肥皂水 煮沸 +6 70 bc 降温结晶 B>A>C 24 25 < B
【详解】
(1)①滤液中有难闻的异味,可添加火星(有吸附色素和异味的作用)除去,
②生活中常用肥皂水来比较所取水样与制得的蒸馏水的硬度。
③经过净化后的水,在生活中通过加热、煮沸方法,降低水的硬度并杀菌;
④消毒剂为高铁酸钾(K2FeO4)。高铁酸钾中氧元素为-2价,钾元素为+1价,铁元素的化合价为+3价,表示为:。
(2)①在t2℃时,甲物质的溶解度为40g,将30gA物质充分溶解在盛有50g水的烧杯中,只能溶解20g,所得溶液的质量为20g+50g=70g;若将烧杯内物质降温至t1℃,溶液中变化的是
a 溶剂的质量不会改变;
b 降温后,溶质析出,溶液质量减少
c 降温后,溶质析出,溶质质量减少,溶剂质量不变,则溶质的质量分数变小;
故选:bc;
②A物质的溶解度受温度影响较大,当A物质中混有少量B、C两种物质时,采用降温结晶的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,A、B降温后,溶质都会析出,但B的溶解度大于A,C物质的溶解度在t2℃时,溶解度最低,降温后不会有溶质析出,溶质质量分数不变,依然最低;所得溶液的溶质质量分数由大到小的顺序是:B>A>C;
(3)实验室用质量分数为 6%的氯化钠溶液配制 50g 质量分数为3%的氯化钠溶液。
①配种溶液时,溶质只质量不变,氯化钠的质量m=50g×3%=1.5g,所需 6%的氯化钠溶液的质量为=,则体积为=≈24mL ;加水入水的质量=50g-25g=25g;
②若量取水时,采取仰视读数,则实际量取的液体体积偏大;其它操作均正确,则配制得到的稀溶液中溶质质量分数<3%;
③解:设生成硫酸锌溶中溶质的质量为x。
有硫酸反应后产出硫酸锌的对应关系可知:
x=16.1g
故选:B。
一、选择题(共16题)
1.下列关于溶液的叙述正确的是
A.任何溶液中只可能含有一种溶质
B.溶液一定是均一、稳定、澄清、透明的
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.一定温度下,物质的溶解度随溶剂的量的变化而变化
2.溶液对人类的生产和生活都有很重要的意义。下列关于溶液的说法正确的是
A.溶液组成中一定含有水
B.凡是均一、稳定的液体一定是溶液
C.溶液中各部分性质相同
D.饱和溶液就是不能再溶解任何物质的溶液
3.木糖醇是目前市场上一种常见的蔗糖替代品,如图所示为木糖醇溶解度曲线.据此判断,下列说法正确的是
A.木糖醇的溶解度随温度降低而增大
B.木糖醇溶液从30℃升温到50℃,溶液的组成不变
C.木糖醇溶液从50℃降温到30℃,一定没有晶体析出
D.30℃时,75克木糖醇可以完全溶解在100克水中
4.下图是甲乙两物质的溶解度曲线,下列说法中错误的是
A.t1℃时,甲的溶解度小于乙的溶解度
B.t2℃时,等质量甲和乙的饱和溶液中含有溶质的质量相等
C.将t3℃的甲乙两物质的溶液降温到t2℃时都会析出晶体
D.当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲
5.将60℃时的硝酸钠饱和溶液冷却到20℃,下列说法正确的是
A.溶液的溶质质量分数不变 B.溶液变成不饱和溶液
C.溶液质量增加 D.溶液中溶质的溶解度减少
6.室温时将下列各物质加入到一定量的水中不能形成饱和溶液的是
A.KNO3晶体 B.CO2气体 C.NaCl晶体 D.C2H5OH(酒精)
7.下图是甲、乙两种固体(不含结晶水)的溶解度曲线。t℃时,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液, 分别恒温蒸发等质量的水(未蒸干),正确的说法是
A.蒸发前,甲、乙溶液质量的大小关系为:甲>乙
B.蒸发后,所得甲溶液依然饱和,乙溶液不饱和
C.蒸发后,所得溶液中溶剂质量的大小关系为:甲<乙
D.蒸发后,析出固体质量的大小关系为:甲<乙
8.下列实验方案中不正确的是( )
A.鉴别食盐水和蒸馏水,可分别取少量做蒸发操作,蒸干后有固体留下的是食盐水
B.可以通过升高温度,将接近饱和的硝酸钾溶液转变成饱和溶液
C.鉴别空气、氧气、氮气三瓶无色气体,可以用燃着的木条进行鉴别
D.检验石蜡中是否含有氢元素,在其燃烧火焰上方罩上干冷的烧杯,观察烧杯内壁有无水雾
9.如图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是
A.P点表示甲、丙两种物质的饱和溶液的质量相等
B.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4
C.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液
D.将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质
10.下列实验中,对应的现象以及结论都正确且两者相符的是
选 项 A B C D
实 验
实 验 现 象 打开汽水瓶盖时,汽水 会自动喷出来 碘溶于水,几乎不溶于 汽油 白磷燃烧,产生大量白 烟,活塞先向右再向左移动,冷却至室温后, 最终停在刻度“4”附近 空气中,带火星的木条 复燃;呼出气体中,带 火星的木条熄灭
实 验 结 论 说明气体在水中的溶 解度随压强的增大而 减小 说明物质的溶解性与 溶剂的种类有关 氧气约占空气体积的 五分之一 空气中的氧气比呼出 气体中氧气多
A.A B.B C.C D.D
11.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.t1℃时,甲、乙的饱和溶液中溶质的质量相等
B.t2℃时,甲的饱和溶液中溶质和溶液的质量比为2:5
C.t2℃时,将等质量的甲乙配制成该温度下的饱和溶液,所得溶液的质量甲>乙
D.分别将甲、乙的饱和溶液从t2℃降温到t1℃,所得溶液中溶质质量分数相等
12.一定温度下,把l克熟石灰加入到100克水中,充分搅拌后仍有少许的熟石灰未溶解,静置后取上层清液,关于此清液的叙述正确的是( )
A.它是不饱和溶液 B.它是浓溶液 C.它是该温度下的饱和溶液 D.它的溶质质量分数为l%
13.已知蔗糖的溶解度随温度升高而变大。20 ℃下蔗糖加入一定量水中静止后如图所示,若要让试管中的蔗糖固体全部溶解,下列办法不可行的是
A.试管内加入适量水
B.烧杯内加入适量氢氧化钠固体
C.烧杯内加入适量生石灰
D.烧杯内加入适量硝酸铵固体
14.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
A.从a的饱和溶液中得到a晶体,可采用降温的方法
B.等质量三种物质的饱和溶液分别从40℃降温到20℃,a、c析出的晶体质量相等
C.c物质可能是氢氧化钙的溶解度曲线
D.三种物质的饱和溶液分别从40℃降温到20℃,所得溶液质量分数为b>a>c
15.如图是甲、乙两种固体的溶解度曲线。下列说法中正确的是
A.甲的溶解度大于乙的溶解度
B.t1℃时,50 g克水中溶解甲最多能形成65克溶液
C.t2℃时乙的饱和溶液降温至t1℃变为不饱和溶液
D.将t1℃时甲的饱和溶液升温至t2℃,溶质的质量分数增大
16.KNO3和NH4Cl的溶解度曲线如图所示,由图获得的信息中,不正确的是
A.两种物质的溶解度均随温度的升高而增大
B.t1℃时,NH4Cl饱和溶液中溶质与溶液的质量比为2:5
C.t2℃时,KNO3饱和溶液比NH4Cl饱和溶液的溶质质量分数大
D.t1℃时,KNO3溶解度大于NH4Cl溶解度
二、综合题(共6题)
17.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
18.根据下面的溶解度表与溶解度曲线回答下列问题。
(1)B是________的溶解度曲线。
(2)40 ℃时,氯化钠的溶解度________(填“大于”“小于”或“等于”)硝酸钾的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是________。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是________________。
(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是______(填字母)。
A.反应消耗水,氢氧化钙析出
B.反应放热,温度升高,氢氧化钙溶解度降低
C.生石灰与水反应生成的氢氧化钙不再溶解
19.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
20.(1)在H、C、O、Na、Fe、Cl几种元素中,选择适当元素组成符合下列要求的物质,将其化学式填在下面相应横线上.
①遇到干旱时节,可用于人工降雨的干冰___;
②厨房中常备,可用作调味剂的是____;
③天然气的主要成分_____;
④可用来冶炼铁的赤铁矿的主要成分是________.
(2)学好化学,必须要熟悉物质的组成与分类.图中“”和“”分别表示质子数不同的两种原子,则下列图中表示化合物的是______.(填字母)
(3)随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所关注.图1是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.
由此可知,下列说法错误的是______.(填字母)
A.碘原子的核电荷数为53
B.碘原子核外有五个电子层,在化学反应中容易失去电子
C.碘属于非金属元素
D.碘的相对原子质量为126.9
(4)甲、乙两固体物质的溶解度曲线如图2所示,下列说法正确的是____.(填字母,可能有多个选项)
A.随着温度的升高,甲的溶解度增大,乙的溶解度减小
B.t1℃时,30g甲加入到50g水中最多可得80g溶液
C.t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲<乙
D.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙.
21.水、溶液与生活息息相关。
(1)现有六个常见化学名词:乳化、溶解、煮沸、蒸馏、降温结晶、蒸发结晶。请选择适合的词填在后面的横线上。
①用洗洁精洗去衣服上的油污_____;
②生活中常用来降低水的硬度_____;
③海水晒盐的原理是_____。
(2)如图是A、B、C三种物质的溶解度曲线,回答下列问题:
①A、B两种物质在_____℃时溶解度相同。
②t2℃时,三种物质的溶解度由大到小的顺序是_____;
③t2℃时,将三种物质各ag分别加入到100g水中,充分溶解后,若只有一种物质能形成饱和溶液,则a的取值范围是_____。
22.(1)小明取串场河的河水,按下列流程进行实验,制取蒸馏水。请回答下列问题:
①滤液中有难闻的异味,可添加__________除去,
②生活中常用_____________来比较所取水样与制得的蒸馏水的硬度。
③经过净化后的水,在生活中通过__________方法,降低水的硬度并杀菌;
④消毒剂为高铁酸钾(K2FeO4)。高铁酸钾中铁元素的化合价为____________。
(2)如图是A、B、C三种物质的溶解度曲线,请回答:
①在t2℃时,将30gA物质充分溶解在盛有50g水的烧杯中,所得溶液的质量为_________g;若将烧杯内物质降温至t1℃(不考虑水蒸发),溶液中变化的是_____________(填字母序号)。
a 溶剂的质量 b 溶液的质量 c 溶质的质量分数
②当A物质中混有少量B、C两种物质时,采用_____________的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,所得溶液的溶质质量分数由大到小的顺序是____________。
(3)实验室用质量分数为 6%的氯化钠溶液(密度为1.04g/cm3)配制 50g 质量分数为3%的氯化钠溶液。
①经计算,所需 6%的氯化钠的体积为________mL;加水_______克
②若量取水时,采取仰视读数,其它操作均正确,则配制得到的稀溶液中溶质质量分数_______3% (填“>”“<”或“ = ”)。
③向该49g20%的稀硫酸中,加入7.3g已部分氧化的锌粉,恰好完全反应。则所得溶液中溶质的质量为 ___(填字母序号)
A 15.5g B 16.1g C 18.1g
参考答案
1.B
【详解】
A、溶液是指一种或几种物质分散到另一种物质中形成均一稳定的混合物,所以溶质可以是一种或多种,故错误;
B、溶液的特点:均一性、稳定性、属于混合物,故正确;
C、溶液的饱和与浓稀没有关系,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故错误;
D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,溶解度不受溶剂质量、溶液质量多少的影响,故错误。
故选B。
2.C
【详解】
A. 溶液组成中不一定含有水,如碘酒是酒精与碘组成的溶液,溶剂为酒精,选项错误;
B. 均一、稳定的液体不一定是溶液,如水也具有均一、稳定的性质,但不是溶液,选项错误;
C. 溶液具有均一性,所以溶液中各部分性质相同,选项正确;
D. 饱和溶液就是不能再溶解某种或某些物质的溶液,而不是不能溶解所有物质,选项错误,故选C。
3.B
【详解】
A、木糖醇的溶解度随温度降低而减小,故错误;
B、木糖醇的溶解度随温度的升高而增大,所以木糖醇溶液从30℃升温到50℃,不会析出晶体,溶质的质量不变,溶剂的质量不变,所以溶液的组成不变,正确;
C、不知溶液的状态,无法判断降温是否有晶体析出,故错误;
D、30℃时木糖醇的溶解度是60g,即100g水中最多溶解60g木糖醇,故75克木糖醇不能完全溶解在100克水中,最多溶解60g,故错误;
故选B.
4.C
【解析】A、根据溶解度曲线可知,t1℃时,甲的溶解度小于乙的溶解度,正确;B、t2℃时甲和乙的溶解度相等,在相同质量的饱和溶液中含溶质质量相同,正确;C、没有确定降温前溶液的状态,无法判断降温是否会析出晶体,若降温后仍然是不饱和溶液,则无晶体析出,错误;D、甲的溶解度受温度影响较大,当甲中混有少量的乙时,可采用冷却热饱和溶液的方法提纯甲,正确。故选C。
5.D
【解析】
试题分析:A、因硝酸钠的溶解度随温度的升高而增大,降温至20℃时,溶解度变小且仍为饱和溶液,则溶质质量分数减小,错误;B、溶液仍然为饱和溶液,错误;C、因溶解度减小,溶解溶质质量减小,则溶液质量减小,错误;D、溶液中荣知道溶解度减少,正确。故选D
6.D
【详解】
A. KNO3晶体易溶于水,和水能形成饱和溶液,此选项不符合题意;B. CO2气体易溶于水,和水能形成饱和溶液,此选项不符合题意;C. NaCl晶体易溶于水,和水能形成饱和溶液,此选项不符合题意;D. C2H5OH(酒精)能与水以任意比例互溶,不能形成饱和溶液,此选项符合题意。故选D。
7.C
【详解】
A、t℃时,甲物质的溶解度大于乙物质的溶解度,所以蒸发前,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液,甲、乙溶液质量的大小关系为:甲<乙,故A错误;
B、恒温蒸发等质量的水,温度不变,溶解度不变,所以析出晶体后的溶液仍然是饱和溶液,故B错误;
C、t℃时,甲物质的溶解度大于乙物质的溶解度,所以蒸发前,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液,蒸发前,甲溶液中的溶剂质量小于乙物质,恒温蒸发等质量的水,所以蒸发后,所得溶液中溶剂质量的大小关系为:甲<乙,故C正确;
D、t℃时,甲物质的溶解度大于乙物质的溶解度,所以恒温蒸发等质量的水,析出固体质量的大小关系为:甲>乙,故D错误。
故选C。
8.B
【详解】
A. 鉴别食盐水和蒸馏水,可分别取少量做蒸发操作,食盐水加热蒸发会有晶体析出,所以可用加热蒸发的方法鉴别食盐水和蒸馏水,方案正确;
B. 硝酸钾溶解度随温度升高而变大,不可以通过升高温度将接近饱和的硝酸钾溶液转变成饱和溶液,方案错误;
C. 鉴别空气、氧气、氮气三瓶无色气体,可以用燃着的木条进行鉴别,无明显变化的是空气,燃烧更旺的的氧气,熄灭的是氮气,方案正确;
D. 根据质量守恒定律,若证明石蜡燃烧生成水,则证明石蜡中含有氢元素,方案正确。
故选:B。
9.B
【详解】
A、P点表示t1℃甲、丙两种物质溶解度相等,不能说明它们饱和溶液的质量相等,说法错误;
B、t1℃时,甲的溶解度为25g,故甲物质的饱和溶液中溶质和溶剂的质量比为25g:100g=1:4,说法正确;
C、乙物质溶解度随温度升高而增大,t1℃时,乙物质的饱和溶液,升温至t2℃时不再是饱和溶液,说法错误;
D、将三种物质的饱和溶液从t2℃降至t1℃,但选项没有提及溶液的状态和质量,不能直接比较,说法错误;
故选:B。
10.C
【详解】
A、打开汽水瓶盖时,汽水会自动喷出来,说明气体在水中的溶解度随压强的减少而减小,结论错误;B、碘几乎不溶于水,能溶于汽油,溶质相同,溶剂不同,溶解性不同,说明物质的溶解性与溶剂的种类有关,现象错误;C、白磷燃烧,产生大量白烟,活塞先向右再向左移动,冷却至室温后, 最终停在刻度“4”附近,白磷燃烧消耗了空气中的氧气,氧气约占空气体积的五分之一,现象与结论都正确;D、空气中,带火星的木条不能复燃;呼出气体中,带火星的木条熄灭,现象错误。故选C。
11.D
【详解】
A、t1℃时,甲、乙两种物质的溶解度相同,则它们饱和溶液中溶质的质量分数相等,选项中没有说明甲、乙溶液质量是否相等,所以无法判断溶质质量是否相等,故错误;
B、t2℃时,甲物质的溶解度是40g,所以甲的饱和溶液中溶质和溶剂的质量之比为:40g:140g=2:7,故错误;
C、t2℃时,甲的溶解度大于乙,将等质量的甲乙配制成该温度下的饱和溶液,甲需要的水较少,所得溶液的质量甲<乙,故错误;
D、降低温度,甲、乙物质的溶解度都减小,都会有晶体析出, t1℃时甲乙的溶解度相等,根据饱和溶液质量分数= ,所以分别将甲、乙的饱和溶液从t2℃降温到t1℃,所得溶液中溶质质量分数相等,故正确。
故选:D。
12.C
【详解】
充分搅拌后仍有少许的熟石灰未溶解,因此所得的溶液为该温度下饱和溶液,A选项错误;溶液的浓稀是相比较而言的,只有一种溶液,无法判断溶液的浓稀,B选项错误;在该温度下,不能再溶解熟石灰了,因此所得的溶液是该温度下的饱和溶液,C选项错误;由于l克熟石灰未完全溶解,无法计算溶质质量分数,D选项错误。故选择C项。
13.D
【详解】
A选项,加入溶剂可以溶解更多的蔗糖
B选项,加入氢氧化钠固体放热,溶液温度升高,蔗糖溶解度升高,可以溶解更多的蔗糖
C选项,加入适量的生石灰放热,溶液温度升高,蔗糖溶解度升高,可以溶解更多的蔗糖
D选项,加入适量的硝酸铵固体吸热,溶液温度降低,蔗糖溶解度降低,不能溶解更多的蔗糖,故选D。
14.B
【详解】
A.由溶解度曲线可知,a物质的溶解度随温度的升高而明显增大,所以a的饱和溶液中得到a晶体,可以采用降温的方法,说法A不符合题意;
B.由溶解度曲线可知,c物质的溶解度随温度的降低而增大,所以c物质的饱和溶液40℃降温到20℃时,变成了不饱和溶液,没有晶体析出,说法B符合题意;
C.由溶解度曲线可知,c物质的溶解度随着温度的升高而减小,氢氧化钙的溶解度随着温度的升高而减小,所以c物质可能是氢氧化钙,说法C不符合题意;
D.将40℃时,a、b、c三种物质的饱和溶液降温至20℃,a和b的溶解度都变小,析出晶体,都仍然是饱和溶液,降温到20℃,谁的溶解度大,谁的溶质质量分数大,所以降温后,b物质的溶质质量分数大于a物质的溶质质量分数;c物质降温后,溶解度变大,变成不饱和溶液,溶质质量分数不变,溶质质量分数按照40℃时c物质的溶解度计算,因为20℃,a物质的溶解度大于40℃时物质的溶解度,所以降温后,a物质的溶质质量分数大于c物质的溶质质量分数,所以20℃时溶液质量分数为b>a>c;
故选B。
15.B
【详解】
A.溶解度受温度影响,不指名温度,无法比较溶解的大小;B. t1℃时,甲的溶解度等于30g,50 g克水中溶解甲最多能溶解的溶质为15g,形成等于65克溶液;C. t2℃时乙的饱和溶液降温至t1℃时,溶解度变小,溶质析出,得到的仍是饱和溶液;D. 将t1℃时甲的饱和溶液升温至t2℃,溶解度变大,溶质的质量不变,溶质的质量分数不变。
16.B
【详解】
A、根据图象可以看出,两种物质的溶解度均随温度的升高而增大,故正确;
B、t1℃时,NH4Cl的溶解度为40g,饱和溶液中溶质与溶液的质量比为40g:140g=2:7,故错误;
C、t2℃时,KNO3的溶解度大于NH4Cl的溶解度,故KNO3饱和溶液比NH4Cl饱和溶液的溶质质量分数大,故正确;
D、t1℃时,KNO3溶解度大于NH4Cl溶解度,故正确。
故选B。
17.
(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
【分析】
(1)
大气中二氧化碳的含量过高会加剧温室效应,所以控制CO2的排放,是为了减缓温室效应,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度增大;
(2)
石灰石的主要成分是碳酸钙,在高温的条件下,碳酸钙分解为氧化钙和二氧化碳,反应的符号表达式 为:,生成的CaO疏松多孔,结构与活性炭相似,其在捕集过程中对CO2具有良好的吸附性;
(3)
对CO2气体加压、降温,可获得干冰,从构成物质的微粒视角分析,该过程主要改变的是分子间隔,干冰升华吸收热量,所以干冰能用于人工降雨;
(4)
①气体中CO2体积分数增大时,pH变小,溶液的酸性增强,即溶液中碳酸的浓度增大;故填:H2CO3;
②酸溶液能使紫色的石蕊试液变红色,所以可使用石蕊试液;
(5)
①由如图可推测,影响公园中植物与大气碳交换的因素有气温、光照强度;
②水是植物光合作用的原料之一,所以为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天水分含量的变化。
18.NaCl 小于 (重)结晶 加KNO3 (固体)(或蒸发水分,或降低温度) B
【解析】
(1)根据溶解度表与溶解度曲线可知:B是NaCl(或食盐)的溶解度曲线;(2)由溶解度表格中的数据可知,40℃时,氯化钠的溶解度小于硝酸钾的溶解度;(3)根据溶解度曲线可知:硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是(重)结晶;(4)因为硝酸钾的溶解度受温度的影响较大,故可知欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是加KNO3 (固体)(或蒸发水分,或降低温度);(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,而氢氧化钙的溶解度随温度的升高而降低;向烧杯B中加入生石灰后,生石灰溶于水放热,溶液的温度升高,氢氧化钙溶解度降低,有晶体析出。故选B。
19.吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
【详解】
(1)活性炭具有吸附性,加入活性炭的作用是吸附水中的色素和异味。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+和一个Mg2+均带两个单位的正电荷,由图可知,一个Ca2+和一个Mg2+可交换出个4Na+,所以一个Ca2+可以交换出2个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。阳离子交换柱中Na+含量较高,属于硬水。则利用生活中常见物质检验阳离子交换柱已失效的方法是:取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开后,瓶内压强变小,所以CO2的溶解度变化如图中的a点变化到c点。
(4)①t1℃时,甲的溶解度是20g,则该饱和溶液中溶质与溶液的质量比为:20g:(20g+100g)=1:6。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,甲、乙的溶解度减小,溶质质量分数变小,丙的溶解度增大,变为不饱和溶液,溶质质量分数不变,由于t1℃时,乙的溶解度大于甲的溶解度,t1℃时,甲的溶解度大于t2℃时丙的溶解度,所以所得溶液中溶质质量分数的大小关系为:乙>甲>丙。
(5)解:设这一定量石油产品中含硫酸的质量是x。
,
x=9.8g
20.CO2 NaCl CH4 Fe2O3 A B ACD
【解析】
试题分析:(1)①干冰是固态的二氧化碳,其化学式是CO2;
②厨房中常备,可用作调味剂的是氯化钠,其化学式是NaCl;
③天然气的主要成分是甲烷,其化学式为CH4;
④赤铁矿的主要成分是氧化铁,其化学式是Fe2O3;
故答案为(1)①CO2;②NaCl;③CH4;④Fe2O3;
(2)A、图中四个分子构成相同,为同种物质的分子,该图所示物质为纯净物;每个分子由不同种原子构成,为化合物的分子;故A图所示物质为化合物;故A正确;
B、图中四个分子构成相同,为同种物质的分子,图所示物质为纯净物;而每个分子是由同种原子构成的单质分子,则该图所示物质为单质;故B不正确;
C、图中四种分子其中有两个分子构成相同,而其余两个分子构成不同,图中共有三种分子,图所示物质为混合物;故C不正确;
D、图中四个分子为两种构成不同的分子,为两种物质的分子,图示物质为化合物的混合物;故D不正确;
故选A;
(3)A、由元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,可知碘的原子序数是53,因此核电荷数是53,故说法正确;
B、由碘原子的结构示意图,碘原子核外有五个电子层,最外层有7个电子,在化学反应中容易得到电子,故说法错误;
C、由汉语名称“碘”,可知其为非金属元素,故说法正确;
D、由元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,可知碘的相对原子质量为126.9,故说法正确.
故选B;
(4)A、根据甲、乙两固体物质的溶解度曲线图可知,随着温度的升高,甲的溶解度增大,乙的溶解度减小,说法正确;
B、根据甲、乙两固体物质的溶解度曲线图可知,t1℃时,甲的溶解度是20g,即100g水中最多溶解20g甲,因此30g甲加入到50g水中最多溶解10g,可得60g溶液,故说法错误;
C、降低温度甲的溶解度减小析出晶体,乙的溶解度增大,不会析出晶体,所以t2℃时等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲<乙,说法正确;
D、t2℃时,将甲、乙两物质的溶解度甲大于乙,所以该温度下甲乙的饱和溶液溶质质量分数也是甲大于乙;降低温度甲的溶解度减小析出晶体,溶质质量分数减小,乙的溶解度增大,但不会析出晶体所以溶液的溶质质量分数不变;降温到t1℃甲仍是饱和溶液,溶质质量分数=×100%;温度从t2℃降温到t1℃时乙不饱和,溶质质量分数小于×100%,t1℃时甲乙的溶解度相等,所以得出该温度时所得溶液溶质质量分数甲大于乙,故说法正确.
故选ACD.
21.乳化 煮沸 蒸发结晶 t1 A>B>C 20≤a<40
【详解】
(1)①洗洁精具有乳化功能,所以用洗洁精洗去衣服上的油污是乳化;
②生活中常用来降低水的硬度是煮沸;
③氯化钠的溶解度受温度变化影响较小,所以海水晒盐的原理是蒸发结晶。
(2)①通过分析溶解度曲线可知,A、B两种物质溶解度曲线在t1℃相交,说明A、B两种物质在t1℃时溶解度相同;
②t2℃时,三种物质的溶解度由大到小的顺序是A>B>C;
③t2℃时,A物质的溶解度是60g,B物质的溶解度是40g,C物质的溶解度是20g,所以将三种物质各ag分别加入到100g水中,充分溶解后,若只有一种物质能形成饱和溶液,则这种物质只能是C,则a的取值范围是20≤a<40。
22.活性炭 肥皂水 煮沸 +6 70 bc 降温结晶 B>A>C 24 25 < B
【详解】
(1)①滤液中有难闻的异味,可添加火星(有吸附色素和异味的作用)除去,
②生活中常用肥皂水来比较所取水样与制得的蒸馏水的硬度。
③经过净化后的水,在生活中通过加热、煮沸方法,降低水的硬度并杀菌;
④消毒剂为高铁酸钾(K2FeO4)。高铁酸钾中氧元素为-2价,钾元素为+1价,铁元素的化合价为+3价,表示为:。
(2)①在t2℃时,甲物质的溶解度为40g,将30gA物质充分溶解在盛有50g水的烧杯中,只能溶解20g,所得溶液的质量为20g+50g=70g;若将烧杯内物质降温至t1℃,溶液中变化的是
a 溶剂的质量不会改变;
b 降温后,溶质析出,溶液质量减少
c 降温后,溶质析出,溶质质量减少,溶剂质量不变,则溶质的质量分数变小;
故选:bc;
②A物质的溶解度受温度影响较大,当A物质中混有少量B、C两种物质时,采用降温结晶的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,A、B降温后,溶质都会析出,但B的溶解度大于A,C物质的溶解度在t2℃时,溶解度最低,降温后不会有溶质析出,溶质质量分数不变,依然最低;所得溶液的溶质质量分数由大到小的顺序是:B>A>C;
(3)实验室用质量分数为 6%的氯化钠溶液配制 50g 质量分数为3%的氯化钠溶液。
①配种溶液时,溶质只质量不变,氯化钠的质量m=50g×3%=1.5g,所需 6%的氯化钠溶液的质量为=,则体积为=≈24mL ;加水入水的质量=50g-25g=25g;
②若量取水时,采取仰视读数,则实际量取的液体体积偏大;其它操作均正确,则配制得到的稀溶液中溶质质量分数<3%;
③解:设生成硫酸锌溶中溶质的质量为x。
有硫酸反应后产出硫酸锌的对应关系可知:
x=16.1g
故选:B。
