高中化学苏教版(2019)必修第二册7.3氮及其化合物复习课件(28张ppt)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册7.3氮及其化合物复习课件(28张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-04 10:12:34 | ||
图片预览





文档简介
(共28张PPT)
苏教版《化学》必修2
氮及其化合物复习
生物固氮
汽车尾气处理
氮气的物理性质
氮氧化物的污染
常见氮肥的种类
化肥的合理使用
氮气的用途
硝酸的用途
铵盐的受热分解
硝酸的化学性质
硝酸的物理性质
铵盐与碱的反应
高能固氮
氮气的化学性质
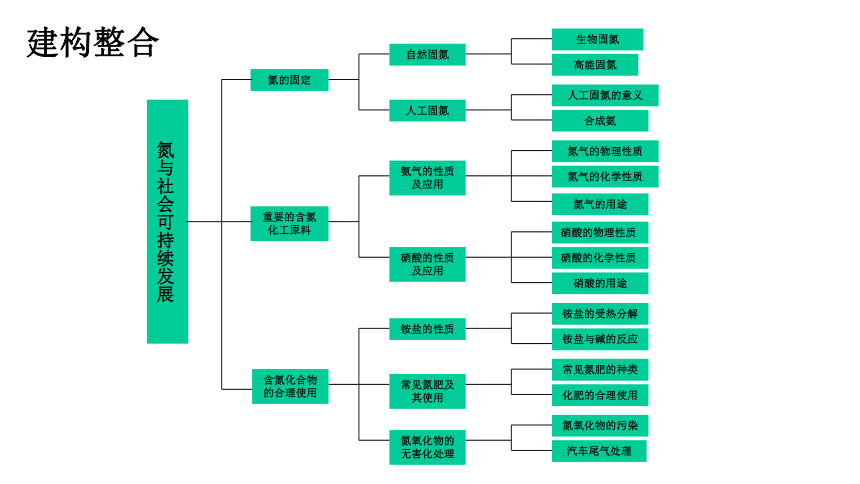
人工固氮的意义
合成氨
自然固氮
氮与社会可持续发展
人工固氮
氨气的性质及应用
硝酸的性质及应用
铵盐的性质
常见氮肥及其使用
氮氧化物的无害化处理
重要的含氮化工原料
含氮化合物的合理使用
氮的固定
建构整合
请写出N在周期表中的位置, N2的电子式、结构式,并从结构角度分析氮分子稳定的原因。
N2
第二周期,第VA族
N
自然固氮
生物固氮
高能固氮
“氮”之香味
人工固氮
请写出“雷雨发庄稼”、合成氨的化学反应方程式。
工业合成氨
N2+O2 == 2NO
放电
2NO+O2 = 2NO2
3NO2+H2O=2HNO3+NO
N2 + 3H2 2NH3
高温高压
催化剂
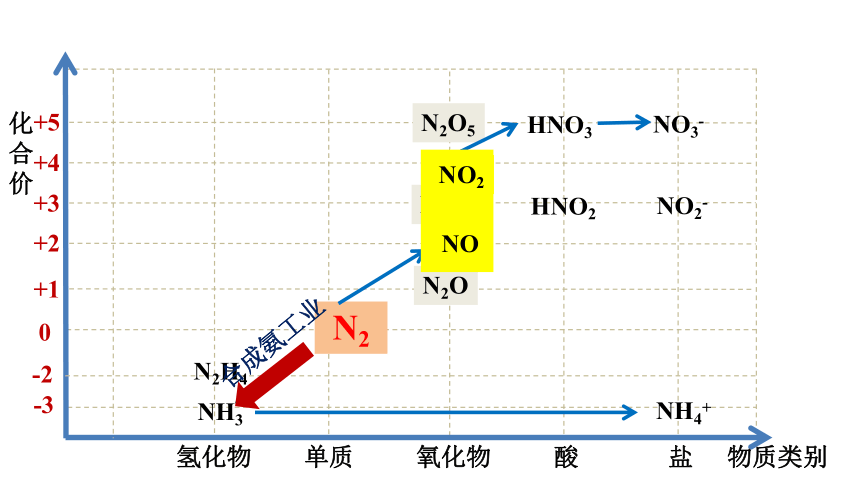
氢化物
氧化物
酸
盐
单质
-3
0
+1
+2
+3
+4
+5
N2
NH3
NO
NO2
NH4+
HNO3
NO3-
物质类别
化
合
价
N2O3
N2O
N2O5
HNO2
NO2-
-2
N2H4
合成氨工业
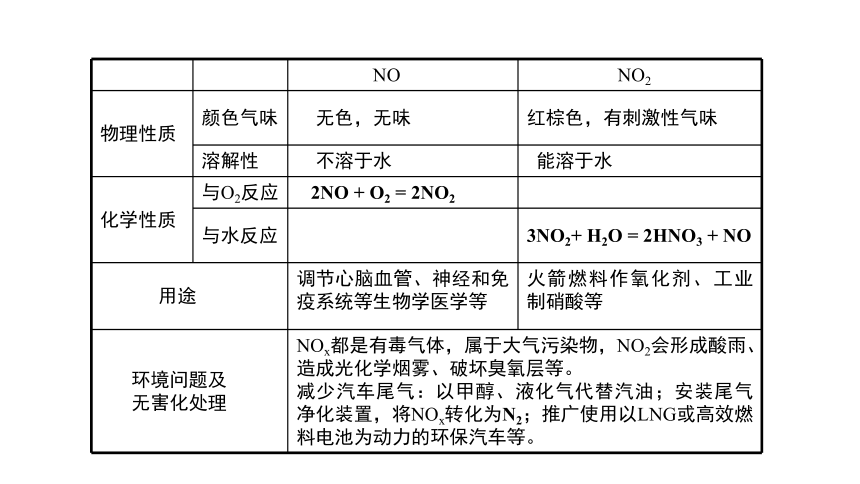
NO NO2
物理性质 颜色气味 无色,无味 红棕色,有刺激性气味
溶解性 不溶于水 能溶于水
化学性质 与O2反应 2NO + O2 = 2NO2
与水反应 3NO2+ H2O = 2HNO3 + NO
用途 调节心脑血管、神经和免疫系统等生物学医学等 火箭燃料作氧化剂、工业制硝酸等
环境问题及
无害化处理 NOx都是有毒气体,属于大气污染物,NO2会形成酸雨、造成光化学烟雾、破坏臭氧层等。
减少汽车尾气:以甲醇、液化气代替汽油;安装尾气净化装置,将NOx转化为N2;推广使用以LNG或高效燃料电池为动力的环保汽车等。
请写出氨分子的电子式、结构式
NH3
N
H
H
H
:
:
..
..
H—N—H
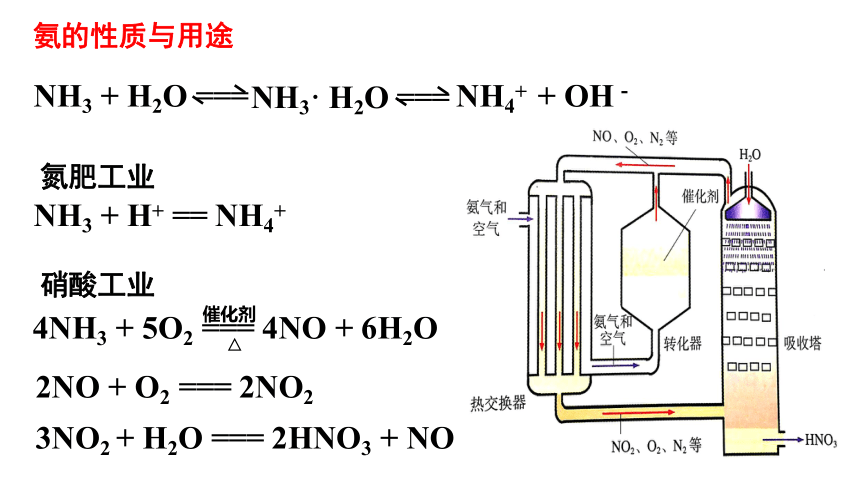
NH3 + H+ == NH4+
△
催化剂
4NH3 + 5O2 === 4NO + 6H2O
2NO + O2 === 2NO2
3NO2 + H2O === 2HNO3 + NO
氮肥工业
硝酸工业
NH3 + H2O === NH4+ + OH-
NH3· H2O ===
氨的性质与用途
氢化物
氧化物
酸
盐
单质
-3
0
+1
+2
+3
+4
+5
NH3
NH4+
HNO3
NO3-
物质类别
化
合
价
HNO2
NO2-
-2
N2
氧化剂
还原剂
4NH3+6NO 5N2+6H2O
催化剂
8NH3+6NO2 7N2+12H2O
归中反应
氧化剂
还原剂
2NO+2CO===N2+2CO2
催化剂
处理汽车尾气的催化 转化器
氨气处理氮氧化物
8NH3+6NO2===7N2+12H2O
失去24e-
得到24e-
-3
+4
0
催化剂
臭氧也可用于烟气脱硝。O3氧化NO结合水洗,可产生HNO3和O2,
写出该反应的化学方程式 ;若
产生1mol O2,需转移的电子数为 mol。
3O3 + 2NO + H2O == 2HNO3 + 3O2
2
用氢氧化钠溶液处理氮氧化物
2NO2+2 NaOH=NaNO2+NaNO3+H2O
NO+ NO2+2NaOH=2NaNO2+H2O
氢化物
氧化物
酸
盐
单质
-3
0
+1
+2
+3
+4
+5
NH3
HNO3
NO3
物质类别
化
合
价
HNO2
NO2-
有机物
-2
N2
2NO2+2 NaOH=NaNO2+NaNO3+H2O
NO+ NO2+2NaOH=2NaNO2+H2O
NH4+
NH4+
NO3-
NO2-
氧化剂
还原剂
归中反应
氧化剂
歧化反应
3ClO- + 2NH4+ + 2OH- == N2 ↑ + 3Cl - +5H2O
3NO2+ H2O =2HNO3+ NO
NH3
实验室制法:2NH4Cl+Ca(OH)2== CaCl2+2NH3↑+2H2O
化学性质: 与水、酸、氧气等反应
铵盐
性质:白色、易溶于水的晶体,受热易分解,能与碱反应
NH4+的检验:取样,加入氢氧化钠溶液并加热,如果产生能使湿润的 红色石蕊试纸变蓝的气体(NH3),证明原物质中含NH4+
HNO3
性质:挥发性、强酸性、不稳定性、强氧化性
下列有关实验室制取、干燥、收集、吸收氨气的方法中,正确的是
分析:NH4Cl受热易分解,但分解生成的NH3和HCl遇冷又重新化合生成NH4Cl,A错误,实验室制法:2NH4Cl+Ca(OH)2== CaCl2+2NH3↑+2H2O
浓硫酸能与NH3反应,B错误;收集NH3时,导管的末端应插入到试管的底部,C错误;NH3极易溶于水,采用防倒吸装置吸收,D正确。
D
浓硝酸、稀硝酸氧化性的比较
(1)由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮元素的化
合价变化为+5 +4;稀硝酸被还原为NO,氮元素的化合价变化为+5
+2。一般情况下,硝酸的浓度越小,其还原产物的价态越低。
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 ↑ +2H2O
C + 4HNO3(浓) == CO2 ↑ + 4NO2 ↑ +2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
(2)实验证明,硝酸浓度越大,得电子的能力越强,因而其氧化能力越强。 如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
6HI+2HNO3(稀) 3I2+2NO↑+4H2O
HI+6HNO3(浓) HIO3+6NO2↑+3H2O
(3)硝酸在氧化还原反应中,其还原产物可能有多种价态的物质: O2、
2O3、 O、 O、 、 H3等,这取决于硝酸的浓度和还原剂还原性的
强弱。除前面的实例外,锌与硝酸可发生如下反应:
4Zn+10HNO3(稀) 4Zn(NO3)2+N2O↑+5H2O
4Zn+10HNO3(极稀) 4Zn(NO3)2+NH4NO3+3H2O
AB
A
【答案】6.C 7.C
【答案】8.A
9.
10.
苏教版《化学》必修2
氮及其化合物复习
生物固氮
汽车尾气处理
氮气的物理性质
氮氧化物的污染
常见氮肥的种类
化肥的合理使用
氮气的用途
硝酸的用途
铵盐的受热分解
硝酸的化学性质
硝酸的物理性质
铵盐与碱的反应
高能固氮
氮气的化学性质
人工固氮的意义
合成氨
自然固氮
氮与社会可持续发展
人工固氮
氨气的性质及应用
硝酸的性质及应用
铵盐的性质
常见氮肥及其使用
氮氧化物的无害化处理
重要的含氮化工原料
含氮化合物的合理使用
氮的固定
建构整合
请写出N在周期表中的位置, N2的电子式、结构式,并从结构角度分析氮分子稳定的原因。
N2
第二周期,第VA族
N
自然固氮
生物固氮
高能固氮
“氮”之香味
人工固氮
请写出“雷雨发庄稼”、合成氨的化学反应方程式。
工业合成氨
N2+O2 == 2NO
放电
2NO+O2 = 2NO2
3NO2+H2O=2HNO3+NO
N2 + 3H2 2NH3
高温高压
催化剂
氢化物
氧化物
酸
盐
单质
-3
0
+1
+2
+3
+4
+5
N2
NH3
NO
NO2
NH4+
HNO3
NO3-
物质类别
化
合
价
N2O3
N2O
N2O5
HNO2
NO2-
-2
N2H4
合成氨工业
NO NO2
物理性质 颜色气味 无色,无味 红棕色,有刺激性气味
溶解性 不溶于水 能溶于水
化学性质 与O2反应 2NO + O2 = 2NO2
与水反应 3NO2+ H2O = 2HNO3 + NO
用途 调节心脑血管、神经和免疫系统等生物学医学等 火箭燃料作氧化剂、工业制硝酸等
环境问题及
无害化处理 NOx都是有毒气体,属于大气污染物,NO2会形成酸雨、造成光化学烟雾、破坏臭氧层等。
减少汽车尾气:以甲醇、液化气代替汽油;安装尾气净化装置,将NOx转化为N2;推广使用以LNG或高效燃料电池为动力的环保汽车等。
请写出氨分子的电子式、结构式
NH3
N
H
H
H
:
:
..
..
H—N—H
NH3 + H+ == NH4+
△
催化剂
4NH3 + 5O2 === 4NO + 6H2O
2NO + O2 === 2NO2
3NO2 + H2O === 2HNO3 + NO
氮肥工业
硝酸工业
NH3 + H2O === NH4+ + OH-
NH3· H2O ===
氨的性质与用途
氢化物
氧化物
酸
盐
单质
-3
0
+1
+2
+3
+4
+5
NH3
NH4+
HNO3
NO3-
物质类别
化
合
价
HNO2
NO2-
-2
N2
氧化剂
还原剂
4NH3+6NO 5N2+6H2O
催化剂
8NH3+6NO2 7N2+12H2O
归中反应
氧化剂
还原剂
2NO+2CO===N2+2CO2
催化剂
处理汽车尾气的催化 转化器
氨气处理氮氧化物
8NH3+6NO2===7N2+12H2O
失去24e-
得到24e-
-3
+4
0
催化剂
臭氧也可用于烟气脱硝。O3氧化NO结合水洗,可产生HNO3和O2,
写出该反应的化学方程式 ;若
产生1mol O2,需转移的电子数为 mol。
3O3 + 2NO + H2O == 2HNO3 + 3O2
2
用氢氧化钠溶液处理氮氧化物
2NO2+2 NaOH=NaNO2+NaNO3+H2O
NO+ NO2+2NaOH=2NaNO2+H2O
氢化物
氧化物
酸
盐
单质
-3
0
+1
+2
+3
+4
+5
NH3
HNO3
NO3
物质类别
化
合
价
HNO2
NO2-
有机物
-2
N2
2NO2+2 NaOH=NaNO2+NaNO3+H2O
NO+ NO2+2NaOH=2NaNO2+H2O
NH4+
NH4+
NO3-
NO2-
氧化剂
还原剂
归中反应
氧化剂
歧化反应
3ClO- + 2NH4+ + 2OH- == N2 ↑ + 3Cl - +5H2O
3NO2+ H2O =2HNO3+ NO
NH3
实验室制法:2NH4Cl+Ca(OH)2== CaCl2+2NH3↑+2H2O
化学性质: 与水、酸、氧气等反应
铵盐
性质:白色、易溶于水的晶体,受热易分解,能与碱反应
NH4+的检验:取样,加入氢氧化钠溶液并加热,如果产生能使湿润的 红色石蕊试纸变蓝的气体(NH3),证明原物质中含NH4+
HNO3
性质:挥发性、强酸性、不稳定性、强氧化性
下列有关实验室制取、干燥、收集、吸收氨气的方法中,正确的是
分析:NH4Cl受热易分解,但分解生成的NH3和HCl遇冷又重新化合生成NH4Cl,A错误,实验室制法:2NH4Cl+Ca(OH)2== CaCl2+2NH3↑+2H2O
浓硫酸能与NH3反应,B错误;收集NH3时,导管的末端应插入到试管的底部,C错误;NH3极易溶于水,采用防倒吸装置吸收,D正确。
D
浓硝酸、稀硝酸氧化性的比较
(1)由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮元素的化
合价变化为+5 +4;稀硝酸被还原为NO,氮元素的化合价变化为+5
+2。一般情况下,硝酸的浓度越小,其还原产物的价态越低。
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 ↑ +2H2O
C + 4HNO3(浓) == CO2 ↑ + 4NO2 ↑ +2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
(2)实验证明,硝酸浓度越大,得电子的能力越强,因而其氧化能力越强。 如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
6HI+2HNO3(稀) 3I2+2NO↑+4H2O
HI+6HNO3(浓) HIO3+6NO2↑+3H2O
(3)硝酸在氧化还原反应中,其还原产物可能有多种价态的物质: O2、
2O3、 O、 O、 、 H3等,这取决于硝酸的浓度和还原剂还原性的
强弱。除前面的实例外,锌与硝酸可发生如下反应:
4Zn+10HNO3(稀) 4Zn(NO3)2+N2O↑+5H2O
4Zn+10HNO3(极稀) 4Zn(NO3)2+NH4NO3+3H2O
AB
A
【答案】6.C 7.C
【答案】8.A
9.
10.
