高中化学苏教版(2019)必修第二册专题9金属及其化合物复习课件(42张ppt)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册专题9金属及其化合物复习课件(42张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-04 10:13:25 | ||
图片预览








文档简介
(共42张PPT)
金属及其化合物复习
一、建构知识网络
1.钠及其重要化合物
2.铁及其化合物
(1)
一、建构知识网络
(2)重要反应必练
写出下列反应的化学方程式,是离子反应的写离子方程式。
①Fe和过量稀HNO3的反应
;
②Fe高温下和水蒸气的反应
;
③铝与氧化铁的铝热反应
;
Fe+4H++ ===Fe3++NO↑+2H2O
④用赤铁矿冶炼铁的原理
;
⑤Fe(OH)2长时间露置于空气中
;
⑥FeO和稀HNO3的反应
;
3FeO+10H++ NO3- ===3Fe3++NO↑+5H2O
4Fe(OH)2+O2+2H2O===4Fe(OH)3
⑦FeCl3溶液可溶解铁片
⑧印刷电路板原理
2Fe3++Cu===2Fe2++2Cu2+
2Fe3++Fe===3Fe2+
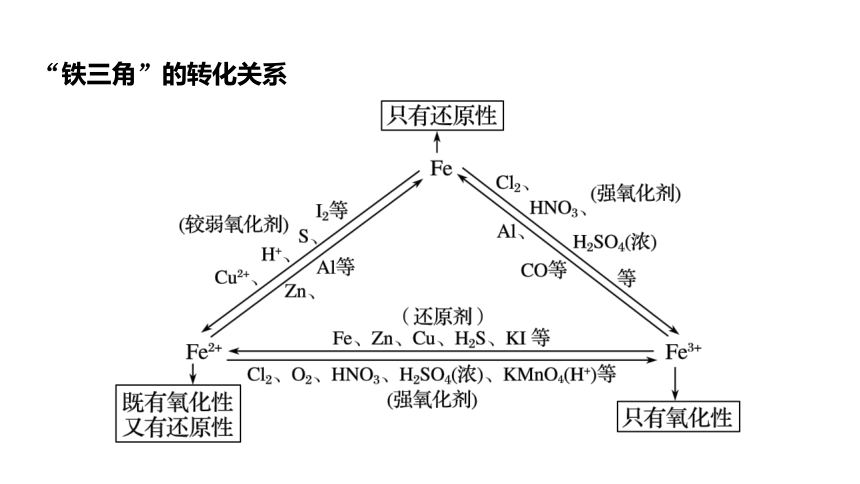
“铁三角”的转化关系
完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。
(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:
。
(2)将FeCl3溶液滴入KI- 淀粉溶液,溶液变蓝:
。
H2S+2Fe3+===S↓+2Fe2++2H+
2I-+2Fe3+===I2+2Fe2+
(3)FeSO4可使酸性KMnO4溶液褪色:
。
(4)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出:
。
5Fe2++ +8H+===5Fe3++Mn2++4H2O
3Fe2++NO3- +4H+===3Fe3++NO↑+2H2O
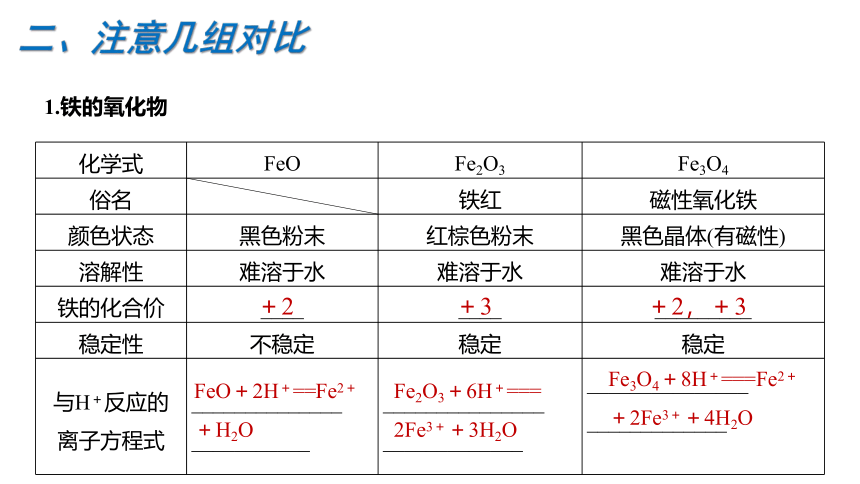
1.铁的氧化物
化学式 FeO Fe2O3 Fe3O4
俗名 铁红 磁性氧化铁
颜色状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
溶解性 难溶于水 难溶于水 难溶于水
铁的化合价 ____ ____ _________
稳定性 不稳定 稳定 稳定
与H+反应的 离子方程式 ______________ ___________ _______________ _____________ _______________
_____________
Fe2O3+6H+===
2Fe3++3H2O
+2
+3
+2,+3
FeO+2H+==Fe2++H2O
Fe3O4+8H+===Fe2+
+2Fe3++4H2O
二、注意几组对比
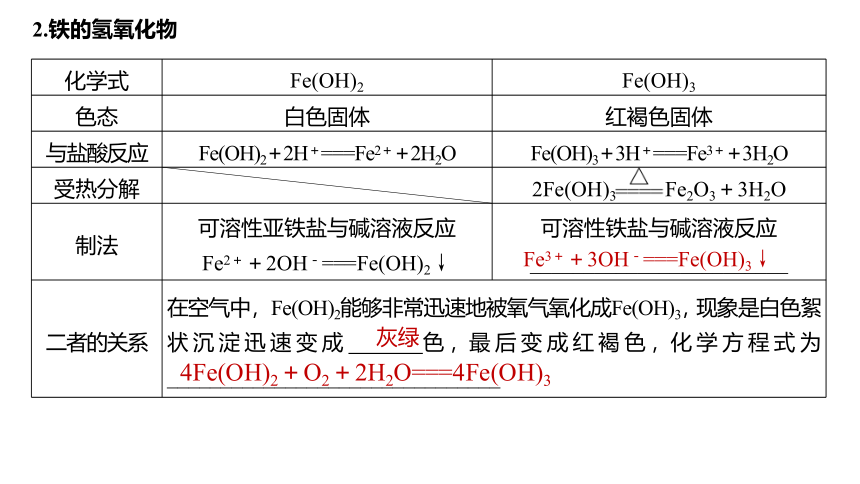
2.铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
色态 白色固体 红褐色固体
与盐酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
受热分解 2Fe(OH)3 Fe2O3+3H2O
制法 可溶性亚铁盐与碱溶液反应 Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应
________________________
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成 色,最后变成红褐色,化学方程式为_______________________________ 4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe3++3OH-===Fe(OH)3↓
灰绿
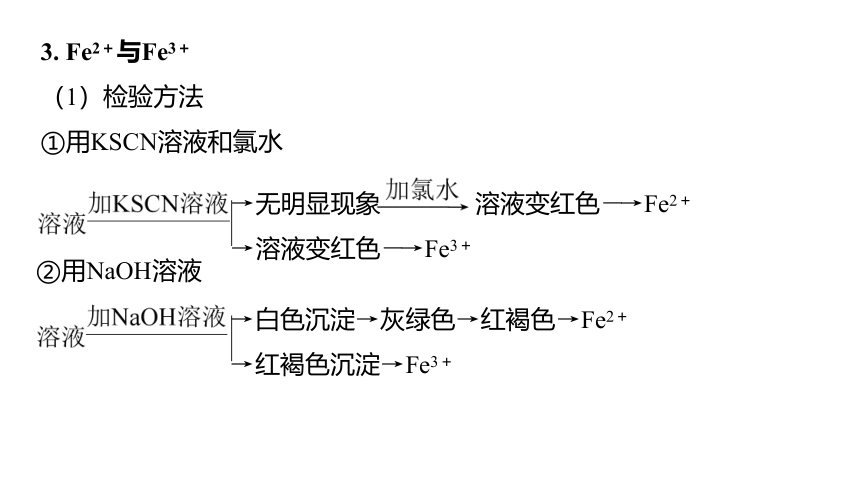
3. Fe2+与Fe3+
(1)检验方法
①用KSCN溶液和氯水
→无明显现象 溶液变红色―→Fe2+
→溶液变红色―→Fe3+
②用NaOH溶液
→白色沉淀→灰绿色→红褐色→Fe2+
→红褐色沉淀→Fe3+
③含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验
④Fe2+的特征检验方法
溶液 产生蓝色沉淀,说明溶液中含有Fe2+,3Fe2++
2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓
(2)含Fe2+、Fe3+的除杂问题
主要成分 杂质 除杂方法
FeCl3(aq) FeCl2(aq)
FeCl2(aq) FeCl3(aq)
FeCl2(aq) CuCl2(aq)
加入氯水或H2O2
加过量铁粉后过滤
加过量铁粉后过滤
4. +6价Fe
在酸性溶液中, FeO4 2-是一种很强的氧化剂,一般氧化剂很难把Fe3+氧化为FeO4 2-
在强碱性介质中, +2价、+3价铁能被一些氧化剂氧化。例如,工业上用次氯酸盐氧化氢氧化铁制备高铁酸盐
3NaClO+2Fe(OH)3+4NaOH==2Na2FeO4+3NaCl+5H2O
例如, K2FeO4 、 Na2FeO4中的Fe为+6价
高铁酸盐是一种高效绿色净水剂,FeO42- 中Fe呈+6价,具有很强的氧化性,能通过氧化作用进行消毒。同时,+6价的铁被还原为+3价的铁,形成具有强吸附性的氢氧化铁胶体,通过吸附与水中的细微悬浮物共同聚沉,对环境和生命都不会造成危害。
1.侯氏制碱法
三、关注工艺流程
2.从海水中提取镁
3.从铝土矿提取铝(拓展视野)
金属的冶炼本质:
金属的冶炼本质是通过还原剂使化合态的金属得到电子变成金属单质。金属越不活泼,从其化合物中还原出来越容易,金属越活泼,从其化合物中还原出来越困难。金属的活动性与冶炼方法关系如下:
+1
+2
+3
0
单质
氧化物
氢氧化物
盐
Fe
Fe(OH)2
Fe(OH)3
FeO
Fe3O4
Fe2O3
FeCl3
FeSO4
磁性材料
制做涂料油漆
焊接铁轨
冶炼金属铁
净水剂
制作印刷电路板
检验苯酚
食品抗氧化剂
合金应用
净水剂
补血剂
K2FeO4
净水剂
+6
价态
制颜料、药物
四、掌握由物质性质所决定的用途
1.铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的说法中正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生红色沉淀
√
五、课堂练习
2.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
选项 操作、现象 解释
A 向KI- 淀粉溶液中加入FeCl3溶液,溶液变蓝 Fe3+能与淀粉发生显色反应
B 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 铁在潮湿的空气中易生成Fe(OH)3
C 向稀硝酸中加入少量铁粉,有气泡产生 说明Fe置换出硝酸中的氢,生成了氢气
D 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 说明Fe(OH)2易被O2氧化成Fe(OH)3
√
√
√
5.已知三氯化铁的熔点为306 ℃,沸点为315 ℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
(1)装置的连接顺序为_________。
aghdebcf
浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→ d→e→b→c→f。
(2)饱和食盐水的作用是________________________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
除去氯气中的氯化氢气体
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为_____________
Fe3++3SCN-===Fe(SCN)3
Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈红色,离子方程式为Fe3++3SCN-===Fe(SCN)3。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是________________
Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,溶液颜色加深。
双氧水将Fe2+
氧化成Fe3+
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明____________________________________;
实验②的目的是_______________________________________;
得出结论:_________________________。
SCN-发生了反应而不是Fe3+发生反应
排除H2O2分解产生的O2氧化SCN-的可能
H2O2将SCN-氧化成SO42-
根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明生成了 ;
根据②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,所以氧化SCN-的为双氧水。
(5) FeCl3可通过多种途径转化成FeCl2。工业上常将无水FeCl3在氮气作保护气的条件下加热至300~350 ℃,再通入干燥的H2而制得FeCl2。
该反应的化学方程式为______________________________
FeCl3转化为FeCl2,Fe的化合价降低,则H的化合价必定升高,这样即可写出反应的化学方程式。
谢谢大家!
金属及其化合物复习
一、建构知识网络
1.钠及其重要化合物
2.铁及其化合物
(1)
一、建构知识网络
(2)重要反应必练
写出下列反应的化学方程式,是离子反应的写离子方程式。
①Fe和过量稀HNO3的反应
;
②Fe高温下和水蒸气的反应
;
③铝与氧化铁的铝热反应
;
Fe+4H++ ===Fe3++NO↑+2H2O
④用赤铁矿冶炼铁的原理
;
⑤Fe(OH)2长时间露置于空气中
;
⑥FeO和稀HNO3的反应
;
3FeO+10H++ NO3- ===3Fe3++NO↑+5H2O
4Fe(OH)2+O2+2H2O===4Fe(OH)3
⑦FeCl3溶液可溶解铁片
⑧印刷电路板原理
2Fe3++Cu===2Fe2++2Cu2+
2Fe3++Fe===3Fe2+
“铁三角”的转化关系
完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。
(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:
。
(2)将FeCl3溶液滴入KI- 淀粉溶液,溶液变蓝:
。
H2S+2Fe3+===S↓+2Fe2++2H+
2I-+2Fe3+===I2+2Fe2+
(3)FeSO4可使酸性KMnO4溶液褪色:
。
(4)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出:
。
5Fe2++ +8H+===5Fe3++Mn2++4H2O
3Fe2++NO3- +4H+===3Fe3++NO↑+2H2O
1.铁的氧化物
化学式 FeO Fe2O3 Fe3O4
俗名 铁红 磁性氧化铁
颜色状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
溶解性 难溶于水 难溶于水 难溶于水
铁的化合价 ____ ____ _________
稳定性 不稳定 稳定 稳定
与H+反应的 离子方程式 ______________ ___________ _______________ _____________ _______________
_____________
Fe2O3+6H+===
2Fe3++3H2O
+2
+3
+2,+3
FeO+2H+==Fe2++H2O
Fe3O4+8H+===Fe2+
+2Fe3++4H2O
二、注意几组对比
2.铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
色态 白色固体 红褐色固体
与盐酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
受热分解 2Fe(OH)3 Fe2O3+3H2O
制法 可溶性亚铁盐与碱溶液反应 Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应
________________________
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成 色,最后变成红褐色,化学方程式为_______________________________ 4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe3++3OH-===Fe(OH)3↓
灰绿
3. Fe2+与Fe3+
(1)检验方法
①用KSCN溶液和氯水
→无明显现象 溶液变红色―→Fe2+
→溶液变红色―→Fe3+
②用NaOH溶液
→白色沉淀→灰绿色→红褐色→Fe2+
→红褐色沉淀→Fe3+
③含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验
④Fe2+的特征检验方法
溶液 产生蓝色沉淀,说明溶液中含有Fe2+,3Fe2++
2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓
(2)含Fe2+、Fe3+的除杂问题
主要成分 杂质 除杂方法
FeCl3(aq) FeCl2(aq)
FeCl2(aq) FeCl3(aq)
FeCl2(aq) CuCl2(aq)
加入氯水或H2O2
加过量铁粉后过滤
加过量铁粉后过滤
4. +6价Fe
在酸性溶液中, FeO4 2-是一种很强的氧化剂,一般氧化剂很难把Fe3+氧化为FeO4 2-
在强碱性介质中, +2价、+3价铁能被一些氧化剂氧化。例如,工业上用次氯酸盐氧化氢氧化铁制备高铁酸盐
3NaClO+2Fe(OH)3+4NaOH==2Na2FeO4+3NaCl+5H2O
例如, K2FeO4 、 Na2FeO4中的Fe为+6价
高铁酸盐是一种高效绿色净水剂,FeO42- 中Fe呈+6价,具有很强的氧化性,能通过氧化作用进行消毒。同时,+6价的铁被还原为+3价的铁,形成具有强吸附性的氢氧化铁胶体,通过吸附与水中的细微悬浮物共同聚沉,对环境和生命都不会造成危害。
1.侯氏制碱法
三、关注工艺流程
2.从海水中提取镁
3.从铝土矿提取铝(拓展视野)
金属的冶炼本质:
金属的冶炼本质是通过还原剂使化合态的金属得到电子变成金属单质。金属越不活泼,从其化合物中还原出来越容易,金属越活泼,从其化合物中还原出来越困难。金属的活动性与冶炼方法关系如下:
+1
+2
+3
0
单质
氧化物
氢氧化物
盐
Fe
Fe(OH)2
Fe(OH)3
FeO
Fe3O4
Fe2O3
FeCl3
FeSO4
磁性材料
制做涂料油漆
焊接铁轨
冶炼金属铁
净水剂
制作印刷电路板
检验苯酚
食品抗氧化剂
合金应用
净水剂
补血剂
K2FeO4
净水剂
+6
价态
制颜料、药物
四、掌握由物质性质所决定的用途
1.铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的说法中正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生红色沉淀
√
五、课堂练习
2.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
选项 操作、现象 解释
A 向KI- 淀粉溶液中加入FeCl3溶液,溶液变蓝 Fe3+能与淀粉发生显色反应
B 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 铁在潮湿的空气中易生成Fe(OH)3
C 向稀硝酸中加入少量铁粉,有气泡产生 说明Fe置换出硝酸中的氢,生成了氢气
D 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 说明Fe(OH)2易被O2氧化成Fe(OH)3
√
√
√
5.已知三氯化铁的熔点为306 ℃,沸点为315 ℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
(1)装置的连接顺序为_________。
aghdebcf
浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→ d→e→b→c→f。
(2)饱和食盐水的作用是________________________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
除去氯气中的氯化氢气体
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为_____________
Fe3++3SCN-===Fe(SCN)3
Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈红色,离子方程式为Fe3++3SCN-===Fe(SCN)3。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是________________
Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,溶液颜色加深。
双氧水将Fe2+
氧化成Fe3+
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明____________________________________;
实验②的目的是_______________________________________;
得出结论:_________________________。
SCN-发生了反应而不是Fe3+发生反应
排除H2O2分解产生的O2氧化SCN-的可能
H2O2将SCN-氧化成SO42-
根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明生成了 ;
根据②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,所以氧化SCN-的为双氧水。
(5) FeCl3可通过多种途径转化成FeCl2。工业上常将无水FeCl3在氮气作保护气的条件下加热至300~350 ℃,再通入干燥的H2而制得FeCl2。
该反应的化学方程式为______________________________
FeCl3转化为FeCl2,Fe的化合价降低,则H的化合价必定升高,这样即可写出反应的化学方程式。
谢谢大家!
