北京市高三各区第一学期期末化学考试分类汇编 :基础实验 科学探究pdf
文档属性
| 名称 | 北京市高三各区第一学期期末化学考试分类汇编 :基础实验 科学探究pdf |  | |
| 格式 | zip | ||
| 文件大小 | 745.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-04 21:25:11 | ||
图片预览




文档简介
北京市 2020-2021 学年高三各区第一学期期末化学---科学探究
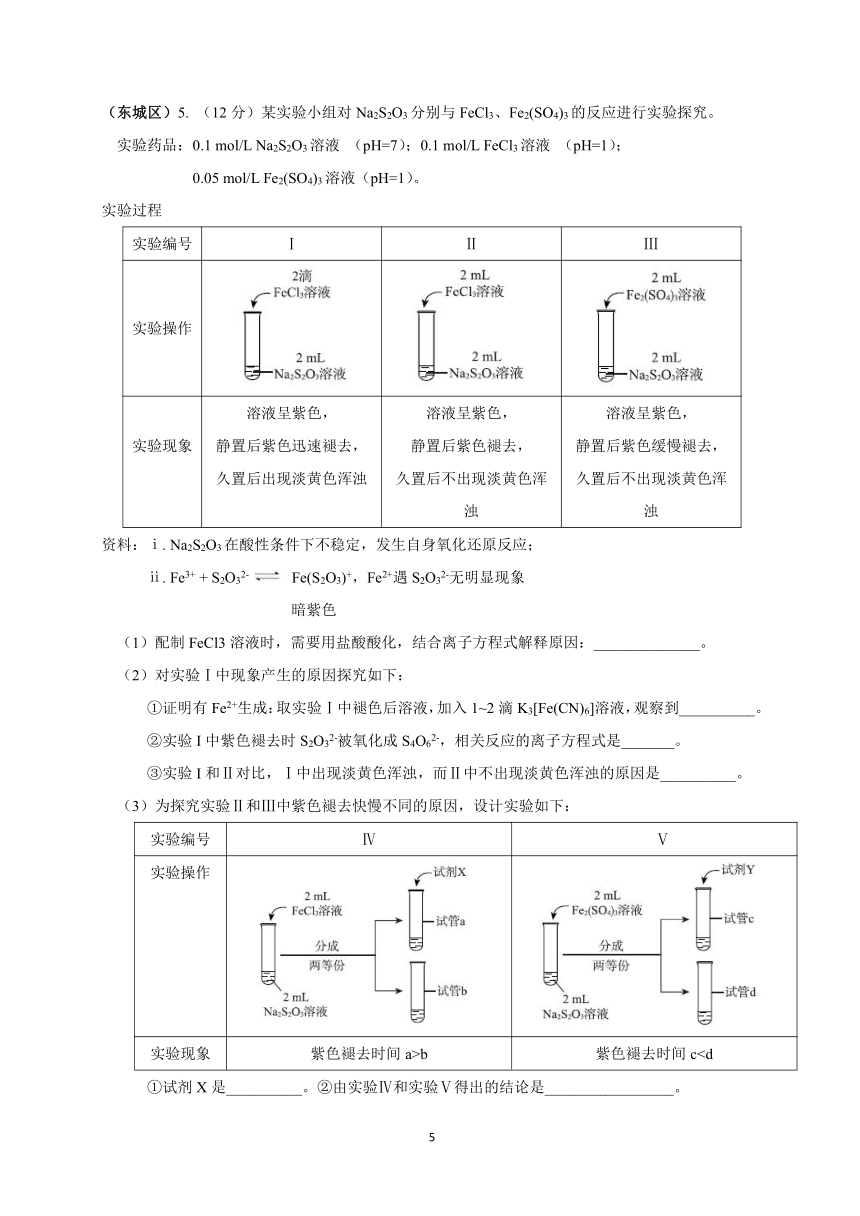
(海淀区)1(. 12分)实验小组探究酸对 Fe3++3SCN- Fe(SCN)3 平衡的影响。将 0.005 mol/L FeCl3
溶液(接近无色)和 0.01 mol/L KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进
行如下操作并记录现象。(1)FeCl3水解显酸性的原因是_____(用方程式表示)。
(2)甲同学认为加入酸后,会使 Fe3++3SCN- Fe(SCN)3体系中_____浓度改变,导致该平衡正
向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
Fe3+和 Cl-、SO2 -4 均能发生络合反应:
Fe3++4Cl- [FeCl4]-(黄色);Fe3++2SO2 -4 [Fe(SO4) ]
-
2 (无色)。
实验 I. 探究现象 a中溶液颜色变化的原因
编号 操作 现象
① 向 2 mL红色溶液中滴加 5滴水 溶液颜色无明显变化
② 向 2 mL红色溶液中滴加 5滴 3 mol/L KCl溶液 溶液颜色变浅,呈橙色
(3)实验①的目的是_____。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象 a:______。
实验Ⅱ. 探究现象 b中溶液呈浅黄色的原因
编号 操作 现象
③ 取 1 mL 0.0025 mol/L Fe2(SO4)3溶液(无色),加入 1mL 0.01 溶液先变红,加硫酸
mol/L KSCN溶液,再加入 5滴 1.5 mol/L H2SO4溶液 后变为浅黄色
④ 取 1 mL 0.005 mol/L FeCl3溶液,
(5)结合实验③可推测现象 b中使溶液呈浅黄色的微粒可能有两种,分别是_____。
(6)乙同学进一步补充了实验④,确证了现象 b中使溶液呈浅黄色的微粒只是(5)中的一种,请
将实验④的操作及现象补充完整:_____。
1
(朝阳区)2.(10分)用 FeSO4·7H2O晶体配制 FeSO4溶液,放置一天后发现产生黄色固体。实验
小组同学研究固体成分及产生的原因。
(1)① 配制 100 mL 0.100 mol·L-1FeSO4溶液,需要称取 g FeSO4·7H2O晶体。
(已知:FeSO4·7H2O 的摩尔质量为 278 g·mol-1)
② 需要的主要玻璃仪器有:烧杯、玻璃棒、量筒、胶头滴管和 。
(2)小组同学推测放置一天后的 FeSO4溶液中存在 Fe3+。将产生 Fe3+的离子方程式补充完整:
Fe2+ + H+ + === Fe3+ +
(3)分离出黄色固体,经多次洗涤后完成如下实验:
证实黄色固体中含 Fe3+和 SO 2-4 ,试剂 1和试剂 2分别是______、______。
(4)实验测定 FeSO4溶液放置过程中溶液的 pH和黄色固体的量的变化,结果如下:
1 小时 6小时 24 小时
溶液的 pH 2.39 2.35 1.40
黄色固体的量 几乎没有 少量 大量
分析黄色固体中除 Fe3+、SO42-还可能含有______离子。
(5)查阅资料:不同 pH下 Fe2+的氧化率随时间变化的关系如下图。为避免 Fe2+被氧化,配制 FeSO4
溶液时,需要添加______。
2
(朝阳区)3.(12分)实验小组研究 Ag2S的生成与转化。
已知:i. AgCl(s) + 3Cl-(aq) AgCl -43 (aq)
ii.常温下一些盐在水中的溶解度及颜色如下表:
盐 AgCl Ag2S Ag2SO3 Ag2SO4 CuS
溶解度/g 1.5×10-4 1.3×10-16 4.6×10-4 0.796 1.08×10-17
颜色 白色 黑色 白色 白色 黑色
(1)证明 AgCl能够转化为 Ag2S,实验如下:
① AgNO3溶液是溶液_______(填“a”或“b”),另一溶液是 NaCl溶液。
② 现象 a是_______。
(2)研究 CuCl2溶液能否使 Ag2S转化为 AgCl,实验如下:
① 白色固体含 AgCl,结合平衡移动原理解释加水稀释产生白色固体的原因:_____。
② 小组同学对 Ag2S转化为 AgCl的原因提出假设:
假设一:S2-可与 Cu2+形成 CuS c S2 ,从而降低 ,加入 Cu2+是使 Ag2S发生转化的主要
原因;
假设二:Ag 可与Cl 3 形成AgCl4 ,从而降低 c Ag ,加入Cl 是使 Ag2S发生转化的
主要原因。
……
小组同学设计对比实验,证明假设二不.合.理.,实验操作和现象是_____。
(3)有文献表明,HNO3能使 Ag2S转化为 Ag2SO3,实验如下:
① 加入浓氨水,溶解白色固体 a的目的是______。
② 检验白色固体 b中含有亚硫酸根的实验操作和现象是______。
(4)综合上述实验,溶解度较大的银盐转化为 Ag2S较容易;而使 Ag2S转化为溶解
度较大的银盐,可采取的措施有______。
3
(东城区)4. (10分)氯化钠是自然界中常见的盐,在生产生活中有着广泛的用途。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以 Cl-形式存在的原因: 。
②海水晒制的粗盐中还含有泥沙、CaCl2、MgCl2以及可溶的硫酸盐等杂质,可以依次通过
溶解、过滤、 (选填字母序号;所加试剂均过量)、结晶等一系列流程得到精
盐。
a. 加入 Na2CO3溶液→加入 NaOH溶液→加入 BaCl2溶液→过滤→加入稀盐酸
b. 加入 NaOH溶液→加入 BaCl2溶液→加入 Na2CO3溶液→加入稀盐酸→过滤
c. 加入 BaCl2溶液→加入 Na2CO3溶液→加入 NaOH溶液→过滤→加入稀盐酸
③检验精盐中 SO42-是否除净的原理是_____________(用离子方程式表示)
(2)食品加工中的氯化钠
①腌渍蔬菜时,食盐的主要作用是 (选填字母序号)。
a. 着色剂 b. 防腐剂 c. 营养强化剂
②动物血制品富含蛋白质。在制作血豆腐的过程中,向新鲜动物血液中加入食盐,蛋白质发
生了 (填“盐析”或“变性”) 。
(3)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是 。
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物 O2,结合下
图解释 O2含量随阳极区溶液的 pH变化的原因: 。
4
(东城区)5. (12分)某实验小组对 Na2S2O3分别与 FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1 mol/L Na2S2O3溶液 (pH=7);0.1 mol/L FeCl3溶液 (pH=1);
0.05 mol/L Fe2(SO4)3溶液(pH=1)。
实验过程
实验编号 Ⅰ Ⅱ Ⅲ
实验操作
溶液呈紫色, 溶液呈紫色, 溶液呈紫色,
实验现象 静置后紫色迅速褪去, 静置后紫色褪去, 静置后紫色缓慢褪去,
久置后出现淡黄色浑浊 久置后不出现淡黄色浑 久置后不出现淡黄色浑
浊 浊
资料:ⅰ. Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ⅱ. Fe3+ + S2O32- Fe(S2O3)+,Fe2+遇 S2O32-无明显现象
暗紫色
(1)配制 FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:______________。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有 Fe2+生成:取实验Ⅰ中褪色后溶液,加入 1~2滴 K3[Fe(CN)6]溶液,观察到__________。
②实验 I中紫色褪去时 S2O32-被氧化成 S4O62-,相关反应的离子方程式是_______。
③实验 I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是__________。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
实验编号 Ⅳ Ⅴ
实验操作
实验现象 紫色褪去时间 a>b 紫色褪去时间 c①试剂 X是__________。②由实验Ⅳ和实验Ⅴ得出的结论是_________________。
5
(西城区)6.(10分)
某铁矿石中铁元素的化合价为+2价和+3价,测定其中铁元素总含量的实验如下。
已知:ⅰ.该实验条件下,SnCl2的氧化产物为 SnCl62 ,Cr2O72 的还原产物为 Cr3+。
ⅱ.杂质不参加反应。
Ⅰ.将铁矿石粉碎,取 m g铁矿石粉于烧杯中,加入浓盐酸,加热使其充分溶解;
Ⅱ.冷却后过滤、洗涤,将滤液和洗涤液转移到 250 mL仪器 a中定容;
Ⅲ.移取 25 mL溶液于锥形瓶中,加入 4 mol·L 1盐酸,加热至接近沸腾,边摇动锥形瓶边缓慢
滴加一定浓度的 SnCl2溶液,至恰好完全反应,停止滴加 SnCl2溶液;
Ⅳ.冷却后加入 50 mL蒸馏水和指示剂,用 c mol·L 1K2Cr2O7溶液滴定至终点;
Ⅴ.重复测定三次,消耗 K2Cr2O7溶液的平均体积为 v mL。
(1)Ⅰ中,加快化学反应速率的措施有______(至少写出 2个)。
(2)Ⅱ中,仪器 a的名称是______。
(3)Ⅲ中,Sn2+还原 Fe3+的离子方程式是______。
(4)该铁矿石中铁元素的质量分数为______。
(5)Ⅲ中,若 SnCl2过量,测得的铁矿石中铁元素的质量分数会______(填“偏大”、“偏小”或
“不变”)。
6
(西城区)7.(12分)
某同学研究浓硝酸与 KSCN溶液的反应。
资料:Ⅰ.SCN 中 S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ.SCN 的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合
为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
实验一:
(1)向浓硝酸中滴加 KSCN溶液,溶液立即变红是因为生成了______(填化学式)。
(2)研究 SCN 的转化产物。
实验二:
a.将实验一ⅲ中的气体通入 Ba(OH)2和 NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少
量 KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入 BaCl2溶液,产生大量白色沉淀。
①通过 b证实了红棕色气体中不含 SO2,证据是______。
②a中,Ba(OH)2溶液中加入 NaOH溶液以增大 OH 浓度的目的是______。
③由上述实验现象可知:SCN 转化的最终产物中一定有______。
(3)继续研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。
实验三:
①对比实验一和实验三可得结论:一定浓度的 NO2 ______。
②结合实验三,从化学反应速率的角度解释实验一ⅱ和ⅲ中的现象:______。
7
(丰台区)8.为进一步研究过氧化钠与水的反应,某活动小组进行了如下探究。
(1)把一定量水滴入盛有少量过氧化钠固体的试管中,反应的化学方程式为 。
(2)向反应后的溶液中滴入酚酞,一段时间后,发现溶液颜色逐渐变浅,最后颜色消失。为探
究原因,进行实验 1(环境温度为 30℃)结果如下:
NaOH溶液浓度(/ mol/L) 10.0 2.0 1.0 0.10 0.010
滴入酚酞时现象 深紫红色 深红色 深红色 深红色 深红色
溶液变为浅红色时间 2~3s 26~30s 54~60s 6~7min 45min内稳定不变
7~8s 50~54s 100~110s 20min后仍溶液完全褪色时间 2h后略变浅
几乎无色 几乎无色 为浅红色
最终溶液是否褪色 褪色 褪色 褪色 不褪色 不褪色
结合表中数据,判断下列说法正确的是 。(填字母)
a. 其他条件相同时,NaOH溶液浓度越大褪色越快
b. 溶液褪色可能是 NaOH溶液浓度过大导致的
c. 当NaOH溶液浓度大于或等于 1.0 mol/L时,对溶液颜色变化有明显影响
(3)中间产物 H2O2也可能会对溶液颜色的变化产生影响。
①假设 1:受 H2O2自身氧化性的影响。
为验证假设,设计实验方案: 。实验表明,随 H2O2浓度的增大,溶液颜色变化更快。
②假设 2: 。
为验证假设,设计了实验 2,请补全实验装置。
实验 2结果如下:
NaOH溶液浓度/(mol/L) 滴入酚酞时现象 溶液完全褪色时间
2.0 深红色 约 50s
1.0 深红色 约 1min50s
对比实验 1,表中数据说明 。
(4)若准确称取 Na2O2的质量为 1.56 g,加入一定体积的水后得到 20 mL 溶液,则所得 NaOH
溶液的物质的量浓度为 。
(5)实验过程中,需待 Na2O2固体完全溶解后再加入酚酞,原因是 。
综上所述,Na2O2与水反应过程复杂,滴入酚酞时溶液颜色变化受多因素影响。
8
(石景山区)9.(14分)实验小组探究 FeCl3溶液灼烧的变化。
已知:FeO是一种黑色粉末,不稳定,在空气中加热,可被氧化成 Fe3O4,隔绝空气加热会歧化
为 Fe 和 Fe3O4。
Ⅰ. FeCl3溶液的灼烧。
实验ⅰ:将一只白粉笔浸泡在 FeCl3溶液中,用坩埚钳夹持粉笔于酒精
灯上灼烧,很快观察到粉笔表面颜色的变化:黄色→红褐色→铁锈色→ 浸泡过 FeCl3
溶液的粉笔
黑色。
酒精灯
(1)配制 FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀
释到所需要的浓度。结合化学用语解释将氯化铁晶体溶于盐酸的目的______。
(2)“黄色→红褐色→铁锈色→黑色”颜色变化中的“铁锈色”物质是______。(填化学式)
(3)针对“黑色”物质,小组成员提出猜想。
猜想 1:酒精灼烧粉笔的产物;猜想 2:酒精还原“铁锈色”物质得到的产物。
通过实验排除了猜想①,实验操作和现象是______。
Ⅱ.探究“黑色”物质的成分。
实验ⅱ:先用酒精蒸气排尽装置中的空气,再在“铁锈色”物质处加热,充分反应至“铁锈色”
物质完全变成“黑色”物质。取下装有新制 Cu(OH)2的试管,加热,有砖红色沉淀生成。
“铁锈色”物质
热水浴中
的酒精
新制 Cu(OH)2悬
浊液
实验ⅲ:在“黑色”物质中加入热的硫酸,“黑色”物质溶解,无气泡产生。
(4)甲同学根据实验ⅱ和ⅲ的现象,判断“黑色”物质中含有二价铁,其理由是____。
(5)乙同学用实验ⅲ中所得溶液进行实验 iv,证实了甲的判断,实验 iv的离子反应方程式为______。
(6)丙同学发现“黑色”物质完全被磁铁吸引,推测“黑色”物质是 Fe3O4,写出
“铁锈色”物质变成 Fe3O4的化学方程式______。
(7)丁同学为证明“黑色”物质是 Fe3O4,设计实验方案并预测:取实验ⅲ中少量清液滴入足量
的 Na2S溶液,认为得到物质的量之比为 3∶1的 FeS 和 S沉淀,即可证明。你认为是否合
理,并说明理由______。
9
(通州区)10.某同学对 Cl2与 KI溶液的反应进行了实验探究。反应装置如右图所示:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。
继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与 NaOH溶液反应的化学方程式是________________________;
(2)KI溶液变为黄色说明氯气具有____________性,该反应的离子方程式是____________;
(3)已知 I2 I I3 , I2 、 I3 在水中均呈黄色。为确定黄色溶液的成分,进行以下实验:
操作 实验现象
a 取 2~3mL 黄色溶液,加入足量CCl4,振荡静置 CCl4层呈紫红色,水层显浅黄色
b 取 2~3mL 饱和碘水,加入足量CCl4,振荡静置 CCl4层呈紫红色,水层几近无色
1 实验 b的目的是______________________________________________________;
2 根据实验 a可知,水层中含有的粒子有_____________;
③用化学平衡原理解释实验 a中水溶液颜色变浅的原因:_________________;
(4)通入氯气,溶液由黄色变为无色,是因为氯气将 I2 氧化。已知1molCl2可氧化0.2molI2,该
反应的离子方程式是____________________________;
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为___________;
(6)溶液最终变为浅黄绿色的原因是_________________________。
北京市 2020-2021 学年高三各区第一学期期末化学考试分类汇编
(十一)基础实验 科学探究 参考答案
(海淀区)1.(12 分)
(1)Fe3++3H2O Fe(OH) +3+3H
(2)c(Fe3+)
(3)排除稀释使溶液颜色变化的干扰(证明溶液颜色变化是否与稀释有关)
(4)在 Fe3++3SCN- Fe(SCN) -3平衡体系中加入盐酸,Fe3+和 Cl 发生络合反应使得 c(Fe3+)减小,
10
平衡逆向移动,c[Fe(SCN)3]减小,使溶液颜色变浅呈橙色。
(5)FeCl-4 和 Fe(SCN)3
(6)加入 1mL 蒸馏水,再加入 5 滴 1.5 mol/L H2SO4溶液;得无色溶液。
(朝阳区)2.(10分)
(1)① 2.78
② 100 mL容量瓶
(2) 4Fe2++ 4H++ O2=== 4Fe3++ 2H2O
(3) KSCN溶液 BaCl2溶液
(4) OH-
(5) 适量的稀硫酸和铁粉
(朝阳区)3.(12分)
(1)① b
② 白色沉淀变为黑色沉淀
2 AgCl(s) + 3Cl-( )① 加水稀释使平衡 (aq) AgCl43-(aq)逆向移动,生成白色沉淀
② 用 2mL 4mol/L NaCl溶液浸泡 Ag2S沉淀,取上层清液,加水稀释,未见白色沉淀产生
(3)① 使白色沉淀 a中的 SO32-进入溶液中,以便后续检验
② 向白色固体 b中加入足量盐酸,沉淀部分溶解
(4) 加入合适的试剂,使之转化为更难溶的硫化物;
加入合适的氧化剂,将 S2-氧化
(东城区)4.(10 分)
(1)①氯原子结构示意图为 ,最外层为 7 个电子,且原子半径较小,易得 1 个电子形成
稳定结构。
② c ③Ba2+ + SO 2-4 =BaSO4↓
(2)① b ② 盐析
电解
(3)① 2NaCl + 2H2O === Cl2↑+ H2↑+ 2NaOH
② 随着溶液的 pH 增大,c(OH-)增大,OH-还原性增强,因此 OH-更易在阳极放电,O2含量
增大
(东城区)5.(12 分)
(1) FeCl 溶液中存在平衡 Fe3+3 + 3H2O Fe(OH)3 + 3H+,加入盐酸,c(H+)增加,上述平衡左
11
移,进而抑制 Fe3+水解
(2) ①有蓝色沉淀生成
②2Fe3+ + 2S O 2- = 2Fe2+ + S O 2-[或 2Fe(S O )+ 2+2 3 4 6 2 3 = 2Fe + S4O 2-6 ]
③Ⅱ中 Fe3+和 S O 2-2 3 的物质的量之比为 1:1,反应后 S2O 2-3 没有剩余;Ⅰ中 S O 2-2 3 过量且溶液
呈酸性,因此久置后溶液中发生反应 2H+ + S O 2-2 3 = S↓+ SO2↑ + H2O
(3) ①Na2SO4固体
②其他条件相同时,Cl-能加快 Fe(S + 2-2O3) 发生反应,加速紫色褪去,而 SO4 能减慢该反应
(西城区)6.(每空 2分,共 10分)
(1)粉碎、加入浓盐酸、加热
(2)容量瓶
(3)2Fe3++Sn2++6Cl =△==2Fe2++SnCl62
(4)3.36cv/m×100%
(5)偏大
(西城区)7.(每空 2分,共 12分)
(1)(SCN)x
(2)①向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量 KMnO4
溶液,不褪色
②避免混合气体中大量的 NO2使溶液呈酸性,干扰检验 CO2和 SO2
③CO2、SO42
(3)①能加快浓硝酸氧化(SCN)x 的化学反应速率(或能催化浓硝酸氧化(SCN)x)
②实验一中存在反应:a.浓硝酸氧化 SCN ,b.浓硝酸氧化(SCN)x,化学反应速率:υa>
υb,所以ⅱ中溶液立即变红;静置过程中,生成的 NO2溶于硝酸,浓度积累到一定程度
时,使υb增大,红色迅速褪去
(丰台区)8.(12分)
(1)2Na2O2+ 2H2O === 4NaOH + O2↑(2分)
(2)abc(2分)
(3)①取等体积的 0.010 mol/L的 NaOH溶液分置于 3个小烧杯中,分别滴加 2d酚酞试液,然
后同时加入 3种不同浓度的 H2O2溶液(2分)
②H2O2分解产生的 O2的影响(1分)
30mL 10%12H2O2溶液
(2分)
中间产物 H2O2分解产生的 O2对滴入酚酞溶液时颜色变化几乎没有影响(1 分)
(4)2mol/L(1分)
(5)排除因 Na2O2剩余时其氧化性对实验造成干扰(1 分)
(石景山区)9.(14分)(每空 2分)
(1)FeCl3 + 3H2O Fe(OH)3+ 3HCl,溶于较浓的盐酸中的目的是抑制 FeCl3水解。
(2)Fe2O3
(3)把洁净的粉笔置于酒精灯上灼烧未呈现黑色
(4)实验ⅱ中酒精被氧化成乙醛,红色物质 Fe2O3中 Fe元素即被还原成 0价或+2价。实验ⅲ中
无气泡生成,可说明黑色物质中没有 Fe 单质,则一定含有+2价铁元素。(逻辑合理即可,
分部给分)
(5) 5Fe2+ + 8H+ + MnO4 === Mn2+ + 5Fe3+ + 4H2O
或 3Fe2+ + 2[Fe(CN)6]3 === Fe3[Fe(CN)6]2↓
(6)CH3CH2OH + 3Fe2O3 === CH3CHO + 2Fe3O4 + H2O
(7)合理;根据产物 FeS和 S物质的量比为 3∶1,可知实验中发生了 2Fe3+ + 3S2 = 2FeS + S和
Fe2+ + S2 === FeS两个反应,进而可知实验ⅲ所得清液中 n(Fe3+)∶n(Fe2+) = 2∶1,由此可判
断黑色物质是 Fe3O4。(逻辑合理即可)
不合理;实验中 Fe3+与Na2S溶液还可能发生 2Fe3+ + 3S2- === 2Fe2S3↓ 2Fe3+ + 3S2-和 + 6H2O
=== 2Fe(OH)3↓ + 3H2S↑等反应。(逻辑合理即可)
(通州区)10.(1)Cl2 2NaOH NaCl NaClO H2O;
(2)氧化性(1分); 2I Cl2 2Cl
I2(1分);
(3)①对比实验,证明实验 a中水层显浅黄色是因为存在 I2 I
I 3 平衡,不是单一的 I2 浓度
降低所导致的;
② I2 、 I 、 I3 、Cl 、K (可不写H2O、H
OH 、 );
③由于萃取使水溶液中 I2 浓度降低,同时 I2 I
I 3 平衡逆向移动, I3 浓度也降低,导
致水溶液颜色变浅。
(4) I2 5Cl2 6H2O 12H
2IO 3 10Cl
;
(5)溶液先变蓝后褪色;(1分)
(6)氯气过量,过量的氯气溶解于水,水中含有氯气分子。(1分)
13
(海淀区)1(. 12分)实验小组探究酸对 Fe3++3SCN- Fe(SCN)3 平衡的影响。将 0.005 mol/L FeCl3
溶液(接近无色)和 0.01 mol/L KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进
行如下操作并记录现象。(1)FeCl3水解显酸性的原因是_____(用方程式表示)。
(2)甲同学认为加入酸后,会使 Fe3++3SCN- Fe(SCN)3体系中_____浓度改变,导致该平衡正
向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
Fe3+和 Cl-、SO2 -4 均能发生络合反应:
Fe3++4Cl- [FeCl4]-(黄色);Fe3++2SO2 -4 [Fe(SO4) ]
-
2 (无色)。
实验 I. 探究现象 a中溶液颜色变化的原因
编号 操作 现象
① 向 2 mL红色溶液中滴加 5滴水 溶液颜色无明显变化
② 向 2 mL红色溶液中滴加 5滴 3 mol/L KCl溶液 溶液颜色变浅,呈橙色
(3)实验①的目的是_____。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象 a:______。
实验Ⅱ. 探究现象 b中溶液呈浅黄色的原因
编号 操作 现象
③ 取 1 mL 0.0025 mol/L Fe2(SO4)3溶液(无色),加入 1mL 0.01 溶液先变红,加硫酸
mol/L KSCN溶液,再加入 5滴 1.5 mol/L H2SO4溶液 后变为浅黄色
④ 取 1 mL 0.005 mol/L FeCl3溶液,
(5)结合实验③可推测现象 b中使溶液呈浅黄色的微粒可能有两种,分别是_____。
(6)乙同学进一步补充了实验④,确证了现象 b中使溶液呈浅黄色的微粒只是(5)中的一种,请
将实验④的操作及现象补充完整:_____。
1
(朝阳区)2.(10分)用 FeSO4·7H2O晶体配制 FeSO4溶液,放置一天后发现产生黄色固体。实验
小组同学研究固体成分及产生的原因。
(1)① 配制 100 mL 0.100 mol·L-1FeSO4溶液,需要称取 g FeSO4·7H2O晶体。
(已知:FeSO4·7H2O 的摩尔质量为 278 g·mol-1)
② 需要的主要玻璃仪器有:烧杯、玻璃棒、量筒、胶头滴管和 。
(2)小组同学推测放置一天后的 FeSO4溶液中存在 Fe3+。将产生 Fe3+的离子方程式补充完整:
Fe2+ + H+ + === Fe3+ +
(3)分离出黄色固体,经多次洗涤后完成如下实验:
证实黄色固体中含 Fe3+和 SO 2-4 ,试剂 1和试剂 2分别是______、______。
(4)实验测定 FeSO4溶液放置过程中溶液的 pH和黄色固体的量的变化,结果如下:
1 小时 6小时 24 小时
溶液的 pH 2.39 2.35 1.40
黄色固体的量 几乎没有 少量 大量
分析黄色固体中除 Fe3+、SO42-还可能含有______离子。
(5)查阅资料:不同 pH下 Fe2+的氧化率随时间变化的关系如下图。为避免 Fe2+被氧化,配制 FeSO4
溶液时,需要添加______。
2
(朝阳区)3.(12分)实验小组研究 Ag2S的生成与转化。
已知:i. AgCl(s) + 3Cl-(aq) AgCl -43 (aq)
ii.常温下一些盐在水中的溶解度及颜色如下表:
盐 AgCl Ag2S Ag2SO3 Ag2SO4 CuS
溶解度/g 1.5×10-4 1.3×10-16 4.6×10-4 0.796 1.08×10-17
颜色 白色 黑色 白色 白色 黑色
(1)证明 AgCl能够转化为 Ag2S,实验如下:
① AgNO3溶液是溶液_______(填“a”或“b”),另一溶液是 NaCl溶液。
② 现象 a是_______。
(2)研究 CuCl2溶液能否使 Ag2S转化为 AgCl,实验如下:
① 白色固体含 AgCl,结合平衡移动原理解释加水稀释产生白色固体的原因:_____。
② 小组同学对 Ag2S转化为 AgCl的原因提出假设:
假设一:S2-可与 Cu2+形成 CuS c S2 ,从而降低 ,加入 Cu2+是使 Ag2S发生转化的主要
原因;
假设二:Ag 可与Cl 3 形成AgCl4 ,从而降低 c Ag ,加入Cl 是使 Ag2S发生转化的
主要原因。
……
小组同学设计对比实验,证明假设二不.合.理.,实验操作和现象是_____。
(3)有文献表明,HNO3能使 Ag2S转化为 Ag2SO3,实验如下:
① 加入浓氨水,溶解白色固体 a的目的是______。
② 检验白色固体 b中含有亚硫酸根的实验操作和现象是______。
(4)综合上述实验,溶解度较大的银盐转化为 Ag2S较容易;而使 Ag2S转化为溶解
度较大的银盐,可采取的措施有______。
3
(东城区)4. (10分)氯化钠是自然界中常见的盐,在生产生活中有着广泛的用途。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以 Cl-形式存在的原因: 。
②海水晒制的粗盐中还含有泥沙、CaCl2、MgCl2以及可溶的硫酸盐等杂质,可以依次通过
溶解、过滤、 (选填字母序号;所加试剂均过量)、结晶等一系列流程得到精
盐。
a. 加入 Na2CO3溶液→加入 NaOH溶液→加入 BaCl2溶液→过滤→加入稀盐酸
b. 加入 NaOH溶液→加入 BaCl2溶液→加入 Na2CO3溶液→加入稀盐酸→过滤
c. 加入 BaCl2溶液→加入 Na2CO3溶液→加入 NaOH溶液→过滤→加入稀盐酸
③检验精盐中 SO42-是否除净的原理是_____________(用离子方程式表示)
(2)食品加工中的氯化钠
①腌渍蔬菜时,食盐的主要作用是 (选填字母序号)。
a. 着色剂 b. 防腐剂 c. 营养强化剂
②动物血制品富含蛋白质。在制作血豆腐的过程中,向新鲜动物血液中加入食盐,蛋白质发
生了 (填“盐析”或“变性”) 。
(3)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是 。
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物 O2,结合下
图解释 O2含量随阳极区溶液的 pH变化的原因: 。
4
(东城区)5. (12分)某实验小组对 Na2S2O3分别与 FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1 mol/L Na2S2O3溶液 (pH=7);0.1 mol/L FeCl3溶液 (pH=1);
0.05 mol/L Fe2(SO4)3溶液(pH=1)。
实验过程
实验编号 Ⅰ Ⅱ Ⅲ
实验操作
溶液呈紫色, 溶液呈紫色, 溶液呈紫色,
实验现象 静置后紫色迅速褪去, 静置后紫色褪去, 静置后紫色缓慢褪去,
久置后出现淡黄色浑浊 久置后不出现淡黄色浑 久置后不出现淡黄色浑
浊 浊
资料:ⅰ. Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ⅱ. Fe3+ + S2O32- Fe(S2O3)+,Fe2+遇 S2O32-无明显现象
暗紫色
(1)配制 FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:______________。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有 Fe2+生成:取实验Ⅰ中褪色后溶液,加入 1~2滴 K3[Fe(CN)6]溶液,观察到__________。
②实验 I中紫色褪去时 S2O32-被氧化成 S4O62-,相关反应的离子方程式是_______。
③实验 I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是__________。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
实验编号 Ⅳ Ⅴ
实验操作
实验现象 紫色褪去时间 a>b 紫色褪去时间 c
5
(西城区)6.(10分)
某铁矿石中铁元素的化合价为+2价和+3价,测定其中铁元素总含量的实验如下。
已知:ⅰ.该实验条件下,SnCl2的氧化产物为 SnCl62 ,Cr2O72 的还原产物为 Cr3+。
ⅱ.杂质不参加反应。
Ⅰ.将铁矿石粉碎,取 m g铁矿石粉于烧杯中,加入浓盐酸,加热使其充分溶解;
Ⅱ.冷却后过滤、洗涤,将滤液和洗涤液转移到 250 mL仪器 a中定容;
Ⅲ.移取 25 mL溶液于锥形瓶中,加入 4 mol·L 1盐酸,加热至接近沸腾,边摇动锥形瓶边缓慢
滴加一定浓度的 SnCl2溶液,至恰好完全反应,停止滴加 SnCl2溶液;
Ⅳ.冷却后加入 50 mL蒸馏水和指示剂,用 c mol·L 1K2Cr2O7溶液滴定至终点;
Ⅴ.重复测定三次,消耗 K2Cr2O7溶液的平均体积为 v mL。
(1)Ⅰ中,加快化学反应速率的措施有______(至少写出 2个)。
(2)Ⅱ中,仪器 a的名称是______。
(3)Ⅲ中,Sn2+还原 Fe3+的离子方程式是______。
(4)该铁矿石中铁元素的质量分数为______。
(5)Ⅲ中,若 SnCl2过量,测得的铁矿石中铁元素的质量分数会______(填“偏大”、“偏小”或
“不变”)。
6
(西城区)7.(12分)
某同学研究浓硝酸与 KSCN溶液的反应。
资料:Ⅰ.SCN 中 S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ.SCN 的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合
为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
实验一:
(1)向浓硝酸中滴加 KSCN溶液,溶液立即变红是因为生成了______(填化学式)。
(2)研究 SCN 的转化产物。
实验二:
a.将实验一ⅲ中的气体通入 Ba(OH)2和 NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少
量 KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入 BaCl2溶液,产生大量白色沉淀。
①通过 b证实了红棕色气体中不含 SO2,证据是______。
②a中,Ba(OH)2溶液中加入 NaOH溶液以增大 OH 浓度的目的是______。
③由上述实验现象可知:SCN 转化的最终产物中一定有______。
(3)继续研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。
实验三:
①对比实验一和实验三可得结论:一定浓度的 NO2 ______。
②结合实验三,从化学反应速率的角度解释实验一ⅱ和ⅲ中的现象:______。
7
(丰台区)8.为进一步研究过氧化钠与水的反应,某活动小组进行了如下探究。
(1)把一定量水滴入盛有少量过氧化钠固体的试管中,反应的化学方程式为 。
(2)向反应后的溶液中滴入酚酞,一段时间后,发现溶液颜色逐渐变浅,最后颜色消失。为探
究原因,进行实验 1(环境温度为 30℃)结果如下:
NaOH溶液浓度(/ mol/L) 10.0 2.0 1.0 0.10 0.010
滴入酚酞时现象 深紫红色 深红色 深红色 深红色 深红色
溶液变为浅红色时间 2~3s 26~30s 54~60s 6~7min 45min内稳定不变
7~8s 50~54s 100~110s 20min后仍溶液完全褪色时间 2h后略变浅
几乎无色 几乎无色 为浅红色
最终溶液是否褪色 褪色 褪色 褪色 不褪色 不褪色
结合表中数据,判断下列说法正确的是 。(填字母)
a. 其他条件相同时,NaOH溶液浓度越大褪色越快
b. 溶液褪色可能是 NaOH溶液浓度过大导致的
c. 当NaOH溶液浓度大于或等于 1.0 mol/L时,对溶液颜色变化有明显影响
(3)中间产物 H2O2也可能会对溶液颜色的变化产生影响。
①假设 1:受 H2O2自身氧化性的影响。
为验证假设,设计实验方案: 。实验表明,随 H2O2浓度的增大,溶液颜色变化更快。
②假设 2: 。
为验证假设,设计了实验 2,请补全实验装置。
实验 2结果如下:
NaOH溶液浓度/(mol/L) 滴入酚酞时现象 溶液完全褪色时间
2.0 深红色 约 50s
1.0 深红色 约 1min50s
对比实验 1,表中数据说明 。
(4)若准确称取 Na2O2的质量为 1.56 g,加入一定体积的水后得到 20 mL 溶液,则所得 NaOH
溶液的物质的量浓度为 。
(5)实验过程中,需待 Na2O2固体完全溶解后再加入酚酞,原因是 。
综上所述,Na2O2与水反应过程复杂,滴入酚酞时溶液颜色变化受多因素影响。
8
(石景山区)9.(14分)实验小组探究 FeCl3溶液灼烧的变化。
已知:FeO是一种黑色粉末,不稳定,在空气中加热,可被氧化成 Fe3O4,隔绝空气加热会歧化
为 Fe 和 Fe3O4。
Ⅰ. FeCl3溶液的灼烧。
实验ⅰ:将一只白粉笔浸泡在 FeCl3溶液中,用坩埚钳夹持粉笔于酒精
灯上灼烧,很快观察到粉笔表面颜色的变化:黄色→红褐色→铁锈色→ 浸泡过 FeCl3
溶液的粉笔
黑色。
酒精灯
(1)配制 FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀
释到所需要的浓度。结合化学用语解释将氯化铁晶体溶于盐酸的目的______。
(2)“黄色→红褐色→铁锈色→黑色”颜色变化中的“铁锈色”物质是______。(填化学式)
(3)针对“黑色”物质,小组成员提出猜想。
猜想 1:酒精灼烧粉笔的产物;猜想 2:酒精还原“铁锈色”物质得到的产物。
通过实验排除了猜想①,实验操作和现象是______。
Ⅱ.探究“黑色”物质的成分。
实验ⅱ:先用酒精蒸气排尽装置中的空气,再在“铁锈色”物质处加热,充分反应至“铁锈色”
物质完全变成“黑色”物质。取下装有新制 Cu(OH)2的试管,加热,有砖红色沉淀生成。
“铁锈色”物质
热水浴中
的酒精
新制 Cu(OH)2悬
浊液
实验ⅲ:在“黑色”物质中加入热的硫酸,“黑色”物质溶解,无气泡产生。
(4)甲同学根据实验ⅱ和ⅲ的现象,判断“黑色”物质中含有二价铁,其理由是____。
(5)乙同学用实验ⅲ中所得溶液进行实验 iv,证实了甲的判断,实验 iv的离子反应方程式为______。
(6)丙同学发现“黑色”物质完全被磁铁吸引,推测“黑色”物质是 Fe3O4,写出
“铁锈色”物质变成 Fe3O4的化学方程式______。
(7)丁同学为证明“黑色”物质是 Fe3O4,设计实验方案并预测:取实验ⅲ中少量清液滴入足量
的 Na2S溶液,认为得到物质的量之比为 3∶1的 FeS 和 S沉淀,即可证明。你认为是否合
理,并说明理由______。
9
(通州区)10.某同学对 Cl2与 KI溶液的反应进行了实验探究。反应装置如右图所示:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。
继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与 NaOH溶液反应的化学方程式是________________________;
(2)KI溶液变为黄色说明氯气具有____________性,该反应的离子方程式是____________;
(3)已知 I2 I I3 , I2 、 I3 在水中均呈黄色。为确定黄色溶液的成分,进行以下实验:
操作 实验现象
a 取 2~3mL 黄色溶液,加入足量CCl4,振荡静置 CCl4层呈紫红色,水层显浅黄色
b 取 2~3mL 饱和碘水,加入足量CCl4,振荡静置 CCl4层呈紫红色,水层几近无色
1 实验 b的目的是______________________________________________________;
2 根据实验 a可知,水层中含有的粒子有_____________;
③用化学平衡原理解释实验 a中水溶液颜色变浅的原因:_________________;
(4)通入氯气,溶液由黄色变为无色,是因为氯气将 I2 氧化。已知1molCl2可氧化0.2molI2,该
反应的离子方程式是____________________________;
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为___________;
(6)溶液最终变为浅黄绿色的原因是_________________________。
北京市 2020-2021 学年高三各区第一学期期末化学考试分类汇编
(十一)基础实验 科学探究 参考答案
(海淀区)1.(12 分)
(1)Fe3++3H2O Fe(OH) +3+3H
(2)c(Fe3+)
(3)排除稀释使溶液颜色变化的干扰(证明溶液颜色变化是否与稀释有关)
(4)在 Fe3++3SCN- Fe(SCN) -3平衡体系中加入盐酸,Fe3+和 Cl 发生络合反应使得 c(Fe3+)减小,
10
平衡逆向移动,c[Fe(SCN)3]减小,使溶液颜色变浅呈橙色。
(5)FeCl-4 和 Fe(SCN)3
(6)加入 1mL 蒸馏水,再加入 5 滴 1.5 mol/L H2SO4溶液;得无色溶液。
(朝阳区)2.(10分)
(1)① 2.78
② 100 mL容量瓶
(2) 4Fe2++ 4H++ O2=== 4Fe3++ 2H2O
(3) KSCN溶液 BaCl2溶液
(4) OH-
(5) 适量的稀硫酸和铁粉
(朝阳区)3.(12分)
(1)① b
② 白色沉淀变为黑色沉淀
2 AgCl(s) + 3Cl-( )① 加水稀释使平衡 (aq) AgCl43-(aq)逆向移动,生成白色沉淀
② 用 2mL 4mol/L NaCl溶液浸泡 Ag2S沉淀,取上层清液,加水稀释,未见白色沉淀产生
(3)① 使白色沉淀 a中的 SO32-进入溶液中,以便后续检验
② 向白色固体 b中加入足量盐酸,沉淀部分溶解
(4) 加入合适的试剂,使之转化为更难溶的硫化物;
加入合适的氧化剂,将 S2-氧化
(东城区)4.(10 分)
(1)①氯原子结构示意图为 ,最外层为 7 个电子,且原子半径较小,易得 1 个电子形成
稳定结构。
② c ③Ba2+ + SO 2-4 =BaSO4↓
(2)① b ② 盐析
电解
(3)① 2NaCl + 2H2O === Cl2↑+ H2↑+ 2NaOH
② 随着溶液的 pH 增大,c(OH-)增大,OH-还原性增强,因此 OH-更易在阳极放电,O2含量
增大
(东城区)5.(12 分)
(1) FeCl 溶液中存在平衡 Fe3+3 + 3H2O Fe(OH)3 + 3H+,加入盐酸,c(H+)增加,上述平衡左
11
移,进而抑制 Fe3+水解
(2) ①有蓝色沉淀生成
②2Fe3+ + 2S O 2- = 2Fe2+ + S O 2-[或 2Fe(S O )+ 2+2 3 4 6 2 3 = 2Fe + S4O 2-6 ]
③Ⅱ中 Fe3+和 S O 2-2 3 的物质的量之比为 1:1,反应后 S2O 2-3 没有剩余;Ⅰ中 S O 2-2 3 过量且溶液
呈酸性,因此久置后溶液中发生反应 2H+ + S O 2-2 3 = S↓+ SO2↑ + H2O
(3) ①Na2SO4固体
②其他条件相同时,Cl-能加快 Fe(S + 2-2O3) 发生反应,加速紫色褪去,而 SO4 能减慢该反应
(西城区)6.(每空 2分,共 10分)
(1)粉碎、加入浓盐酸、加热
(2)容量瓶
(3)2Fe3++Sn2++6Cl =△==2Fe2++SnCl62
(4)3.36cv/m×100%
(5)偏大
(西城区)7.(每空 2分,共 12分)
(1)(SCN)x
(2)①向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量 KMnO4
溶液,不褪色
②避免混合气体中大量的 NO2使溶液呈酸性,干扰检验 CO2和 SO2
③CO2、SO42
(3)①能加快浓硝酸氧化(SCN)x 的化学反应速率(或能催化浓硝酸氧化(SCN)x)
②实验一中存在反应:a.浓硝酸氧化 SCN ,b.浓硝酸氧化(SCN)x,化学反应速率:υa>
υb,所以ⅱ中溶液立即变红;静置过程中,生成的 NO2溶于硝酸,浓度积累到一定程度
时,使υb增大,红色迅速褪去
(丰台区)8.(12分)
(1)2Na2O2+ 2H2O === 4NaOH + O2↑(2分)
(2)abc(2分)
(3)①取等体积的 0.010 mol/L的 NaOH溶液分置于 3个小烧杯中,分别滴加 2d酚酞试液,然
后同时加入 3种不同浓度的 H2O2溶液(2分)
②H2O2分解产生的 O2的影响(1分)
30mL 10%12H2O2溶液
(2分)
中间产物 H2O2分解产生的 O2对滴入酚酞溶液时颜色变化几乎没有影响(1 分)
(4)2mol/L(1分)
(5)排除因 Na2O2剩余时其氧化性对实验造成干扰(1 分)
(石景山区)9.(14分)(每空 2分)
(1)FeCl3 + 3H2O Fe(OH)3+ 3HCl,溶于较浓的盐酸中的目的是抑制 FeCl3水解。
(2)Fe2O3
(3)把洁净的粉笔置于酒精灯上灼烧未呈现黑色
(4)实验ⅱ中酒精被氧化成乙醛,红色物质 Fe2O3中 Fe元素即被还原成 0价或+2价。实验ⅲ中
无气泡生成,可说明黑色物质中没有 Fe 单质,则一定含有+2价铁元素。(逻辑合理即可,
分部给分)
(5) 5Fe2+ + 8H+ + MnO4 === Mn2+ + 5Fe3+ + 4H2O
或 3Fe2+ + 2[Fe(CN)6]3 === Fe3[Fe(CN)6]2↓
(6)CH3CH2OH + 3Fe2O3 === CH3CHO + 2Fe3O4 + H2O
(7)合理;根据产物 FeS和 S物质的量比为 3∶1,可知实验中发生了 2Fe3+ + 3S2 = 2FeS + S和
Fe2+ + S2 === FeS两个反应,进而可知实验ⅲ所得清液中 n(Fe3+)∶n(Fe2+) = 2∶1,由此可判
断黑色物质是 Fe3O4。(逻辑合理即可)
不合理;实验中 Fe3+与Na2S溶液还可能发生 2Fe3+ + 3S2- === 2Fe2S3↓ 2Fe3+ + 3S2-和 + 6H2O
=== 2Fe(OH)3↓ + 3H2S↑等反应。(逻辑合理即可)
(通州区)10.(1)Cl2 2NaOH NaCl NaClO H2O;
(2)氧化性(1分); 2I Cl2 2Cl
I2(1分);
(3)①对比实验,证明实验 a中水层显浅黄色是因为存在 I2 I
I 3 平衡,不是单一的 I2 浓度
降低所导致的;
② I2 、 I 、 I3 、Cl 、K (可不写H2O、H
OH 、 );
③由于萃取使水溶液中 I2 浓度降低,同时 I2 I
I 3 平衡逆向移动, I3 浓度也降低,导
致水溶液颜色变浅。
(4) I2 5Cl2 6H2O 12H
2IO 3 10Cl
;
(5)溶液先变蓝后褪色;(1分)
(6)氯气过量,过量的氯气溶解于水,水中含有氯气分子。(1分)
13
