高中化学人教版(2019)化学必修第一册2.2.2 氯气与碱反应及氯离子的检验 课件(21张ppt)
文档属性
| 名称 | 高中化学人教版(2019)化学必修第一册2.2.2 氯气与碱反应及氯离子的检验 课件(21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 744.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-05 10:27:36 | ||
图片预览





文档简介
(共21张PPT)
组织建设
氯气与碱反应及氯离子检验
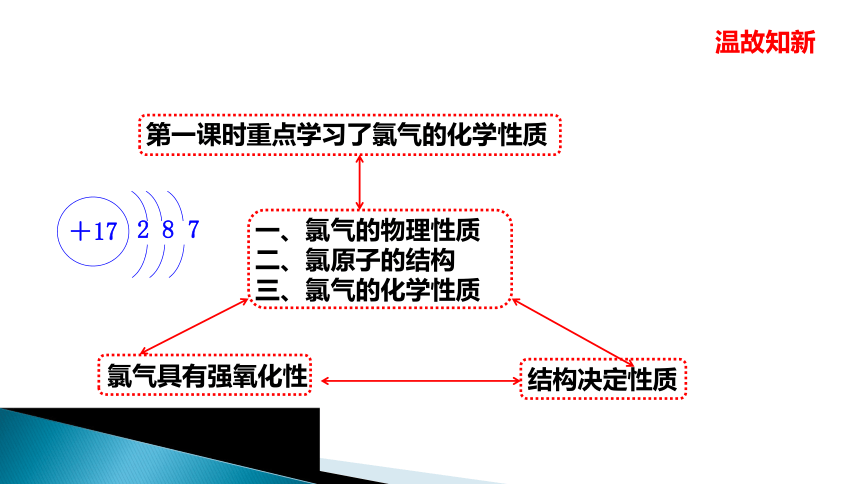
温故知新
第一课时重点学习了氯气的化学性质
一、氯气的物理性质
二、氯原子的结构
三、氯气的化学性质
氯气具有强氧化性
结构决定性质
+17
2 8 7
问题导学
游泳池消毒
漂白粉或氯气
漂白粉是如何制备的呢?
问题导学
思考交流
问题一、工业上如何制取漂白液和漂白粉?漂白液、漂白粉的有效成分是什么?漂白原理是什么?用化学方程式表示。
制取漂白液 2NaOH+Cl2=NaClO+NaCl+H2O
制取漂白粉 2 Ca(OH)2+2Cl2= Ca(ClO)2+CaCl2+2H2O
Ca(ClO)2 +H2O+ CO2= CaCO3 ↓+2HClO
2NaClO+H2O+ CO2=Na2CO3+2HClO
漂白原理
书写时注意方程式的配平
问题探讨
思考交流
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2 HClO
怎样保存漂白粉?
密封,保存于阴凉干燥处。
2 HClO 2HCl + O2↑
光照
问题二、漂白液、漂白粉久置于空气中会失效,其原因是什么?
用化学方程式表示。
2NaClO+H2O+ CO2= Na2CO3 +2HClO
制取漂白剂
作消毒剂(自来水)
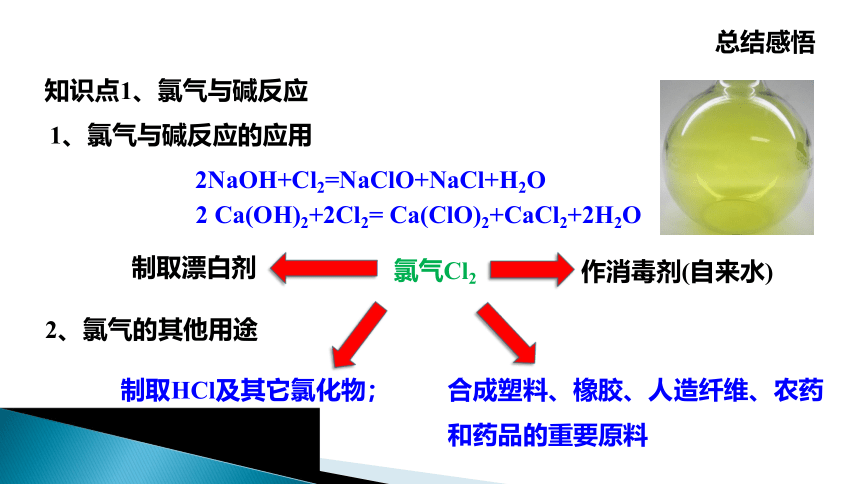
1、氯气与碱反应的应用
氯气Cl2
知识点1、氯气与碱反应
总结感悟
2NaOH+Cl2=NaClO+NaCl+H2O
2 Ca(OH)2+2Cl2= Ca(ClO)2+CaCl2+2H2O
2、氯气的其他用途
制取HCl及其它氯化物;
合成塑料、橡胶、人造纤维、农药
和药品的重要原料
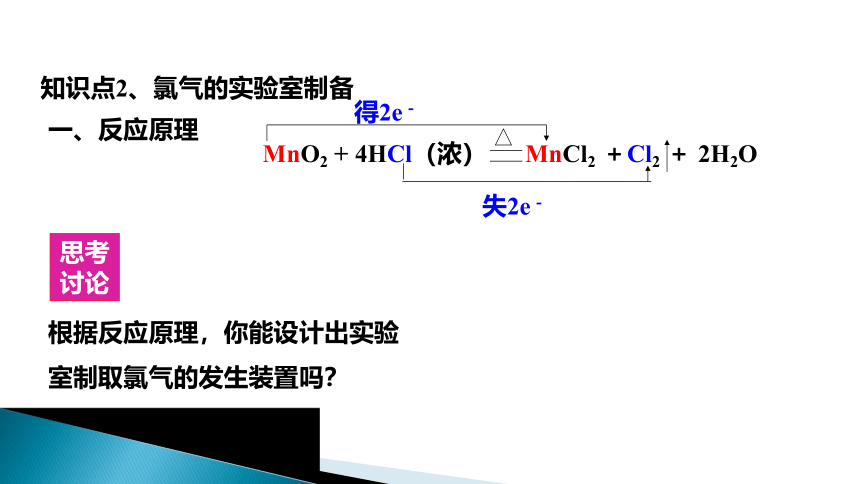
知识点2、氯气的实验室制备
一、反应原理
失2e-
得2e-
MnO2 + 4HCl(浓) MnCl2 +Cl2 + 2H2O
根据反应原理,你能设计出实验室制取氯气的发生装置吗?
思考讨论
(2) MnO2可用 KMnO4、KClO3、NaClO 等强氧化剂代替
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
浓盐酸可用浓H2SO4和NaCl固体代替。
(1) 浓HCl的作用:
(只能用浓盐酸)
足量 MnO2与含HCl 0.2mol 的浓盐酸反应,可制得标况下Cl2的体积是多少?
还原剂、酸性
内容解读
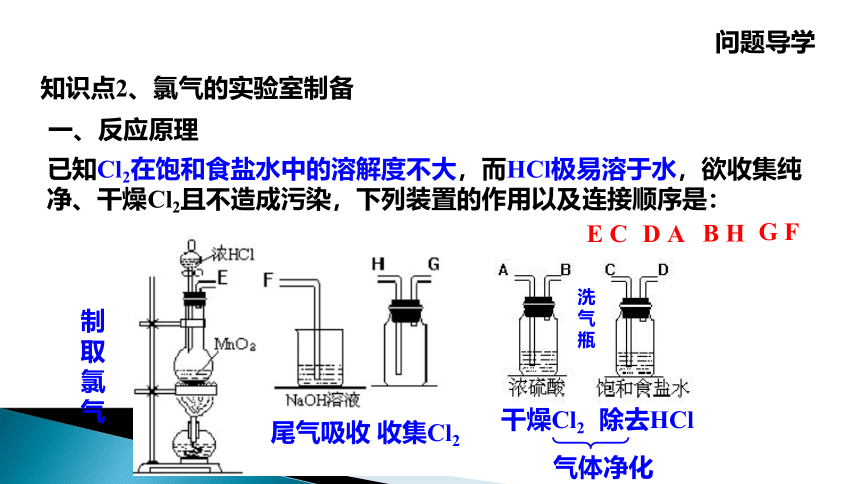
知识点2、氯气的实验室制备
问题讨论
一、反应原理
已知Cl2在饱和食盐水中的溶解度不大,而HCl极易溶于水,欲收集纯净、干燥Cl2且不造成污染,下列装置的作用以及连接顺序是:
D A
G F
B H
E C
除去HCl
干燥Cl2
收集Cl2
尾气吸收
制取氯气
气体净化
洗气瓶
知识点2、氯气的实验室制备
问题导学
一、反应原理
知识点2、氯气的实验室制备
二、制取装置
内容解读
发生装置:
固体与液体加热制气体
净化装置:
饱和食盐水(HCl),浓硫酸(H2O)
收集装置:
向上排空气法
(或排饱和食盐水法)
尾气处理:
NaOH溶液吸收
知识点2、氯气的实验室制备
三、实验步骤
⑴仪器的安装: 由下而上,从左到右
⑵检查气密性:
⑶添加药品: 先固后液,先下后上
⑷缓缓加热:
思考:如何验满?
制备实验”二、三、四”
二意识:安全意识与环保意识
三原理:反应原理、装置原理、操作原理
四过程:气体发生过程、净化过程、收集过程、 尾气处理过程
内容解读
知识点2、氯气的实验室制备
总结感悟
拓展: Cl2工业制法电解饱和食盐水
知识点3、Cl-的检验
问题探讨
问题讨论
在下列溶液中各滴入几滴AgNO3溶液,再分别加入少量稀HNO3,出现什么现象?
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
知识点3、Cl-的检验
问题探讨
问题讨论
在下列溶液中各滴入几滴AgNO3溶液,再分别加入少量稀HNO3,出现什么现象?
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
白色↓
白色↓
白色↓
轻微白色↓
不溶解
不溶解
产生气泡
不溶解
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
2Ag++CO32- =Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2 ↑+H2O
检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
原因: AgNO3溶液与Cl-形成AgCl白色沉淀,还可与CO32-形成Ag2CO3白色沉淀,AgCl不与稀硝酸反应; Ag2CO3可与稀硝酸反应,沉淀溶解。
思考交流
样品 酸化液 白色沉淀
稀硝酸
AgNO3溶液
样品 白色沉淀 沉淀不溶解
稀硝酸
AgNO3溶液
氯离子检验的一般步骤
知识点3、Cl-的检验
问题探讨
科学视野
氟原子
氯原子
溴原子
碘原子
卤素原子结构
2 7
+9
2 8 7
+17
2 8 18 7
+35
2 8 18 18 7
+35
①最外层电子都有7个电子,易得到一个电子;
③都能与Na、K、Ca、Mg等金属化合生成盐,统称为卤素(成盐元素)。
②都是典型的非金属元素;
科学视野
感光胶卷
变色眼镜
变色眼镜
卤素单质及其化合物的用途
科学视野
课堂感悟
课时小结
氯气与碱的反应
2NaOH+Cl2=NaClO+NaCl+H2O 制漂白液或吸收尾气
2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O制漂白粉
Cl2的制备
Cl2的性质
Cl2的用途
Cl-的检验
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
1. 氯水中存在多种分子和离子,可通过实验的方法加以确定。下列有关氯水中存在的粒子的说法错误的是( )
实验操作及现象 结论
A 加入含有NaHSO3的石蕊试液,红色褪去 有Cl2分子存在
B 加入有色布条,有色布条褪色 有HClO分子存在
C 氯水呈浅黄绿色,且有刺激性气味 说明有氯分子存在
D 加硝酸酸化的AgNO3溶液,产生白色沉淀 说明有Cl-存在
A
说明有HClO才有漂白性
当堂巩固
2、在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
下列收集Cl2的正确装置是( )
C
当堂巩固
氯气密度比空气大;
能溶于水
组织建设
氯气与碱反应及氯离子检验
温故知新
第一课时重点学习了氯气的化学性质
一、氯气的物理性质
二、氯原子的结构
三、氯气的化学性质
氯气具有强氧化性
结构决定性质
+17
2 8 7
问题导学
游泳池消毒
漂白粉或氯气
漂白粉是如何制备的呢?
问题导学
思考交流
问题一、工业上如何制取漂白液和漂白粉?漂白液、漂白粉的有效成分是什么?漂白原理是什么?用化学方程式表示。
制取漂白液 2NaOH+Cl2=NaClO+NaCl+H2O
制取漂白粉 2 Ca(OH)2+2Cl2= Ca(ClO)2+CaCl2+2H2O
Ca(ClO)2 +H2O+ CO2= CaCO3 ↓+2HClO
2NaClO+H2O+ CO2=Na2CO3+2HClO
漂白原理
书写时注意方程式的配平
问题探讨
思考交流
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2 HClO
怎样保存漂白粉?
密封,保存于阴凉干燥处。
2 HClO 2HCl + O2↑
光照
问题二、漂白液、漂白粉久置于空气中会失效,其原因是什么?
用化学方程式表示。
2NaClO+H2O+ CO2= Na2CO3 +2HClO
制取漂白剂
作消毒剂(自来水)
1、氯气与碱反应的应用
氯气Cl2
知识点1、氯气与碱反应
总结感悟
2NaOH+Cl2=NaClO+NaCl+H2O
2 Ca(OH)2+2Cl2= Ca(ClO)2+CaCl2+2H2O
2、氯气的其他用途
制取HCl及其它氯化物;
合成塑料、橡胶、人造纤维、农药
和药品的重要原料
知识点2、氯气的实验室制备
一、反应原理
失2e-
得2e-
MnO2 + 4HCl(浓) MnCl2 +Cl2 + 2H2O
根据反应原理,你能设计出实验室制取氯气的发生装置吗?
思考讨论
(2) MnO2可用 KMnO4、KClO3、NaClO 等强氧化剂代替
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
浓盐酸可用浓H2SO4和NaCl固体代替。
(1) 浓HCl的作用:
(只能用浓盐酸)
足量 MnO2与含HCl 0.2mol 的浓盐酸反应,可制得标况下Cl2的体积是多少?
还原剂、酸性
内容解读
知识点2、氯气的实验室制备
问题讨论
一、反应原理
已知Cl2在饱和食盐水中的溶解度不大,而HCl极易溶于水,欲收集纯净、干燥Cl2且不造成污染,下列装置的作用以及连接顺序是:
D A
G F
B H
E C
除去HCl
干燥Cl2
收集Cl2
尾气吸收
制取氯气
气体净化
洗气瓶
知识点2、氯气的实验室制备
问题导学
一、反应原理
知识点2、氯气的实验室制备
二、制取装置
内容解读
发生装置:
固体与液体加热制气体
净化装置:
饱和食盐水(HCl),浓硫酸(H2O)
收集装置:
向上排空气法
(或排饱和食盐水法)
尾气处理:
NaOH溶液吸收
知识点2、氯气的实验室制备
三、实验步骤
⑴仪器的安装: 由下而上,从左到右
⑵检查气密性:
⑶添加药品: 先固后液,先下后上
⑷缓缓加热:
思考:如何验满?
制备实验”二、三、四”
二意识:安全意识与环保意识
三原理:反应原理、装置原理、操作原理
四过程:气体发生过程、净化过程、收集过程、 尾气处理过程
内容解读
知识点2、氯气的实验室制备
总结感悟
拓展: Cl2工业制法电解饱和食盐水
知识点3、Cl-的检验
问题探讨
问题讨论
在下列溶液中各滴入几滴AgNO3溶液,再分别加入少量稀HNO3,出现什么现象?
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
知识点3、Cl-的检验
问题探讨
问题讨论
在下列溶液中各滴入几滴AgNO3溶液,再分别加入少量稀HNO3,出现什么现象?
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
白色↓
白色↓
白色↓
轻微白色↓
不溶解
不溶解
产生气泡
不溶解
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
2Ag++CO32- =Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2 ↑+H2O
检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
原因: AgNO3溶液与Cl-形成AgCl白色沉淀,还可与CO32-形成Ag2CO3白色沉淀,AgCl不与稀硝酸反应; Ag2CO3可与稀硝酸反应,沉淀溶解。
思考交流
样品 酸化液 白色沉淀
稀硝酸
AgNO3溶液
样品 白色沉淀 沉淀不溶解
稀硝酸
AgNO3溶液
氯离子检验的一般步骤
知识点3、Cl-的检验
问题探讨
科学视野
氟原子
氯原子
溴原子
碘原子
卤素原子结构
2 7
+9
2 8 7
+17
2 8 18 7
+35
2 8 18 18 7
+35
①最外层电子都有7个电子,易得到一个电子;
③都能与Na、K、Ca、Mg等金属化合生成盐,统称为卤素(成盐元素)。
②都是典型的非金属元素;
科学视野
感光胶卷
变色眼镜
变色眼镜
卤素单质及其化合物的用途
科学视野
课堂感悟
课时小结
氯气与碱的反应
2NaOH+Cl2=NaClO+NaCl+H2O 制漂白液或吸收尾气
2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O制漂白粉
Cl2的制备
Cl2的性质
Cl2的用途
Cl-的检验
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
1. 氯水中存在多种分子和离子,可通过实验的方法加以确定。下列有关氯水中存在的粒子的说法错误的是( )
实验操作及现象 结论
A 加入含有NaHSO3的石蕊试液,红色褪去 有Cl2分子存在
B 加入有色布条,有色布条褪色 有HClO分子存在
C 氯水呈浅黄绿色,且有刺激性气味 说明有氯分子存在
D 加硝酸酸化的AgNO3溶液,产生白色沉淀 说明有Cl-存在
A
说明有HClO才有漂白性
当堂巩固
2、在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
下列收集Cl2的正确装置是( )
C
当堂巩固
氯气密度比空气大;
能溶于水
