8.1金属材料与金属冶炼同步练习—2021_2022学年九年级化学仁爱版下册(word版含解析)
文档属性
| 名称 | 8.1金属材料与金属冶炼同步练习—2021_2022学年九年级化学仁爱版下册(word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 298.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-05 22:26:23 | ||
图片预览



文档简介
8.1金属材料与金属冶炼
一、选择题(共16题)
1.化学使我们学会了从微观的角度认识宏观现象。下列对宏观现象解释错误的是
A.水变为水蒸气一一分子体积变大 B.电解水——化学变化中分子可再分
C.闻到远处花香—一分子不断运动 D.生铁和钢性能不同——含碳量不同
2.下列铜制品的用途中,利用金属导电性的是
A.铜火锅 B.铜导线
C.铜钟 D.铜钱
3.下列说法正确的是
A.用肥皂水可以区分软水和硬水
B.红磷在空气中燃烧产生大量白色烟雾
C.金刚石、液氧、生铁属于单质
D.一切原子都是由质子、中子和电子构成
4.下列对有关事实的解释中,错误的是
A.生铁和钢的性能不同——含碳量不同
B.氮和氧的元素种类不同——核内质子数不同
C.一氧化碳和二氧化碳的化学性质不同——氧原子个数不同
D.带火星的木条在空气和氧气中的现象不同——氧气浓度不同
5.某新型“防盗玻璃”为多层结构,每层中间嵌有细金属线,当玻璃被击碎时,与金属相连的警报系统就会立刻报警。“防盗玻璃”报警时主要利用了金属的
A.延展性 B.导电性 C.导热性 D.硬度
6.下列说法错误的是
A.把铅加入锡中制成合金焊锡的主要目的是降低熔点
B.用洗涤剂除去油污是因为洗涤剂能溶解油污形成溶液
C.向蒸馏水中加入肥皂水会产生大量的泡沫
D.生煤火炉时,点燃木柴来引燃煤,是为了使温度达到煤的着火点
7.下列过程中只发生物理变化的是
A.制作叶脉书签
B.木条遇浓硫酸变黑
C.比较合金和纯金属的硬度
D.紫花变红花
8.下列各项比较中,正确的是
A.灯焰温度:焰心>外焰 B.硬度:纯铁>生铁
C.pH:食醋>食盐水 D.地壳中金属元素含量:铝>铁
9.推理是化学学习的常用方法。下列推理合理的是
A.离子是带电的粒子,所以带电的粒子一定是离子
B.置换反应中有单质参与,但有单质参与的反应不一定都是置换反应
C.生铁和钢都是铁合金,因此它们性能相同
D.化合物是由不同元素组成的纯净物,但由不同元素组成的纯净物不一定是化合物
10.推理是化学学习中常用的思维方法,下列推理正确的是
A.物质与氧气发生的反应属于氧化反应,则氧化反应一定有氧气参加
B.金属能导电,则能导电的物质一定是金属
C.钠离子、氯离子的最外层电子数都是8,则离子的最外层电子数都是8
D.单质是由同种元素组成的,则同种元素组成的纯净物一定是单质
11.物质的结构决定性质,下列说法不正确的是
A.石墨与金刚石性质存在差异,原因是构成二者的碳原子不同
B.生铁和钢的性能存在差异,原因是二者的含碳量不同
C.一氧化碳与二氧化碳的性质不同,原因是二者的分子构成不同
D.钠原子与钠离子的性质不同,原因是二者的最外层电子数不同
12.下列说法中,完全正确的是
A.儿童缺锌会患智力低下;生成盐和水的反应都是中和反应
B.向某NaOH溶液中滴加几滴盐酸没有气泡则未变质;合金的熔点都高于它的成分金属
C.用洗洁精乳化试管壁上的油脂;使用新能源,能减少酸雨产生
D.用铁质容器配制农药波尔多液;吹灭蜡烛的原理是降低了着火点
13.小明同学记录的下列实验操作正确的是
A.浓硫酸稀释,将水倒入浓硫酸
B.闻气体气味,靠近瓶口吸气
C.氢气验纯:试管口向上移近火焰
D.比较黄铜片与铜片的硬度:相互刻画
14.下列有关物质的性质与用途具有对应关系的是
A.金属铜有金属光泽,可用作导电材料
B.浓硫酸有脱水性,可用作干燥剂
C.一氧化碳有可燃性,可用于工业炼铁
D.不锈钢耐腐蚀,可用作医疗器械
15.下列物质鉴别的方法不正确的是
A.水区分石灰石和生石灰 B.用燃着的木条区分氮气和二氧化碳
C.用颜色区别铜片和铝片 D.用二氧化锰区别水和过氧化氢溶液
16.以下说法正确的是( )
A.“生铁”、“钢”、“赤铁矿”都是金属材料
B.金刚石和石墨都是由碳元素组成,因此金刚石和石墨的性质相同
C.用石油炼制汽油、煤油等产品是物理变化
D.置换反应有单质生成,所以有单质生成的反应一定是置换反应
二、综合题(共6题)
17.在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
(1)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有_____(填字母序号)。
a.金属原料的成本 b.生产过程中的能耗与污染 c.金属的回收利用
(2)比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学成分的角度分析“磁铁矿作炼铁原料更具优势”,其原因是_____。
(3)钛和钛合金是21世纪重要的金属材料。钛合金制品放在海水中数年取出后仍光亮如新,是因为其_____(填字母序号)非常好。
a.可塑性 b.机械性能 c.抗腐蚀性能
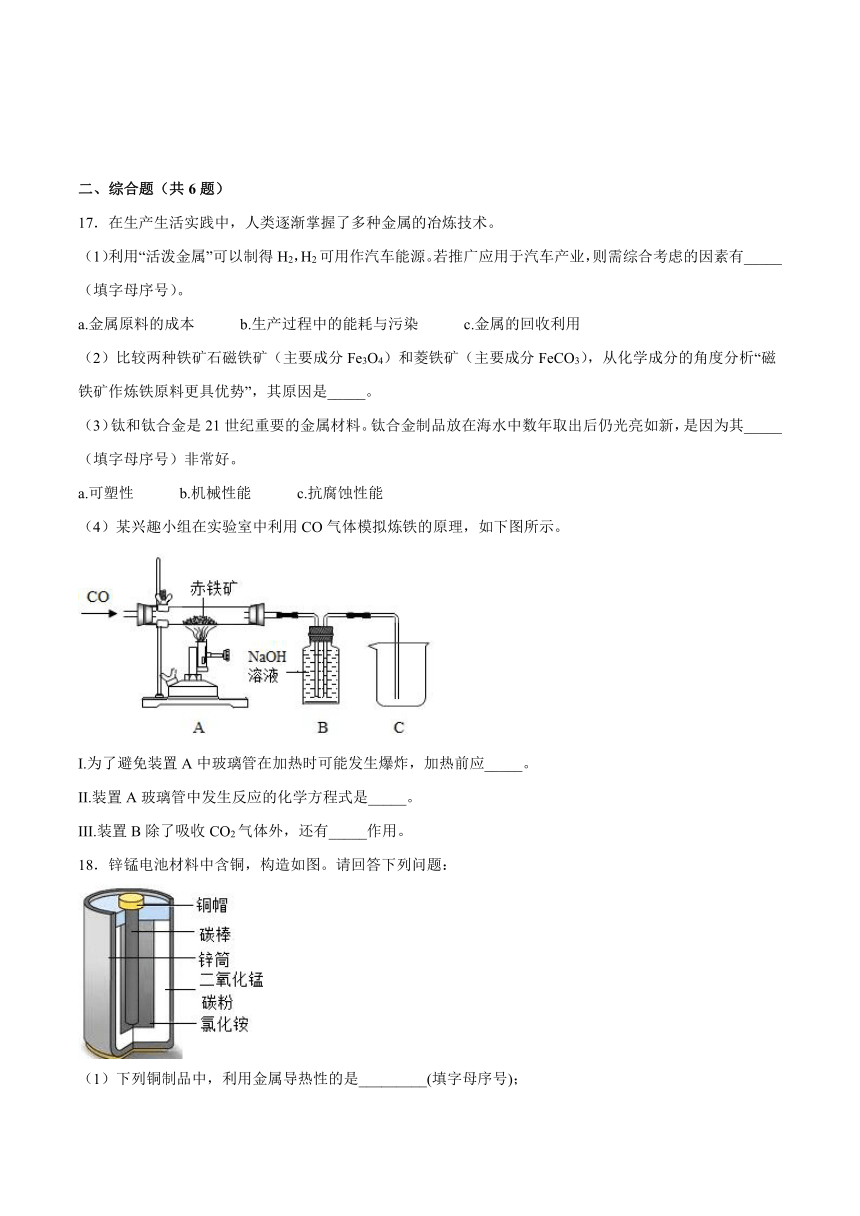
(4)某兴趣小组在实验室中利用CO气体模拟炼铁的原理,如下图所示。
I.为了避免装置A中玻璃管在加热时可能发生爆炸,加热前应_____。
II.装置A玻璃管中发生反应的化学方程式是_____。
III.装置B除了吸收CO2气体外,还有_____作用。
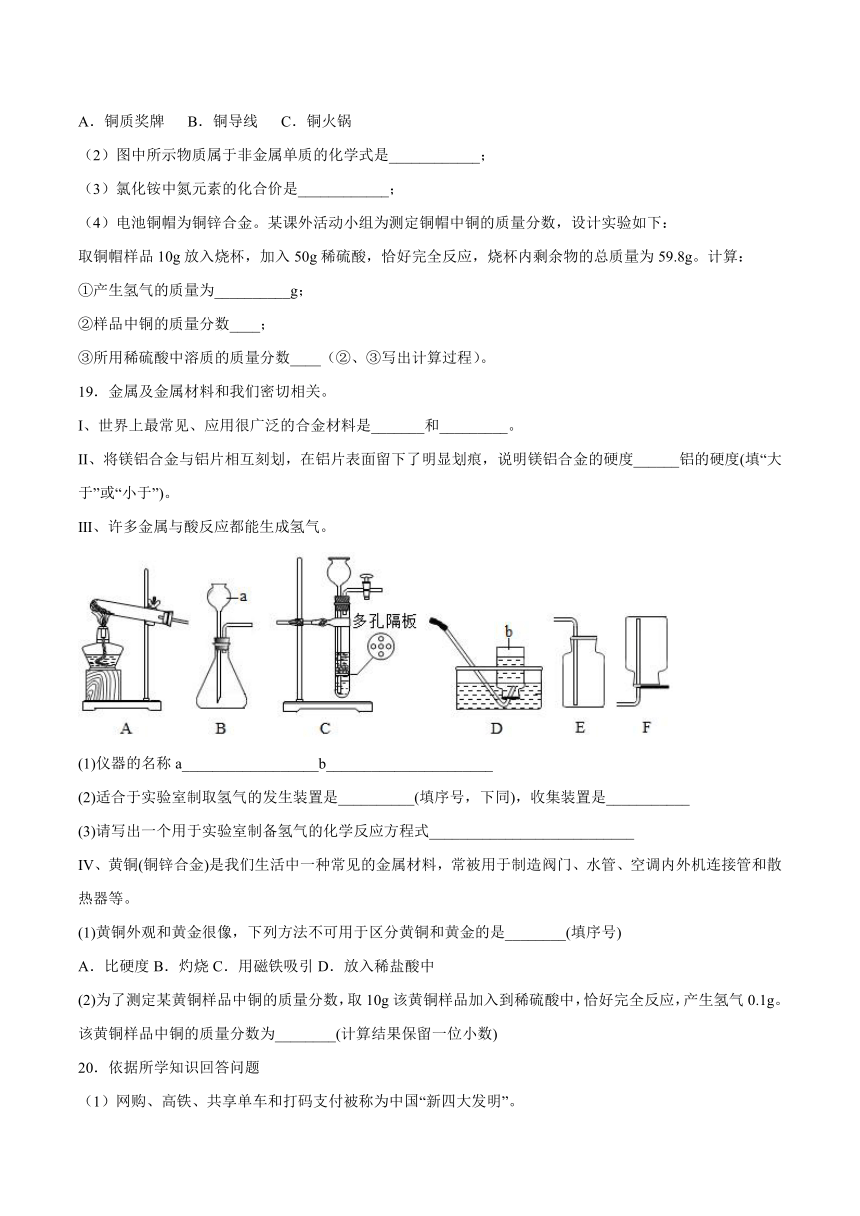
18.锌锰电池材料中含铜,构造如图。请回答下列问题:
(1)下列铜制品中,利用金属导热性的是_________(填字母序号);
A.铜质奖牌 B.铜导线 C.铜火锅
(2)图中所示物质属于非金属单质的化学式是____________;
(3)氯化铵中氮元素的化合价是____________;
(4)电池铜帽为铜锌合金。某课外活动小组为测定铜帽中铜的质量分数,设计实验如下:
取铜帽样品10g放入烧杯,加入50g稀硫酸,恰好完全反应,烧杯内剩余物的总质量为59.8g。计算:
①产生氢气的质量为__________g;
②样品中铜的质量分数____;
③所用稀硫酸中溶质的质量分数____(②、③写出计算过程)。
19.金属及金属材料和我们密切相关。
I、世界上最常见、应用很广泛的合金材料是_______和_________。
II、将镁铝合金与铝片相互刻划,在铝片表面留下了明显划痕,说明镁铝合金的硬度______铝的硬度(填“大于”或“小于”)。
Ⅲ、许多金属与酸反应都能生成氢气。
(1)仪器的名称a__________________b______________________
(2)适合于实验室制取氢气的发生装置是__________(填序号,下同),收集装置是___________
(3)请写出一个用于实验室制备氢气的化学反应方程式___________________________
IV、黄铜(铜锌合金)是我们生活中一种常见的金属材料,常被用于制造阀门、水管、空调内外机连接管和散热器等。
(1)黄铜外观和黄金很像,下列方法不可用于区分黄铜和黄金的是________(填序号)
A.比硬度B.灼烧C.用磁铁吸引D.放入稀盐酸中
(2)为了测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到稀硫酸中,恰好完全反应,产生氢气0.1g。该黄铜样品中铜的质量分数为________(计算结果保留一位小数)
20.依据所学知识回答问题
(1)网购、高铁、共享单车和打码支付被称为中国“新四大发明”。
①网购离不开光纤宽带。光纤的主要成分是SiO2,其中Si的化合价是_______。
②高铁车体的外壳由铝合金制成,用铝合金制作外壳的优点是_______(答一条)。
③共享单车的轮胎为实体轮胎,而普通自行车的轮胎在夏天易爆胎请用分子观点解释“夏天易爆胎”的原因_______。
④许多商品的二维码印在PVC不干胶贴纸上,PVC(化学式(C2H3C1)n)中碳、氢元素的质量比是_。
(2)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒,制取ClO2的反应过程示意图如下:
(其中,表示钠原子,表示氯原子, 表示氧原子)请回答题:
①A物质中氯元素的化合价为_______。
②D物质的名称是_______。
③该反应的化学方程式是_______。
21.小军用下图形式对所学知识进行归纳整理。
(1)盐中纯碱的化学式是_____。
(2)小军归纳整理中有种物质归纳错误,该物质是_____。
(3)生石灰用作干燥剂的原理是_____(用化学方程式表示)。
22.绿色出行,美丽冰城!相信同学们最近在街上一定看到了许多“绿车牌”。这是我市正式启用的新能源汽车专用号牌。几年来。哈尔滨市淘汰“黄标车”,引进“绿牌车”,在生态文明建设的路上,我们决不驰于空想,不骛于虚声!请回答:
(1)特斯拉电动车是—类典型的新能源车,其外部车身体板采用碳纤维材料构造,底盘由模压铝合金构成,铝合金属于①_______材料,推测车身体板和底盘共同具有的一个物理性质是_____(填字母)。
A.硬度大 B.熔点低 C.密度大
(2)在特斯拉电动车行驶的过程中,储存在锂离子电池中的①______能转化为电能,最终转化为汽车运行时的②_______能。
(3)二氧化钛(TiO2)也是制备化学电源不可或缺的重要原料,其工业制法是在一定条件下,利用四氯化钛和一种气体单质反应制得,同时生成氯气(Cl2),此反应的化学方程式为①__________________________,反应前后氯元素的化合价分别为②_________。
参考答案
1.A
【详解】
A、水变为水蒸气,是因为分子之间的间隔变大,分子体积不变,符合题意;
B、电解水,是因为化学变化中分子可再分为原子,原子可重新组合为新的分子,不符合题意;
C、闻到远处花香,是因为分子不断运动,不符合题意;
D、生铁和钢性能不同,是因为含碳量不同,生铁的含碳量为2%-4.3%,钢的含碳量为0.03%-2%,不符合题意。
故选A。
2.B
【详解】
A、铜火锅利用了铜的导热性,不符合题意;
B、铜导线利用了铜的导电性,符合题意;
C、铜合金较硬,化学性质比较稳定,铜钟敲击时能发出宏亮的声音,铜做铜钟没有利用铜的导电性,不符合题意;
D、铜做铜钱是因为铜具有良好的可铸造性,化学性质比较稳定,与导电性无关,不符合题意。故选B。
3.A
【详解】
A、加肥皂水后,生成泡沫较多的是软水,生成泡沫较少的是硬水,所以肥皂水能够区分软水和硬水,正确;
B、红磷在空气中燃烧,产生大量的白烟,而不是白色烟雾,错误;
C、金刚石、液氧属于单质,生铁是铁的合金,属于混合物,错误;
D、原子不一定是由质子、中子和电子构成,例如氢原子不含有中子,错误。
故选A。
4.C
【详解】
A. 物质的性质是由物质的组成和结构,生铁和钢的性能不同——含碳量不同;B. 质子数决定决定元素的类别,氮和氧的元素种类不同——核内质子数不同;C. 一氧化碳和二氧化碳的化学性质不同,是因为一个分子中氧原子个数不同;D. 带火星的木条在空气和氧气中的现象不同,氧气浓度不同,空气中氧气只占21%。选D
5.B
【详解】
“细金属线”体现了金属的延展性,当玻璃被击碎时,与金属相连的警报系统就会立刻报警,利用了金属的导电性,“防盗玻璃”报警时主要利用了金属的导电性。故选B。
6.B
【详解】
A、合金的熔点比组成它的纯金属的熔点低,把铅加入锡中制成合金焊锡,主要目的是降低熔点,故选项说法正确;B、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,形成的不是溶液,故选项说法错误;C、蒸馏水属于软水,加肥皂水会产生大量的气泡,故选项说法正确;D、生煤火炉时,可点燃木柴来引燃煤,是为了使温度达到煤的着火点,故选项说法正确。故选B。
7.C
【详解】
A、制作叶脉书签有新物质产生,属于化学变化,不符合题意;
B、木条遇浓硫酸变黑有新物质产生,属于化学变化,不符合题意;
C、比较合金和纯金属的硬度没有新物质产生,属于物理变化,符合题意;
D、紫花变红花有新物质产生,属于化学变化,不符合题意;
故选C。
8.D
【详解】
A、焰心与空气接触不充分,酒精燃烧不充分,放出热量少,外焰与空气接触充分,酒精燃烧充分,放出热量多,灯焰温度:焰心<外焰,故A错误;
B、合金的硬度比组成它的纯金属的硬度大,硬度:纯铁<生铁,故B错误;
C、食盐水显中性,pH等于7,食醋显酸性,pH小于7,pH:食醋<食盐水,故C错误;
D、地壳中含量居前五位的元素是氧、硅、铝、铁、钙,地壳中金属元素含量:铝>铁,故D,正确。故选D。
9.B
【详解】
A、离子是带电的粒子,但是带电的粒子不一定是离子,如质子、电子等,故错误;
B、置换反应的反应物和生成物均是一种单质和一种化合物,但有单质参与的反应不一定都是置换反应,如氢气在氧气中燃烧,属于化合反应,故正确;
C、生铁和钢都是铁的合金,生铁是含碳量为的铁合金,钢是含碳量为的铁合金,生铁和钢主要成分都是铁,由于含碳量不同,性能不完全相同,故错误;
D、由化合物概念可知至少由两种元素组成,则化合物都是由不同元素组成,又纯净物包括单质和化合物,则由不同元素组成的纯净物一定是化合物,故错误。
故选B。
10.D
【详解】
A、物质与氧气发生的反应属于氧化反应,但氧化反应不一定有氧气参加,如氢气与氧化铜反应生成铜和水,氢气得到氧元素,发生氧化反应,故选项推理错误;
B、金属能导电,但能导电的物质不一定是金属,例如石墨能导电却属于非金属,故选项推理错误;
C、钠离子、氯离子的最外层电子数都是8,但离子的最外层电子数不都是8,例如氢离子核外没有电子,故选项推理错误;
D、单质是由同种元素组成的,则同种元素组成的纯净物一定是单质,故选项推理正确。
故选:D。
11.A
【详解】
A、石墨与金刚石性质存在差异,原因是碳原子的排列方式不同,错误;
B、生铁和钢的性能存在差异,原因是二者的含碳量不同,正确;
C、一氧化碳与二氧化碳的性质不同,原因是二者的分子构成不同,正确;
D、钠原子与钠离子的性质不同,原因是二者的最外层电子数不同,正确。
故选A。
12.C
【解析】A.人体中缺锌易引起食欲不振,生长迟缓,发育不良,智力低下;CO2和NaOH溶液反应生成盐和水,但不是中和反应,故A错误;B.向某NaOH溶液中滴加过量盐酸没有气泡则未变质,盐酸量少,NaOH过量,则无法判断是否变质;合金的熔点都低于它的成分金属,故B错误;C.洗洁精对油污具有乳化作用,可以洗去餐具上的油污;使用新能源,能减少SO2的排放,降低酸雨产生,故C正确;D.农药波尔多液中的硫酸铜能和铁反应,不能用铁质容器配制农药波尔多液;着火点是物质的一种固有属性,一般不会改变,所以最吹蜡烛并不能降低蜡烛的着火点,故D错误;答案为C。
13.D
【详解】
A、浓硫酸稀释,将浓硫酸倒入水中,且用玻璃棒不断搅拌,防止局部温度过高液体飞溅,A错误。
B、闻气体气味用扇闻法,不能靠近瓶口吸气,容易呛到,B错误。
C、氢气密度比空气小,防止空气逸出,试管口向下移近火焰,C错误。
D、比较黄铜片与铜片的硬度:相互刻画,D正确。
故选:D。
14.D
【详解】
A、金属铜有导电性,可用作导电材料,A错误。
B、浓硫酸有吸水性,可用作干燥剂,B错误。
C、一氧化碳有还原性,可用于工业炼铁,C错误。
D、不锈钢耐腐蚀,可用作医疗器械,D正确。
故选:D。
15.B
【详解】
A. 石灰石不溶于水,和水混合无明显现象,生石灰和水混合生成氢氧化钙放出大量热,选项正确;
B. 二氧化碳和氮气都能使燃着的木条熄灭,不能用燃着的木条区分氮气和二氧化碳,选项错误;
C. 铜片是紫红色金属,铝是银白色金属,能用颜色区别铜片和铝片,选项正确;
D. 水和二氧化锰混合无明显现象,过氧化氢在二氧化锰的作用下反应生成氧气,有气泡产生,用二氧化锰能区别水和过氧化氢溶液,选项正确。故选B。
16.C
【详解】
A、赤铁矿是一种混合物,没有金属特性,其主要成分是氧化铁,赤铁矿不属于金属材料,故说法不正确;
B、金刚石和石墨都是由碳元素组成,但是金刚石和石墨中碳原子的排列方式不同,所以二者物理性质存在很大差异,故说法不正确;
C、用石油炼制汽油、煤油等产品的过程中,只是物质状态的改变,没有新物质生成,发生的是物理变化,故说法正确;
D、置换反应是指由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应.有单质生成的反应不一定属于置换反应,如水通电生成氢气和氧气,故说法不正确。
故选:C。
17.abc 磁铁矿中铁元素含量更高 c 先通一会儿CO,然后再加热 3CO+Fe2O32Fe+3CO2 收集未反应的CO,防止污染或中毒
【详解】
(1)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需要考虑金属的成本,生产过程中的能源损耗和污染,以及金属元素能否回收利用等,故选abc;
(2)Fe3O4中铁元素的质量分数为
FeCO3中铁元素的质量分数为
故磁铁矿中铁元素的质量分数更高,因此,从化学成分的角度分析“磁铁矿作炼铁原料更具优势”;
(3)钛合金制品放在海水中数年取出后仍光亮如新,说明钛合金制品抗腐蚀性较好,故选c;
(4)Ⅰ一氧化碳具有可燃性,与空气混合,加热可能会发生爆炸,所以在加热前要先通一氧化碳,将玻璃管中的空气排尽,防止一氧化碳不纯,发生爆炸,故加热前应先通一会一氧化碳,然后再加热;
Ⅱ赤铁矿为三氧化二铁,装置A中,三氧化二铁和一氧化碳反应生成铁和二氧化碳,其化学方程式为;
Ⅲ.装置B中的氢氧化钠可以和CO2气体反应,从而起到吸收二氧化碳的作用,同时一氧化碳可以将装置B中的溶液排出,从而被收集在B中,故装置B还有收集未反应的CO,防止污染和中毒的作用。
18.C C -3 0.2 35% 19.6%
【详解】
试题分析:利用金属导热性是铜火锅;图中所示物质属于非金属单质的化学式是C,其余单质属于金属,设氯化铵中氮元素的化合价是X,则X+(+1)*4+(-1)=0,则X=-3,;根据质量守恒定律知道产生氢气的质量为 =10克+60克-59.8克=0.2克g;设样品中锌的质量为X;所用稀硫酸中溶质的质量为Y,
Zn+H2SO4 ZnSO4+H2↑
65 98 2
X Y 0.2克
列比例式得:65:X=98:Y=2:0.2克
求得X=6.5克 Y=9.8克
样品中铜的质量分数=(10克-6.5克)/10克*100%=35%,
所用稀硫酸中溶质的质量分数=9.8克/50克*100%=19.6%。
19.钢 生铁 大于 长颈漏斗 集气瓶 B或C D或F Zn+H2SO4═ZnSO4+H2↑ C 【答题空10】67.5%
【详解】
I、世界上最常见、应用很广泛的合金材料是钢和生铁;
II、将镁铝合金与铝片相互刻划,在铝片表面留下了明显划痕,说明镁铝合金的硬度大于铝的硬度;
Ⅲ、(1)仪器a是长颈漏斗;仪器b是集气瓶;
(2)实验室用金属锌与稀硫酸反应制取氢气不需要加热,应该用B或C装置作为发生装置;氢气不溶于水,可以用排水法收集,即用D装置收集,密度比空气小,可以用向下排空气法收集,即用F装置收集;
(3)锌与稀硫酸生成硫酸锌和氢气,化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
IV、(1)A、合金的硬度大于纯金属,所以相互刻划,比较硬度的方法可以区分,正确;B、灼烧时铜能与氧气反应所以灼烧时能变黑色的是假黄金,不变色的是真黄金,正确;C、黄铜和黄金都不会被磁铁吸引,错误;D、金不会与酸反应,而锌能与酸反应生成氢气,所以加酸时能生成气体的是假黄金,没有现象的是真黄金,正确。故选C。
(2)解:设锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
x=3.25g
黄铜样品中铜的质量分数为×100%=67.5%。
答:黄铜样品中铜的质量分数为67.5%。
20.
(1) +4 密度小 温度升高,分子间的间隔变大,体积膨胀 8:1
(2) +3 二氧化氯
【分析】
(1)
根据各元素的化合价的代数和为零,SiO2中氧元素的化合价为-2价,所以Si的化合价是+4价;
铝合金具有密度小,机械强度大 、抗腐蚀性强等优点;
夏天易爆胎”的原因是温度升高,分子运动剧烈,分子间的间隙增大,气体的体积膨胀;
PVC【化学式(C2H3C1)n】中碳、氢元素的质量比是
故填:+4;密度小;温度升高,分子间的间隔变大,体积膨胀;8:1
(2)
由微观示意图可知该反应方程式为:,所以A为NaClO2中钠元素的化合价为+1价,氧元素的化合价为-2价,根据元素的化合价的代数和为零,所以物质中氯元素的化合价为+3价;
D为ClO2,名称为二氧化氯;
该反应的化学方程式是:
故填:+3;二氧化氯;
21.Na2CO3 合金 CaO+H2O=Ca(OH)2
【解析】
(1)纯碱是碳酸钠的俗称,其是由显+1价的钠元素和显 2价的碳酸根组成的,根据化合价原则,其化学式为:Na2CO3;(2)有机合成材料简称合成材料,要判断是否属于合成材料,可抓住三个特征:有机物、合成、高分子化合物,故合金不属于合成材料;(3)生石灰能与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O=Ca(OH)2。
22.金属 A 化学 机械 TiCl4+O2 =TiO2+2Cl2 -1价、0价
【解析】
(1) 铝合金属于金属材料,车身体板和底盘共同具有的一个物理性质是硬度大,不易变形;(2) 在特斯拉电动车行驶的过程中,储存在锂离子电池中的化学能转化为电能,最终转化为汽车运行时的机械能;(3)根据质量守恒定律可知,反应前还应含有氧元素,故该单质为氧气,即四氯化钛和氧气在一定条件下反应生成二氧化钛和氯气,化学反应方程式为:TiCl4+O2 =TiO2+2Cl2,反应前四氯化钛中氯元素显-1价,反应后生成氯气单质,化合价为0价。
一、选择题(共16题)
1.化学使我们学会了从微观的角度认识宏观现象。下列对宏观现象解释错误的是
A.水变为水蒸气一一分子体积变大 B.电解水——化学变化中分子可再分
C.闻到远处花香—一分子不断运动 D.生铁和钢性能不同——含碳量不同
2.下列铜制品的用途中,利用金属导电性的是
A.铜火锅 B.铜导线
C.铜钟 D.铜钱
3.下列说法正确的是
A.用肥皂水可以区分软水和硬水
B.红磷在空气中燃烧产生大量白色烟雾
C.金刚石、液氧、生铁属于单质
D.一切原子都是由质子、中子和电子构成
4.下列对有关事实的解释中,错误的是
A.生铁和钢的性能不同——含碳量不同
B.氮和氧的元素种类不同——核内质子数不同
C.一氧化碳和二氧化碳的化学性质不同——氧原子个数不同
D.带火星的木条在空气和氧气中的现象不同——氧气浓度不同
5.某新型“防盗玻璃”为多层结构,每层中间嵌有细金属线,当玻璃被击碎时,与金属相连的警报系统就会立刻报警。“防盗玻璃”报警时主要利用了金属的
A.延展性 B.导电性 C.导热性 D.硬度
6.下列说法错误的是
A.把铅加入锡中制成合金焊锡的主要目的是降低熔点
B.用洗涤剂除去油污是因为洗涤剂能溶解油污形成溶液
C.向蒸馏水中加入肥皂水会产生大量的泡沫
D.生煤火炉时,点燃木柴来引燃煤,是为了使温度达到煤的着火点
7.下列过程中只发生物理变化的是
A.制作叶脉书签
B.木条遇浓硫酸变黑
C.比较合金和纯金属的硬度
D.紫花变红花
8.下列各项比较中,正确的是
A.灯焰温度:焰心>外焰 B.硬度:纯铁>生铁
C.pH:食醋>食盐水 D.地壳中金属元素含量:铝>铁
9.推理是化学学习的常用方法。下列推理合理的是
A.离子是带电的粒子,所以带电的粒子一定是离子
B.置换反应中有单质参与,但有单质参与的反应不一定都是置换反应
C.生铁和钢都是铁合金,因此它们性能相同
D.化合物是由不同元素组成的纯净物,但由不同元素组成的纯净物不一定是化合物
10.推理是化学学习中常用的思维方法,下列推理正确的是
A.物质与氧气发生的反应属于氧化反应,则氧化反应一定有氧气参加
B.金属能导电,则能导电的物质一定是金属
C.钠离子、氯离子的最外层电子数都是8,则离子的最外层电子数都是8
D.单质是由同种元素组成的,则同种元素组成的纯净物一定是单质
11.物质的结构决定性质,下列说法不正确的是
A.石墨与金刚石性质存在差异,原因是构成二者的碳原子不同
B.生铁和钢的性能存在差异,原因是二者的含碳量不同
C.一氧化碳与二氧化碳的性质不同,原因是二者的分子构成不同
D.钠原子与钠离子的性质不同,原因是二者的最外层电子数不同
12.下列说法中,完全正确的是
A.儿童缺锌会患智力低下;生成盐和水的反应都是中和反应
B.向某NaOH溶液中滴加几滴盐酸没有气泡则未变质;合金的熔点都高于它的成分金属
C.用洗洁精乳化试管壁上的油脂;使用新能源,能减少酸雨产生
D.用铁质容器配制农药波尔多液;吹灭蜡烛的原理是降低了着火点
13.小明同学记录的下列实验操作正确的是
A.浓硫酸稀释,将水倒入浓硫酸
B.闻气体气味,靠近瓶口吸气
C.氢气验纯:试管口向上移近火焰
D.比较黄铜片与铜片的硬度:相互刻画
14.下列有关物质的性质与用途具有对应关系的是
A.金属铜有金属光泽,可用作导电材料
B.浓硫酸有脱水性,可用作干燥剂
C.一氧化碳有可燃性,可用于工业炼铁
D.不锈钢耐腐蚀,可用作医疗器械
15.下列物质鉴别的方法不正确的是
A.水区分石灰石和生石灰 B.用燃着的木条区分氮气和二氧化碳
C.用颜色区别铜片和铝片 D.用二氧化锰区别水和过氧化氢溶液
16.以下说法正确的是( )
A.“生铁”、“钢”、“赤铁矿”都是金属材料
B.金刚石和石墨都是由碳元素组成,因此金刚石和石墨的性质相同
C.用石油炼制汽油、煤油等产品是物理变化
D.置换反应有单质生成,所以有单质生成的反应一定是置换反应
二、综合题(共6题)
17.在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
(1)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有_____(填字母序号)。
a.金属原料的成本 b.生产过程中的能耗与污染 c.金属的回收利用
(2)比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学成分的角度分析“磁铁矿作炼铁原料更具优势”,其原因是_____。
(3)钛和钛合金是21世纪重要的金属材料。钛合金制品放在海水中数年取出后仍光亮如新,是因为其_____(填字母序号)非常好。
a.可塑性 b.机械性能 c.抗腐蚀性能
(4)某兴趣小组在实验室中利用CO气体模拟炼铁的原理,如下图所示。
I.为了避免装置A中玻璃管在加热时可能发生爆炸,加热前应_____。
II.装置A玻璃管中发生反应的化学方程式是_____。
III.装置B除了吸收CO2气体外,还有_____作用。
18.锌锰电池材料中含铜,构造如图。请回答下列问题:
(1)下列铜制品中,利用金属导热性的是_________(填字母序号);
A.铜质奖牌 B.铜导线 C.铜火锅
(2)图中所示物质属于非金属单质的化学式是____________;
(3)氯化铵中氮元素的化合价是____________;
(4)电池铜帽为铜锌合金。某课外活动小组为测定铜帽中铜的质量分数,设计实验如下:
取铜帽样品10g放入烧杯,加入50g稀硫酸,恰好完全反应,烧杯内剩余物的总质量为59.8g。计算:
①产生氢气的质量为__________g;
②样品中铜的质量分数____;
③所用稀硫酸中溶质的质量分数____(②、③写出计算过程)。
19.金属及金属材料和我们密切相关。
I、世界上最常见、应用很广泛的合金材料是_______和_________。
II、将镁铝合金与铝片相互刻划,在铝片表面留下了明显划痕,说明镁铝合金的硬度______铝的硬度(填“大于”或“小于”)。
Ⅲ、许多金属与酸反应都能生成氢气。
(1)仪器的名称a__________________b______________________
(2)适合于实验室制取氢气的发生装置是__________(填序号,下同),收集装置是___________
(3)请写出一个用于实验室制备氢气的化学反应方程式___________________________
IV、黄铜(铜锌合金)是我们生活中一种常见的金属材料,常被用于制造阀门、水管、空调内外机连接管和散热器等。
(1)黄铜外观和黄金很像,下列方法不可用于区分黄铜和黄金的是________(填序号)
A.比硬度B.灼烧C.用磁铁吸引D.放入稀盐酸中
(2)为了测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到稀硫酸中,恰好完全反应,产生氢气0.1g。该黄铜样品中铜的质量分数为________(计算结果保留一位小数)
20.依据所学知识回答问题
(1)网购、高铁、共享单车和打码支付被称为中国“新四大发明”。
①网购离不开光纤宽带。光纤的主要成分是SiO2,其中Si的化合价是_______。
②高铁车体的外壳由铝合金制成,用铝合金制作外壳的优点是_______(答一条)。
③共享单车的轮胎为实体轮胎,而普通自行车的轮胎在夏天易爆胎请用分子观点解释“夏天易爆胎”的原因_______。
④许多商品的二维码印在PVC不干胶贴纸上,PVC(化学式(C2H3C1)n)中碳、氢元素的质量比是_。
(2)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒,制取ClO2的反应过程示意图如下:
(其中,表示钠原子,表示氯原子, 表示氧原子)请回答题:
①A物质中氯元素的化合价为_______。
②D物质的名称是_______。
③该反应的化学方程式是_______。
21.小军用下图形式对所学知识进行归纳整理。
(1)盐中纯碱的化学式是_____。
(2)小军归纳整理中有种物质归纳错误,该物质是_____。
(3)生石灰用作干燥剂的原理是_____(用化学方程式表示)。
22.绿色出行,美丽冰城!相信同学们最近在街上一定看到了许多“绿车牌”。这是我市正式启用的新能源汽车专用号牌。几年来。哈尔滨市淘汰“黄标车”,引进“绿牌车”,在生态文明建设的路上,我们决不驰于空想,不骛于虚声!请回答:
(1)特斯拉电动车是—类典型的新能源车,其外部车身体板采用碳纤维材料构造,底盘由模压铝合金构成,铝合金属于①_______材料,推测车身体板和底盘共同具有的一个物理性质是_____(填字母)。
A.硬度大 B.熔点低 C.密度大
(2)在特斯拉电动车行驶的过程中,储存在锂离子电池中的①______能转化为电能,最终转化为汽车运行时的②_______能。
(3)二氧化钛(TiO2)也是制备化学电源不可或缺的重要原料,其工业制法是在一定条件下,利用四氯化钛和一种气体单质反应制得,同时生成氯气(Cl2),此反应的化学方程式为①__________________________,反应前后氯元素的化合价分别为②_________。
参考答案
1.A
【详解】
A、水变为水蒸气,是因为分子之间的间隔变大,分子体积不变,符合题意;
B、电解水,是因为化学变化中分子可再分为原子,原子可重新组合为新的分子,不符合题意;
C、闻到远处花香,是因为分子不断运动,不符合题意;
D、生铁和钢性能不同,是因为含碳量不同,生铁的含碳量为2%-4.3%,钢的含碳量为0.03%-2%,不符合题意。
故选A。
2.B
【详解】
A、铜火锅利用了铜的导热性,不符合题意;
B、铜导线利用了铜的导电性,符合题意;
C、铜合金较硬,化学性质比较稳定,铜钟敲击时能发出宏亮的声音,铜做铜钟没有利用铜的导电性,不符合题意;
D、铜做铜钱是因为铜具有良好的可铸造性,化学性质比较稳定,与导电性无关,不符合题意。故选B。
3.A
【详解】
A、加肥皂水后,生成泡沫较多的是软水,生成泡沫较少的是硬水,所以肥皂水能够区分软水和硬水,正确;
B、红磷在空气中燃烧,产生大量的白烟,而不是白色烟雾,错误;
C、金刚石、液氧属于单质,生铁是铁的合金,属于混合物,错误;
D、原子不一定是由质子、中子和电子构成,例如氢原子不含有中子,错误。
故选A。
4.C
【详解】
A. 物质的性质是由物质的组成和结构,生铁和钢的性能不同——含碳量不同;B. 质子数决定决定元素的类别,氮和氧的元素种类不同——核内质子数不同;C. 一氧化碳和二氧化碳的化学性质不同,是因为一个分子中氧原子个数不同;D. 带火星的木条在空气和氧气中的现象不同,氧气浓度不同,空气中氧气只占21%。选D
5.B
【详解】
“细金属线”体现了金属的延展性,当玻璃被击碎时,与金属相连的警报系统就会立刻报警,利用了金属的导电性,“防盗玻璃”报警时主要利用了金属的导电性。故选B。
6.B
【详解】
A、合金的熔点比组成它的纯金属的熔点低,把铅加入锡中制成合金焊锡,主要目的是降低熔点,故选项说法正确;B、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,形成的不是溶液,故选项说法错误;C、蒸馏水属于软水,加肥皂水会产生大量的气泡,故选项说法正确;D、生煤火炉时,可点燃木柴来引燃煤,是为了使温度达到煤的着火点,故选项说法正确。故选B。
7.C
【详解】
A、制作叶脉书签有新物质产生,属于化学变化,不符合题意;
B、木条遇浓硫酸变黑有新物质产生,属于化学变化,不符合题意;
C、比较合金和纯金属的硬度没有新物质产生,属于物理变化,符合题意;
D、紫花变红花有新物质产生,属于化学变化,不符合题意;
故选C。
8.D
【详解】
A、焰心与空气接触不充分,酒精燃烧不充分,放出热量少,外焰与空气接触充分,酒精燃烧充分,放出热量多,灯焰温度:焰心<外焰,故A错误;
B、合金的硬度比组成它的纯金属的硬度大,硬度:纯铁<生铁,故B错误;
C、食盐水显中性,pH等于7,食醋显酸性,pH小于7,pH:食醋<食盐水,故C错误;
D、地壳中含量居前五位的元素是氧、硅、铝、铁、钙,地壳中金属元素含量:铝>铁,故D,正确。故选D。
9.B
【详解】
A、离子是带电的粒子,但是带电的粒子不一定是离子,如质子、电子等,故错误;
B、置换反应的反应物和生成物均是一种单质和一种化合物,但有单质参与的反应不一定都是置换反应,如氢气在氧气中燃烧,属于化合反应,故正确;
C、生铁和钢都是铁的合金,生铁是含碳量为的铁合金,钢是含碳量为的铁合金,生铁和钢主要成分都是铁,由于含碳量不同,性能不完全相同,故错误;
D、由化合物概念可知至少由两种元素组成,则化合物都是由不同元素组成,又纯净物包括单质和化合物,则由不同元素组成的纯净物一定是化合物,故错误。
故选B。
10.D
【详解】
A、物质与氧气发生的反应属于氧化反应,但氧化反应不一定有氧气参加,如氢气与氧化铜反应生成铜和水,氢气得到氧元素,发生氧化反应,故选项推理错误;
B、金属能导电,但能导电的物质不一定是金属,例如石墨能导电却属于非金属,故选项推理错误;
C、钠离子、氯离子的最外层电子数都是8,但离子的最外层电子数不都是8,例如氢离子核外没有电子,故选项推理错误;
D、单质是由同种元素组成的,则同种元素组成的纯净物一定是单质,故选项推理正确。
故选:D。
11.A
【详解】
A、石墨与金刚石性质存在差异,原因是碳原子的排列方式不同,错误;
B、生铁和钢的性能存在差异,原因是二者的含碳量不同,正确;
C、一氧化碳与二氧化碳的性质不同,原因是二者的分子构成不同,正确;
D、钠原子与钠离子的性质不同,原因是二者的最外层电子数不同,正确。
故选A。
12.C
【解析】A.人体中缺锌易引起食欲不振,生长迟缓,发育不良,智力低下;CO2和NaOH溶液反应生成盐和水,但不是中和反应,故A错误;B.向某NaOH溶液中滴加过量盐酸没有气泡则未变质,盐酸量少,NaOH过量,则无法判断是否变质;合金的熔点都低于它的成分金属,故B错误;C.洗洁精对油污具有乳化作用,可以洗去餐具上的油污;使用新能源,能减少SO2的排放,降低酸雨产生,故C正确;D.农药波尔多液中的硫酸铜能和铁反应,不能用铁质容器配制农药波尔多液;着火点是物质的一种固有属性,一般不会改变,所以最吹蜡烛并不能降低蜡烛的着火点,故D错误;答案为C。
13.D
【详解】
A、浓硫酸稀释,将浓硫酸倒入水中,且用玻璃棒不断搅拌,防止局部温度过高液体飞溅,A错误。
B、闻气体气味用扇闻法,不能靠近瓶口吸气,容易呛到,B错误。
C、氢气密度比空气小,防止空气逸出,试管口向下移近火焰,C错误。
D、比较黄铜片与铜片的硬度:相互刻画,D正确。
故选:D。
14.D
【详解】
A、金属铜有导电性,可用作导电材料,A错误。
B、浓硫酸有吸水性,可用作干燥剂,B错误。
C、一氧化碳有还原性,可用于工业炼铁,C错误。
D、不锈钢耐腐蚀,可用作医疗器械,D正确。
故选:D。
15.B
【详解】
A. 石灰石不溶于水,和水混合无明显现象,生石灰和水混合生成氢氧化钙放出大量热,选项正确;
B. 二氧化碳和氮气都能使燃着的木条熄灭,不能用燃着的木条区分氮气和二氧化碳,选项错误;
C. 铜片是紫红色金属,铝是银白色金属,能用颜色区别铜片和铝片,选项正确;
D. 水和二氧化锰混合无明显现象,过氧化氢在二氧化锰的作用下反应生成氧气,有气泡产生,用二氧化锰能区别水和过氧化氢溶液,选项正确。故选B。
16.C
【详解】
A、赤铁矿是一种混合物,没有金属特性,其主要成分是氧化铁,赤铁矿不属于金属材料,故说法不正确;
B、金刚石和石墨都是由碳元素组成,但是金刚石和石墨中碳原子的排列方式不同,所以二者物理性质存在很大差异,故说法不正确;
C、用石油炼制汽油、煤油等产品的过程中,只是物质状态的改变,没有新物质生成,发生的是物理变化,故说法正确;
D、置换反应是指由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应.有单质生成的反应不一定属于置换反应,如水通电生成氢气和氧气,故说法不正确。
故选:C。
17.abc 磁铁矿中铁元素含量更高 c 先通一会儿CO,然后再加热 3CO+Fe2O32Fe+3CO2 收集未反应的CO,防止污染或中毒
【详解】
(1)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需要考虑金属的成本,生产过程中的能源损耗和污染,以及金属元素能否回收利用等,故选abc;
(2)Fe3O4中铁元素的质量分数为
FeCO3中铁元素的质量分数为
故磁铁矿中铁元素的质量分数更高,因此,从化学成分的角度分析“磁铁矿作炼铁原料更具优势”;
(3)钛合金制品放在海水中数年取出后仍光亮如新,说明钛合金制品抗腐蚀性较好,故选c;
(4)Ⅰ一氧化碳具有可燃性,与空气混合,加热可能会发生爆炸,所以在加热前要先通一氧化碳,将玻璃管中的空气排尽,防止一氧化碳不纯,发生爆炸,故加热前应先通一会一氧化碳,然后再加热;
Ⅱ赤铁矿为三氧化二铁,装置A中,三氧化二铁和一氧化碳反应生成铁和二氧化碳,其化学方程式为;
Ⅲ.装置B中的氢氧化钠可以和CO2气体反应,从而起到吸收二氧化碳的作用,同时一氧化碳可以将装置B中的溶液排出,从而被收集在B中,故装置B还有收集未反应的CO,防止污染和中毒的作用。
18.C C -3 0.2 35% 19.6%
【详解】
试题分析:利用金属导热性是铜火锅;图中所示物质属于非金属单质的化学式是C,其余单质属于金属,设氯化铵中氮元素的化合价是X,则X+(+1)*4+(-1)=0,则X=-3,;根据质量守恒定律知道产生氢气的质量为 =10克+60克-59.8克=0.2克g;设样品中锌的质量为X;所用稀硫酸中溶质的质量为Y,
Zn+H2SO4 ZnSO4+H2↑
65 98 2
X Y 0.2克
列比例式得:65:X=98:Y=2:0.2克
求得X=6.5克 Y=9.8克
样品中铜的质量分数=(10克-6.5克)/10克*100%=35%,
所用稀硫酸中溶质的质量分数=9.8克/50克*100%=19.6%。
19.钢 生铁 大于 长颈漏斗 集气瓶 B或C D或F Zn+H2SO4═ZnSO4+H2↑ C 【答题空10】67.5%
【详解】
I、世界上最常见、应用很广泛的合金材料是钢和生铁;
II、将镁铝合金与铝片相互刻划,在铝片表面留下了明显划痕,说明镁铝合金的硬度大于铝的硬度;
Ⅲ、(1)仪器a是长颈漏斗;仪器b是集气瓶;
(2)实验室用金属锌与稀硫酸反应制取氢气不需要加热,应该用B或C装置作为发生装置;氢气不溶于水,可以用排水法收集,即用D装置收集,密度比空气小,可以用向下排空气法收集,即用F装置收集;
(3)锌与稀硫酸生成硫酸锌和氢气,化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
IV、(1)A、合金的硬度大于纯金属,所以相互刻划,比较硬度的方法可以区分,正确;B、灼烧时铜能与氧气反应所以灼烧时能变黑色的是假黄金,不变色的是真黄金,正确;C、黄铜和黄金都不会被磁铁吸引,错误;D、金不会与酸反应,而锌能与酸反应生成氢气,所以加酸时能生成气体的是假黄金,没有现象的是真黄金,正确。故选C。
(2)解:设锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
x=3.25g
黄铜样品中铜的质量分数为×100%=67.5%。
答:黄铜样品中铜的质量分数为67.5%。
20.
(1) +4 密度小 温度升高,分子间的间隔变大,体积膨胀 8:1
(2) +3 二氧化氯
【分析】
(1)
根据各元素的化合价的代数和为零,SiO2中氧元素的化合价为-2价,所以Si的化合价是+4价;
铝合金具有密度小,机械强度大 、抗腐蚀性强等优点;
夏天易爆胎”的原因是温度升高,分子运动剧烈,分子间的间隙增大,气体的体积膨胀;
PVC【化学式(C2H3C1)n】中碳、氢元素的质量比是
故填:+4;密度小;温度升高,分子间的间隔变大,体积膨胀;8:1
(2)
由微观示意图可知该反应方程式为:,所以A为NaClO2中钠元素的化合价为+1价,氧元素的化合价为-2价,根据元素的化合价的代数和为零,所以物质中氯元素的化合价为+3价;
D为ClO2,名称为二氧化氯;
该反应的化学方程式是:
故填:+3;二氧化氯;
21.Na2CO3 合金 CaO+H2O=Ca(OH)2
【解析】
(1)纯碱是碳酸钠的俗称,其是由显+1价的钠元素和显 2价的碳酸根组成的,根据化合价原则,其化学式为:Na2CO3;(2)有机合成材料简称合成材料,要判断是否属于合成材料,可抓住三个特征:有机物、合成、高分子化合物,故合金不属于合成材料;(3)生石灰能与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O=Ca(OH)2。
22.金属 A 化学 机械 TiCl4+O2 =TiO2+2Cl2 -1价、0价
【解析】
(1) 铝合金属于金属材料,车身体板和底盘共同具有的一个物理性质是硬度大,不易变形;(2) 在特斯拉电动车行驶的过程中,储存在锂离子电池中的化学能转化为电能,最终转化为汽车运行时的机械能;(3)根据质量守恒定律可知,反应前还应含有氧元素,故该单质为氧气,即四氯化钛和氧气在一定条件下反应生成二氧化钛和氯气,化学反应方程式为:TiCl4+O2 =TiO2+2Cl2,反应前四氯化钛中氯元素显-1价,反应后生成氯气单质,化合价为0价。
