2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(word版 含答案)
文档属性
| 名称 | 2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 223.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-06 16:29:54 | ||
图片预览

文档简介
2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练
班级__________ 座号_____ 姓名__________ 分数__________
一、选择题
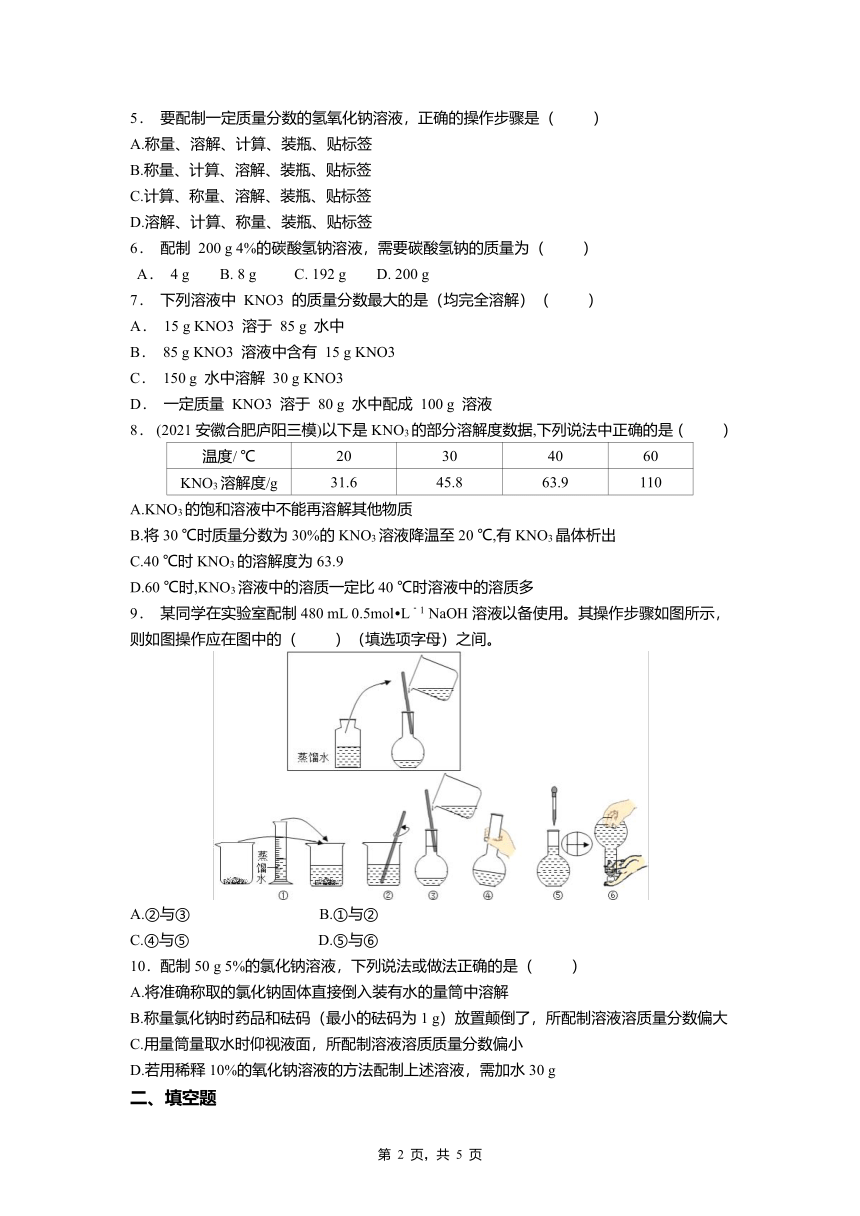
1. (2021广东珠海香洲二模)20 ℃时,甲、乙两固体在水中最多能溶解的质量如图所示。下列描述不正确的是( )
A.20 ℃时,甲的溶解度比乙大
B.20 ℃时,20 g水和40 g水中最多溶解甲的质量不相等,但形成饱和溶液的溶质质量分数相等
C.20 ℃时,a点表示的甲、乙两固体所对应的溶液都是不饱和溶液
D.20 ℃时,乙的溶解度为60 g
2. 将 50g 98%的浓硫酸全部溶于水配制成 10%的稀硫酸,需要加入水的质量为( )g
A.400 B.440 C.450 D.500
3. 保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是( )
A. B.
C. D.
4. 如图是某同体物质的溶解度曲线。则t2℃时,该物质的饱和溶液中溶质的质量分数为( )
A.20% B.l6.7%
C.30% D.23.1%
5. 要配制一定质量分数的氢氧化钠溶液,正确的操作步骤是( )
A.称量、溶解、计算、装瓶、贴标签
B.称量、计算、溶解、装瓶、贴标签
C.计算、称量、溶解、装瓶、贴标签
D.溶解、计算、称量、装瓶、贴标签
6. 配制 200 g 4%的碳酸氢钠溶液,需要碳酸氢钠的质量为( )
A. 4 g B. 8 g C. 192 g D. 200 g
7. 下列溶液中 KNO3 的质量分数最大的是(均完全溶解)( )
A. 15 g KNO3 溶于 85 g 水中
B. 85 g KNO3 溶液中含有 15 g KNO3
C. 150 g 水中溶解 30 g KNO3
D. 一定质量 KNO3 溶于 80 g 水中配成 100 g 溶液
8. (2021安徽合肥庐阳三模)以下是KNO3的部分溶解度数据,下列说法中正确的是( )
温度/ ℃ 20 30 40 60
KNO3溶解度/g 31.6 45.8 63.9 110
A.KNO3的饱和溶液中不能再溶解其他物质
B.将30 ℃时质量分数为30%的KNO3溶液降温至20 ℃,有KNO3晶体析出
C.40 ℃时KNO3的溶解度为63.9
D.60 ℃时,KNO3溶液中的溶质一定比40 ℃时溶液中的溶质多
9. 某同学在实验室配制480 mL 0.5mol L﹣1 NaOH溶液以备使用。其操作步骤如图所示,则如图操作应在图中的( )(填选项字母)之间。
A.②与③ B.①与②
C.④与⑤ D.⑤与⑥
10.配制50 g 5%的氯化钠溶液,下列说法或做法正确的是( )
A.将准确称取的氯化钠固体直接倒入装有水的量筒中溶解
B.称量氯化钠时药品和砝码(最小的砝码为1 g)放置颠倒了,所配制溶液溶质量分数偏大
C.用量筒量取水时仰视液面,所配制溶液溶质质量分数偏小
D.若用稀释10%的氧化钠溶液的方法配制上述溶液,需加水30 g
二、填空题
11.(2021吉林长春二模)硝酸钾、氯化钾的溶解度曲线如图甲所示,回答下列问题:
甲
乙
(1)t1 ℃时硝酸钾的溶解度 氯化钾的溶解度(填“>”“<”或“=”);
(2)t2 ℃时,将60 g 氯化钾放入 g水中,完全溶解后,可得到恰好饱和的溶液;
(3)如图乙是有关硝酸钾溶液的实验操作及变化情况,下列说法正确的是 ;
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.若将等温度等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.若将等温度等质量的硝酸钾和氯化钾的饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
(4)用40%的硝酸钾溶液配制100 g 10%的硝酸钾溶液,需要加入水的体积是 。
12.溶解性是指________。物质的溶解性主要与________、________和________等因素有关。其中________被称为影响物质溶解性的外部因素;而________和________被称为影响溶解性的内部因素。
13.(2021湖南郴州中考)T ℃时,等质量的甲、乙、丙三种固体分别加入等质量的水中,加入固体的质量与溶液溶质质量分数的关系如图所示,请回答下列问题:
(1)该温度下,甲、乙、丙三种固体溶解度由大到小的顺序是 ;
(2)乙溶液在B点属于 溶液(填“饱和”或“不饱和”);
(3)将甲的不饱和溶液变为饱和溶液,可用方法是 ;
(4)该温度下,甲的溶解度为 ;
(5)已知乙的溶解度受温度影响较小,丙的溶解度受温度影响较大,当丙中混有少量乙,提纯方法是 。
14.用固体氯化钠和水配制100g溶质质量分数为5%的氯化钠溶液,除用托盘天平、药匙外,还需要的玻璃仪器有________、________、________、________;配制溶液的实验步骤包括①称量、②________、③________、④溶液倒入试剂瓶。
15.用5%的KNO3溶液配制150g溶质质量分数为2%的硝酸钾营养液,需要加水的质量是________g;用量筒量取水时,若读数时仰视,则导致配制溶液的质量分数________(天“偏大”或“偏小”);玻璃棒在配制过程中的作用是________。
三、计算题
16.如图所示,往水电解器中加入 96 g 蒸馏水和 2 g Na2SO4(Na2SO4 不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到 2 g 气体时,停止实验。
计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中 Na2SO4的质量分数是多少?
17.配制 20%的稀硫酸 300 g,需要 98%密度是 1.84 g/cm3 的浓硫酸多少 mL? 加多少 mL 水?(水的密度是 1 g/cm3)(结果保留一位小数)
2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(参考答案)
一、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 C B A D C B D B C C
二、填空题
11. (1)= (2)150 (3)ABD (4)75 mL
12.物质在溶剂里的溶解能力 溶质的性质 溶剂的性质 温度 温度 溶质的性质 溶剂的性质
13. (1)丙>乙>甲 (2)饱和 (3)加入甲物质或蒸发溶剂 (4)25 g (5)降温结晶
14.筒 胶头滴管 烧杯 玻璃棒 量取 溶解
15.90 偏小 搅拌,使溶液混合均匀
三、计算题
16. 解:(1)设生成 2 g 氢气时消耗的水的质量为 x。
2H2O 2H2↑+O2↑
36 4
x 2 g
x=18 g
(2)由于电解过程中硫酸钠仅起增加水的导电性的作用,其质量保持不变,剩余溶液中 Na2SO4 的质量分数为:
×100%=2.5%
答:(1)停止实验时,电解消耗水的质量是18 g。
(2)停止实验后,剩余溶液中 Na2SO4 的质量分数是 2.5%。
17. 解:设需浓硫酸的体积为 x。
300 g×20%=1.84 g/cm3×x×98%x=33.3 cm3=33.3 mL
需加水质量:300 g-1.84 g/cm3×33.3 cm3=238.7 g
需加水体积:238.7 cm3=238.7 mL
答:需要 98%密度是1.84 g/cm3 的浓硫酸的体积是33.3 mL, 加水 238.7 mL。
第 1 页,共 3 页
班级__________ 座号_____ 姓名__________ 分数__________
一、选择题
1. (2021广东珠海香洲二模)20 ℃时,甲、乙两固体在水中最多能溶解的质量如图所示。下列描述不正确的是( )
A.20 ℃时,甲的溶解度比乙大
B.20 ℃时,20 g水和40 g水中最多溶解甲的质量不相等,但形成饱和溶液的溶质质量分数相等
C.20 ℃时,a点表示的甲、乙两固体所对应的溶液都是不饱和溶液
D.20 ℃时,乙的溶解度为60 g
2. 将 50g 98%的浓硫酸全部溶于水配制成 10%的稀硫酸,需要加入水的质量为( )g
A.400 B.440 C.450 D.500
3. 保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是( )
A. B.
C. D.
4. 如图是某同体物质的溶解度曲线。则t2℃时,该物质的饱和溶液中溶质的质量分数为( )
A.20% B.l6.7%
C.30% D.23.1%
5. 要配制一定质量分数的氢氧化钠溶液,正确的操作步骤是( )
A.称量、溶解、计算、装瓶、贴标签
B.称量、计算、溶解、装瓶、贴标签
C.计算、称量、溶解、装瓶、贴标签
D.溶解、计算、称量、装瓶、贴标签
6. 配制 200 g 4%的碳酸氢钠溶液,需要碳酸氢钠的质量为( )
A. 4 g B. 8 g C. 192 g D. 200 g
7. 下列溶液中 KNO3 的质量分数最大的是(均完全溶解)( )
A. 15 g KNO3 溶于 85 g 水中
B. 85 g KNO3 溶液中含有 15 g KNO3
C. 150 g 水中溶解 30 g KNO3
D. 一定质量 KNO3 溶于 80 g 水中配成 100 g 溶液
8. (2021安徽合肥庐阳三模)以下是KNO3的部分溶解度数据,下列说法中正确的是( )
温度/ ℃ 20 30 40 60
KNO3溶解度/g 31.6 45.8 63.9 110
A.KNO3的饱和溶液中不能再溶解其他物质
B.将30 ℃时质量分数为30%的KNO3溶液降温至20 ℃,有KNO3晶体析出
C.40 ℃时KNO3的溶解度为63.9
D.60 ℃时,KNO3溶液中的溶质一定比40 ℃时溶液中的溶质多
9. 某同学在实验室配制480 mL 0.5mol L﹣1 NaOH溶液以备使用。其操作步骤如图所示,则如图操作应在图中的( )(填选项字母)之间。
A.②与③ B.①与②
C.④与⑤ D.⑤与⑥
10.配制50 g 5%的氯化钠溶液,下列说法或做法正确的是( )
A.将准确称取的氯化钠固体直接倒入装有水的量筒中溶解
B.称量氯化钠时药品和砝码(最小的砝码为1 g)放置颠倒了,所配制溶液溶质量分数偏大
C.用量筒量取水时仰视液面,所配制溶液溶质质量分数偏小
D.若用稀释10%的氧化钠溶液的方法配制上述溶液,需加水30 g
二、填空题
11.(2021吉林长春二模)硝酸钾、氯化钾的溶解度曲线如图甲所示,回答下列问题:
甲
乙
(1)t1 ℃时硝酸钾的溶解度 氯化钾的溶解度(填“>”“<”或“=”);
(2)t2 ℃时,将60 g 氯化钾放入 g水中,完全溶解后,可得到恰好饱和的溶液;
(3)如图乙是有关硝酸钾溶液的实验操作及变化情况,下列说法正确的是 ;
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.若将等温度等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.若将等温度等质量的硝酸钾和氯化钾的饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
(4)用40%的硝酸钾溶液配制100 g 10%的硝酸钾溶液,需要加入水的体积是 。
12.溶解性是指________。物质的溶解性主要与________、________和________等因素有关。其中________被称为影响物质溶解性的外部因素;而________和________被称为影响溶解性的内部因素。
13.(2021湖南郴州中考)T ℃时,等质量的甲、乙、丙三种固体分别加入等质量的水中,加入固体的质量与溶液溶质质量分数的关系如图所示,请回答下列问题:
(1)该温度下,甲、乙、丙三种固体溶解度由大到小的顺序是 ;
(2)乙溶液在B点属于 溶液(填“饱和”或“不饱和”);
(3)将甲的不饱和溶液变为饱和溶液,可用方法是 ;
(4)该温度下,甲的溶解度为 ;
(5)已知乙的溶解度受温度影响较小,丙的溶解度受温度影响较大,当丙中混有少量乙,提纯方法是 。
14.用固体氯化钠和水配制100g溶质质量分数为5%的氯化钠溶液,除用托盘天平、药匙外,还需要的玻璃仪器有________、________、________、________;配制溶液的实验步骤包括①称量、②________、③________、④溶液倒入试剂瓶。
15.用5%的KNO3溶液配制150g溶质质量分数为2%的硝酸钾营养液,需要加水的质量是________g;用量筒量取水时,若读数时仰视,则导致配制溶液的质量分数________(天“偏大”或“偏小”);玻璃棒在配制过程中的作用是________。
三、计算题
16.如图所示,往水电解器中加入 96 g 蒸馏水和 2 g Na2SO4(Na2SO4 不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到 2 g 气体时,停止实验。
计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中 Na2SO4的质量分数是多少?
17.配制 20%的稀硫酸 300 g,需要 98%密度是 1.84 g/cm3 的浓硫酸多少 mL? 加多少 mL 水?(水的密度是 1 g/cm3)(结果保留一位小数)
2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(参考答案)
一、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 C B A D C B D B C C
二、填空题
11. (1)= (2)150 (3)ABD (4)75 mL
12.物质在溶剂里的溶解能力 溶质的性质 溶剂的性质 温度 温度 溶质的性质 溶剂的性质
13. (1)丙>乙>甲 (2)饱和 (3)加入甲物质或蒸发溶剂 (4)25 g (5)降温结晶
14.筒 胶头滴管 烧杯 玻璃棒 量取 溶解
15.90 偏小 搅拌,使溶液混合均匀
三、计算题
16. 解:(1)设生成 2 g 氢气时消耗的水的质量为 x。
2H2O 2H2↑+O2↑
36 4
x 2 g
x=18 g
(2)由于电解过程中硫酸钠仅起增加水的导电性的作用,其质量保持不变,剩余溶液中 Na2SO4 的质量分数为:
×100%=2.5%
答:(1)停止实验时,电解消耗水的质量是18 g。
(2)停止实验后,剩余溶液中 Na2SO4 的质量分数是 2.5%。
17. 解:设需浓硫酸的体积为 x。
300 g×20%=1.84 g/cm3×x×98%x=33.3 cm3=33.3 mL
需加水质量:300 g-1.84 g/cm3×33.3 cm3=238.7 g
需加水体积:238.7 cm3=238.7 mL
答:需要 98%密度是1.84 g/cm3 的浓硫酸的体积是33.3 mL, 加水 238.7 mL。
第 1 页,共 3 页
同课章节目录
