7.1酸性溶液和碱性溶液同步练习—2021_2022学年九年级化学仁爱版下册(word版 含解析)
文档属性
| 名称 | 7.1酸性溶液和碱性溶液同步练习—2021_2022学年九年级化学仁爱版下册(word版 含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 302.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-06 16:49:02 | ||
图片预览




文档简介
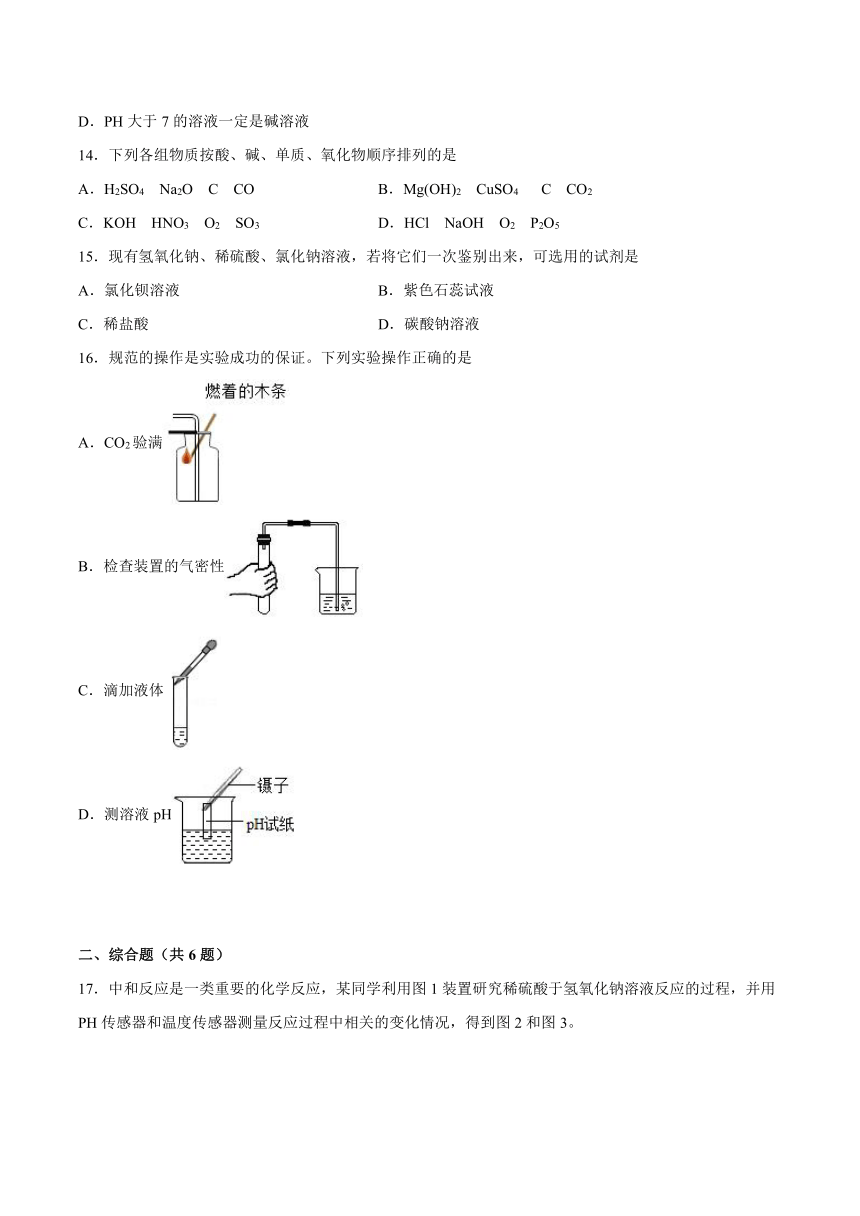
7.1酸性溶液和碱性溶液
一、选择题(共16题)
1.下列说法中错误的是
A.物质发生氧化反应时一定有发光、放热的现象发生
B.能使酚酞试液变红色溶液一定是碱性溶液
C.同一种元素可以构成不同的单质,如金刚石和石墨都是碳元素的单质
D.由于分子构成不同,二氧化碳和一氧化碳具有不同的性质
2.下列清洁用品中,碱性最强的是
A.洁厕灵pH=1 B.油烟净pH=13 C.肥皂水pH=10 D.牙膏pH=8
3.一些食物的pH近似值如下,其中酸性最强的是( )
食物 A葡萄汁 B牛奶 C某矿泉水 D鸡蛋清
pH 3.5~4.5 6.3~6.5 7.3~7.5 7.6~8.0
A.A B.B C.C D.D
4.下图实验基本操作都有错误,经四位同学纠正后仍有错误的是
A. B.
C. D.
5.只用一种试剂就能将稀硫酸、石灰水、食盐水三种无色溶液区别出来,这种试剂是
A.稀盐酸 B.Fe C.石蕊试液 D.酚酞试液
6.由物质分类知识可知,下列属于同一类物质的一组是( )
A.红磷、铁丝、乙醇 B.生石灰、熟石灰、石灰水
C.食醋、加碘食盐、酱油 D.海水、糖水、蒸馏水
7.以下关于化学知识的叙述,正确的叙述有
①可燃性气体或固体粉尘,遇到明火都会爆炸
②“稀土”被称为“工业的维生素”
③等质量的镁、铁两种金属,镁所含的原子个数多
④用湿润的pH试纸测定溶液的pH,会使得pH偏大
⑤如图,某物质的着火点为t℃,图中该物质燃烧得最旺的点是Q点
A.1个 B.2个 C.3个 D.4个
8.下列做法正确的是
A.用肥皂水区分硬水和软水
B.用活性炭净化水就可以得到纯水
C.用酚酞试液区分二氧化碳气体和氯化氢气体
D.用pH试纸测定溶液pH时,应先用蒸馏水将试纸润湿
9.下列区分物质的方法或试剂不正确的是
A.用肥皂水区分硬水、软水
B.用带火星的木条区分、
C.用区分、
D.用pH试纸区分氢氧化钠、氯化钠
10.下列叙述中不符合化学知识的是( )
A.皮蛋有碱性,食用时可加点醋中和 B.pH<5.6的雨水称为酸雨
C.稀溶液不一定是不饱和溶液 D.水能变油(油主要含C、H元素的物质)
11.下列实验操作正确的是
A.铁丝在氧气中燃烧 B.加热高锰酸钾
C.测定溶液pH D.暂时储存氧气
12.火星的土壤呈弱碱性。若火星具备作物生长的条件,则适宜在火星上种植的是
选项 A B C D
作物 茶树 棉花 甘 草 水稻
适宜作物生长的pH 5.0~5.5 6.0~6.8 7.2~8.5 6.0~7.0
A.A B.B C.C D.D
13.下列有关溶液的酸碱性的说法中,正确的是
A.PH=0时,溶液呈中性
B.用湿润的PH试纸测定某盐酸的PH时,测定结果会偏低
C.PH越小,溶液的酸性越强
D.PH大于7的溶液一定是碱溶液
14.下列各组物质按酸、碱、单质、氧化物顺序排列的是
A.H2SO4 Na2O C CO B.Mg(OH)2 CuSO4 C CO2
C.KOH HNO3 O2 SO3 D.HCl NaOH O2 P2O5
15.现有氢氧化钠、稀硫酸、氯化钠溶液,若将它们一次鉴别出来,可选用的试剂是
A.氯化钡溶液 B.紫色石蕊试液
C.稀盐酸 D.碳酸钠溶液
16.规范的操作是实验成功的保证。下列实验操作正确的是
A.CO2验满
B.检查装置的气密性
C.滴加液体
D.测溶液pH
二、综合题(共6题)
17.中和反应是一类重要的化学反应,某同学利用图1装置研究稀硫酸于氢氧化钠溶液反应的过程,并用PH传感器和温度传感器测量反应过程中相关的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为______。
(2)仪器A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______((填“6”、“12”或“16”)。
(4)下列说法正确的是______。
A.图2中b点所示溶液中的溶质是Na2SO4和NaOH
B.图2中d点所示溶液中所含微粒有Na+、、H+
C.图2中c→d所示溶液中Na2SO4的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
(5)本实验中需要准备溶质质量分数为9.8%的稀硫酸250g,若用98%的浓硫酸来配制,需要浓硫酸______克,需加水______mL(水的密度为lg/mL)。
18.KMnO4可用作消毒剂、氧化剂、药物和分析化学试剂等.某小组为探究制备高锰酸钾的绿色化方案,设计了如下图所示的实验流程.
(资料):
①K2MnO4水溶液呈墨绿色,在水及酸性条件下会发生歧化反应,生成KMnO4和MnO2.
②在 K2CO3溶液中持续通入 CO2,会生成 KHCO3.
③室温时,K2CO3、KHCO3、KMnO4的溶解度分别为 111g、33.7g、6.36g.
(1)共熔时(加温加压),反应生成 K2MnO4和 H2O,反应的化学方程式是___________ .
(2)浸取前,需将共熔后所得的物质粉碎,目的是___________ .
(3)歧化反应的化学方程式是 2_____.判断歧化时K2MnO4完全反应的方法是:用璃棒蘸取溶液点在滤纸上,若观察到 ___________,表示反应已完全.当溶液 pH 为 10~11,停止通 CO2,若 CO2过多,可能造成的不良后果是__________.
(4)操作 1 的名称是_________________,在实验室完成此操作,需要用到的玻璃仪器有烧杯、玻璃棒 和________,玻璃棒的作用是___________ .
(5)“…”表示一系列操作,包含蒸发浓缩→__________ →过滤→洗涤→烘干.烘干时,温度不宜过高,原因是__________.此过程中,洗涤的目的是__________ .
(6)从经济角度考虑,实验中可循环使用的物质是__________ (填化学式 ).
(7)实验中,也可以加入醋酸(HAc)进行歧化,下图是歧化时 HAc 加入量与产物中 KMnO4含量的关系图.可以发现:当 HAc 加入量为__________ mL 时,产物的纯度较高.
(8)实验室中可用 KMnO4制取氧气.理论上 31.6g高锰酸钾完全分解可以制得多少克氧气.写出计算过程,计算结果精确到小数点后1 位)。____
19.(一) 下图所示为实验室中常见的气体制备和收集装置.
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是_____ (填字 母序号)。若用装置B制取二氧化碳,反应的原理是(用化学方程式表示)_____。
(2)实验室用H2O2溶液和MnO2制取氧气, 若选用C做发生装置,你认为选用C的优点是_____。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应从_____ (填“a”或“b”) 端通入:欲使用装置E.用排水法收集氧气,先将瓶中装满水,再将气体从_____ (填“a”或“b”) 端通入。
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置_____(填字母序号)。
(二)小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,井向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应:②氢氧化钠有剩余:③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
实验方法 可能观察到的现象 结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。 如果_____。 则盐酸过量
如果_____。 则盐酸与氢氧化钠恰好完全反应
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是_____。(填序号).
A 生锈的铁钉
B 碳酸钠粉末
C 硫酸钠粉末
D 氢氧化铜
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是_____(填序号)。
20.水、溶液与人们的生产生活密切相关请回答:
(1)如图所示电解水的实验中,试管a、b中产生气体的体积比约为 _____ ,该实验证明水是由 _____ 组成的。
(2)下列净化水的单一操作中,相对净化程度较高的是 _____ (填字母)。
A 静置沉淀 B 吸附沉淀 C 过滤 D 蒸馏
(3)测定某地下水的酸碱度,最简单的方法是使用 _____ 。
(4)下图是三种固体物质的溶解度曲线。根据溶解度曲线回答问题:
①物质c的溶解度随温度的升高而 _____ ;
②物质a的溶解度大于物质c的溶解度的温度范围 _____ ;
③℃时,用50g水配制物质a的饱和溶液,至少需要a物质 _____ g;
④将℃时三种物质的饱和溶液升温至℃(溶剂量不变),溶液中溶质质量分数不变的是 _____ 。
21.某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____;剩余固体A的成分是_____。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据_____。
22.二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O, K2MnO4易溶于水
(1)实验室加热高锰酸钾制氧气,反应的化学方程式为_____。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是____。
Ⅱ.用硫酸锰制备
(2)电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为_____,一段时间后溶液的pH将________(填“变大”、“变小”或“不变”)。
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:
请回答下列问题:
(3)“滤液”中溶质的主要成分是_________(填化学式)。
(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、_______和_________。
(5) MnO2与碳粉经下列三步反应制得纳米MnO2:
①②MnO+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有___________(填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:
(6)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式
(7) MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如上图所示。图中A点(300, 75.65)对应固体成分的化学式为____________。
参考答案
1.A
【详解】
A、物质发生缓慢氧化反应时没有发光的现象发生,说法错误,符合题意;
B、酚酞试液是酸碱指示剂,遇到碱性溶液变红色,说法正确,不符合题意;
C、单质是由一种元素组成的纯净物。同一种元素可以构成不同的单质,如金刚石和石墨都是碳元素的单质,说法正确,不符合题意;
D、分子是保持物质化学性质的最小粒子。由于分子构成不同,二氧化碳和一氧化碳具有不同的性质,说法正确,不符合题意。
故选A。
2.B
【详解】
A、厕所清洁剂pH=1,小于7,显酸性。
B、油烟净pH=13,大于7,显碱性。
C、肥皂的pH=10,大于7,显碱性。
D、牙膏的pH=8,大于7,显碱性。
根据当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,油烟净的pH最大,碱性最强。
故选B。
3.A
【详解】
pH值越小,酸性越强,故选A。
4.B
【详解】
A、用pH试纸测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值,不符合题意;
B、把金属颗粒放入试管时,应该把试管横放,把金属颗粒放入试管口后,再把试管慢慢的竖立起来,使金属颗粒缓缓的滑到试管底部,而用手扔会导致试管破裂,故此法错误,符合题意;
C、过滤应用玻璃棒引流,不符合题意;
D、量筒不能用作反应器,应在烧杯中溶解,不符合题意。
故选:B。
5.C
【详解】
题目中所给物质稀硫酸溶质属于酸,石灰水溶质属于碱,食盐水溶质属于盐。对应的酸碱性分别为酸性溶液、碱性溶液、中性溶液。
A.稀盐酸与石灰水反应,温度变高,与稀硫酸和食盐水反应无现象,无法分辨,A选项错误
B.铁与稀硫酸反应产生气泡,与石灰水、食盐水不反应,无法分辨,B选项错误
C.石蕊与酸性溶液反应显红色,碱性溶液反应呈蓝色,中性溶液不反应为原色紫色,可以分辨出题目中的三种物质,C选项正确
D.酚酞与石灰水反应呈红色,但酚酞对酸性和中性溶液均不显色,无法分辨稀硫酸和食盐水,D选项错误
故选C
6.C
【详解】
A、红磷、铁丝均是由同种元素组成的纯净物,属于单质;乙醇属于化合物,此选项不符合题意;
B、生石灰是氧化钙的俗称,属于氧化物;熟石灰是氢氧化钙的俗称,属于碱;石灰水由水、氢氧化钙两种物质组成,属于混合物,此选项不符合题意;
C、食醋是醋酸的水溶液,属于混合物;加碘食盐中含有氯化钠、碘酸钾,属于混合物;酱油中含有水、氯化钠等物质,属于混合物,此选项符合题意;
D、海水、糖水属于混合物,蒸馏水属于纯净物,此选项不符合题意。
故选C。
7.C
【详解】
①可燃性气体或固体粉尘,混有一定量的空气,遇到明火,达到爆炸极限,才会爆炸,错误;
②稀土被誉为“工业的维生素”,是不可再生资源,正确;
③原子的质量与其相对原子质量成正比,相对原子质量:镁小于铁,故等质量的镁、铁两种金属,镁所含的原子个数多,正确;
④用湿润的pH试纸测定溶液的pH,如果溶液显酸性,会使得pH偏大,如果溶液显碱性,会使pH偏小,如果溶液显中性,pH不变,错误;
⑤某物质的着火点为t℃,图中该物质燃烧得最旺的点是Q点,是因为Q点温度大于该物质的着火点,且氧气含量最高,正确。
故正确的个数是3个。
故选C。
8.A
【解析】
A、用肥皂水区分硬水和软水,硬水泡沫少,软水泡沫多,故A正确; B、用活性炭净化水不可以得到纯水,活性炭具有吸附性,可以吸附色素和异味,不可以吸附钙镁离子,故B错误;C、不可用酚酞试液区分二氧化碳气体和氯化氢气体,二氧化碳气体和氯化氢气体遇水形成碳酸和盐酸,酚酞试液均不变色,故C错误;D、用pH试纸测定溶液pH时,不应先用蒸馏水将试纸润湿,否则会影响测试效果,故D错误。
9.C
【详解】
A、区分硬水和软水的方法是:用肥皂水,加入肥皂水,泡沫多的是软水,泡沫少的是硬水,正确;
B、氧气能使带火星的木条复燃,二氧化碳不能,能用带火星的木条鉴别,正确;
C、氢氧化钡不能与氯化钙反应,氢氧化钡与稀盐酸反应生成水,无现象,无法鉴别,错误;
D、氢氧化钠溶液显碱性,氯化钠溶液显中性,pH试纸会出现不同的颜色,再与标准比色卡对照即可,正确;
故选:C。
10.D
【详解】
A、皮蛋有碱性,能与酸发生中和反应,食用时可加点醋中和,故选项说法正确;
B、pH<5.6的雨水称为酸雨,故选项说法正确;
C. 稀溶液不一定是不饱和溶液,如氢氧化钙的饱和溶液,溶质质量分数很小,故选项说法正确;
D、根据质量守恒定律,化学反应中元素不会无中生有,水不能变成油,故选项说法错误。
故选:D。
11.D
【详解】
A、铁丝在O2中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙,图中集气瓶的底部没有放少量的水或铺一层细沙,图中操作错误;B、加热高锰酸钾制氧气时,试管口应略向下倾斜,以防止冷凝水的倒流,图中操作错误;C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH。不能将pH试纸伸入待测液中,以免污染待测液,图中操作错误;D、氧气的密度比空气大,放置集满氧气的集气瓶时,瓶口应向上放置,且毛玻璃粗糙面朝下,图中操作正确。故选D。
12.C
【详解】
火星的土壤呈弱碱性。pH应大于7. pH<7,溶液呈弱酸性。则适宜在火星上种植的是C甘草。
13.C
【详解】
试题分析:PH=0时,溶液呈强酸性;用湿润的PH试纸测定某盐酸的PH时,测定结果会偏低,因为相当于将试液稀释,溶液的酸性降低,PH会增大;PH越小,溶液的酸性越强;PH大于7的溶液一定是碱性溶液,但不一定是碱。故选C.
14.D
【详解】
A、Na2O属于金属氧化物不属于碱,故A错误;
B、Mg(OH)2不属于酸,而属于碱,CuSO4也不是碱而属于盐,故B错误;
C、KOH不属于酸,而属于碱,HNO3也不是碱而属于酸,故C错误;
D、HCl属于酸,NaOH属于碱,O2属于单质,P2O5属于氧化物,故D正确;
故选D。
15.B
【解析】
A、氯化钡不与氢氧化钠溶液和氯化钠溶液反应,无现象;故不符合题意;
B、氢氧化钠,紫色石蕊试液溶液变蓝色;稀硫酸,紫色石蕊溶液变红色;氯化钠,溶液为紫色,故合题意;
C、稀盐酸与NaOH溶液反应无现象,与稀H2SO4、NaCl溶液不反应,故不符合题意;
D、碳酸钠溶液与氢氧化钠溶液和氯化钠溶液不反应,与稀硫酸反应,故不符合题意。
16.B
【详解】
A、二氧化碳验满:二氧化碳不燃烧,也不支持燃烧,应将燃着的木条放在集气瓶口,木条熄灭,说明已经集满,图中操作错误,不符合题意;
B、检查装置的气密性:将导管置于水中,用手紧握试管,观察导管口是否有气泡冒出,有气泡冒出,说明气密性良好,图中操作正确,符合题意;
C、胶头滴管加液时,既不能伸入容器,更不能接触容器,应垂直悬空于容器上方0.5cm处,图中操作错误,不符合题意;
D、测溶液的pH值:用洁净、干燥的玻璃棒蘸取待测液点在pH试纸上,观察颜色的变化,然后与标准比色卡对照,图中操作错误,不符合题意。
故选B。
17.2NaOH+H2SO4═Na2SO4+2H2O H2SO4 12 AD 25 225
【详解】
(1)稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,2NaOH+H2SO4═Na2SO4+2H2O。
(2)由图象可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,不断加入的是酸性溶液,使pH减小,故仪器A中溶液硫酸H2SO4。
(3)图3中V时,放出的热量最多,溶液恰好完全反应,pH=7,结合图2可知,图3中V的数值最接近12。
(4)A、b点溶液的pH大于7,溶液显碱性,b点所示溶液中的溶质是反应生成的Na2SO4和过量的NaOH,正确;
B、d点溶液的pH小于7,溶液显酸性,d点所示溶液中溶质是硫酸钠和过量的硫酸,溶液中所含微粒有Na+、、H+及溶剂水分子H2O,错误;
C、c→d,是完全反应后继续向溶液中滴加稀硫酸,溶液中Na2SO4的质量不变,错误;
D、e→f,温度逐渐升高,该变化趋势可说明该反应是放热反应,正确。
故选AD。
(5)设需要浓硫酸的质量为,根据溶液稀释前后溶质的质量不变,则250g×9.8%=×98%,=25g,需加水的质量为250g-25g=225g,水的密度为1g/mL,水的体积=225mL。
18. 增大接触面积,浸取更充分(加快浸取) 全是(只有)紫红色(或无墨绿色)痕迹 产物中会混有 (回答产物不纯不得分) 过滤 漏斗 引流 冷却热饱和溶液结晶(降温结晶) 防止高锰酸钾受热分解 除去产物中的碳酸钾等杂质(使产物更纯净) 35(30 ~ 40) 解:设可制得氧气的质量为 x
x = 3.2g
答:可制得 3.2g 氧气。
【详解】
(1)分析流程图可知,二氧化锰、氢氧化钾和氧气在加温加压的条件下,反应生成锰酸钾和水,反应的化学方程式为: ,故填:;
(2)浸取前,需将共熔后所得的物质粉碎,目的是增大接触面积,浸取更充分(加快浸取),故填:增大接触面积,浸取更充分(加快浸取);
(3)根据质量守恒定律可知,反应前后原子的种类和数目不变;设要求的物质的化学式为X,根据化学方程式分析,反应前钾、锰、氧、碳原子个数分别为6、3、16、2,反应后的生成物中钾、锰、氧、碳原子个数分别为2、3、10、0,根据反应前后原子种类、数目不变,则2 X分子中含有4个钾原子、6个氧原子和2个碳原子,则物质X的化学式为;当 (墨绿色)全部转化为(紫红色),即可判断歧化时 完全反应,方法是:用璃棒蘸取溶液点在滤纸上,若观察到全是(只有)紫红色(或无墨绿色)痕迹;当溶液 pH 为 10~11,停止通 ,若 过多会与水、碳酸钾共同作用生成碳酸氢钾,且结晶时,碳酸氢钾和高锰酸钾一起析出,导致产品纯度降低,故填:;全是(只有)紫红色(或无墨绿色)痕迹;产物中会混有 ;
(4)由操作 1后的滤液和滤渣可知,该操作是过滤,在实验室完成此操作,需要用到的玻璃仪器有烧杯、玻璃棒和漏斗,玻璃棒的作用是引流,故填:过滤;漏斗;引流;
(5)先蒸发使溶液达到一个较高的浓度,有利于提高高锰酸钾的产率,再冷却热饱和溶液结晶(降温结晶),是为了得到较纯晶体;烘干时,温度过高,高锰酸钾会受热分解生成锰酸钾、二氧化锰和氧气,这会降低高锰酸钾的产率;此过程中,洗涤的目的是除去产物中的碳酸钾等杂质(使产物更纯净);故填:冷却热饱和溶液结晶(降温结晶);防止高锰酸钾受热分解;除去产物中的碳酸钾等杂质(使产物更纯净);
(6)因二氧化锰不溶于水,在进行过滤操作时,滤渣上的固体便是固体,从经济角度考虑,实验中二氧化锰可循环使用,故填:;
(7)由图分析可知,当 HAc 加入量为35mL 时,高锰酸钾的纯度较高,故填:35;
(8)解:设可制得氧气的质量为 x
x = 3.2g
答:可制得 3.2g 氧气。
19.A 可以控制产生氧气的速率 a b F 观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余; 有气泡冒出 没有气体生成 C C
【详解】
(一)(1)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,应选用的发生装置是固体加热型的装置A;若用装置B制取二氧化碳,反应物是碳酸钙和稀盐酸,生成二氧化碳和水和氯化钙,反应的原理是(用化学方程式表示);
(2)实验室用H2O2溶液和MnO2制取氧气, 选用C做发生装置,利用注射器可以控制液体滴加的速度,从而控制反应产生氧气的速率,故优点是可以控制产生氧气的速率;
(3)欲使用装置E用排空气法收集二氧化碳,由于相同情况下二氧化碳密度比空气密度大,气体应长进短出,即从a端通入;欲使用装置E用排水法收集氧气,氧气密度比水小,先将瓶中装满水,再将气体从b端通入;
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中排水法收集装置F;
(二)(1)氢氧化钠能使酚酞变红色。向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;
(2)将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中,如果有气泡冒出,则盐酸过量;如果没有气体生成,则盐酸与氢氧化钠恰好完全反应;
(3)A、盐酸能与生锈的铁钉反应生成黄色溶液,可行;
B、碳酸钠粉末与盐酸反应能产生二氧化碳气体,可行;
C、硫酸钠粉末与盐酸不反应,不可行;
D、氢氧化铜与盐酸反应产生氯化铜和水,可行;故填:C;
(4)小红向氢氧化钠溶液中滴加一定量稀盐酸,反应开始时溶液的pH>7,随着酸的不断加人,pH不断减小,至恰好反应时pH=7,若继续滴加稀盐酸,则pH<7,根据题意反应后从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化,说明氢氧化钠无剩余,则pH应从大于7变化到等于7进而小于7,观察图像,只有C符合,故填C。
20.2∶1 氢元素和氧元素 D pH试纸 减小 大于t1℃ 25 ab
【详解】
(1)在电解水实验中,和负极相连的试管生成的气体较多,是氢气,和电源正极相连的试管生成的气体较少是氧气,氢气和氧气的体积比约为2∶1,所以试管a、b中产生气体的体积比约为2∶1;水电解生成氢气和氧气,氢气是由氢元素组成的,氧气是由氧元素组成的,该实验证明水是由氢元素和氧元素组成的;
(2)在静置沉淀、吸附、沉淀、过滤和蒸馏四种净化水的方法中,单一操作净化程度最高的是蒸馏;
(3)测定某地下水的酸碱度,最简单的方法是使用pH试纸测定;
(4)
①根据溶解度曲线可知,物质c的溶解度随温度的升高而减小;
②由溶解度曲线可知,温度低于t1℃时,物质a的溶解度小于物质c的溶解度,温度等于t1℃时,物质a、c的溶解度相等,温度高于t1℃时物质a的溶解度大于物质c的溶解度,则温度范围为>t1℃;
③t2℃时,a物质的溶解度为50g,即该温度下100g水中最多溶解50g的a物质就达到饱和状态,则t2℃时,50g水最多溶解25g物质a,所以用50g水配制物质a的饱和溶液,至少需要a物质25g;
④t1℃时,三种物质的溶解度大小是b>a=c,此时饱和溶液的质量分数大小是b>a=c,当升高温度至t2℃时,a、b两种物质的溶解度都升高,溶液变为不饱和溶液,溶质质量分数均保持不变,而c物质的溶解度随温度升高而减小,即c溶液中有晶体析出,溶质质量分数减小,所以溶液中溶质质量分数不变的是ab。
21.0.1mol 将导管从石灰水中取出 Ca(OH)2 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaO、CaCO3 称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g【详解】
(1)设10g碳酸钙完全分解生成二氧化碳的质量为x
故10g碳酸钙完全分解生成二氧化碳的物质的量为
(2)加热一段时间后欲停止实验,为防止水倒吸,应先将导管从石灰水中取出。
(3)对加热后的剩余固体A进行实验,氧化钙和水反应生成氢氧化钙,滤液B滴加无色酚酞溶液变红,说明溶液显碱性,故滤液B的溶质是氢氧化钙(Ca(OH)2);步骤Ⅲ中生成气体的反应是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑;滤液B的溶质是氢氧化钙,剩余固体A加入水,生成滤液B和白色固体C,碳酸钙不溶于水,说明A中含有碳酸钙和氧化钙,故剩余固体A的成分是氧化钙和碳酸钙(CaO、CaCO3)。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分的过程:称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g22.2KMnO4△K2MnO4+MnO2+O2↑ 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰; 变小 NaAlO2 漏斗和玻璃棒 ①③ MnO2
【详解】
(1)根据高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气解答;根据稀硫酸能与锰酸钾反应生成二氧化锰解答;(2)根据硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰解答;(3)根据题中信息分析解答;(4)根据过滤操作需要用到的仪器解答;(5)根据反应的化学方程式分析解答;(6)根据氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰解答;(7)根据图中信息计算解答。(1)高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;根据信息提示“3K2MnO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+H2O”,将反应后的固体剩余物(锰酸钾和二氧化锰的混合物)用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,使锰酸钾转化得到二氧化锰,获得更多的二氧化锰,所以用稀硫酸而不用水浸取;;(2)硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰,反应的化学方程式为2H2O+MnSO4H2↑+H2SO4+MnO2↓,由于水越来越少,硫酸越来越多,也就是酸的质量分数变大,所以酸性越来越强,而pH越来越小,所以一段时间后溶液的pH将变小;(3)滤液中存在可溶性物质,而废旧锂电池正极材料和氢氧化钠溶液反应,根据信息“2Al+2NaOH+2H2O═2NaAlO2+3H2↑”,可知生成了偏铝酸钠,所以溶质的主要成分是NaAlO2;(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和玻璃棒;(5)MnO2与碳粉经下列三步反应制得纳米MnO2:①2MnO2+C2MnO+CO2↑,有单质参与反应,所以有化合价改变;②MnO+H2SO4═MnSO4+H2O,为复分解反应,无化合价改变;③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4,硫酸锰中的锰元素有+2变化+4价,而高锰酸钾中的锰元素由+7价变为+4价,所以有化合价的改变,故选①③;(6)氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰,反应的化学方程式为 O2+2MnCO32CO2+2MnO2;(7)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示,样品100g在图中A点对应固体的质量为75.65g,而过程中锰元素的质量不变,100g碳酸锰中锰元素的质量为100g×,则A点物质含氧元素的质量为75.65g-100g×,在固体中锰原子和氧原子个数比为:=1:2则固体成分的化学式为MnO2。
一、选择题(共16题)
1.下列说法中错误的是
A.物质发生氧化反应时一定有发光、放热的现象发生
B.能使酚酞试液变红色溶液一定是碱性溶液
C.同一种元素可以构成不同的单质,如金刚石和石墨都是碳元素的单质
D.由于分子构成不同,二氧化碳和一氧化碳具有不同的性质
2.下列清洁用品中,碱性最强的是
A.洁厕灵pH=1 B.油烟净pH=13 C.肥皂水pH=10 D.牙膏pH=8
3.一些食物的pH近似值如下,其中酸性最强的是( )
食物 A葡萄汁 B牛奶 C某矿泉水 D鸡蛋清
pH 3.5~4.5 6.3~6.5 7.3~7.5 7.6~8.0
A.A B.B C.C D.D
4.下图实验基本操作都有错误,经四位同学纠正后仍有错误的是
A. B.
C. D.
5.只用一种试剂就能将稀硫酸、石灰水、食盐水三种无色溶液区别出来,这种试剂是
A.稀盐酸 B.Fe C.石蕊试液 D.酚酞试液
6.由物质分类知识可知,下列属于同一类物质的一组是( )
A.红磷、铁丝、乙醇 B.生石灰、熟石灰、石灰水
C.食醋、加碘食盐、酱油 D.海水、糖水、蒸馏水
7.以下关于化学知识的叙述,正确的叙述有
①可燃性气体或固体粉尘,遇到明火都会爆炸
②“稀土”被称为“工业的维生素”
③等质量的镁、铁两种金属,镁所含的原子个数多
④用湿润的pH试纸测定溶液的pH,会使得pH偏大
⑤如图,某物质的着火点为t℃,图中该物质燃烧得最旺的点是Q点
A.1个 B.2个 C.3个 D.4个
8.下列做法正确的是
A.用肥皂水区分硬水和软水
B.用活性炭净化水就可以得到纯水
C.用酚酞试液区分二氧化碳气体和氯化氢气体
D.用pH试纸测定溶液pH时,应先用蒸馏水将试纸润湿
9.下列区分物质的方法或试剂不正确的是
A.用肥皂水区分硬水、软水
B.用带火星的木条区分、
C.用区分、
D.用pH试纸区分氢氧化钠、氯化钠
10.下列叙述中不符合化学知识的是( )
A.皮蛋有碱性,食用时可加点醋中和 B.pH<5.6的雨水称为酸雨
C.稀溶液不一定是不饱和溶液 D.水能变油(油主要含C、H元素的物质)
11.下列实验操作正确的是
A.铁丝在氧气中燃烧 B.加热高锰酸钾
C.测定溶液pH D.暂时储存氧气
12.火星的土壤呈弱碱性。若火星具备作物生长的条件,则适宜在火星上种植的是
选项 A B C D
作物 茶树 棉花 甘 草 水稻
适宜作物生长的pH 5.0~5.5 6.0~6.8 7.2~8.5 6.0~7.0
A.A B.B C.C D.D
13.下列有关溶液的酸碱性的说法中,正确的是
A.PH=0时,溶液呈中性
B.用湿润的PH试纸测定某盐酸的PH时,测定结果会偏低
C.PH越小,溶液的酸性越强
D.PH大于7的溶液一定是碱溶液
14.下列各组物质按酸、碱、单质、氧化物顺序排列的是
A.H2SO4 Na2O C CO B.Mg(OH)2 CuSO4 C CO2
C.KOH HNO3 O2 SO3 D.HCl NaOH O2 P2O5
15.现有氢氧化钠、稀硫酸、氯化钠溶液,若将它们一次鉴别出来,可选用的试剂是
A.氯化钡溶液 B.紫色石蕊试液
C.稀盐酸 D.碳酸钠溶液
16.规范的操作是实验成功的保证。下列实验操作正确的是
A.CO2验满
B.检查装置的气密性
C.滴加液体
D.测溶液pH
二、综合题(共6题)
17.中和反应是一类重要的化学反应,某同学利用图1装置研究稀硫酸于氢氧化钠溶液反应的过程,并用PH传感器和温度传感器测量反应过程中相关的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为______。
(2)仪器A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______((填“6”、“12”或“16”)。
(4)下列说法正确的是______。
A.图2中b点所示溶液中的溶质是Na2SO4和NaOH
B.图2中d点所示溶液中所含微粒有Na+、、H+
C.图2中c→d所示溶液中Na2SO4的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
(5)本实验中需要准备溶质质量分数为9.8%的稀硫酸250g,若用98%的浓硫酸来配制,需要浓硫酸______克,需加水______mL(水的密度为lg/mL)。
18.KMnO4可用作消毒剂、氧化剂、药物和分析化学试剂等.某小组为探究制备高锰酸钾的绿色化方案,设计了如下图所示的实验流程.
(资料):
①K2MnO4水溶液呈墨绿色,在水及酸性条件下会发生歧化反应,生成KMnO4和MnO2.
②在 K2CO3溶液中持续通入 CO2,会生成 KHCO3.
③室温时,K2CO3、KHCO3、KMnO4的溶解度分别为 111g、33.7g、6.36g.
(1)共熔时(加温加压),反应生成 K2MnO4和 H2O,反应的化学方程式是___________ .
(2)浸取前,需将共熔后所得的物质粉碎,目的是___________ .
(3)歧化反应的化学方程式是 2_____.判断歧化时K2MnO4完全反应的方法是:用璃棒蘸取溶液点在滤纸上,若观察到 ___________,表示反应已完全.当溶液 pH 为 10~11,停止通 CO2,若 CO2过多,可能造成的不良后果是__________.
(4)操作 1 的名称是_________________,在实验室完成此操作,需要用到的玻璃仪器有烧杯、玻璃棒 和________,玻璃棒的作用是___________ .
(5)“…”表示一系列操作,包含蒸发浓缩→__________ →过滤→洗涤→烘干.烘干时,温度不宜过高,原因是__________.此过程中,洗涤的目的是__________ .
(6)从经济角度考虑,实验中可循环使用的物质是__________ (填化学式 ).
(7)实验中,也可以加入醋酸(HAc)进行歧化,下图是歧化时 HAc 加入量与产物中 KMnO4含量的关系图.可以发现:当 HAc 加入量为__________ mL 时,产物的纯度较高.
(8)实验室中可用 KMnO4制取氧气.理论上 31.6g高锰酸钾完全分解可以制得多少克氧气.写出计算过程,计算结果精确到小数点后1 位)。____
19.(一) 下图所示为实验室中常见的气体制备和收集装置.
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是_____ (填字 母序号)。若用装置B制取二氧化碳,反应的原理是(用化学方程式表示)_____。
(2)实验室用H2O2溶液和MnO2制取氧气, 若选用C做发生装置,你认为选用C的优点是_____。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应从_____ (填“a”或“b”) 端通入:欲使用装置E.用排水法收集氧气,先将瓶中装满水,再将气体从_____ (填“a”或“b”) 端通入。
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置_____(填字母序号)。
(二)小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,井向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应:②氢氧化钠有剩余:③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
实验方法 可能观察到的现象 结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。 如果_____。 则盐酸过量
如果_____。 则盐酸与氢氧化钠恰好完全反应
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是_____。(填序号).
A 生锈的铁钉
B 碳酸钠粉末
C 硫酸钠粉末
D 氢氧化铜
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是_____(填序号)。
20.水、溶液与人们的生产生活密切相关请回答:
(1)如图所示电解水的实验中,试管a、b中产生气体的体积比约为 _____ ,该实验证明水是由 _____ 组成的。
(2)下列净化水的单一操作中,相对净化程度较高的是 _____ (填字母)。
A 静置沉淀 B 吸附沉淀 C 过滤 D 蒸馏
(3)测定某地下水的酸碱度,最简单的方法是使用 _____ 。
(4)下图是三种固体物质的溶解度曲线。根据溶解度曲线回答问题:
①物质c的溶解度随温度的升高而 _____ ;
②物质a的溶解度大于物质c的溶解度的温度范围 _____ ;
③℃时,用50g水配制物质a的饱和溶液,至少需要a物质 _____ g;
④将℃时三种物质的饱和溶液升温至℃(溶剂量不变),溶液中溶质质量分数不变的是 _____ 。
21.某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____;剩余固体A的成分是_____。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据_____。
22.二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O, K2MnO4易溶于水
(1)实验室加热高锰酸钾制氧气,反应的化学方程式为_____。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是____。
Ⅱ.用硫酸锰制备
(2)电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为_____,一段时间后溶液的pH将________(填“变大”、“变小”或“不变”)。
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:
请回答下列问题:
(3)“滤液”中溶质的主要成分是_________(填化学式)。
(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、_______和_________。
(5) MnO2与碳粉经下列三步反应制得纳米MnO2:
①②MnO+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有___________(填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:
(6)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式
(7) MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如上图所示。图中A点(300, 75.65)对应固体成分的化学式为____________。
参考答案
1.A
【详解】
A、物质发生缓慢氧化反应时没有发光的现象发生,说法错误,符合题意;
B、酚酞试液是酸碱指示剂,遇到碱性溶液变红色,说法正确,不符合题意;
C、单质是由一种元素组成的纯净物。同一种元素可以构成不同的单质,如金刚石和石墨都是碳元素的单质,说法正确,不符合题意;
D、分子是保持物质化学性质的最小粒子。由于分子构成不同,二氧化碳和一氧化碳具有不同的性质,说法正确,不符合题意。
故选A。
2.B
【详解】
A、厕所清洁剂pH=1,小于7,显酸性。
B、油烟净pH=13,大于7,显碱性。
C、肥皂的pH=10,大于7,显碱性。
D、牙膏的pH=8,大于7,显碱性。
根据当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,油烟净的pH最大,碱性最强。
故选B。
3.A
【详解】
pH值越小,酸性越强,故选A。
4.B
【详解】
A、用pH试纸测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值,不符合题意;
B、把金属颗粒放入试管时,应该把试管横放,把金属颗粒放入试管口后,再把试管慢慢的竖立起来,使金属颗粒缓缓的滑到试管底部,而用手扔会导致试管破裂,故此法错误,符合题意;
C、过滤应用玻璃棒引流,不符合题意;
D、量筒不能用作反应器,应在烧杯中溶解,不符合题意。
故选:B。
5.C
【详解】
题目中所给物质稀硫酸溶质属于酸,石灰水溶质属于碱,食盐水溶质属于盐。对应的酸碱性分别为酸性溶液、碱性溶液、中性溶液。
A.稀盐酸与石灰水反应,温度变高,与稀硫酸和食盐水反应无现象,无法分辨,A选项错误
B.铁与稀硫酸反应产生气泡,与石灰水、食盐水不反应,无法分辨,B选项错误
C.石蕊与酸性溶液反应显红色,碱性溶液反应呈蓝色,中性溶液不反应为原色紫色,可以分辨出题目中的三种物质,C选项正确
D.酚酞与石灰水反应呈红色,但酚酞对酸性和中性溶液均不显色,无法分辨稀硫酸和食盐水,D选项错误
故选C
6.C
【详解】
A、红磷、铁丝均是由同种元素组成的纯净物,属于单质;乙醇属于化合物,此选项不符合题意;
B、生石灰是氧化钙的俗称,属于氧化物;熟石灰是氢氧化钙的俗称,属于碱;石灰水由水、氢氧化钙两种物质组成,属于混合物,此选项不符合题意;
C、食醋是醋酸的水溶液,属于混合物;加碘食盐中含有氯化钠、碘酸钾,属于混合物;酱油中含有水、氯化钠等物质,属于混合物,此选项符合题意;
D、海水、糖水属于混合物,蒸馏水属于纯净物,此选项不符合题意。
故选C。
7.C
【详解】
①可燃性气体或固体粉尘,混有一定量的空气,遇到明火,达到爆炸极限,才会爆炸,错误;
②稀土被誉为“工业的维生素”,是不可再生资源,正确;
③原子的质量与其相对原子质量成正比,相对原子质量:镁小于铁,故等质量的镁、铁两种金属,镁所含的原子个数多,正确;
④用湿润的pH试纸测定溶液的pH,如果溶液显酸性,会使得pH偏大,如果溶液显碱性,会使pH偏小,如果溶液显中性,pH不变,错误;
⑤某物质的着火点为t℃,图中该物质燃烧得最旺的点是Q点,是因为Q点温度大于该物质的着火点,且氧气含量最高,正确。
故正确的个数是3个。
故选C。
8.A
【解析】
A、用肥皂水区分硬水和软水,硬水泡沫少,软水泡沫多,故A正确; B、用活性炭净化水不可以得到纯水,活性炭具有吸附性,可以吸附色素和异味,不可以吸附钙镁离子,故B错误;C、不可用酚酞试液区分二氧化碳气体和氯化氢气体,二氧化碳气体和氯化氢气体遇水形成碳酸和盐酸,酚酞试液均不变色,故C错误;D、用pH试纸测定溶液pH时,不应先用蒸馏水将试纸润湿,否则会影响测试效果,故D错误。
9.C
【详解】
A、区分硬水和软水的方法是:用肥皂水,加入肥皂水,泡沫多的是软水,泡沫少的是硬水,正确;
B、氧气能使带火星的木条复燃,二氧化碳不能,能用带火星的木条鉴别,正确;
C、氢氧化钡不能与氯化钙反应,氢氧化钡与稀盐酸反应生成水,无现象,无法鉴别,错误;
D、氢氧化钠溶液显碱性,氯化钠溶液显中性,pH试纸会出现不同的颜色,再与标准比色卡对照即可,正确;
故选:C。
10.D
【详解】
A、皮蛋有碱性,能与酸发生中和反应,食用时可加点醋中和,故选项说法正确;
B、pH<5.6的雨水称为酸雨,故选项说法正确;
C. 稀溶液不一定是不饱和溶液,如氢氧化钙的饱和溶液,溶质质量分数很小,故选项说法正确;
D、根据质量守恒定律,化学反应中元素不会无中生有,水不能变成油,故选项说法错误。
故选:D。
11.D
【详解】
A、铁丝在O2中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙,图中集气瓶的底部没有放少量的水或铺一层细沙,图中操作错误;B、加热高锰酸钾制氧气时,试管口应略向下倾斜,以防止冷凝水的倒流,图中操作错误;C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH。不能将pH试纸伸入待测液中,以免污染待测液,图中操作错误;D、氧气的密度比空气大,放置集满氧气的集气瓶时,瓶口应向上放置,且毛玻璃粗糙面朝下,图中操作正确。故选D。
12.C
【详解】
火星的土壤呈弱碱性。pH应大于7. pH<7,溶液呈弱酸性。则适宜在火星上种植的是C甘草。
13.C
【详解】
试题分析:PH=0时,溶液呈强酸性;用湿润的PH试纸测定某盐酸的PH时,测定结果会偏低,因为相当于将试液稀释,溶液的酸性降低,PH会增大;PH越小,溶液的酸性越强;PH大于7的溶液一定是碱性溶液,但不一定是碱。故选C.
14.D
【详解】
A、Na2O属于金属氧化物不属于碱,故A错误;
B、Mg(OH)2不属于酸,而属于碱,CuSO4也不是碱而属于盐,故B错误;
C、KOH不属于酸,而属于碱,HNO3也不是碱而属于酸,故C错误;
D、HCl属于酸,NaOH属于碱,O2属于单质,P2O5属于氧化物,故D正确;
故选D。
15.B
【解析】
A、氯化钡不与氢氧化钠溶液和氯化钠溶液反应,无现象;故不符合题意;
B、氢氧化钠,紫色石蕊试液溶液变蓝色;稀硫酸,紫色石蕊溶液变红色;氯化钠,溶液为紫色,故合题意;
C、稀盐酸与NaOH溶液反应无现象,与稀H2SO4、NaCl溶液不反应,故不符合题意;
D、碳酸钠溶液与氢氧化钠溶液和氯化钠溶液不反应,与稀硫酸反应,故不符合题意。
16.B
【详解】
A、二氧化碳验满:二氧化碳不燃烧,也不支持燃烧,应将燃着的木条放在集气瓶口,木条熄灭,说明已经集满,图中操作错误,不符合题意;
B、检查装置的气密性:将导管置于水中,用手紧握试管,观察导管口是否有气泡冒出,有气泡冒出,说明气密性良好,图中操作正确,符合题意;
C、胶头滴管加液时,既不能伸入容器,更不能接触容器,应垂直悬空于容器上方0.5cm处,图中操作错误,不符合题意;
D、测溶液的pH值:用洁净、干燥的玻璃棒蘸取待测液点在pH试纸上,观察颜色的变化,然后与标准比色卡对照,图中操作错误,不符合题意。
故选B。
17.2NaOH+H2SO4═Na2SO4+2H2O H2SO4 12 AD 25 225
【详解】
(1)稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,2NaOH+H2SO4═Na2SO4+2H2O。
(2)由图象可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,不断加入的是酸性溶液,使pH减小,故仪器A中溶液硫酸H2SO4。
(3)图3中V时,放出的热量最多,溶液恰好完全反应,pH=7,结合图2可知,图3中V的数值最接近12。
(4)A、b点溶液的pH大于7,溶液显碱性,b点所示溶液中的溶质是反应生成的Na2SO4和过量的NaOH,正确;
B、d点溶液的pH小于7,溶液显酸性,d点所示溶液中溶质是硫酸钠和过量的硫酸,溶液中所含微粒有Na+、、H+及溶剂水分子H2O,错误;
C、c→d,是完全反应后继续向溶液中滴加稀硫酸,溶液中Na2SO4的质量不变,错误;
D、e→f,温度逐渐升高,该变化趋势可说明该反应是放热反应,正确。
故选AD。
(5)设需要浓硫酸的质量为,根据溶液稀释前后溶质的质量不变,则250g×9.8%=×98%,=25g,需加水的质量为250g-25g=225g,水的密度为1g/mL,水的体积=225mL。
18. 增大接触面积,浸取更充分(加快浸取) 全是(只有)紫红色(或无墨绿色)痕迹 产物中会混有 (回答产物不纯不得分) 过滤 漏斗 引流 冷却热饱和溶液结晶(降温结晶) 防止高锰酸钾受热分解 除去产物中的碳酸钾等杂质(使产物更纯净) 35(30 ~ 40) 解:设可制得氧气的质量为 x
x = 3.2g
答:可制得 3.2g 氧气。
【详解】
(1)分析流程图可知,二氧化锰、氢氧化钾和氧气在加温加压的条件下,反应生成锰酸钾和水,反应的化学方程式为: ,故填:;
(2)浸取前,需将共熔后所得的物质粉碎,目的是增大接触面积,浸取更充分(加快浸取),故填:增大接触面积,浸取更充分(加快浸取);
(3)根据质量守恒定律可知,反应前后原子的种类和数目不变;设要求的物质的化学式为X,根据化学方程式分析,反应前钾、锰、氧、碳原子个数分别为6、3、16、2,反应后的生成物中钾、锰、氧、碳原子个数分别为2、3、10、0,根据反应前后原子种类、数目不变,则2 X分子中含有4个钾原子、6个氧原子和2个碳原子,则物质X的化学式为;当 (墨绿色)全部转化为(紫红色),即可判断歧化时 完全反应,方法是:用璃棒蘸取溶液点在滤纸上,若观察到全是(只有)紫红色(或无墨绿色)痕迹;当溶液 pH 为 10~11,停止通 ,若 过多会与水、碳酸钾共同作用生成碳酸氢钾,且结晶时,碳酸氢钾和高锰酸钾一起析出,导致产品纯度降低,故填:;全是(只有)紫红色(或无墨绿色)痕迹;产物中会混有 ;
(4)由操作 1后的滤液和滤渣可知,该操作是过滤,在实验室完成此操作,需要用到的玻璃仪器有烧杯、玻璃棒和漏斗,玻璃棒的作用是引流,故填:过滤;漏斗;引流;
(5)先蒸发使溶液达到一个较高的浓度,有利于提高高锰酸钾的产率,再冷却热饱和溶液结晶(降温结晶),是为了得到较纯晶体;烘干时,温度过高,高锰酸钾会受热分解生成锰酸钾、二氧化锰和氧气,这会降低高锰酸钾的产率;此过程中,洗涤的目的是除去产物中的碳酸钾等杂质(使产物更纯净);故填:冷却热饱和溶液结晶(降温结晶);防止高锰酸钾受热分解;除去产物中的碳酸钾等杂质(使产物更纯净);
(6)因二氧化锰不溶于水,在进行过滤操作时,滤渣上的固体便是固体,从经济角度考虑,实验中二氧化锰可循环使用,故填:;
(7)由图分析可知,当 HAc 加入量为35mL 时,高锰酸钾的纯度较高,故填:35;
(8)解:设可制得氧气的质量为 x
x = 3.2g
答:可制得 3.2g 氧气。
19.A 可以控制产生氧气的速率 a b F 观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余; 有气泡冒出 没有气体生成 C C
【详解】
(一)(1)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,应选用的发生装置是固体加热型的装置A;若用装置B制取二氧化碳,反应物是碳酸钙和稀盐酸,生成二氧化碳和水和氯化钙,反应的原理是(用化学方程式表示);
(2)实验室用H2O2溶液和MnO2制取氧气, 选用C做发生装置,利用注射器可以控制液体滴加的速度,从而控制反应产生氧气的速率,故优点是可以控制产生氧气的速率;
(3)欲使用装置E用排空气法收集二氧化碳,由于相同情况下二氧化碳密度比空气密度大,气体应长进短出,即从a端通入;欲使用装置E用排水法收集氧气,氧气密度比水小,先将瓶中装满水,再将气体从b端通入;
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中排水法收集装置F;
(二)(1)氢氧化钠能使酚酞变红色。向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;
(2)将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中,如果有气泡冒出,则盐酸过量;如果没有气体生成,则盐酸与氢氧化钠恰好完全反应;
(3)A、盐酸能与生锈的铁钉反应生成黄色溶液,可行;
B、碳酸钠粉末与盐酸反应能产生二氧化碳气体,可行;
C、硫酸钠粉末与盐酸不反应,不可行;
D、氢氧化铜与盐酸反应产生氯化铜和水,可行;故填:C;
(4)小红向氢氧化钠溶液中滴加一定量稀盐酸,反应开始时溶液的pH>7,随着酸的不断加人,pH不断减小,至恰好反应时pH=7,若继续滴加稀盐酸,则pH<7,根据题意反应后从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化,说明氢氧化钠无剩余,则pH应从大于7变化到等于7进而小于7,观察图像,只有C符合,故填C。
20.2∶1 氢元素和氧元素 D pH试纸 减小 大于t1℃ 25 ab
【详解】
(1)在电解水实验中,和负极相连的试管生成的气体较多,是氢气,和电源正极相连的试管生成的气体较少是氧气,氢气和氧气的体积比约为2∶1,所以试管a、b中产生气体的体积比约为2∶1;水电解生成氢气和氧气,氢气是由氢元素组成的,氧气是由氧元素组成的,该实验证明水是由氢元素和氧元素组成的;
(2)在静置沉淀、吸附、沉淀、过滤和蒸馏四种净化水的方法中,单一操作净化程度最高的是蒸馏;
(3)测定某地下水的酸碱度,最简单的方法是使用pH试纸测定;
(4)
①根据溶解度曲线可知,物质c的溶解度随温度的升高而减小;
②由溶解度曲线可知,温度低于t1℃时,物质a的溶解度小于物质c的溶解度,温度等于t1℃时,物质a、c的溶解度相等,温度高于t1℃时物质a的溶解度大于物质c的溶解度,则温度范围为>t1℃;
③t2℃时,a物质的溶解度为50g,即该温度下100g水中最多溶解50g的a物质就达到饱和状态,则t2℃时,50g水最多溶解25g物质a,所以用50g水配制物质a的饱和溶液,至少需要a物质25g;
④t1℃时,三种物质的溶解度大小是b>a=c,此时饱和溶液的质量分数大小是b>a=c,当升高温度至t2℃时,a、b两种物质的溶解度都升高,溶液变为不饱和溶液,溶质质量分数均保持不变,而c物质的溶解度随温度升高而减小,即c溶液中有晶体析出,溶质质量分数减小,所以溶液中溶质质量分数不变的是ab。
21.0.1mol 将导管从石灰水中取出 Ca(OH)2 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaO、CaCO3 称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g
(1)设10g碳酸钙完全分解生成二氧化碳的质量为x
故10g碳酸钙完全分解生成二氧化碳的物质的量为
(2)加热一段时间后欲停止实验,为防止水倒吸,应先将导管从石灰水中取出。
(3)对加热后的剩余固体A进行实验,氧化钙和水反应生成氢氧化钙,滤液B滴加无色酚酞溶液变红,说明溶液显碱性,故滤液B的溶质是氢氧化钙(Ca(OH)2);步骤Ⅲ中生成气体的反应是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑;滤液B的溶质是氢氧化钙,剩余固体A加入水,生成滤液B和白色固体C,碳酸钙不溶于水,说明A中含有碳酸钙和氧化钙,故剩余固体A的成分是氧化钙和碳酸钙(CaO、CaCO3)。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分的过程:称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g
【详解】
(1)根据高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气解答;根据稀硫酸能与锰酸钾反应生成二氧化锰解答;(2)根据硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰解答;(3)根据题中信息分析解答;(4)根据过滤操作需要用到的仪器解答;(5)根据反应的化学方程式分析解答;(6)根据氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰解答;(7)根据图中信息计算解答。(1)高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;根据信息提示“3K2MnO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+H2O”,将反应后的固体剩余物(锰酸钾和二氧化锰的混合物)用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,使锰酸钾转化得到二氧化锰,获得更多的二氧化锰,所以用稀硫酸而不用水浸取;;(2)硫酸锰溶液在通电的条件下分解生成氢气、硫酸和二氧化锰,反应的化学方程式为2H2O+MnSO4H2↑+H2SO4+MnO2↓,由于水越来越少,硫酸越来越多,也就是酸的质量分数变大,所以酸性越来越强,而pH越来越小,所以一段时间后溶液的pH将变小;(3)滤液中存在可溶性物质,而废旧锂电池正极材料和氢氧化钠溶液反应,根据信息“2Al+2NaOH+2H2O═2NaAlO2+3H2↑”,可知生成了偏铝酸钠,所以溶质的主要成分是NaAlO2;(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和玻璃棒;(5)MnO2与碳粉经下列三步反应制得纳米MnO2:①2MnO2+C2MnO+CO2↑,有单质参与反应,所以有化合价改变;②MnO+H2SO4═MnSO4+H2O,为复分解反应,无化合价改变;③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4,硫酸锰中的锰元素有+2变化+4价,而高锰酸钾中的锰元素由+7价变为+4价,所以有化合价的改变,故选①③;(6)氧气与碳酸锰在一定温度下反应生成二氧化碳和二氧化锰,反应的化学方程式为 O2+2MnCO32CO2+2MnO2;(7)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示,样品100g在图中A点对应固体的质量为75.65g,而过程中锰元素的质量不变,100g碳酸锰中锰元素的质量为100g×,则A点物质含氧元素的质量为75.65g-100g×,在固体中锰原子和氧原子个数比为:=1:2则固体成分的化学式为MnO2。
