2022年京改版九年级化学-第9章溶液检测题(word版有答案)
文档属性
| 名称 | 2022年京改版九年级化学-第9章溶液检测题(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 193.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-07 15:35:55 | ||
图片预览

文档简介
第9章《溶液》检测题
一、单选题
1.化学与生产、生活息息相关。下列说法不正确的是
A.蔗糖加入到水中,充分搅拌后,形成均一、稳定的溶液
B.洗洁精有乳化作用,可用来清洗油污
C.电解水生成氢气和氧气的体积比为2:1
D.利用活性炭对自来水进行杀菌消毒
2.下列有关物质的除杂、分离、提纯的方法正确的是
A.除去NaCl溶液中混有的少量CaCl2:加入过量的Na2CO3溶液,过滤
B.除去KCl固体中混有的少量MnO2:加水溶解、过滤、烘干
C.除去CO2中混有的少量CO:将气体依次通过足量的浓NaOH溶液、浓硫酸
D.除去KNO3固体中混有的少量KCl:冷却热饱和溶液,过滤,烘干
3.下列物质放入水中搅排后能形成溶液的是
A.白糖 B.植物油 C.面粉 D.牛奶
4.水是生命之源。下列有关水的说法正确的是
A.生活中常用煮沸的方法降低水的硬度 B.冰水共存物属于溶液
C.电解水的实验中,电源正极产生氢气 D.水变燃油可以实现
5.下列实验操作不能达到实验目的的是
选项 物质 目的 主要实验操作
A 铜粉中混有少量炭粉 除杂 在空气中灼烧
B NaCl和NH4NO3固体 鉴别 取样,分别加适量水溶解
C CO中是否混有CH4 检验 点燃,火焰上方罩干冷烧杯
D KCl和MnO2固体 分离 溶解、过滤、洗涤、干燥、蒸发
A.A B.B C.C D.D
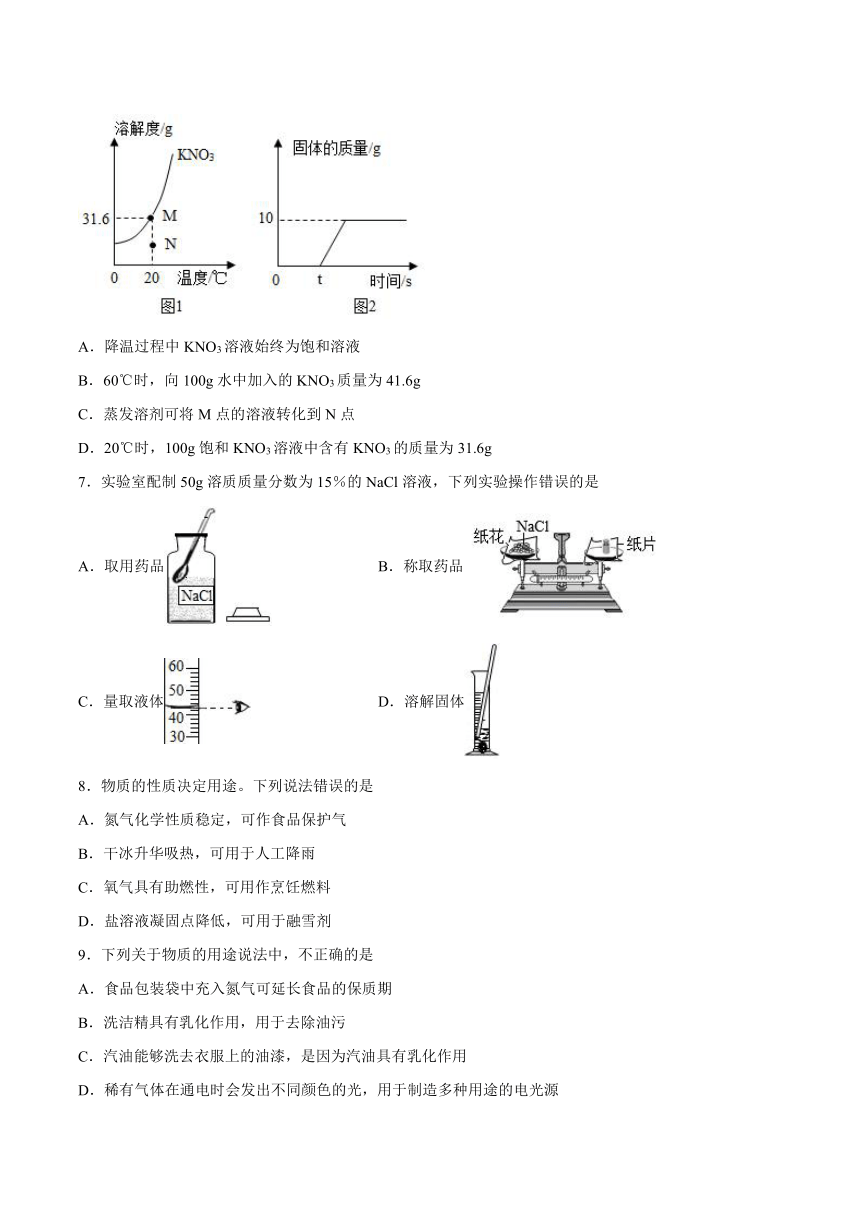
6.图甲是KNO3的溶解度曲线图:图乙是60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃时析出固体质量的变化示意图。下列说法正确的是
A.降温过程中KNO3溶液始终为饱和溶液
B.60℃时,向100g水中加入的KNO3质量为41.6g
C.蒸发溶剂可将M点的溶液转化到N点
D.20℃时,100g饱和KNO3溶液中含有KNO3的质量为31.6g
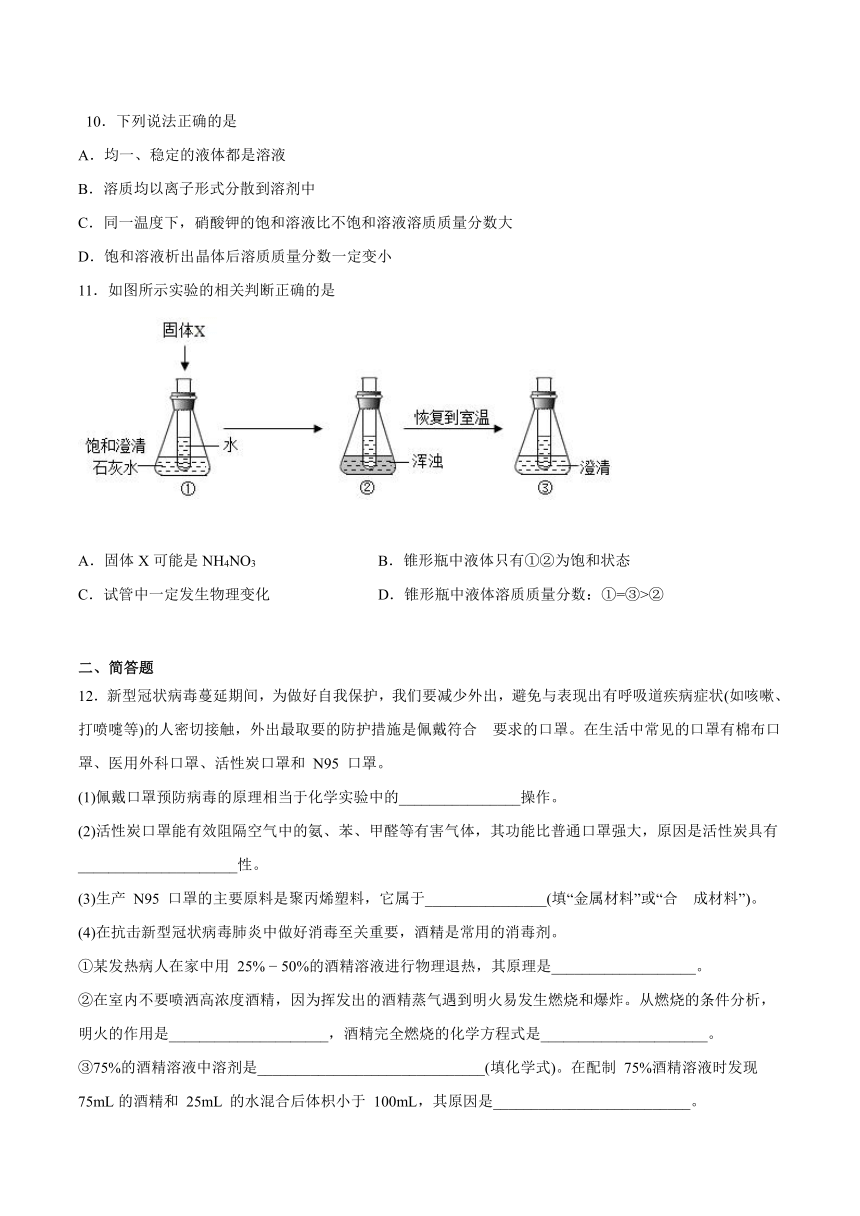
7.实验室配制50g溶质质量分数为15%的NaCl溶液,下列实验操作错误的是
A.取用药品 B.称取药品
C.量取液体 D.溶解固体
8.物质的性质决定用途。下列说法错误的是
A.氮气化学性质稳定,可作食品保护气
B.干冰升华吸热,可用于人工降雨
C.氧气具有助燃性,可用作烹饪燃料
D.盐溶液凝固点降低,可用于融雪剂
9.下列关于物质的用途说法中,不正确的是
A.食品包装袋中充入氮气可延长食品的保质期
B.洗洁精具有乳化作用,用于去除油污
C.汽油能够洗去衣服上的油漆,是因为汽油具有乳化作用
D.稀有气体在通电时会发出不同颜色的光,用于制造多种用途的电光源
10.下列说法正确的是
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液溶质质量分数大
D.饱和溶液析出晶体后溶质质量分数一定变小
11.如图所示实验的相关判断正确的是
A.固体X可能是NH4NO3 B.锥形瓶中液体只有①②为饱和状态
C.试管中一定发生物理变化 D.锥形瓶中液体溶质质量分数:①=③>②
二、简答题
12.新型冠状病毒蔓延期间,为做好自我保护,我们要减少外出,避免与表现出有呼吸道疾病症状(如咳嗽、打喷嚏等)的人密切接触,外出最取要的防护措施是佩戴符合 要求的口罩。在生活中常见的口罩有棉布口罩、医用外科口罩、活性炭口罩和 N95 口罩。
(1)佩戴口罩预防病毒的原理相当于化学实验中的________________操作。
(2)活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害气体,其功能比普通口罩强大,原因是活性炭具有_____________________性。
(3)生产 N95 口罩的主要原料是聚丙烯塑料,它属于________________(填“金属材料”或“合 成材料”)。
(4)在抗击新型冠状病毒肺炎中做好消毒至关重要,酒精是常用的消毒剂。
①某发热病人在家中用 25% 50%的酒精溶液进行物理退热,其原理是___________________。
②在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧和爆炸。从燃烧的条件分析,明火的作用是_____________________,酒精完全燃烧的化学方程式是______________________。
③75%的酒精溶液中溶剂是______________________________(填化学式)。在配制 75%酒精溶液时发现 75mL的酒精和 25mL 的水混合后体枳小于 100mL,其原因是__________________________。
三、推断题
13.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)若A在完全燃烧和不完全燃烧时,生成不同的气体。则A完全燃烧时反应的化学方程式为 ___________________________ ,该反应属于基本反应类型中的 _____________ 反应。
(2)B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是(用化学式表示),D物质的一种用途是 _____________ 。
(3)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。
则E的化学式可能为 _____________ ,产生此现象的原因是 _____________ 。
14.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
15.学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,配制150g质量分数为10%的氢氧化钠溶液的操作过程如下:
(1)用上述图示序号表示配制该溶液的正确操作顺序________。
(2)图①中玻璃棒搅拌的目的是___________。
(3)配制过程中需称取_________g氢氧化钠固体。
(4)经检验,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填字母)。
A.用量筒量取水时俯视读数 B.配制溶液的烧杯用少量蒸馏水润洗
C.氢氧化钠固体不纯 D.转移已配好的溶液时,有少量溶液溅出
(5)用上述配制好的氢氧化钠溶液(密度约为1.1g/cm3)配制50g溶质质量分数为3%的氢氧化钠溶液,需要量取10%的氢氧化钠溶液_________mL(结果精确到0.1)。
16.根据如图所示实验回答问题。
(1)甲是探究物质燃烧条件的实验。根据乒乓球碎片燃烧时滤纸碎片未燃烧,得出物质燃烧条件的结论是_______。
(2)用图乙装置验证燃烧的条件。将两小块白磷固定在U形管底部基座上,分别加入等体积冷水和热水,白磷均不燃烧(白磷的着火点为40℃);一段时间后,将装置倒置。能证明甲实验结论的现象是____。
(3)丙是探究物质的溶解性与溶质和溶剂种类有关的实验。
①X为_______,C中加入碘的质量为_______。
②若要得出“不同溶质在同一种溶剂中的溶解性不同”的结论,所依据的实验是_______(填字母)。已知20℃时NaCl的溶解度为36g。则A烧杯中所得的NaCl溶液为_____(选填“饱和”或“不饱和”)溶液。
17.如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则需要量取水的体积是__________mL(水的密度为1g/mL).
(2)若实验所得的溶液溶质质量分数偏小,其原因可能是
A.称量时砝码端忘垫质量相同的纸片 B.量取水时,俯视读数
C.溶解的烧杯残留有湿润的水 D.装瓶时,有少量溶液洒出
五、计算题
18.某年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取24g“石头纸”样品(杂质不溶于水也不与稀盐酸反应)。向其中逐渐加入100g稀盐酸,所用稀盐酸的质量与剩余固体的质量关系如图所示,请根据图中的数据进行计算。
(1)“石头纸”样品中碳酸钙的质量为_____g;
(2)样品与100g稀盐酸充分反应后产生二氧化碳的质量为多少?
(3)计算所用稀盐酸中溶质的质量分数。(请根据化学方程式写出完整的计算步骤)
19.将10.0g含NaHCO384.0%的样品与67.0g稀硫酸放入同一烧杯中混盘(杂质不溶于水,也不参与反应),二者恰好完全反应,请计算:
(已知:H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑)
(1)样品中NaHCO3的质量_____;
(2)反应后所得溶液的溶质质量分数______。
20.石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用25 g石灰石样品,把125 g稀盐酸分5次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
次数 1 2 3 4 5
稀盐酸的用量 25g 25g 25g 25g 25g
剩余固体的质量 20 15 g 10 g 5 g 5 g
(1)该石灰石样品中碳酸钙的质量分数是______;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
参考答案
1.D 2.D 3.A 4.A 5.A 6.B 7.D 8.C 9.C 10.C 11.D
12.过滤 吸附 合成材料 酒精挥发需要吸收热量,带走一部分热量,使人体温度降低 给可燃物提供温度,使可燃物温度达到着火点 C2H6O + 3O22CO2 +3H2O H2O 分子之间有间隔
13.C+O2CO2;化合反应 H2O2;潜水(答案合理给分) NaOH(或CaO); 溶于水或与水反应放出热量,F溶液温度升高; 氢氧化钙的溶解度随温度的升高而降低,有固体析出。
14.CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
15.
(1)④③②①
(2)加快氢氧化钠固体的溶解速率
(3)15
(4)BC
(5)13.6
16.
(1)温度达到可燃物的着火点
(2)热水一端白磷燃烧,产生大量白烟
(3) 水2O 2g AC 不饱和
17.
(1)163.8
(2)AC
18.
(1)20
(2)解:设样品与100g稀盐酸充分反应后产生二氧化碳的质量为x
x=8.8g
答:样品与100g稀盐酸充分反应后产生二氧化碳的质量为8.8g
(3)解:设所用稀盐酸中溶质的质量分数为y
y=18.25%
答:所用稀盐酸中溶质的质量分数为18.25%
19.
(1)8.4g
(2)解:设反应生成的Na2SO4的质量为,CO2的质量为
所以反应后所得溶液的质量=8.4g+67g-4.4g=71g
反应后所得溶液的溶质质量分数
答:反应后所得溶液的溶质质量分数为10%。
20.
(1)80%
(2)由表中数据可知,加入25g稀盐酸,消耗碳酸钙的质量为:25g-20g=5g。
解:设该稀盐酸的溶质质量分数是x
x=14.6%
答:该稀盐酸的溶质质量分数是14.6%
一、单选题
1.化学与生产、生活息息相关。下列说法不正确的是
A.蔗糖加入到水中,充分搅拌后,形成均一、稳定的溶液
B.洗洁精有乳化作用,可用来清洗油污
C.电解水生成氢气和氧气的体积比为2:1
D.利用活性炭对自来水进行杀菌消毒
2.下列有关物质的除杂、分离、提纯的方法正确的是
A.除去NaCl溶液中混有的少量CaCl2:加入过量的Na2CO3溶液,过滤
B.除去KCl固体中混有的少量MnO2:加水溶解、过滤、烘干
C.除去CO2中混有的少量CO:将气体依次通过足量的浓NaOH溶液、浓硫酸
D.除去KNO3固体中混有的少量KCl:冷却热饱和溶液,过滤,烘干
3.下列物质放入水中搅排后能形成溶液的是
A.白糖 B.植物油 C.面粉 D.牛奶
4.水是生命之源。下列有关水的说法正确的是
A.生活中常用煮沸的方法降低水的硬度 B.冰水共存物属于溶液
C.电解水的实验中,电源正极产生氢气 D.水变燃油可以实现
5.下列实验操作不能达到实验目的的是
选项 物质 目的 主要实验操作
A 铜粉中混有少量炭粉 除杂 在空气中灼烧
B NaCl和NH4NO3固体 鉴别 取样,分别加适量水溶解
C CO中是否混有CH4 检验 点燃,火焰上方罩干冷烧杯
D KCl和MnO2固体 分离 溶解、过滤、洗涤、干燥、蒸发
A.A B.B C.C D.D
6.图甲是KNO3的溶解度曲线图:图乙是60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃时析出固体质量的变化示意图。下列说法正确的是
A.降温过程中KNO3溶液始终为饱和溶液
B.60℃时,向100g水中加入的KNO3质量为41.6g
C.蒸发溶剂可将M点的溶液转化到N点
D.20℃时,100g饱和KNO3溶液中含有KNO3的质量为31.6g
7.实验室配制50g溶质质量分数为15%的NaCl溶液,下列实验操作错误的是
A.取用药品 B.称取药品
C.量取液体 D.溶解固体
8.物质的性质决定用途。下列说法错误的是
A.氮气化学性质稳定,可作食品保护气
B.干冰升华吸热,可用于人工降雨
C.氧气具有助燃性,可用作烹饪燃料
D.盐溶液凝固点降低,可用于融雪剂
9.下列关于物质的用途说法中,不正确的是
A.食品包装袋中充入氮气可延长食品的保质期
B.洗洁精具有乳化作用,用于去除油污
C.汽油能够洗去衣服上的油漆,是因为汽油具有乳化作用
D.稀有气体在通电时会发出不同颜色的光,用于制造多种用途的电光源
10.下列说法正确的是
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液溶质质量分数大
D.饱和溶液析出晶体后溶质质量分数一定变小
11.如图所示实验的相关判断正确的是
A.固体X可能是NH4NO3 B.锥形瓶中液体只有①②为饱和状态
C.试管中一定发生物理变化 D.锥形瓶中液体溶质质量分数:①=③>②
二、简答题
12.新型冠状病毒蔓延期间,为做好自我保护,我们要减少外出,避免与表现出有呼吸道疾病症状(如咳嗽、打喷嚏等)的人密切接触,外出最取要的防护措施是佩戴符合 要求的口罩。在生活中常见的口罩有棉布口罩、医用外科口罩、活性炭口罩和 N95 口罩。
(1)佩戴口罩预防病毒的原理相当于化学实验中的________________操作。
(2)活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害气体,其功能比普通口罩强大,原因是活性炭具有_____________________性。
(3)生产 N95 口罩的主要原料是聚丙烯塑料,它属于________________(填“金属材料”或“合 成材料”)。
(4)在抗击新型冠状病毒肺炎中做好消毒至关重要,酒精是常用的消毒剂。
①某发热病人在家中用 25% 50%的酒精溶液进行物理退热,其原理是___________________。
②在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧和爆炸。从燃烧的条件分析,明火的作用是_____________________,酒精完全燃烧的化学方程式是______________________。
③75%的酒精溶液中溶剂是______________________________(填化学式)。在配制 75%酒精溶液时发现 75mL的酒精和 25mL 的水混合后体枳小于 100mL,其原因是__________________________。
三、推断题
13.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)若A在完全燃烧和不完全燃烧时,生成不同的气体。则A完全燃烧时反应的化学方程式为 ___________________________ ,该反应属于基本反应类型中的 _____________ 反应。
(2)B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是(用化学式表示),D物质的一种用途是 _____________ 。
(3)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。
则E的化学式可能为 _____________ ,产生此现象的原因是 _____________ 。
14.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
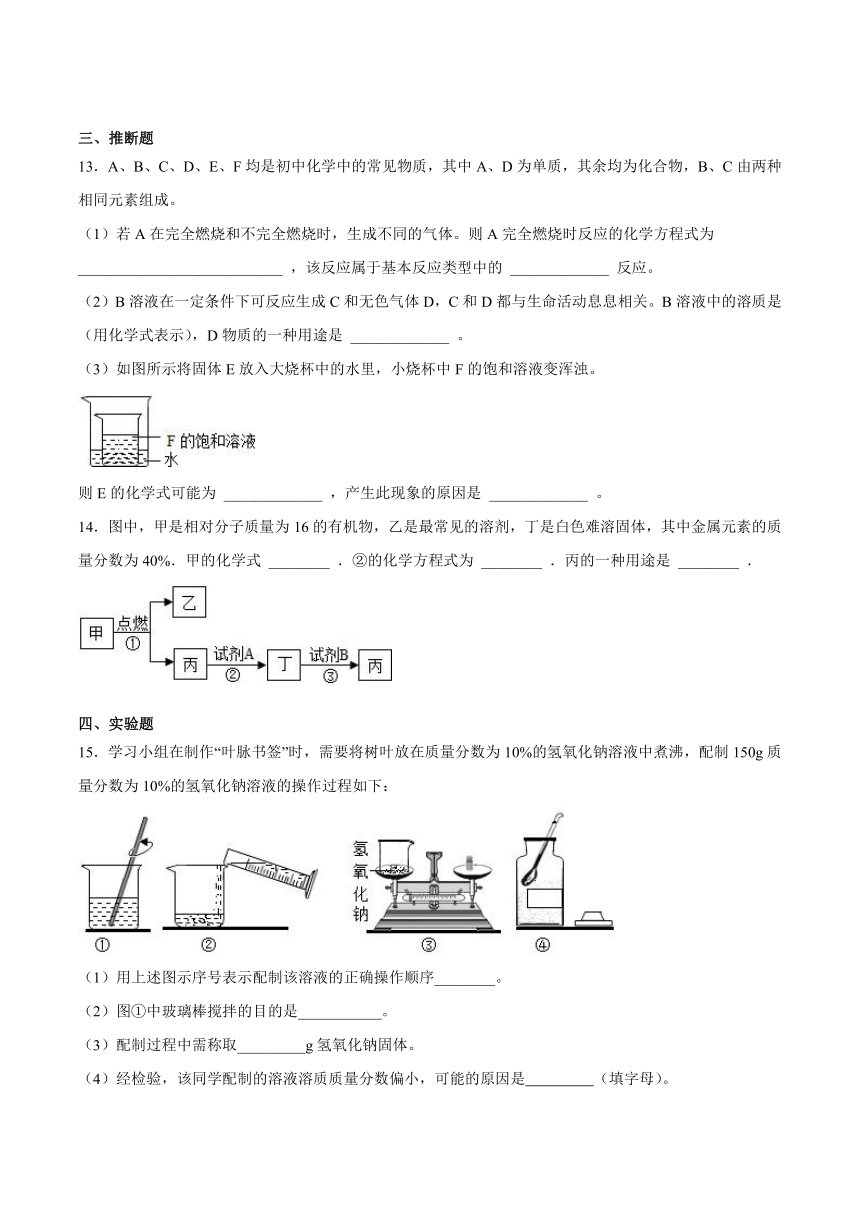
15.学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,配制150g质量分数为10%的氢氧化钠溶液的操作过程如下:
(1)用上述图示序号表示配制该溶液的正确操作顺序________。
(2)图①中玻璃棒搅拌的目的是___________。
(3)配制过程中需称取_________g氢氧化钠固体。
(4)经检验,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填字母)。
A.用量筒量取水时俯视读数 B.配制溶液的烧杯用少量蒸馏水润洗
C.氢氧化钠固体不纯 D.转移已配好的溶液时,有少量溶液溅出
(5)用上述配制好的氢氧化钠溶液(密度约为1.1g/cm3)配制50g溶质质量分数为3%的氢氧化钠溶液,需要量取10%的氢氧化钠溶液_________mL(结果精确到0.1)。
16.根据如图所示实验回答问题。
(1)甲是探究物质燃烧条件的实验。根据乒乓球碎片燃烧时滤纸碎片未燃烧,得出物质燃烧条件的结论是_______。
(2)用图乙装置验证燃烧的条件。将两小块白磷固定在U形管底部基座上,分别加入等体积冷水和热水,白磷均不燃烧(白磷的着火点为40℃);一段时间后,将装置倒置。能证明甲实验结论的现象是____。
(3)丙是探究物质的溶解性与溶质和溶剂种类有关的实验。
①X为_______,C中加入碘的质量为_______。
②若要得出“不同溶质在同一种溶剂中的溶解性不同”的结论,所依据的实验是_______(填字母)。已知20℃时NaCl的溶解度为36g。则A烧杯中所得的NaCl溶液为_____(选填“饱和”或“不饱和”)溶液。
17.如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则需要量取水的体积是__________mL(水的密度为1g/mL).
(2)若实验所得的溶液溶质质量分数偏小,其原因可能是
A.称量时砝码端忘垫质量相同的纸片 B.量取水时,俯视读数
C.溶解的烧杯残留有湿润的水 D.装瓶时,有少量溶液洒出
五、计算题
18.某年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取24g“石头纸”样品(杂质不溶于水也不与稀盐酸反应)。向其中逐渐加入100g稀盐酸,所用稀盐酸的质量与剩余固体的质量关系如图所示,请根据图中的数据进行计算。
(1)“石头纸”样品中碳酸钙的质量为_____g;
(2)样品与100g稀盐酸充分反应后产生二氧化碳的质量为多少?
(3)计算所用稀盐酸中溶质的质量分数。(请根据化学方程式写出完整的计算步骤)
19.将10.0g含NaHCO384.0%的样品与67.0g稀硫酸放入同一烧杯中混盘(杂质不溶于水,也不参与反应),二者恰好完全反应,请计算:
(已知:H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑)
(1)样品中NaHCO3的质量_____;
(2)反应后所得溶液的溶质质量分数______。
20.石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用25 g石灰石样品,把125 g稀盐酸分5次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
次数 1 2 3 4 5
稀盐酸的用量 25g 25g 25g 25g 25g
剩余固体的质量 20 15 g 10 g 5 g 5 g
(1)该石灰石样品中碳酸钙的质量分数是______;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
参考答案
1.D 2.D 3.A 4.A 5.A 6.B 7.D 8.C 9.C 10.C 11.D
12.过滤 吸附 合成材料 酒精挥发需要吸收热量,带走一部分热量,使人体温度降低 给可燃物提供温度,使可燃物温度达到着火点 C2H6O + 3O22CO2 +3H2O H2O 分子之间有间隔
13.C+O2CO2;化合反应 H2O2;潜水(答案合理给分) NaOH(或CaO); 溶于水或与水反应放出热量,F溶液温度升高; 氢氧化钙的溶解度随温度的升高而降低,有固体析出。
14.CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
15.
(1)④③②①
(2)加快氢氧化钠固体的溶解速率
(3)15
(4)BC
(5)13.6
16.
(1)温度达到可燃物的着火点
(2)热水一端白磷燃烧,产生大量白烟
(3) 水2O 2g AC 不饱和
17.
(1)163.8
(2)AC
18.
(1)20
(2)解:设样品与100g稀盐酸充分反应后产生二氧化碳的质量为x
x=8.8g
答:样品与100g稀盐酸充分反应后产生二氧化碳的质量为8.8g
(3)解:设所用稀盐酸中溶质的质量分数为y
y=18.25%
答:所用稀盐酸中溶质的质量分数为18.25%
19.
(1)8.4g
(2)解:设反应生成的Na2SO4的质量为,CO2的质量为
所以反应后所得溶液的质量=8.4g+67g-4.4g=71g
反应后所得溶液的溶质质量分数
答:反应后所得溶液的溶质质量分数为10%。
20.
(1)80%
(2)由表中数据可知,加入25g稀盐酸,消耗碳酸钙的质量为:25g-20g=5g。
解:设该稀盐酸的溶质质量分数是x
x=14.6%
答:该稀盐酸的溶质质量分数是14.6%
