2022年京改版九年级化学下册-第11章酸与碱检测题(word版有答案)
文档属性
| 名称 | 2022年京改版九年级化学下册-第11章酸与碱检测题(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 136.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-07 00:00:00 | ||
图片预览


文档简介
第11章《酸与碱》检测题
一、单选题
1.下列区别各组物质的实验方案中,可行的是
A.通过观察颜色来区别硬水和软水 B.用燃着的木条区别N2、O2、CO2
C.用澄清石灰水区别CO和H2 D.用蒸馏水区别碳酸钙粉末和氯化钙粉末
2.“三星堆”遗址是目前我国已知年代最为久远的先秦时代古遗址,三星堆“青铜器”出土后震惊了全世界。青铜器最初制作完成后的初始颜色呈黄色、金色,由于长时间理藏氧化生锈,变成了今天我们看到的青绿色。青绿色物质中含有“碱式碳酸铜”(Cu2(OH)2CO3),为了研究碱式碳酸铜的元素组成同学们设计了如图实验,关于该实验下列说法不正确的是
A.根据试管口有小水珠可以说明碱式碳酸铜中一定含有氢元素
B.根据澄清石灰水变浑浊可以说明碱式碳酸铜中一定含有碳元素
C.试管中剩余的黑色固体一定为炭粉和氧化铜的混合物
D.要确定试管中剩余黑色固体的成分,可以在黑色固体中加足量稀硫酸观察现象
3.下列溶液的pH最小的是
A.使石蕊试液显蓝色的溶液 B.使石蕊试液显红色的溶液
C.使石蕊试液显紫色的溶液 D.使酚酞试液显红色的溶液
4.水是生命之源,下列“水”可以使石蕊溶液变红的是
A.蒸馏水 B.糖水 C.氨水 D.柠檬水
5.下列某同学记录的实验现象中,正确的是
A.氢氧化钠固体溶于水吸收热量,使溶液温度降低
B.向“铜绿”中加入足量稀盐酸,固体逐渐消失
C.碳酸氢铵分解,产生氨气、二氧化碳气体
D.镁带燃烧发出耀眼红光,冒浓厚白烟
6.下列物质露置在空气中,一段时间后,因发生化学变化而质量增加的是
A.氧化钙 B.浓硫酸 C.浓盐酸 D.浓氨水
7.下列物质的用途主要由物理性质决定的是
A.氮气用作保护气 B.稀有气体作电光源
C.生石灰用作干燥剂 D.酒精用作然料
8.对于下列实验操作的说法,错误的是
A.制取气体前先要检查装置的气密性 B.测溶液的pH之前先要把试纸湿润
C.加热试管时,局部加热前先均匀加热 D.点燃可燃性气体前先要检验气体的纯度
9.下列物质的用途中,利用了物质的物理性质的是
A.活性炭吸附 B.氮气做保护气 C.酒精做燃料 D.生石灰做干燥剂
10.20gKOH加入100g水中,配制成溶液。下列说法错误的是
A.该溶液的溶质质量分数为20% B.KOH在水中解离出K+和OH-
C.一个K+带一个单位正电荷 D.向该溶液中滴入无色酚酞试液,试液变红
11.下列各组物质中,前者是纯净物,后者是混合物的是
A.干冰 冰水混合物 B.火碱 清新的空气
C.盐酸 四氧化三铁 D.硬水 澄清石灰水
12.根据下图实验,说法正确的是
A.品红的扩散速度相同
B.浓氨水变红
C.浓氨水有很强的挥发性
D.分子运动速率与温度无关
二、简答题
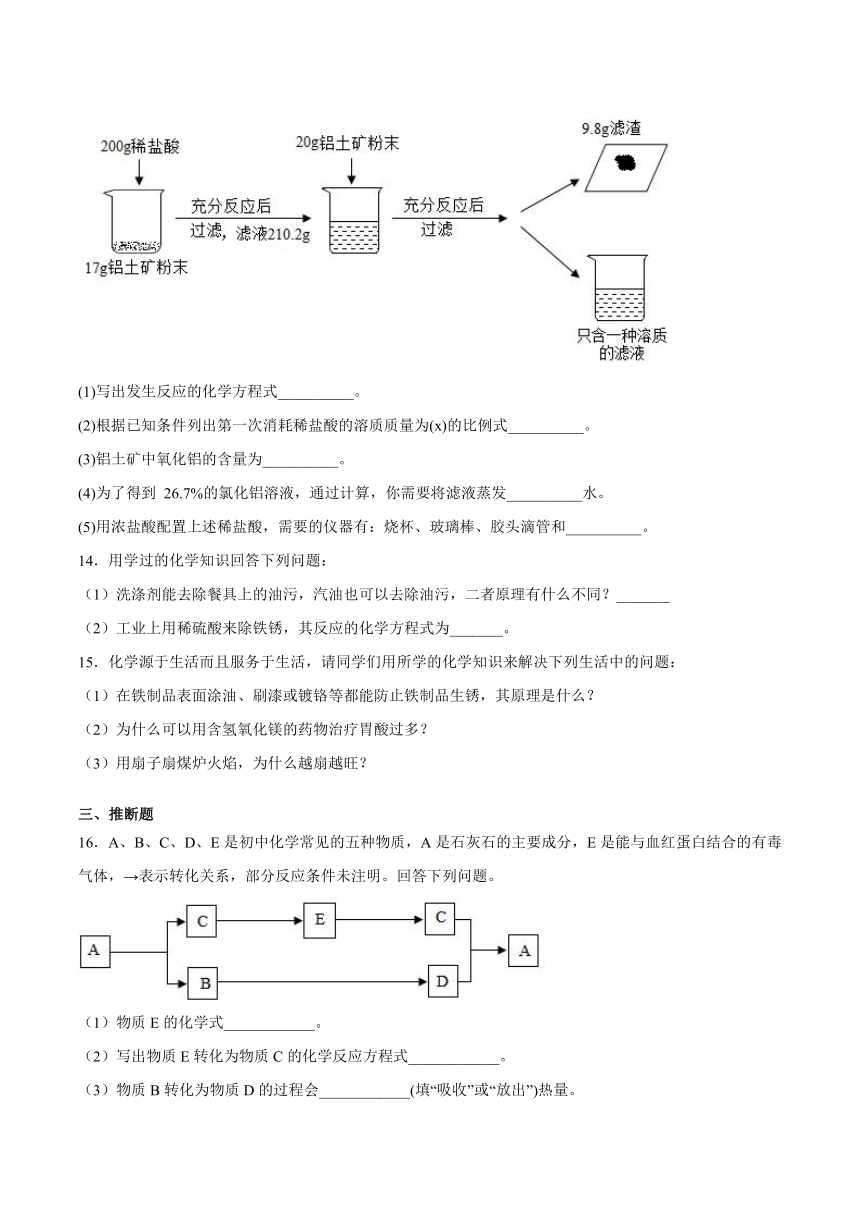
13.某工厂欲测定铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
(1)写出发生反应的化学方程式__________。
(2)根据已知条件列出第一次消耗稀盐酸的溶质质量为(x)的比例式__________。
(3)铝土矿中氧化铝的含量为__________。
(4)为了得到 26.7%的氯化铝溶液,通过计算,你需要将滤液蒸发__________水。
(5)用浓盐酸配置上述稀盐酸,需要的仪器有:烧杯、玻璃棒、胶头滴管和__________。
14.用学过的化学知识回答下列问题:
(1)洗涤剂能去除餐具上的油污,汽油也可以去除油污,二者原理有什么不同?_______
(2)工业上用稀硫酸来除铁锈,其反应的化学方程式为_______。
15.化学源于生活而且服务于生活,请同学们用所学的化学知识来解决下列生活中的问题:
(1)在铁制品表面涂油、刷漆或镀铬等都能防止铁制品生锈,其原理是什么?
(2)为什么可以用含氢氧化镁的药物治疗胃酸过多?
(3)用扇子扇煤炉火焰,为什么越扇越旺?
三、推断题
16.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题。
(1)物质E的化学式____________。
(2)写出物质E转化为物质C的化学反应方程式____________。
(3)物质B转化为物质D的过程会____________(填“吸收”或“放出”)热量。
17.A-E是初中化学常见的五种不同类别的物质,其中B由两种元素组成,C常用作食品干燥剂,并且C、D、E含有一种相同的金属元素,它们之间的转化关系如图所示(图中“一”表示两端的物质间能反应,“→”表示物质间存在转化关系,部分反应物、生成物和反应条件已略去)。请回答:
(1)物质C的化学式:___________。
(2)物质D俗称为___________(写一个);
(3)图中涉及的基本反应类型有___________个。
(4)反应“B-E”的化学方程式是___________。
18.A、B、C、D是四种常见物质。四种物质间的反应如图所示(“—”表示相连物质能发生化学反应,“→”表示物质间能一步转化,部分反应物、生成物和反应条件略去)。
(1)若A、B、C、D分别是酸、碱、盐和单质中的一种,且B与D反应产生蓝色沉淀。则:
①C→B的化学方程式:___________;
②B—D的化学方程式___________;
③写出A的化学式___________。
(2)若A、C为黑色固体,B、D为无色气体。则:
①A—C的化学方程式:___________;
②D的化学式___________。
四、实验题
19.请根据如图所示实验,回答下列问题。
(1)实验一是稀释浓硫酸的错误操作,该错误操造成的后果是_____________。
(2)实验二是蒸发食盐水的实验,蒸发时用玻璃棒不断搅拌的目的是______________。
(3)实验三中滴入氢氧化钠溶液后,可观察到的实验现象是______,发生反应的化学方程式为_______。
五、计算题
20.欲测定某瓶稀硫酸的溶质质量分数,现取20g该样品于烧杯中,将质量分数为10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请回答下列问题:
(1)N点溶液中的溶质是___________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
21.为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入100g稀盐酸恰好完全反应,测得剩余固体的质量为2g(杂质不溶于水也不与酸反应)。请计算:
(1)该赤铁矿中Fe2O3的纯度为_______。
(2)稀盐酸中溶质的质量分数_____。
参考答案
1.D 2.C 3.B 4.D 5.B 6.A 7.B 8.B 9.A 10.A 11.B 12.C
13.Al2O3+6HCl=2AlCl3+3H2O 102:219=10.2g:x 60% 20.4g 量筒
14.
(1)前者是乳化作用,后者是溶解
(2)
15.(1)隔绝氧气和水(2)氢氧化镁与盐酸反应生成氯化镁和水(3)增加了氧气的浓度
16.
(1)CO
(2)
(3)放热
17.CaO 熟石灰(或消石灰) 4 CaCO3+2HCl=CaCl2+H2O+CO2↑
18.
(1) Fe
(2)
19.
(1)液滴飞溅
(2)防止因局部温度过高造成液滴飞溅
(3) 气球变大
20.
(1)Na2SO4、NaOH
(2)当pH值为7时,此时氢氧化钠和稀硫酸恰好完全反应,此时消耗的氢氧化钠溶液的质量为8g,则消耗NaOH溶液中的NaOH质量为8g×10%=0.8g,
设稀硫酸的溶质质量分数为x
x=4.9%
答:该稀硫酸的溶质质量分数为4.9%。
21.
(1)80%
(2)解:设稀盐酸中氯化氢的质量为x。
x=10.95g
稀盐酸中溶质的质量分数为:×100%=10.95%
答:稀盐酸中溶质的质量分数是10.95%。
一、单选题
1.下列区别各组物质的实验方案中,可行的是
A.通过观察颜色来区别硬水和软水 B.用燃着的木条区别N2、O2、CO2
C.用澄清石灰水区别CO和H2 D.用蒸馏水区别碳酸钙粉末和氯化钙粉末
2.“三星堆”遗址是目前我国已知年代最为久远的先秦时代古遗址,三星堆“青铜器”出土后震惊了全世界。青铜器最初制作完成后的初始颜色呈黄色、金色,由于长时间理藏氧化生锈,变成了今天我们看到的青绿色。青绿色物质中含有“碱式碳酸铜”(Cu2(OH)2CO3),为了研究碱式碳酸铜的元素组成同学们设计了如图实验,关于该实验下列说法不正确的是
A.根据试管口有小水珠可以说明碱式碳酸铜中一定含有氢元素
B.根据澄清石灰水变浑浊可以说明碱式碳酸铜中一定含有碳元素
C.试管中剩余的黑色固体一定为炭粉和氧化铜的混合物
D.要确定试管中剩余黑色固体的成分,可以在黑色固体中加足量稀硫酸观察现象
3.下列溶液的pH最小的是
A.使石蕊试液显蓝色的溶液 B.使石蕊试液显红色的溶液
C.使石蕊试液显紫色的溶液 D.使酚酞试液显红色的溶液
4.水是生命之源,下列“水”可以使石蕊溶液变红的是
A.蒸馏水 B.糖水 C.氨水 D.柠檬水
5.下列某同学记录的实验现象中,正确的是
A.氢氧化钠固体溶于水吸收热量,使溶液温度降低
B.向“铜绿”中加入足量稀盐酸,固体逐渐消失
C.碳酸氢铵分解,产生氨气、二氧化碳气体
D.镁带燃烧发出耀眼红光,冒浓厚白烟
6.下列物质露置在空气中,一段时间后,因发生化学变化而质量增加的是
A.氧化钙 B.浓硫酸 C.浓盐酸 D.浓氨水
7.下列物质的用途主要由物理性质决定的是
A.氮气用作保护气 B.稀有气体作电光源
C.生石灰用作干燥剂 D.酒精用作然料
8.对于下列实验操作的说法,错误的是
A.制取气体前先要检查装置的气密性 B.测溶液的pH之前先要把试纸湿润
C.加热试管时,局部加热前先均匀加热 D.点燃可燃性气体前先要检验气体的纯度
9.下列物质的用途中,利用了物质的物理性质的是
A.活性炭吸附 B.氮气做保护气 C.酒精做燃料 D.生石灰做干燥剂
10.20gKOH加入100g水中,配制成溶液。下列说法错误的是
A.该溶液的溶质质量分数为20% B.KOH在水中解离出K+和OH-
C.一个K+带一个单位正电荷 D.向该溶液中滴入无色酚酞试液,试液变红
11.下列各组物质中,前者是纯净物,后者是混合物的是
A.干冰 冰水混合物 B.火碱 清新的空气
C.盐酸 四氧化三铁 D.硬水 澄清石灰水
12.根据下图实验,说法正确的是
A.品红的扩散速度相同
B.浓氨水变红
C.浓氨水有很强的挥发性
D.分子运动速率与温度无关
二、简答题
13.某工厂欲测定铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
(1)写出发生反应的化学方程式__________。
(2)根据已知条件列出第一次消耗稀盐酸的溶质质量为(x)的比例式__________。
(3)铝土矿中氧化铝的含量为__________。
(4)为了得到 26.7%的氯化铝溶液,通过计算,你需要将滤液蒸发__________水。
(5)用浓盐酸配置上述稀盐酸,需要的仪器有:烧杯、玻璃棒、胶头滴管和__________。
14.用学过的化学知识回答下列问题:
(1)洗涤剂能去除餐具上的油污,汽油也可以去除油污,二者原理有什么不同?_______
(2)工业上用稀硫酸来除铁锈,其反应的化学方程式为_______。
15.化学源于生活而且服务于生活,请同学们用所学的化学知识来解决下列生活中的问题:
(1)在铁制品表面涂油、刷漆或镀铬等都能防止铁制品生锈,其原理是什么?
(2)为什么可以用含氢氧化镁的药物治疗胃酸过多?
(3)用扇子扇煤炉火焰,为什么越扇越旺?
三、推断题
16.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题。
(1)物质E的化学式____________。
(2)写出物质E转化为物质C的化学反应方程式____________。
(3)物质B转化为物质D的过程会____________(填“吸收”或“放出”)热量。
17.A-E是初中化学常见的五种不同类别的物质,其中B由两种元素组成,C常用作食品干燥剂,并且C、D、E含有一种相同的金属元素,它们之间的转化关系如图所示(图中“一”表示两端的物质间能反应,“→”表示物质间存在转化关系,部分反应物、生成物和反应条件已略去)。请回答:
(1)物质C的化学式:___________。
(2)物质D俗称为___________(写一个);
(3)图中涉及的基本反应类型有___________个。
(4)反应“B-E”的化学方程式是___________。
18.A、B、C、D是四种常见物质。四种物质间的反应如图所示(“—”表示相连物质能发生化学反应,“→”表示物质间能一步转化,部分反应物、生成物和反应条件略去)。
(1)若A、B、C、D分别是酸、碱、盐和单质中的一种,且B与D反应产生蓝色沉淀。则:
①C→B的化学方程式:___________;
②B—D的化学方程式___________;
③写出A的化学式___________。
(2)若A、C为黑色固体,B、D为无色气体。则:
①A—C的化学方程式:___________;
②D的化学式___________。
四、实验题
19.请根据如图所示实验,回答下列问题。
(1)实验一是稀释浓硫酸的错误操作,该错误操造成的后果是_____________。
(2)实验二是蒸发食盐水的实验,蒸发时用玻璃棒不断搅拌的目的是______________。
(3)实验三中滴入氢氧化钠溶液后,可观察到的实验现象是______,发生反应的化学方程式为_______。
五、计算题
20.欲测定某瓶稀硫酸的溶质质量分数,现取20g该样品于烧杯中,将质量分数为10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请回答下列问题:
(1)N点溶液中的溶质是___________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
21.为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入100g稀盐酸恰好完全反应,测得剩余固体的质量为2g(杂质不溶于水也不与酸反应)。请计算:
(1)该赤铁矿中Fe2O3的纯度为_______。
(2)稀盐酸中溶质的质量分数_____。
参考答案
1.D 2.C 3.B 4.D 5.B 6.A 7.B 8.B 9.A 10.A 11.B 12.C
13.Al2O3+6HCl=2AlCl3+3H2O 102:219=10.2g:x 60% 20.4g 量筒
14.
(1)前者是乳化作用,后者是溶解
(2)
15.(1)隔绝氧气和水(2)氢氧化镁与盐酸反应生成氯化镁和水(3)增加了氧气的浓度
16.
(1)CO
(2)
(3)放热
17.CaO 熟石灰(或消石灰) 4 CaCO3+2HCl=CaCl2+H2O+CO2↑
18.
(1) Fe
(2)
19.
(1)液滴飞溅
(2)防止因局部温度过高造成液滴飞溅
(3) 气球变大
20.
(1)Na2SO4、NaOH
(2)当pH值为7时,此时氢氧化钠和稀硫酸恰好完全反应,此时消耗的氢氧化钠溶液的质量为8g,则消耗NaOH溶液中的NaOH质量为8g×10%=0.8g,
设稀硫酸的溶质质量分数为x
x=4.9%
答:该稀硫酸的溶质质量分数为4.9%。
21.
(1)80%
(2)解:设稀盐酸中氯化氢的质量为x。
x=10.95g
稀盐酸中溶质的质量分数为:×100%=10.95%
答:稀盐酸中溶质的质量分数是10.95%。
