第10章金属检测题-2021-2022学年九年级化学京改版下册(word版有答案)
文档属性
| 名称 | 第10章金属检测题-2021-2022学年九年级化学京改版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 159.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-07 21:56:19 | ||
图片预览


文档简介
第10章《金属》检测题
一、单选题
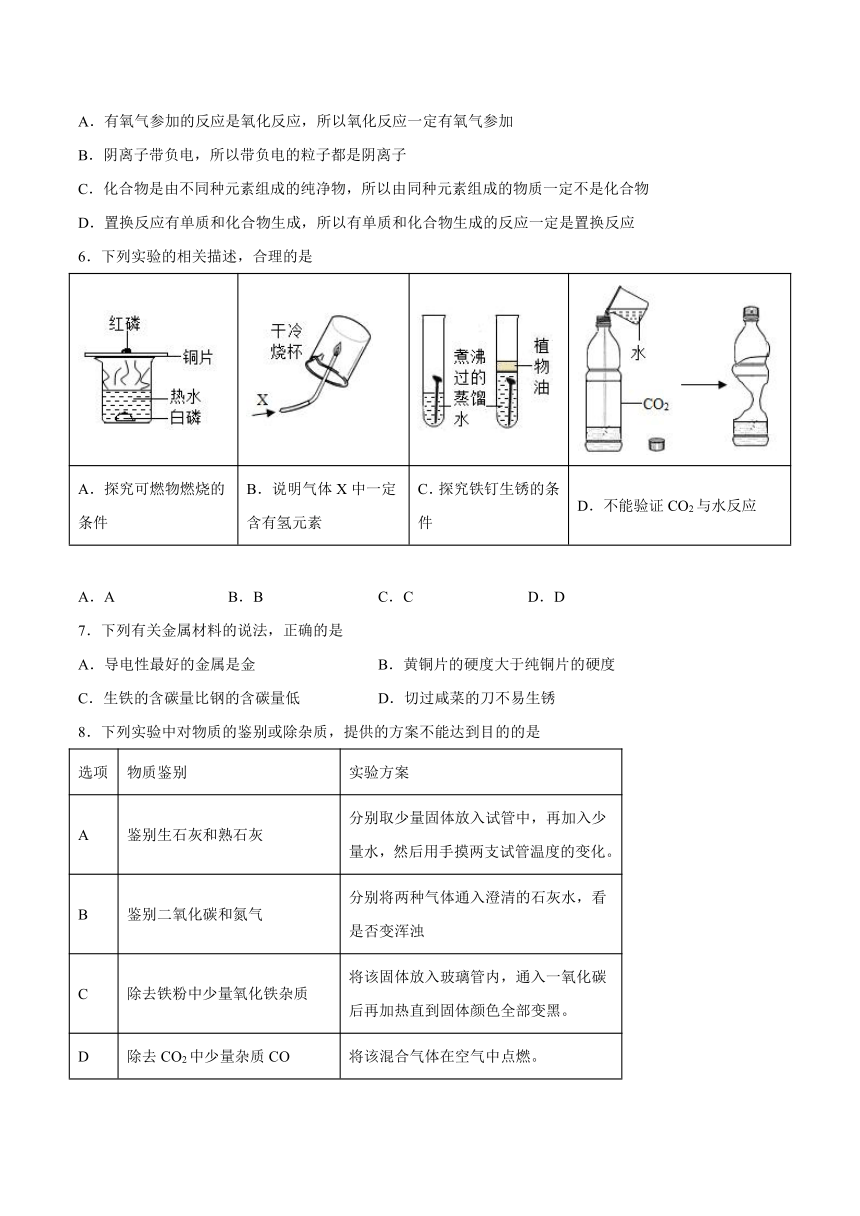
1.乙烯(C2H4)是一种重要的工业原料,在工业上有着重要的用途。乙烯完全燃烧时微观反应示意图如图所示。下列有关叙述正确的是
A.属于置换反应 B.物质D的化学式为CO2
C.反应前后分子数目增多 D.原子是化学变化中的最小微粒
2.下列说法正确的是
A.含有两种元素的物质一定是化合物
B.石蜡燃烧的过程中一定发生了物理变化
C.将带火星的木条伸入集气瓶中,用来检验氧气是否收满
D.活泼金属能与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质一定是活泼金属
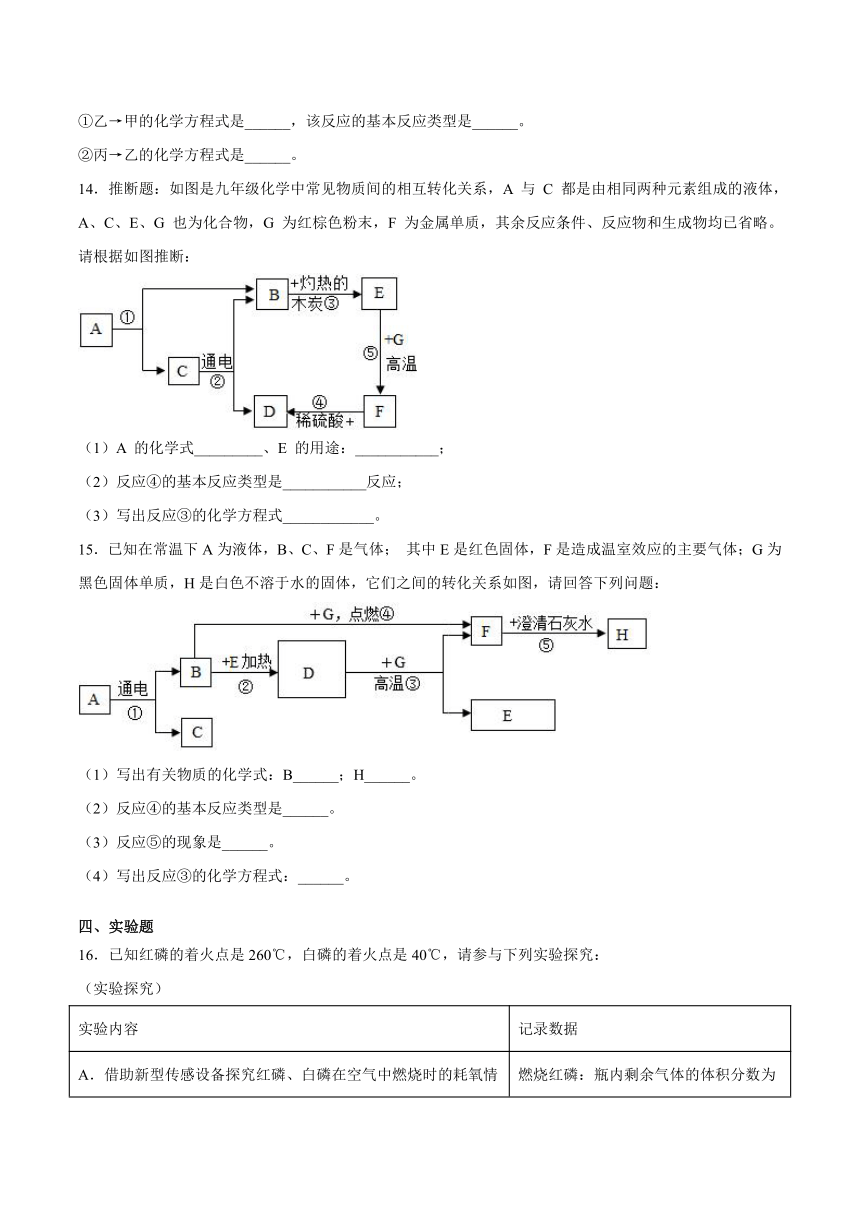
3.下列实验操作能达到目的的是
选项 实验目的 实验操作
A 比较铜片与铝片的硬度 滴盐酸,观察反应情况
B 鉴别CO2与CO 通入石蕊溶液,观察颜色
C 除去CO2中少量CO 点燃得合气体
D 除去ZnCl2溶液中的少量CuCl2 加足量铁粉,搅拌,过滤
A.A B.B C.C D.D
4.物质的性质决定物质的用途。下列物质的性质与其用途相匹配的是
A.氧气具有助燃性,用作火箭发射的燃料 B.焊锡熔点低,用于焊接金属
C.石墨是黑色质软的固体,用于制作电池电极 D.二氧化碳能与水反应,用于灭火
5.推理是化学学习过程中一种重要的思维方法,下列推理正确的是
A.有氧气参加的反应是氧化反应,所以氧化反应一定有氧气参加
B.阴离子带负电,所以带负电的粒子都是阴离子
C.化合物是由不同种元素组成的纯净物,所以由同种元素组成的物质一定不是化合物
D.置换反应有单质和化合物生成,所以有单质和化合物生成的反应一定是置换反应
6.下列实验的相关描述,合理的是
A.探究可燃物燃烧的条件 B.说明气体X中一定含有氢元素 C.探究铁钉生锈的条件 D.不能验证CO2与水反应
A.A B.B C.C D.D
7.下列有关金属材料的说法,正确的是
A.导电性最好的金属是金 B.黄铜片的硬度大于纯铜片的硬度
C.生铁的含碳量比钢的含碳量低 D.切过咸菜的刀不易生锈
8.下列实验中对物质的鉴别或除杂质,提供的方案不能达到目的的是
选项 物质鉴别 实验方案
A 鉴别生石灰和熟石灰 分别取少量固体放入试管中,再加入少量水,然后用手摸两支试管温度的变化。
B 鉴别二氧化碳和氮气 分别将两种气体通入澄清的石灰水,看是否变浑浊
C 除去铁粉中少量氧化铁杂质 将该固体放入玻璃管内,通入一氧化碳后再加热直到固体颜色全部变黑。
D 除去CO2中少量杂质CO 将该混合气体在空气中点燃。
A.A B.B C.C D.D
9.某同学将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液。下列判断中,不正确的是
a 滤渣中一定含有铜 b 滤液中一定含有 Cu2+ c 滤液中一定含有Fe2+d向滤渣中加稀盐酸可能有气泡 e 所得滤液质量一定比原溶液质量小
A.ad B.be C.abe D.acd
10.2021年12月13日国家能源集团召开氢能氨能在煤炭运输产业应用技术研讨会,要求充分认识氢能、氨能在能源绿色低碳转型过程中的重要战略作用。下列说法正确的是
A.分离空气制得氮气和氧气的过程属于化学变化
B.电解水能得到氢气和氧气是因为水中含有氢气和氧气
C.氨气在氧气中燃烧生成水和氮气的反应属于置换反应
D.氨能的开发利用不利于保护环境
11.向200.0gAgNO3溶液中加入mgAl和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得到32.4g固体。向滤液中再次插入洁净光亮的细铜丝,铜丝表面产生银白色物质。下列说法正确的是
A.m的值可能为8.0 B.向过滤所得固体中加入稀盐酸可能会有气体生成
C.滤液的质量为167.6g D.原AgNO3溶液的溶质质量分数是25.5%
二、简答题
12.化学与生产生活密切相关。
(1)净水时加入活性炭除去颜色和利用了活性炭的___________性;
(2)日常生活中,铝制品耐腐蚀的原因是______________;
(3)《本草纲目拾遗》中说:“罐得火气合于肉,即牢不可脱肉上起红晕,罐中有气水出,风寒尽岀。”拔罐法通常利用燃烧酒精等物质排去罐内空气,酒精(C2H5OH)燃烧的化学反应方式______。
三、推断题
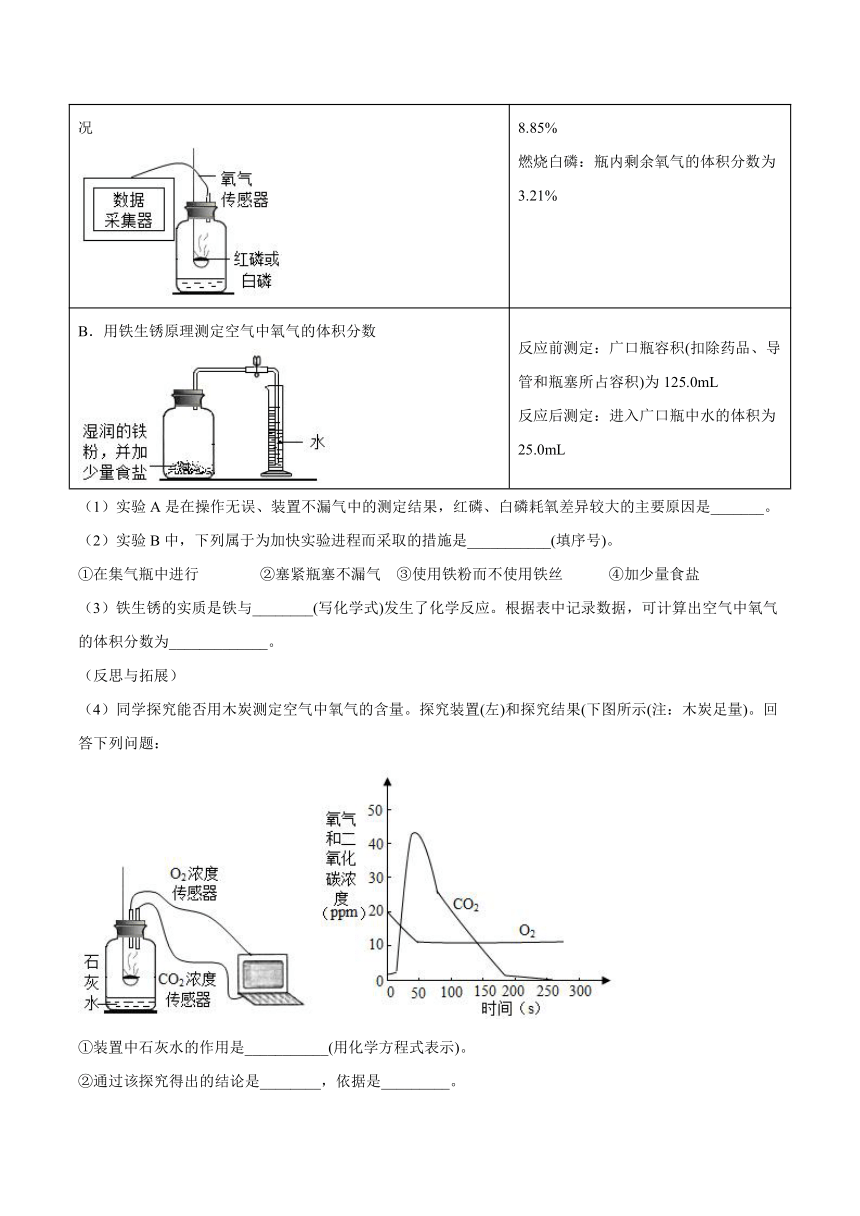
13.物质甲、乙和丙的转化关系如图所示(“→“表示一步进行的反应)。
(1)若甲、丙都是单质,乙是生活中最常见的液体请写出甲的一种用途______。
(2)若甲、乙、丙都是化合物,乙是温室气体,且组成丙物质的元素种类多于甲物质,则甲的化学式是______。
(3)若甲是单质、丙是化合物,乙是年产量最多的金属。
①乙→甲的化学方程式是______,该反应的基本反应类型是______。
②丙→乙的化学方程式是______。
14.推断题:如图是九年级化学中常见物质间的相互转化关系,A 与 C 都是由相同两种元素组成的液体,A、C、E、G 也为化合物,G 为红棕色粉末,F 为金属单质,其余反应条件、反应物和生成物均已省略。请根据如图推断:
(1)A 的化学式_________、E 的用途:___________;
(2)反应④的基本反应类型是___________反应;
(3)写出反应③的化学方程式____________。
15.已知在常温下A为液体,B、C、F是气体; 其中E是红色固体,F是造成温室效应的主要气体;G为黑色固体单质,H是白色不溶于水的固体,它们之间的转化关系如图,请回答下列问题:
(1)写出有关物质的化学式:B______;H______。
(2)反应④的基本反应类型是______。
(3)反应⑤的现象是______。
(4)写出反应③的化学方程式:______。
四、实验题
16.已知红磷的着火点是260℃,白磷的着火点是40℃,请参与下列实验探究:
(实验探究)
实验内容 记录数据
A.借助新型传感设备探究红磷、白磷在空气中燃烧时的耗氧情况 燃烧红磷:瓶内剩余气体的体积分数为8.85% 燃烧白磷:瓶内剩余氧气的体积分数为3.21%
B.用铁生锈原理测定空气中氧气的体积分数 反应前测定:广口瓶容积(扣除药品、导管和瓶塞所占容积)为125.0mL 反应后测定:进入广口瓶中水的体积为25.0mL
(1)实验A是在操作无误、装置不漏气中的测定结果,红磷、白磷耗氧差异较大的主要原因是_______。
(2)实验B中,下列属于为加快实验进程而采取的措施是___________(填序号)。
①在集气瓶中进行 ②塞紧瓶塞不漏气 ③使用铁粉而不使用铁丝 ④加少量食盐
(3)铁生锈的实质是铁与________(写化学式)发生了化学反应。根据表中记录数据,可计算出空气中氧气的体积分数为_____________。
(反思与拓展)
(4)同学探究能否用木炭测定空气中氧气的含量。探究装置(左)和探究结果(下图所示(注:木炭足量)。回答下列问题:
①装置中石灰水的作用是___________(用化学方程式表示)。
②通过该探究得出的结论是________,依据是_________。
17.水蒸气通过灼热的焦炭后得到水煤气,其主要成分是CO、H2,还含有少量的CO2和水蒸气,依据下列装置进行实验,可证明水煤气中含有CO、H2。
(已知:a.无水硫酸铜遇水由白色变为蓝色;b.浓硫酸有吸水性;c.A装置中发生反应的化学方程式是。)
请回答下列问题:
(1)B装置内盛放的物质是________,其作用是________。
(2)C装置内盛放________,其作用是________。
(3)D装置内的现象是_________。
(4)装置F中发生反应的化学方程式是________。
(5)若E装置与F装置位置颠倒,其后果是________。
18.早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式_________。
(2)实验研究铁锈蚀影响因素,记录如下,下列分析错误的是 。
实验装置 序号 其他试剂 100s时O2的含量
① 干燥剂 21%
② 10滴水 15%
③ 10滴水和1.0g食盐 8%
A.②③中O2含量减少表明铁已锈蚀
B.①②证明水对铁锈蚀有影响
C.②③证明食盐能加快铁锈蚀
D.①②③证明炭粉对铁锈蚀有影响
五、计算题
19.2021年5月15日我国首次火星探测任务天问一号探测器在火星着落。为测定天问一号的某电子元件材料的黄铜合金(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取10g黄铜粉末于烧杯中,将40g稀盐酸平均分四次加入,充分反应,测得实验数据如表:
第一次 第二次 第三次 第四次
加入稀盐酸的质量(g) 10 10 10 10
烧杯剩余物的质量(g) 19.96 29.92 39.89 m
(1)m的值为_______ g,完全反应后生产氢气的质量为_______ g。
(2)该黄铜中铜的质量分数是多少?(计算结果精确到0.1%)
20.金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用“长征三号乙”运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝___________(填“高”或“低”)。
(2)交通:制造港珠澳大桥需要大量的钢铁,请写出一种防止钢铁生锈的方法:___________。
(3)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”可用方程是表示为___________。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤液中一定含有的金属离子是___________。
(4)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有20g铜锌合金,与100g质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为___________。
21.某化学兴趣小组同学为回收一块质量为40g的铜锌合金中铜的含量,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,此时称得烧杯中剩余物的质量为139.6g。请完成下列分析及计算。
(1)生成氢气的质量为___________g。
(2)计算该合金中铜的质量分数(精确到0.1%)。
参考答案
1.D 2.B 3.B 4.B 5.C 6.D 7.B 8.D 9.A 10.C 11.A 12.
(1)吸附
(2)铝在空气中和氧气反应产生一层致密的氧化膜,阻止铝被腐蚀
(3)
13.
(1)作燃料
(2)CO
(3) 置换反应
14.
(1) H2O2 作燃料或冶炼金属
(2)置换
(3)
15.
(1) O2 CaCO3
(2)化合反应
(3)澄清的石灰水变浑浊
(4)
16.白磷比红磷的着火点低,更容易燃烧 ③④ O2、H2O 20% 不能用木炭测定空气中氧气的含量 木炭燃烧不能将装置内氧气完全耗尽
17.
(1) 澄清石灰水 检验二氧化碳是否除净
(2) 浓硫酸 除去水蒸气
(3)黑色固体变为红色
(4)
(5)无法判断水煤气中是否有氢气
18.
(1)
(2)D
19.
(1) 49.89 0.11
(2)解:设黄铜中锌的质量为x
所以该黄铜中铜的质量分数是
答:该黄铜中铜的质量分数是64.3%。
20.
(1)高
(2)刷漆等(合理即可)
(3) Fe+CuSO4=FeSO4+Cu Mg2+、Cu2+
(4)解:参加反应的纯硫酸的质量=100g×19.6%=19.6g
设合金中锌的质量为x
=
x=13g
合金中铜的质量=20g 13g=7g
铜锌合金中铜的质量分数=×100%=35%
答:铜锌合金中铜的质量分数为35%。
21.
(1)0.4
(2)解:设合金中锌的质量为x。
x=13g
答:合金中铜的质量分数为: ×100=67.5%
一、单选题
1.乙烯(C2H4)是一种重要的工业原料,在工业上有着重要的用途。乙烯完全燃烧时微观反应示意图如图所示。下列有关叙述正确的是
A.属于置换反应 B.物质D的化学式为CO2
C.反应前后分子数目增多 D.原子是化学变化中的最小微粒
2.下列说法正确的是
A.含有两种元素的物质一定是化合物
B.石蜡燃烧的过程中一定发生了物理变化
C.将带火星的木条伸入集气瓶中,用来检验氧气是否收满
D.活泼金属能与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质一定是活泼金属
3.下列实验操作能达到目的的是
选项 实验目的 实验操作
A 比较铜片与铝片的硬度 滴盐酸,观察反应情况
B 鉴别CO2与CO 通入石蕊溶液,观察颜色
C 除去CO2中少量CO 点燃得合气体
D 除去ZnCl2溶液中的少量CuCl2 加足量铁粉,搅拌,过滤
A.A B.B C.C D.D
4.物质的性质决定物质的用途。下列物质的性质与其用途相匹配的是
A.氧气具有助燃性,用作火箭发射的燃料 B.焊锡熔点低,用于焊接金属
C.石墨是黑色质软的固体,用于制作电池电极 D.二氧化碳能与水反应,用于灭火
5.推理是化学学习过程中一种重要的思维方法,下列推理正确的是
A.有氧气参加的反应是氧化反应,所以氧化反应一定有氧气参加
B.阴离子带负电,所以带负电的粒子都是阴离子
C.化合物是由不同种元素组成的纯净物,所以由同种元素组成的物质一定不是化合物
D.置换反应有单质和化合物生成,所以有单质和化合物生成的反应一定是置换反应
6.下列实验的相关描述,合理的是
A.探究可燃物燃烧的条件 B.说明气体X中一定含有氢元素 C.探究铁钉生锈的条件 D.不能验证CO2与水反应
A.A B.B C.C D.D
7.下列有关金属材料的说法,正确的是
A.导电性最好的金属是金 B.黄铜片的硬度大于纯铜片的硬度
C.生铁的含碳量比钢的含碳量低 D.切过咸菜的刀不易生锈
8.下列实验中对物质的鉴别或除杂质,提供的方案不能达到目的的是
选项 物质鉴别 实验方案
A 鉴别生石灰和熟石灰 分别取少量固体放入试管中,再加入少量水,然后用手摸两支试管温度的变化。
B 鉴别二氧化碳和氮气 分别将两种气体通入澄清的石灰水,看是否变浑浊
C 除去铁粉中少量氧化铁杂质 将该固体放入玻璃管内,通入一氧化碳后再加热直到固体颜色全部变黑。
D 除去CO2中少量杂质CO 将该混合气体在空气中点燃。
A.A B.B C.C D.D
9.某同学将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液。下列判断中,不正确的是
a 滤渣中一定含有铜 b 滤液中一定含有 Cu2+ c 滤液中一定含有Fe2+d向滤渣中加稀盐酸可能有气泡 e 所得滤液质量一定比原溶液质量小
A.ad B.be C.abe D.acd
10.2021年12月13日国家能源集团召开氢能氨能在煤炭运输产业应用技术研讨会,要求充分认识氢能、氨能在能源绿色低碳转型过程中的重要战略作用。下列说法正确的是
A.分离空气制得氮气和氧气的过程属于化学变化
B.电解水能得到氢气和氧气是因为水中含有氢气和氧气
C.氨气在氧气中燃烧生成水和氮气的反应属于置换反应
D.氨能的开发利用不利于保护环境
11.向200.0gAgNO3溶液中加入mgAl和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得到32.4g固体。向滤液中再次插入洁净光亮的细铜丝,铜丝表面产生银白色物质。下列说法正确的是
A.m的值可能为8.0 B.向过滤所得固体中加入稀盐酸可能会有气体生成
C.滤液的质量为167.6g D.原AgNO3溶液的溶质质量分数是25.5%
二、简答题
12.化学与生产生活密切相关。
(1)净水时加入活性炭除去颜色和利用了活性炭的___________性;
(2)日常生活中,铝制品耐腐蚀的原因是______________;
(3)《本草纲目拾遗》中说:“罐得火气合于肉,即牢不可脱肉上起红晕,罐中有气水出,风寒尽岀。”拔罐法通常利用燃烧酒精等物质排去罐内空气,酒精(C2H5OH)燃烧的化学反应方式______。
三、推断题
13.物质甲、乙和丙的转化关系如图所示(“→“表示一步进行的反应)。
(1)若甲、丙都是单质,乙是生活中最常见的液体请写出甲的一种用途______。
(2)若甲、乙、丙都是化合物,乙是温室气体,且组成丙物质的元素种类多于甲物质,则甲的化学式是______。
(3)若甲是单质、丙是化合物,乙是年产量最多的金属。
①乙→甲的化学方程式是______,该反应的基本反应类型是______。
②丙→乙的化学方程式是______。
14.推断题:如图是九年级化学中常见物质间的相互转化关系,A 与 C 都是由相同两种元素组成的液体,A、C、E、G 也为化合物,G 为红棕色粉末,F 为金属单质,其余反应条件、反应物和生成物均已省略。请根据如图推断:
(1)A 的化学式_________、E 的用途:___________;
(2)反应④的基本反应类型是___________反应;
(3)写出反应③的化学方程式____________。
15.已知在常温下A为液体,B、C、F是气体; 其中E是红色固体,F是造成温室效应的主要气体;G为黑色固体单质,H是白色不溶于水的固体,它们之间的转化关系如图,请回答下列问题:
(1)写出有关物质的化学式:B______;H______。
(2)反应④的基本反应类型是______。
(3)反应⑤的现象是______。
(4)写出反应③的化学方程式:______。
四、实验题
16.已知红磷的着火点是260℃,白磷的着火点是40℃,请参与下列实验探究:
(实验探究)
实验内容 记录数据
A.借助新型传感设备探究红磷、白磷在空气中燃烧时的耗氧情况 燃烧红磷:瓶内剩余气体的体积分数为8.85% 燃烧白磷:瓶内剩余氧气的体积分数为3.21%
B.用铁生锈原理测定空气中氧气的体积分数 反应前测定:广口瓶容积(扣除药品、导管和瓶塞所占容积)为125.0mL 反应后测定:进入广口瓶中水的体积为25.0mL
(1)实验A是在操作无误、装置不漏气中的测定结果,红磷、白磷耗氧差异较大的主要原因是_______。
(2)实验B中,下列属于为加快实验进程而采取的措施是___________(填序号)。
①在集气瓶中进行 ②塞紧瓶塞不漏气 ③使用铁粉而不使用铁丝 ④加少量食盐
(3)铁生锈的实质是铁与________(写化学式)发生了化学反应。根据表中记录数据,可计算出空气中氧气的体积分数为_____________。
(反思与拓展)
(4)同学探究能否用木炭测定空气中氧气的含量。探究装置(左)和探究结果(下图所示(注:木炭足量)。回答下列问题:
①装置中石灰水的作用是___________(用化学方程式表示)。
②通过该探究得出的结论是________,依据是_________。
17.水蒸气通过灼热的焦炭后得到水煤气,其主要成分是CO、H2,还含有少量的CO2和水蒸气,依据下列装置进行实验,可证明水煤气中含有CO、H2。
(已知:a.无水硫酸铜遇水由白色变为蓝色;b.浓硫酸有吸水性;c.A装置中发生反应的化学方程式是。)
请回答下列问题:
(1)B装置内盛放的物质是________,其作用是________。
(2)C装置内盛放________,其作用是________。
(3)D装置内的现象是_________。
(4)装置F中发生反应的化学方程式是________。
(5)若E装置与F装置位置颠倒,其后果是________。
18.早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式_________。
(2)实验研究铁锈蚀影响因素,记录如下,下列分析错误的是 。
实验装置 序号 其他试剂 100s时O2的含量
① 干燥剂 21%
② 10滴水 15%
③ 10滴水和1.0g食盐 8%
A.②③中O2含量减少表明铁已锈蚀
B.①②证明水对铁锈蚀有影响
C.②③证明食盐能加快铁锈蚀
D.①②③证明炭粉对铁锈蚀有影响
五、计算题
19.2021年5月15日我国首次火星探测任务天问一号探测器在火星着落。为测定天问一号的某电子元件材料的黄铜合金(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取10g黄铜粉末于烧杯中,将40g稀盐酸平均分四次加入,充分反应,测得实验数据如表:
第一次 第二次 第三次 第四次
加入稀盐酸的质量(g) 10 10 10 10
烧杯剩余物的质量(g) 19.96 29.92 39.89 m
(1)m的值为_______ g,完全反应后生产氢气的质量为_______ g。
(2)该黄铜中铜的质量分数是多少?(计算结果精确到0.1%)
20.金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用“长征三号乙”运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝___________(填“高”或“低”)。
(2)交通:制造港珠澳大桥需要大量的钢铁,请写出一种防止钢铁生锈的方法:___________。
(3)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”可用方程是表示为___________。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤液中一定含有的金属离子是___________。
(4)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有20g铜锌合金,与100g质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为___________。
21.某化学兴趣小组同学为回收一块质量为40g的铜锌合金中铜的含量,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,此时称得烧杯中剩余物的质量为139.6g。请完成下列分析及计算。
(1)生成氢气的质量为___________g。
(2)计算该合金中铜的质量分数(精确到0.1%)。
参考答案
1.D 2.B 3.B 4.B 5.C 6.D 7.B 8.D 9.A 10.C 11.A 12.
(1)吸附
(2)铝在空气中和氧气反应产生一层致密的氧化膜,阻止铝被腐蚀
(3)
13.
(1)作燃料
(2)CO
(3) 置换反应
14.
(1) H2O2 作燃料或冶炼金属
(2)置换
(3)
15.
(1) O2 CaCO3
(2)化合反应
(3)澄清的石灰水变浑浊
(4)
16.白磷比红磷的着火点低,更容易燃烧 ③④ O2、H2O 20% 不能用木炭测定空气中氧气的含量 木炭燃烧不能将装置内氧气完全耗尽
17.
(1) 澄清石灰水 检验二氧化碳是否除净
(2) 浓硫酸 除去水蒸气
(3)黑色固体变为红色
(4)
(5)无法判断水煤气中是否有氢气
18.
(1)
(2)D
19.
(1) 49.89 0.11
(2)解:设黄铜中锌的质量为x
所以该黄铜中铜的质量分数是
答:该黄铜中铜的质量分数是64.3%。
20.
(1)高
(2)刷漆等(合理即可)
(3) Fe+CuSO4=FeSO4+Cu Mg2+、Cu2+
(4)解:参加反应的纯硫酸的质量=100g×19.6%=19.6g
设合金中锌的质量为x
=
x=13g
合金中铜的质量=20g 13g=7g
铜锌合金中铜的质量分数=×100%=35%
答:铜锌合金中铜的质量分数为35%。
21.
(1)0.4
(2)解:设合金中锌的质量为x。
x=13g
答:合金中铜的质量分数为: ×100=67.5%
