第11章 酸与碱检测题—2021-2022学年九年级化学京改版(2013)下册(word版 含答案)
文档属性
| 名称 | 第11章 酸与碱检测题—2021-2022学年九年级化学京改版(2013)下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 204.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-08 00:00:00 | ||
图片预览

文档简介
第11章《酸与碱》检测题
一、单选题
1.下列某同学记录的实验现象中,正确的是
A.氢氧化钠固体溶于水吸收热量,使溶液温度降低
B.向“铜绿”中加入足量稀盐酸,固体逐渐消失
C.碳酸氢铵分解,产生氨气、二氧化碳气体
D.镁带燃烧发出耀眼红光,冒浓厚白烟
2.下列溶液的pH最小的是
A.使石蕊试液显蓝色的溶液 B.使石蕊试液显红色的溶液
C.使石蕊试液显紫色的溶液 D.使酚酞试液显红色的溶液
3.下列操作中,含有乳化过程的是
A.用汽油除去衣服上的油渍 B.用洗洁精洗涤碗筷上的油污
C.用稀盐酸除去水垢(主要成分CaCO3) D.用砂纸除去铁制品表面的铁锈
4.下列实验现象描述正确的是
A.打开盛有浓盐酸的试剂瓶,瓶口出现白烟
B.装有CO2的软塑料瓶倒入一定量的水,立即旋紧瓶盖振荡,塑料瓶变瘪
C.细铁丝在氧气中剧烈燃烧,火星四射,生成了四氧化三铁
D.向滴有酚酞试液的蒸馏水中加入氢氧化铜,溶液显红色
5.酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+,从而呈现酸性,主要用于饮料添加剂或药物工业原料,下列物质不能与酒石酸反应的是
A.CO2 B.CuO C.NaOH D.Mg
6.除去下列物质中的杂质,所选试剂及操作方法错误的是
选项 物质(括号内为杂质) 选用试剂及操作方法
A N2(水蒸气) 通过浓H2SO4
B CaO(CaCO3) 加入足量水,过滤
C CO2(O2) 通过灼热的铜网
D NaCl(泥沙) 加足量水溶解,过滤,蒸发
A.A B.B C.C D.D
7.对于下列实验操作的说法,错误的是
A.制取气体前先要检查装置的气密性 B.测溶液的pH之前先要把试纸湿润
C.加热试管时,局部加热前先均匀加热 D.点燃可燃性气体前先要检验气体的纯度
8.下列化学方程式符合题意且书写正确的是
A.铁在氧气中燃烧:
B.镁在空气中燃烧:
C.硫酸铜溶液和氢氧化钠溶液反应:
D.氢氧化镁与稀硫酸反应:
9.下列化学反应中既属于置换反应又是放热反应的是
A. B.
C. D.
10.下列实验基本操作规范的是
A.称量氢氧化钠 B.蒸发氯化钠溶液
C.稀释浓硫酸 D.测定溶液pH
11.下列物质的俗称或名称化学式都完全正确的是
A.氯化锌——ZnCl B.烧碱、火碱——NaOH
C.氧化铁——FeO D.水银——Ag
二、简答题
12.化学的学科特征是在原子、分子水平上研究物质和创造物质,请从微观角度解释下列问题:
(1)钠原子和钠离子化学性质不同;
(2)一氧化碳和二氧化碳化学性质不同;
(3)NaOH溶液和Ca(OH)2溶液都能使酚酞溶液变红。
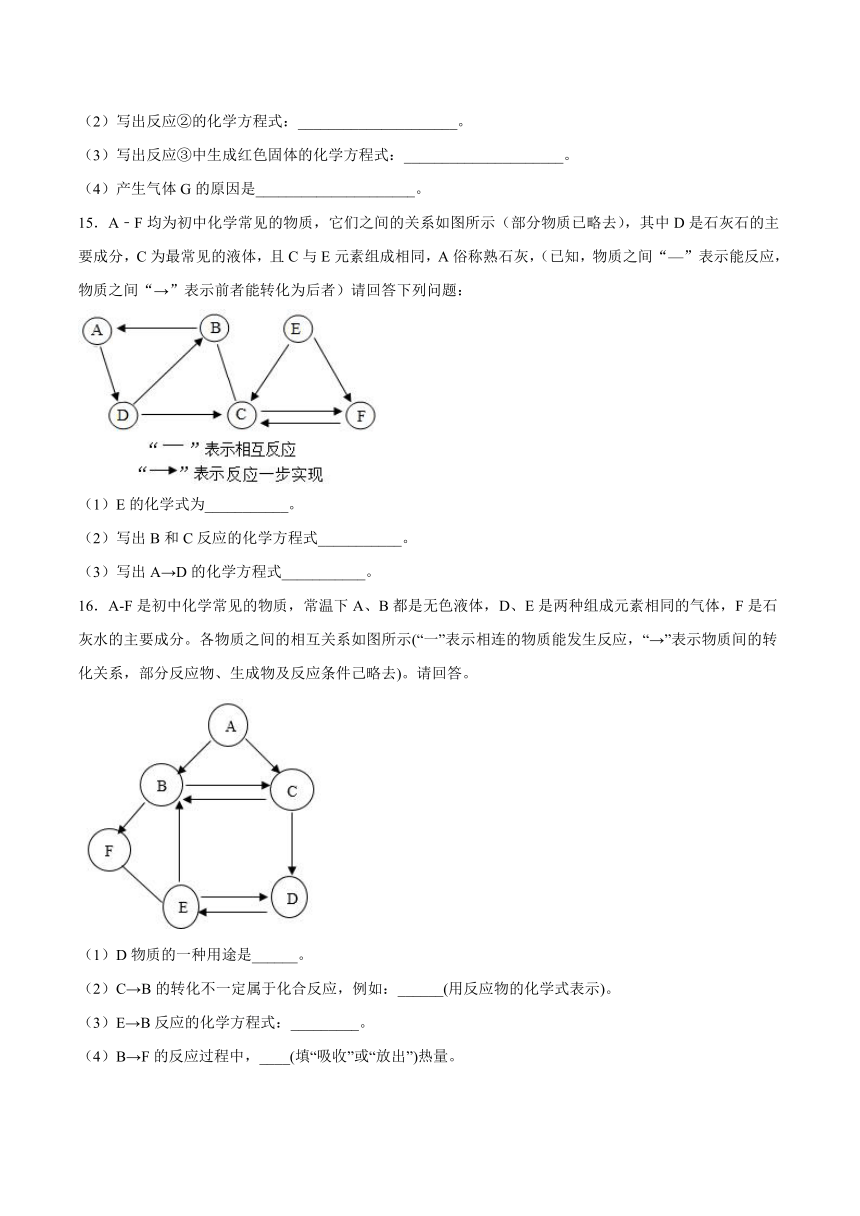
13.如下图所示,在白色点滴板1~6的孔穴中,分别滴加稀硫酸。
(1)反应后溶液颜色有变化的是_____(填序号)。
(2)有一个孔穴中的物质不与稀硫酸反应,原因是_____。
(3)若用石灰水替代稀硫酸滴入孔穴5中,发生反应的化学方程式为_____。
三、推断题
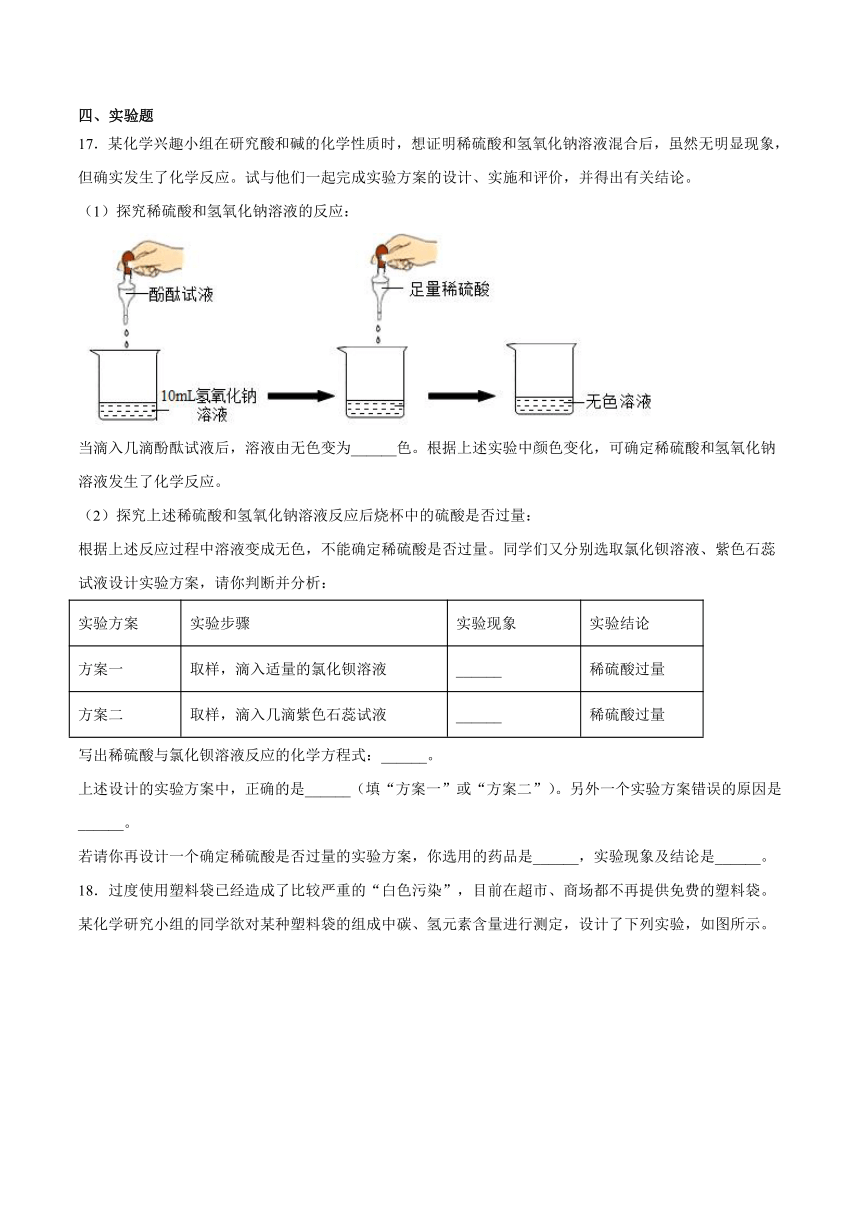
14.A、B、C、D、E、F、G为常见的物质,其中B是黑色固体单质,D是红棕色固体,E是红色固体单质,G是密度最小的气体,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系。请回答:
(1)A物质的化学式为__________,气体G的化学式为____________。
(2)写出反应②的化学方程式:_____________________。
(3)写出反应③中生成红色固体的化学方程式:_____________________。
(4)产生气体G的原因是_____________________。
15.A﹣F均为初中化学常见的物质,它们之间的关系如图所示(部分物质已略去),其中D是石灰石的主要成分,C为最常见的液体,且C与E元素组成相同,A俗称熟石灰,(已知,物质之间“—”表示能反应,物质之间“→”表示前者能转化为后者)请回答下列问题:
(1)E的化学式为___________。
(2)写出B和C反应的化学方程式___________。
(3)写出A→D的化学方程式___________。
16.A-F是初中化学常见的物质,常温下A、B都是无色液体,D、E是两种组成元素相同的气体,F是石灰水的主要成分。各物质之间的相互关系如图所示(“一”表示相连的物质能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件己略去)。请回答。
(1)D物质的一种用途是______。
(2)C→B的转化不一定属于化合反应,例如:______(用反应物的化学式表示)。
(3)E→B反应的化学方程式:_________。
(4)B→F的反应过程中,____(填“吸收”或“放出”)热量。
四、实验题
17.某化学兴趣小组在研究酸和碱的化学性质时,想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
当滴入几滴酚酞试液后,溶液由无色变为______色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
实验方案 实验步骤 实验现象 实验结论
方案一 取样,滴入适量的氯化钡溶液 ______ 稀硫酸过量
方案二 取样,滴入几滴紫色石蕊试液 ______ 稀硫酸过量
写出稀硫酸与氯化钡溶液反应的化学方程式:______。
上述设计的实验方案中,正确的是______(填“方案一”或“方案二”)。另外一个实验方案错误的原因是______。
若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是______,实验现象及结论是______。
18.过度使用塑料袋已经造成了比较严重的“白色污染”,目前在超市、商场都不再提供免费的塑料袋。某化学研究小组的同学欲对某种塑料袋的组成中碳、氢元素含量进行测定,设计了下列实验,如图所示。
(资料显示:该种塑料袋只含碳、氢两种元素,燃烧产物为二氧化碳和水。)
(1)实验时,打开分液漏斗的活塞,将H2O2溶液滴入到A装置的_____(填仪器名称)中,排除装置内空气后,再点燃C处的酒精灯,使反应进行。
(2)装置A中发生反应的化学方程式为_____。
(3)装置B的作用是_____。
(4)在实验前后二次称量装置D,其目的是_____。
(5)实验过程中依据装置E的质量变化,即可得出反应生成二氧化碳的质量,进而计算出塑料碎屑中碳元素的含量,则装置F的作用是_____。
19.请结合下图回答问题:
(1)仪器名称:①_________;②_________。
(2)用高锰酸钾制取氧气,可选用的发生装置是_________(填序号),该反应的化学方程式为___________,该反应的基本反应类型是_________。
(3)实验室制取CO2,反应的化学方程式为__________,为方便控制反应的发生和停止,应选择的发生装置是__________(填序号)。
(4)下列气体可用G所示装置干燥、收集的是_________(填序号)。
①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3
五、计算题
20.实验室中稀硫酸因标签破损,需测定其质量分数。某化学兴趣小组的同学取该稀硫酸样品50g,逐滴加入质量分数为16%的NaOH溶液,溶液的pH随加入NaOH溶液质量的变化如图所示。
(1)图中A点时溶液中阴离子的符号是_____。
(2)求稀硫酸中溶质的质量分数(写出计算过程,计算结果精确到0.01%)。
21.某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应),进行如下实验,第一步反应的稀硫酸与生成的硫酸铁之间的质量关系如坐标图所示:
(1)上述实验过程中发生反应的化学方程式为_____________;
(2)根据已知条件列出求解第二步实验溶液中参加反应的物质质量(x)的比例式_____________;
(3)若用98%的浓酸硫配制实验所需的稀硫酸,则需要加水的质量为________;
(4)赤铁矿样品中Fe2O3的含量___________;
(5)在第二步实验结束后所得溶液中溶质的质量分数是________;
(6)该钢铁厂每天用上述赤铁矿石1800t来生产生铁,则理论上日产含杂质4%的生铁的质量为__________。
参考答案
1.B 2.B 3.B 4.B 5.A 6.B 7.B 8.C 9.D 10.B 11.B
12.(1)钠原子和钠离子最外层电子数不同,所以钠原子和钠离子化学性质不同
(2)一个一氧化碳分子由一个碳原子和一个氧原子构成,一个二氧化碳分子由一个碳原子和两个氧原子构成,分子结构不同一氧化碳和二氧化碳化学性质不同。
(3)NaOH溶液和Ca(OH)2溶液都能解离出氢氧根离子,都能使酚酞溶液变红。
13.3 在金属活动性顺序里,铜位于氢后,不与稀硫酸反应
14.
(1) CuO H2
(2)
(3)
(4)X溶液中含有过量的稀盐酸与Fe反应,产生氢气
15.
(1)H2O2
(2)
(3)
16.
(1)作燃料(或治炼金属)
(2)CH4和O2
(3)
(4)放出
17.
(1)红
(2) 产生白色沉淀 溶液变红 方案二 硫酸钠与氯化钡反应也生成白色沉淀 锌 有气泡产生,说明稀硫酸过量
18.
(1)锥形瓶
(2)2H2O22H2O+O2↑
(3)干燥氧气(吸收氧气中的水蒸气)
(4)测定反应生成水的质量,即可计算出塑料碎片中氢元素含量
(5)防止外界空气中的二氧化碳和水蒸气进入E装置影响碳元素含量测定
19.
(1) 铁架台 分液漏斗
(2) A 分解反应
(3) C
(4)①⑤⑥
20.
(1)Cl-
(2)解:设稀硫酸溶质质量分数为x。
x=7.84%
答:稀硫酸溶质质量分数7.84%。
21.
(1)
(2)
(3)255g
(4)解:设赤铁矿样品中氧化铁的含量为z
z=64%
答:赤铁矿样品中氧化铁的含量为64%;
(5)解:设在第二步实验结束后生成硫酸铁的质量为m
m=60g
故在第二步实验结束后所得溶液中溶质的质量分数是:
(6)解:设理论上日产含杂质4%的生铁的质量为n
n=840t
答:理论上日产含杂质4%的生铁的质量为840t。
一、单选题
1.下列某同学记录的实验现象中,正确的是
A.氢氧化钠固体溶于水吸收热量,使溶液温度降低
B.向“铜绿”中加入足量稀盐酸,固体逐渐消失
C.碳酸氢铵分解,产生氨气、二氧化碳气体
D.镁带燃烧发出耀眼红光,冒浓厚白烟
2.下列溶液的pH最小的是
A.使石蕊试液显蓝色的溶液 B.使石蕊试液显红色的溶液
C.使石蕊试液显紫色的溶液 D.使酚酞试液显红色的溶液
3.下列操作中,含有乳化过程的是
A.用汽油除去衣服上的油渍 B.用洗洁精洗涤碗筷上的油污
C.用稀盐酸除去水垢(主要成分CaCO3) D.用砂纸除去铁制品表面的铁锈
4.下列实验现象描述正确的是
A.打开盛有浓盐酸的试剂瓶,瓶口出现白烟
B.装有CO2的软塑料瓶倒入一定量的水,立即旋紧瓶盖振荡,塑料瓶变瘪
C.细铁丝在氧气中剧烈燃烧,火星四射,生成了四氧化三铁
D.向滴有酚酞试液的蒸馏水中加入氢氧化铜,溶液显红色
5.酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+,从而呈现酸性,主要用于饮料添加剂或药物工业原料,下列物质不能与酒石酸反应的是
A.CO2 B.CuO C.NaOH D.Mg
6.除去下列物质中的杂质,所选试剂及操作方法错误的是
选项 物质(括号内为杂质) 选用试剂及操作方法
A N2(水蒸气) 通过浓H2SO4
B CaO(CaCO3) 加入足量水,过滤
C CO2(O2) 通过灼热的铜网
D NaCl(泥沙) 加足量水溶解,过滤,蒸发
A.A B.B C.C D.D
7.对于下列实验操作的说法,错误的是
A.制取气体前先要检查装置的气密性 B.测溶液的pH之前先要把试纸湿润
C.加热试管时,局部加热前先均匀加热 D.点燃可燃性气体前先要检验气体的纯度
8.下列化学方程式符合题意且书写正确的是
A.铁在氧气中燃烧:
B.镁在空气中燃烧:
C.硫酸铜溶液和氢氧化钠溶液反应:
D.氢氧化镁与稀硫酸反应:
9.下列化学反应中既属于置换反应又是放热反应的是
A. B.
C. D.
10.下列实验基本操作规范的是
A.称量氢氧化钠 B.蒸发氯化钠溶液
C.稀释浓硫酸 D.测定溶液pH
11.下列物质的俗称或名称化学式都完全正确的是
A.氯化锌——ZnCl B.烧碱、火碱——NaOH
C.氧化铁——FeO D.水银——Ag
二、简答题
12.化学的学科特征是在原子、分子水平上研究物质和创造物质,请从微观角度解释下列问题:
(1)钠原子和钠离子化学性质不同;
(2)一氧化碳和二氧化碳化学性质不同;
(3)NaOH溶液和Ca(OH)2溶液都能使酚酞溶液变红。
13.如下图所示,在白色点滴板1~6的孔穴中,分别滴加稀硫酸。
(1)反应后溶液颜色有变化的是_____(填序号)。
(2)有一个孔穴中的物质不与稀硫酸反应,原因是_____。
(3)若用石灰水替代稀硫酸滴入孔穴5中,发生反应的化学方程式为_____。
三、推断题
14.A、B、C、D、E、F、G为常见的物质,其中B是黑色固体单质,D是红棕色固体,E是红色固体单质,G是密度最小的气体,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系。请回答:
(1)A物质的化学式为__________,气体G的化学式为____________。
(2)写出反应②的化学方程式:_____________________。
(3)写出反应③中生成红色固体的化学方程式:_____________________。
(4)产生气体G的原因是_____________________。
15.A﹣F均为初中化学常见的物质,它们之间的关系如图所示(部分物质已略去),其中D是石灰石的主要成分,C为最常见的液体,且C与E元素组成相同,A俗称熟石灰,(已知,物质之间“—”表示能反应,物质之间“→”表示前者能转化为后者)请回答下列问题:
(1)E的化学式为___________。
(2)写出B和C反应的化学方程式___________。
(3)写出A→D的化学方程式___________。
16.A-F是初中化学常见的物质,常温下A、B都是无色液体,D、E是两种组成元素相同的气体,F是石灰水的主要成分。各物质之间的相互关系如图所示(“一”表示相连的物质能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件己略去)。请回答。
(1)D物质的一种用途是______。
(2)C→B的转化不一定属于化合反应,例如:______(用反应物的化学式表示)。
(3)E→B反应的化学方程式:_________。
(4)B→F的反应过程中,____(填“吸收”或“放出”)热量。
四、实验题
17.某化学兴趣小组在研究酸和碱的化学性质时,想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
当滴入几滴酚酞试液后,溶液由无色变为______色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
实验方案 实验步骤 实验现象 实验结论
方案一 取样,滴入适量的氯化钡溶液 ______ 稀硫酸过量
方案二 取样,滴入几滴紫色石蕊试液 ______ 稀硫酸过量
写出稀硫酸与氯化钡溶液反应的化学方程式:______。
上述设计的实验方案中,正确的是______(填“方案一”或“方案二”)。另外一个实验方案错误的原因是______。
若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是______,实验现象及结论是______。
18.过度使用塑料袋已经造成了比较严重的“白色污染”,目前在超市、商场都不再提供免费的塑料袋。某化学研究小组的同学欲对某种塑料袋的组成中碳、氢元素含量进行测定,设计了下列实验,如图所示。
(资料显示:该种塑料袋只含碳、氢两种元素,燃烧产物为二氧化碳和水。)
(1)实验时,打开分液漏斗的活塞,将H2O2溶液滴入到A装置的_____(填仪器名称)中,排除装置内空气后,再点燃C处的酒精灯,使反应进行。
(2)装置A中发生反应的化学方程式为_____。
(3)装置B的作用是_____。
(4)在实验前后二次称量装置D,其目的是_____。
(5)实验过程中依据装置E的质量变化,即可得出反应生成二氧化碳的质量,进而计算出塑料碎屑中碳元素的含量,则装置F的作用是_____。
19.请结合下图回答问题:
(1)仪器名称:①_________;②_________。
(2)用高锰酸钾制取氧气,可选用的发生装置是_________(填序号),该反应的化学方程式为___________,该反应的基本反应类型是_________。
(3)实验室制取CO2,反应的化学方程式为__________,为方便控制反应的发生和停止,应选择的发生装置是__________(填序号)。
(4)下列气体可用G所示装置干燥、收集的是_________(填序号)。
①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3
五、计算题
20.实验室中稀硫酸因标签破损,需测定其质量分数。某化学兴趣小组的同学取该稀硫酸样品50g,逐滴加入质量分数为16%的NaOH溶液,溶液的pH随加入NaOH溶液质量的变化如图所示。
(1)图中A点时溶液中阴离子的符号是_____。
(2)求稀硫酸中溶质的质量分数(写出计算过程,计算结果精确到0.01%)。
21.某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应),进行如下实验,第一步反应的稀硫酸与生成的硫酸铁之间的质量关系如坐标图所示:
(1)上述实验过程中发生反应的化学方程式为_____________;
(2)根据已知条件列出求解第二步实验溶液中参加反应的物质质量(x)的比例式_____________;
(3)若用98%的浓酸硫配制实验所需的稀硫酸,则需要加水的质量为________;
(4)赤铁矿样品中Fe2O3的含量___________;
(5)在第二步实验结束后所得溶液中溶质的质量分数是________;
(6)该钢铁厂每天用上述赤铁矿石1800t来生产生铁,则理论上日产含杂质4%的生铁的质量为__________。
参考答案
1.B 2.B 3.B 4.B 5.A 6.B 7.B 8.C 9.D 10.B 11.B
12.(1)钠原子和钠离子最外层电子数不同,所以钠原子和钠离子化学性质不同
(2)一个一氧化碳分子由一个碳原子和一个氧原子构成,一个二氧化碳分子由一个碳原子和两个氧原子构成,分子结构不同一氧化碳和二氧化碳化学性质不同。
(3)NaOH溶液和Ca(OH)2溶液都能解离出氢氧根离子,都能使酚酞溶液变红。
13.3 在金属活动性顺序里,铜位于氢后,不与稀硫酸反应
14.
(1) CuO H2
(2)
(3)
(4)X溶液中含有过量的稀盐酸与Fe反应,产生氢气
15.
(1)H2O2
(2)
(3)
16.
(1)作燃料(或治炼金属)
(2)CH4和O2
(3)
(4)放出
17.
(1)红
(2) 产生白色沉淀 溶液变红 方案二 硫酸钠与氯化钡反应也生成白色沉淀 锌 有气泡产生,说明稀硫酸过量
18.
(1)锥形瓶
(2)2H2O22H2O+O2↑
(3)干燥氧气(吸收氧气中的水蒸气)
(4)测定反应生成水的质量,即可计算出塑料碎片中氢元素含量
(5)防止外界空气中的二氧化碳和水蒸气进入E装置影响碳元素含量测定
19.
(1) 铁架台 分液漏斗
(2) A 分解反应
(3) C
(4)①⑤⑥
20.
(1)Cl-
(2)解:设稀硫酸溶质质量分数为x。
x=7.84%
答:稀硫酸溶质质量分数7.84%。
21.
(1)
(2)
(3)255g
(4)解:设赤铁矿样品中氧化铁的含量为z
z=64%
答:赤铁矿样品中氧化铁的含量为64%;
(5)解:设在第二步实验结束后生成硫酸铁的质量为m
m=60g
故在第二步实验结束后所得溶液中溶质的质量分数是:
(6)解:设理论上日产含杂质4%的生铁的质量为n
n=840t
答:理论上日产含杂质4%的生铁的质量为840t。
