第八单元 海水中的化学 测试题—2021-2022学年九年级化学鲁教版下册(word版 含答案)
文档属性
| 名称 | 第八单元 海水中的化学 测试题—2021-2022学年九年级化学鲁教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 166.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-08 10:57:19 | ||
图片预览



文档简介
第八单元《海水中的化学》测试题
一、单选题
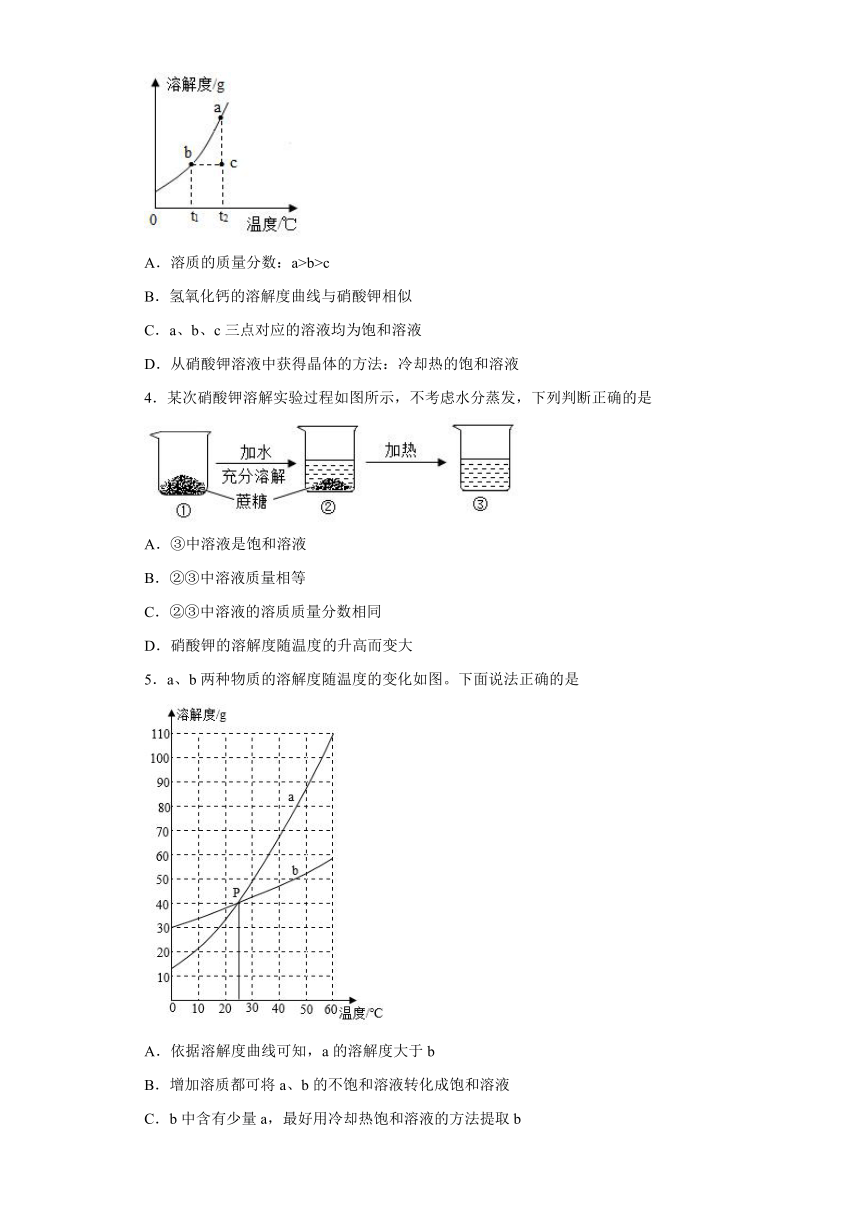
1.实验中出现异常情况的原因分析,错误的是
A.浑浊的液体过滤后仍然浑浊:液面低于滤纸边缘
B.点燃氢气时发生爆炸:点燃前没有检验纯度
C.粗盐提纯的产率偏低:溶解粗盐的水量可能过少
D.用启普发生器制取 CO2,关闭活塞后固液无法分离:稀盐酸可能已反应完
2.下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是
温度℃ 0 20 40 60 80 100
溶解度/g A 27.6 37.0 50.0 59.5 69.1 77.8
B 13.3 36.6 75.9 120 172 246
A.A、B两种物质都属于微溶物
B.40℃时,将20gA加入到50g水中,充分溶解可获得A的饱和溶液
C.60℃时,B物质的饱和溶液中溶质和溶剂的质量比为15:6
D.给出的曲线中①与B物质溶解度变化趋势相符
3.硝酸钾的溶解度曲线如图所示。下列说法正确的是
A.溶质的质量分数:a>b>c
B.氢氧化钙的溶解度曲线与硝酸钾相似
C.a、b、c三点对应的溶液均为饱和溶液
D.从硝酸钾溶液中获得晶体的方法:冷却热的饱和溶液
4.某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
5.a、b两种物质的溶解度随温度的变化如图。下面说法正确的是
A.依据溶解度曲线可知,a的溶解度大于b
B.增加溶质都可将a、b的不饱和溶液转化成饱和溶液
C.b中含有少量a,最好用冷却热饱和溶液的方法提取b
D.P点表示该温度下,a、b的饱和溶液中溶质质量相等
6.下列实验操作中(括号内为待检验物质或杂质)能达到实验目的的是
选项 物质 目的 主要实验操作
A CO(H2) 检验 点燃,火焰上方罩干冷烧杯,观察现象
B K2MnO4(KMnO4)固体 除杂 加热至固体质量不再发生变化
C NaCl溶液、蒸馏水 鉴别 取样,加入肥皂水,观察现象
D KCl和NaCl的混合物 分离 溶解、过滤、洗涤、烘干、蒸发
A.A B.B C.C D.D
7.逻辑推理是学习化学的一种重要方法。下列推理得出的相关结论合理的是
A.化合物中含有不同种元素,由不同元素组成的物质一定是化合物
B.燃烧都伴随着发光、放热,所以有发光、放热现象的就是燃烧
C.碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性
D.复分解反应有沉淀、气体或水生成,有沉淀、气体或水生成的反应就是复分解反应
8.下图表示的是某些物质在常温下的近似pH,下列说法错误的是
A.向厨房清洁剂中滴加几滴石蕊试液,试液变蓝
B.正常雨水显中性
C.酸雨的形成通常与空气中的二氧化硫和氮氧化物有关
D.将小苏打加入到苹果汁中,可能会产生气泡
9.下列叙述中,属于正确的实验现象描述的是
A.木炭在氧气中燃烧,发出红光,生成黑色固体
B.铁在空气中剧烈燃烧,火星四射,生成红色固体
C.氢氧化钠溶液中滴加硫酸铜溶液产生蓝色的沉淀物,加热后变成黑色
D.红磷在空气中燃烧产生大量的白雾,放出热量,生成白色的气体
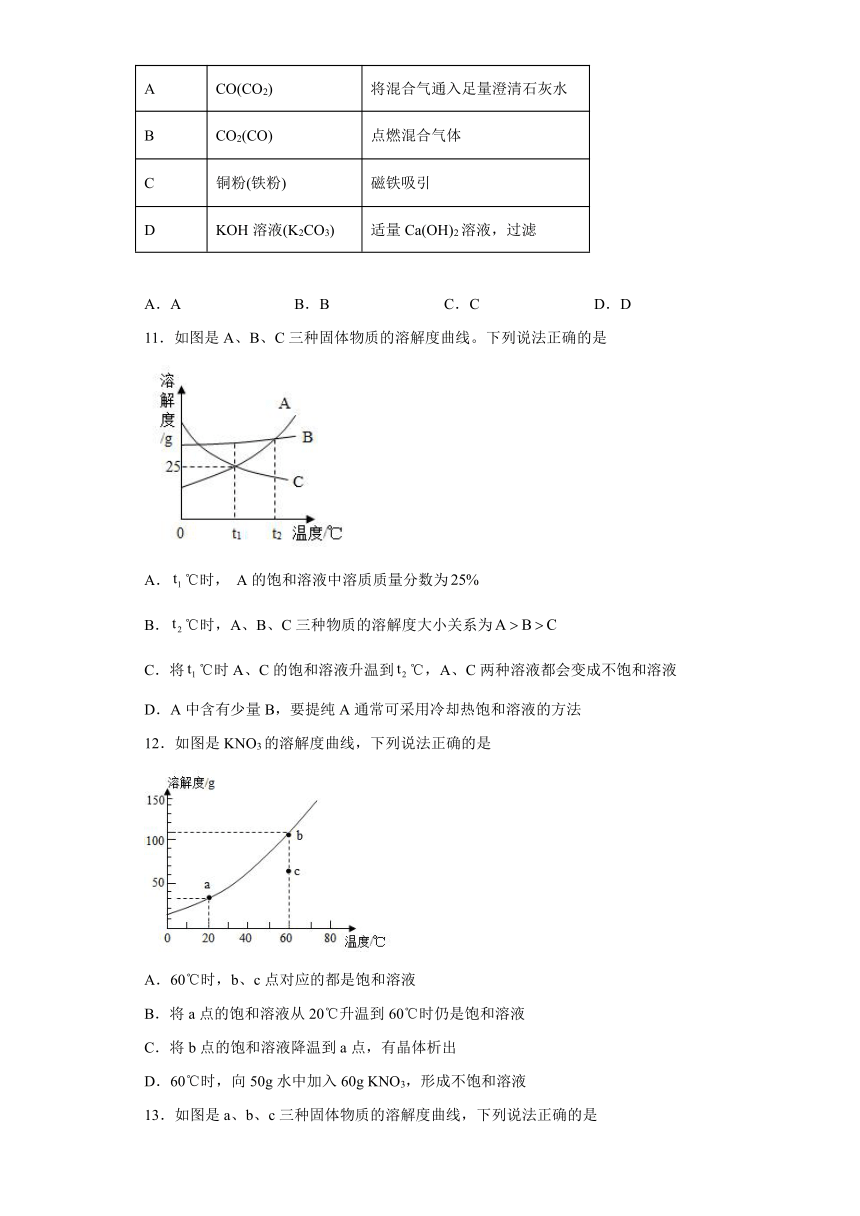
10.下列除去少量杂质(括号内为杂质)的方法不合理的序号组是
序号 混合物 试剂或方法
A CO(CO2) 将混合气通入足量澄清石灰水
B CO2(CO) 点燃混合气体
C 铜粉(铁粉) 磁铁吸引
D KOH溶液(K2CO3) 适量Ca(OH)2溶液,过滤
A.A B.B C.C D.D
11.如图是A、B、C三种固体物质的溶解度曲线。下列说法正确的是
A.℃时, A的饱和溶液中溶质质量分数为
B.℃时,A、B、C三种物质的溶解度大小关系为
C.将℃时A、C的饱和溶液升温到℃,A、C两种溶液都会变成不饱和溶液
D.A中含有少量B,要提纯A通常可采用冷却热饱和溶液的方法
12.如图是KNO3的溶解度曲线,下列说法正确的是
A.60℃时,b、c点对应的都是饱和溶液
B.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
C.将b点的饱和溶液降温到a点,有晶体析出
D.60℃时,向50g水中加入60g KNO3,形成不饱和溶液
13.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,将5ga加入到20g水中充分搅拌,可得到25ga的饱和溶液度-
B.t2℃时将N点的a溶液转变为M点的a溶液,可加水实现
C.将t1℃时c的饱和溶液升温到t2℃,其溶质质量分数不变
D.t2℃时,分别将a、b、c的饱和溶液恒温蒸发相同质量的水,a析出固体的质量最大
14.下列有关物质的检验、鉴别、除杂的做法中正确的是
A.用碳酸钠溶液鉴别稀盐酸和稀硫酸
B.NaCl溶液中混有少量Na2SO4,加入过量的氯化钡溶液,过滤
C.除去CO2气体中混有的少量HCl,可将其通过足量的NaOH溶液
D.CaCl2溶液中混有少量稀盐酸,加入过量碳酸钙粉末充分反应后过滤
15.小亮同学在实验室中制取CO2气体后,对废液进行后续探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液。实验过程中加入Na2CO3溶液的质量与产生沉淀或者气体关系如图1所示,加入Na2CO3溶液的质量与溶液的pH变化关系如图2所示,下列说法正确的是
A.图1中b→c段表示生成气体的过程
B.图1中横轴上x点的值为106
C.图2中h→k段没有发生化学反应
D.图1中c点时,溶液中的溶质有两种
二、填空题
16.海水“晒盐”主要发生___________(选填“物理”或“化学”)变化,“海水晒盐”利用___________的原理进行结晶,析出晶体后的“母液”一定为氯化钠的___________(选填“饱和”或“不饱和”)溶液,氯化钠是由___________构成的(选填“分子”、“原子”或“离子”)。
17.我国将力争于 2030 年前达到峰值,2060 年前实现碳中和。
(1)大气中 CO2 的产生主要来自化石燃料的燃烧,化石燃料属于______(填“可再生”或“不可再生”)能源。
(2)控制 CO2 的排放,目的是为减缓______效应。
(3)加压水洗法可捕集 CO2,是因为压强增大时 CO2 在水中的溶解度______(填“增大”或“减小”)。
(4)我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(化学式为 CH3OH) 和水。
I、该反应的化学方程式为______。
II、甲醇由______种元素组成,2mol 甲醇分子中约含______个氧原子(用科学计数法表示)。
18.2020年9月,中国向世界宜布了2030年前实现“碳达峰”、2060年前实现“碳中和”的目标。
(1)实现“碳中和”,能源转型首当其冲,氢能是绿色能源,光伏发电可为电解水制氢气提供电能,电解水的化学方程式为______。光伏发电用到的高纯硅可用SiO2制取,SiO2中Si元素的化合价为______。
(2)CO2的捕获与封存也是实现膜中和的重要途径,有科学家提出设想:将排放到空气中的二氧化碳液化后压入到冰冷的深海中进行封存,二氧化碳在深海中溶解度比在通常状况下水中的溶解度______(填“大”、“小”或“不变”),原因是______。
(3)CO2若合理利用,也是一种重要原料。CO2与H2在催化条件下能反应生成甲醇(CH4O),反应的化学方程式为,X的化学式为______,CH4O由______种不同元素组成,1molCH4O中约含______个碳原子。
19.NaCl、KNO3两种固体的溶解度曲线如图1。
(1)20℃时,硝酸钾的溶解度为______。
(2)提纯混合溶液中的硝酸钾,进行如图2实验。操作Ⅱ的名称为______。
(3)20℃时,将等质量的NaCl、KNO3固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如图3,加热到60℃时现象如图4(不考虑水分蒸发)。
请根据图1回答:甲烧杯中加入的固体是______(填“KNO3”或“NaCl”)。对乙烧杯中溶液的分析,正确的是______(选填编号)。
A.从20℃升温到60℃,溶质质量没有改变
B.若对20℃溶液降温,一定会析出晶体
C.20℃时,溶质与溶剂的质量比为31.6:100
D.60℃时,溶液一定是不饱和溶液
20.有同学依据Na、Ca、Fe三种元素在某些物质中的化合价,与这些物质所属类别结合,构建了下图所示的关系图。
请回答下列问题:
(1)A、B、C含有相同的金属元素;A与水接触生成B,同时放出大量的热。
①A的名称为________;B在生产生活中的一种用途是_________。
②在B溶液中加入一定量D溶液,可生成C和E。反应的化学方程式为__________。
(2)F、G均可与稀盐酸反应,分别生成含该金属元素的两种盐。写出其中一个反应的化学方程式__________。
21.“水为食之先”,对水的研究让我们对化学有了更深刻的认识。
(1)硬水会给生产生活带来不同程度的危害。区分硬水和软水常用的物质是______,生活中可用______的方法来降低水的硬度。
(2)图1为实验室电解水装置:与a管相连的是电源的______(填“正极”或“负极”)。检验a管中气体的操作及现象是______。
(3)图2为甲、乙两种固体物质的溶解度曲线。
①t1℃时,将10g乙物质放入100g水中,充分溶解后所得的溶液是______(填“饱和”或“不饱和”)溶液。
②t2℃时,甲物质的溶解度为______;该温度下将36g甲物质放入100g水中,若要使甲物质完全溶解,至少应再加入______g水。
三、推断题
22.A、B、C、D为初中化学常见的四种物质,它们之间存在如图所示的转化关系,其中D是一种白色沉淀且相对分子质量为100,B和C为气体,组成元素相同。“→”表示相连的物质之间可以转化。请回答下列问题:
(1)写出C→D的化学反应方程式______。
(2)B和C化学性质不同的原因______。
23.A~E为初中化学五种不同类别的常见物质。已知C含有两种元素,E为世界年产量最高的金属,B的俗称是火碱或烧碱,D为红棕色固体。“—”表示相连的物质能相互反应,“→”表示一种物质转化为另一种物质,请回答下列问题:
(1)物质E是___________(填化学式)
(2)写出B物质的一点用途___________。
(3)写出下列反应的化学方程式:C+E:___________D→E:___________。
四、实验题
24.根据下列实验回答问题。
实验一:炎热的夏天,在家中可以自制汽水来消暑解热。
(制备材料)1.5g小苏打、1.5g柠檬酸、蔗糖、果汁、凉开水、500mL饮料瓶
(制备流程)
(问题讨论)
(1)步骤②中用凉开水制汽水的原因___________。
(2)制汽水时,利用了小苏打能与柠檬酸反应产生气体的性质,为证明柠檬酸溶液中有H+,可以选择下列物质中的 进行验证(填字母)·
A.镁带 B.铜片 C.食盐 D.鸡蛋壳(主要成分碳酸钙)
实验二:据《四川盐法治》记载,“敞锅熬盐”的主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,用木棒不断搅拌,析出粗盐;③用“花水”冲洗粗盐得精品盐。
(3)步骤②中,析出粗盐的过程,当________停止加热,木棒的作用是__________。
(4)步骤③中用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl。则“花水”应当是 (填字母)。
A.蒸馏水 B.饱和NaCl溶液 C.饱和NaOH溶液 D.饱和BaCl2溶液
五、计算题
25.向一锥形瓶中加入100g某品牌的洁厕灵(有效成分为HCl),再逐次加入相同质量分数的Na2CO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
次数 第一次 第二次 第三次 第四次 第五次
加入Na2CO3溶液的质量/g 40 40 40 40 40
反应后溶液的总质量/g 138.9 177.8 216.7 255.6 295.6
计算:
(1)100g洁厕灵反应完全后,共生成_________g二氧化碳。
(2)洁厕灵中溶质的质量分数是______?
26.某补钙剂其主要成分为碳酸钙,先将100g稀盐酸分为5等份,逐次加入到用40g该补钙剂制成的粉末中(其它成分不与盐酸反应且不溶于水),得到部分数据与图像。请回答以下问题:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量(g) 20 20 20 20 20
剩余固体的质量(g) 35 30 25 20 a
(1)表格中a的值为______;
(2)求m的值。(精确到0.1,要求写出化学反应方程式和必要的计算过程)
参考答案
1.A 2.D 3.D 4.D 5.B 6.A 7.C 8.B 9.C 10.B 11.D 12.C 13.D 14.D 15.B
16.物理 蒸发溶剂 饱和 离子
17.(1)不可再生(2)温室(3)增大
(4) 三 1.204×1024
18.(1) +4##+4价
(2) 大 温度越低,压强越大,气体的溶解度增大
(3) H2O 3三 6.02×1023
19.(1)31.6g
(2)降温结晶
(3) KNO3 AD
20.(1) 氧化钙 改良酸性土壤
(2)Fe +2HCl=FeCl2 +H2↑(或Fe2O3 +6HCl=2FeCl3 +3H2O)
21.(1) 肥皂水 煮沸
(2) 正极 将带火星的木条放在a管口处,若木条复燃,说明a管产生的气体是氧气
(3) 不饱和 30g 20
22.(1)
(2)分子构成不同
23.(1)Fe
(2)作干燥剂
(3) Fe+2HCl=FeCl2+H2↑ Fe2O3+3CO2Fe+3CO2
24.(1)CO2的溶解度随温度的降低而增大,凉开水温度低,溶解的CO2较多
(2)AD
(3) 敞口锅中出现较多量晶体 搅拌,防止液体因局部温度过高,造成液滴飞溅
(4)B
25.(1)4.4
(2)设100g洁厕灵中含有HCl的质量为x。
x=7.3g
洁厕灵中溶质的质量分数=×100%=7.3%
答:洁厕灵中溶质的质量分数是7.3%。
26.(1)20
(2)解:由图可知,参加反应的碳酸钙的质量=40g 20g=20g
设反应生成二氧化碳的质量为x
=
x=8.8g,即m的值为8.8
答:m的值为8.8。
一、单选题
1.实验中出现异常情况的原因分析,错误的是
A.浑浊的液体过滤后仍然浑浊:液面低于滤纸边缘
B.点燃氢气时发生爆炸:点燃前没有检验纯度
C.粗盐提纯的产率偏低:溶解粗盐的水量可能过少
D.用启普发生器制取 CO2,关闭活塞后固液无法分离:稀盐酸可能已反应完
2.下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是
温度℃ 0 20 40 60 80 100
溶解度/g A 27.6 37.0 50.0 59.5 69.1 77.8
B 13.3 36.6 75.9 120 172 246
A.A、B两种物质都属于微溶物
B.40℃时,将20gA加入到50g水中,充分溶解可获得A的饱和溶液
C.60℃时,B物质的饱和溶液中溶质和溶剂的质量比为15:6
D.给出的曲线中①与B物质溶解度变化趋势相符
3.硝酸钾的溶解度曲线如图所示。下列说法正确的是
A.溶质的质量分数:a>b>c
B.氢氧化钙的溶解度曲线与硝酸钾相似
C.a、b、c三点对应的溶液均为饱和溶液
D.从硝酸钾溶液中获得晶体的方法:冷却热的饱和溶液
4.某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
5.a、b两种物质的溶解度随温度的变化如图。下面说法正确的是
A.依据溶解度曲线可知,a的溶解度大于b
B.增加溶质都可将a、b的不饱和溶液转化成饱和溶液
C.b中含有少量a,最好用冷却热饱和溶液的方法提取b
D.P点表示该温度下,a、b的饱和溶液中溶质质量相等
6.下列实验操作中(括号内为待检验物质或杂质)能达到实验目的的是
选项 物质 目的 主要实验操作
A CO(H2) 检验 点燃,火焰上方罩干冷烧杯,观察现象
B K2MnO4(KMnO4)固体 除杂 加热至固体质量不再发生变化
C NaCl溶液、蒸馏水 鉴别 取样,加入肥皂水,观察现象
D KCl和NaCl的混合物 分离 溶解、过滤、洗涤、烘干、蒸发
A.A B.B C.C D.D
7.逻辑推理是学习化学的一种重要方法。下列推理得出的相关结论合理的是
A.化合物中含有不同种元素,由不同元素组成的物质一定是化合物
B.燃烧都伴随着发光、放热,所以有发光、放热现象的就是燃烧
C.碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性
D.复分解反应有沉淀、气体或水生成,有沉淀、气体或水生成的反应就是复分解反应
8.下图表示的是某些物质在常温下的近似pH,下列说法错误的是
A.向厨房清洁剂中滴加几滴石蕊试液,试液变蓝
B.正常雨水显中性
C.酸雨的形成通常与空气中的二氧化硫和氮氧化物有关
D.将小苏打加入到苹果汁中,可能会产生气泡
9.下列叙述中,属于正确的实验现象描述的是
A.木炭在氧气中燃烧,发出红光,生成黑色固体
B.铁在空气中剧烈燃烧,火星四射,生成红色固体
C.氢氧化钠溶液中滴加硫酸铜溶液产生蓝色的沉淀物,加热后变成黑色
D.红磷在空气中燃烧产生大量的白雾,放出热量,生成白色的气体
10.下列除去少量杂质(括号内为杂质)的方法不合理的序号组是
序号 混合物 试剂或方法
A CO(CO2) 将混合气通入足量澄清石灰水
B CO2(CO) 点燃混合气体
C 铜粉(铁粉) 磁铁吸引
D KOH溶液(K2CO3) 适量Ca(OH)2溶液,过滤
A.A B.B C.C D.D
11.如图是A、B、C三种固体物质的溶解度曲线。下列说法正确的是
A.℃时, A的饱和溶液中溶质质量分数为
B.℃时,A、B、C三种物质的溶解度大小关系为
C.将℃时A、C的饱和溶液升温到℃,A、C两种溶液都会变成不饱和溶液
D.A中含有少量B,要提纯A通常可采用冷却热饱和溶液的方法
12.如图是KNO3的溶解度曲线,下列说法正确的是
A.60℃时,b、c点对应的都是饱和溶液
B.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
C.将b点的饱和溶液降温到a点,有晶体析出
D.60℃时,向50g水中加入60g KNO3,形成不饱和溶液
13.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,将5ga加入到20g水中充分搅拌,可得到25ga的饱和溶液度-
B.t2℃时将N点的a溶液转变为M点的a溶液,可加水实现
C.将t1℃时c的饱和溶液升温到t2℃,其溶质质量分数不变
D.t2℃时,分别将a、b、c的饱和溶液恒温蒸发相同质量的水,a析出固体的质量最大
14.下列有关物质的检验、鉴别、除杂的做法中正确的是
A.用碳酸钠溶液鉴别稀盐酸和稀硫酸
B.NaCl溶液中混有少量Na2SO4,加入过量的氯化钡溶液,过滤
C.除去CO2气体中混有的少量HCl,可将其通过足量的NaOH溶液
D.CaCl2溶液中混有少量稀盐酸,加入过量碳酸钙粉末充分反应后过滤
15.小亮同学在实验室中制取CO2气体后,对废液进行后续探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液。实验过程中加入Na2CO3溶液的质量与产生沉淀或者气体关系如图1所示,加入Na2CO3溶液的质量与溶液的pH变化关系如图2所示,下列说法正确的是
A.图1中b→c段表示生成气体的过程
B.图1中横轴上x点的值为106
C.图2中h→k段没有发生化学反应
D.图1中c点时,溶液中的溶质有两种
二、填空题
16.海水“晒盐”主要发生___________(选填“物理”或“化学”)变化,“海水晒盐”利用___________的原理进行结晶,析出晶体后的“母液”一定为氯化钠的___________(选填“饱和”或“不饱和”)溶液,氯化钠是由___________构成的(选填“分子”、“原子”或“离子”)。
17.我国将力争于 2030 年前达到峰值,2060 年前实现碳中和。
(1)大气中 CO2 的产生主要来自化石燃料的燃烧,化石燃料属于______(填“可再生”或“不可再生”)能源。
(2)控制 CO2 的排放,目的是为减缓______效应。
(3)加压水洗法可捕集 CO2,是因为压强增大时 CO2 在水中的溶解度______(填“增大”或“减小”)。
(4)我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(化学式为 CH3OH) 和水。
I、该反应的化学方程式为______。
II、甲醇由______种元素组成,2mol 甲醇分子中约含______个氧原子(用科学计数法表示)。
18.2020年9月,中国向世界宜布了2030年前实现“碳达峰”、2060年前实现“碳中和”的目标。
(1)实现“碳中和”,能源转型首当其冲,氢能是绿色能源,光伏发电可为电解水制氢气提供电能,电解水的化学方程式为______。光伏发电用到的高纯硅可用SiO2制取,SiO2中Si元素的化合价为______。
(2)CO2的捕获与封存也是实现膜中和的重要途径,有科学家提出设想:将排放到空气中的二氧化碳液化后压入到冰冷的深海中进行封存,二氧化碳在深海中溶解度比在通常状况下水中的溶解度______(填“大”、“小”或“不变”),原因是______。
(3)CO2若合理利用,也是一种重要原料。CO2与H2在催化条件下能反应生成甲醇(CH4O),反应的化学方程式为,X的化学式为______,CH4O由______种不同元素组成,1molCH4O中约含______个碳原子。
19.NaCl、KNO3两种固体的溶解度曲线如图1。
(1)20℃时,硝酸钾的溶解度为______。
(2)提纯混合溶液中的硝酸钾,进行如图2实验。操作Ⅱ的名称为______。
(3)20℃时,将等质量的NaCl、KNO3固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如图3,加热到60℃时现象如图4(不考虑水分蒸发)。
请根据图1回答:甲烧杯中加入的固体是______(填“KNO3”或“NaCl”)。对乙烧杯中溶液的分析,正确的是______(选填编号)。
A.从20℃升温到60℃,溶质质量没有改变
B.若对20℃溶液降温,一定会析出晶体
C.20℃时,溶质与溶剂的质量比为31.6:100
D.60℃时,溶液一定是不饱和溶液
20.有同学依据Na、Ca、Fe三种元素在某些物质中的化合价,与这些物质所属类别结合,构建了下图所示的关系图。
请回答下列问题:
(1)A、B、C含有相同的金属元素;A与水接触生成B,同时放出大量的热。
①A的名称为________;B在生产生活中的一种用途是_________。
②在B溶液中加入一定量D溶液,可生成C和E。反应的化学方程式为__________。
(2)F、G均可与稀盐酸反应,分别生成含该金属元素的两种盐。写出其中一个反应的化学方程式__________。
21.“水为食之先”,对水的研究让我们对化学有了更深刻的认识。
(1)硬水会给生产生活带来不同程度的危害。区分硬水和软水常用的物质是______,生活中可用______的方法来降低水的硬度。
(2)图1为实验室电解水装置:与a管相连的是电源的______(填“正极”或“负极”)。检验a管中气体的操作及现象是______。
(3)图2为甲、乙两种固体物质的溶解度曲线。
①t1℃时,将10g乙物质放入100g水中,充分溶解后所得的溶液是______(填“饱和”或“不饱和”)溶液。
②t2℃时,甲物质的溶解度为______;该温度下将36g甲物质放入100g水中,若要使甲物质完全溶解,至少应再加入______g水。
三、推断题
22.A、B、C、D为初中化学常见的四种物质,它们之间存在如图所示的转化关系,其中D是一种白色沉淀且相对分子质量为100,B和C为气体,组成元素相同。“→”表示相连的物质之间可以转化。请回答下列问题:
(1)写出C→D的化学反应方程式______。
(2)B和C化学性质不同的原因______。
23.A~E为初中化学五种不同类别的常见物质。已知C含有两种元素,E为世界年产量最高的金属,B的俗称是火碱或烧碱,D为红棕色固体。“—”表示相连的物质能相互反应,“→”表示一种物质转化为另一种物质,请回答下列问题:
(1)物质E是___________(填化学式)
(2)写出B物质的一点用途___________。
(3)写出下列反应的化学方程式:C+E:___________D→E:___________。
四、实验题
24.根据下列实验回答问题。
实验一:炎热的夏天,在家中可以自制汽水来消暑解热。
(制备材料)1.5g小苏打、1.5g柠檬酸、蔗糖、果汁、凉开水、500mL饮料瓶
(制备流程)
(问题讨论)
(1)步骤②中用凉开水制汽水的原因___________。
(2)制汽水时,利用了小苏打能与柠檬酸反应产生气体的性质,为证明柠檬酸溶液中有H+,可以选择下列物质中的 进行验证(填字母)·
A.镁带 B.铜片 C.食盐 D.鸡蛋壳(主要成分碳酸钙)
实验二:据《四川盐法治》记载,“敞锅熬盐”的主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,用木棒不断搅拌,析出粗盐;③用“花水”冲洗粗盐得精品盐。
(3)步骤②中,析出粗盐的过程,当________停止加热,木棒的作用是__________。
(4)步骤③中用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl。则“花水”应当是 (填字母)。
A.蒸馏水 B.饱和NaCl溶液 C.饱和NaOH溶液 D.饱和BaCl2溶液
五、计算题
25.向一锥形瓶中加入100g某品牌的洁厕灵(有效成分为HCl),再逐次加入相同质量分数的Na2CO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
次数 第一次 第二次 第三次 第四次 第五次
加入Na2CO3溶液的质量/g 40 40 40 40 40
反应后溶液的总质量/g 138.9 177.8 216.7 255.6 295.6
计算:
(1)100g洁厕灵反应完全后,共生成_________g二氧化碳。
(2)洁厕灵中溶质的质量分数是______?
26.某补钙剂其主要成分为碳酸钙,先将100g稀盐酸分为5等份,逐次加入到用40g该补钙剂制成的粉末中(其它成分不与盐酸反应且不溶于水),得到部分数据与图像。请回答以下问题:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量(g) 20 20 20 20 20
剩余固体的质量(g) 35 30 25 20 a
(1)表格中a的值为______;
(2)求m的值。(精确到0.1,要求写出化学反应方程式和必要的计算过程)
参考答案
1.A 2.D 3.D 4.D 5.B 6.A 7.C 8.B 9.C 10.B 11.D 12.C 13.D 14.D 15.B
16.物理 蒸发溶剂 饱和 离子
17.(1)不可再生(2)温室(3)增大
(4) 三 1.204×1024
18.(1) +4##+4价
(2) 大 温度越低,压强越大,气体的溶解度增大
(3) H2O 3三 6.02×1023
19.(1)31.6g
(2)降温结晶
(3) KNO3 AD
20.(1) 氧化钙 改良酸性土壤
(2)Fe +2HCl=FeCl2 +H2↑(或Fe2O3 +6HCl=2FeCl3 +3H2O)
21.(1) 肥皂水 煮沸
(2) 正极 将带火星的木条放在a管口处,若木条复燃,说明a管产生的气体是氧气
(3) 不饱和 30g 20
22.(1)
(2)分子构成不同
23.(1)Fe
(2)作干燥剂
(3) Fe+2HCl=FeCl2+H2↑ Fe2O3+3CO2Fe+3CO2
24.(1)CO2的溶解度随温度的降低而增大,凉开水温度低,溶解的CO2较多
(2)AD
(3) 敞口锅中出现较多量晶体 搅拌,防止液体因局部温度过高,造成液滴飞溅
(4)B
25.(1)4.4
(2)设100g洁厕灵中含有HCl的质量为x。
x=7.3g
洁厕灵中溶质的质量分数=×100%=7.3%
答:洁厕灵中溶质的质量分数是7.3%。
26.(1)20
(2)解:由图可知,参加反应的碳酸钙的质量=40g 20g=20g
设反应生成二氧化碳的质量为x
=
x=8.8g,即m的值为8.8
答:m的值为8.8。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
