人教版九年级化学下册 10.3实验活动6 酸、碱的化学性质 课件(共12张PPT)
文档属性
| 名称 | 人教版九年级化学下册 10.3实验活动6 酸、碱的化学性质 课件(共12张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 469.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-09 17:24:09 | ||
图片预览


文档简介
(共12张PPT)
第十单元 酸和碱
实验活动6 酸、碱的化学性质
情景导入
复习:盐酸、硫酸、氢氧化钠、氢氧化钙的主要化学性质有哪些?通过实验再具体认识。
自学互研
知识一
酸、碱与指示剂的作用
实验用品
试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴。
稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
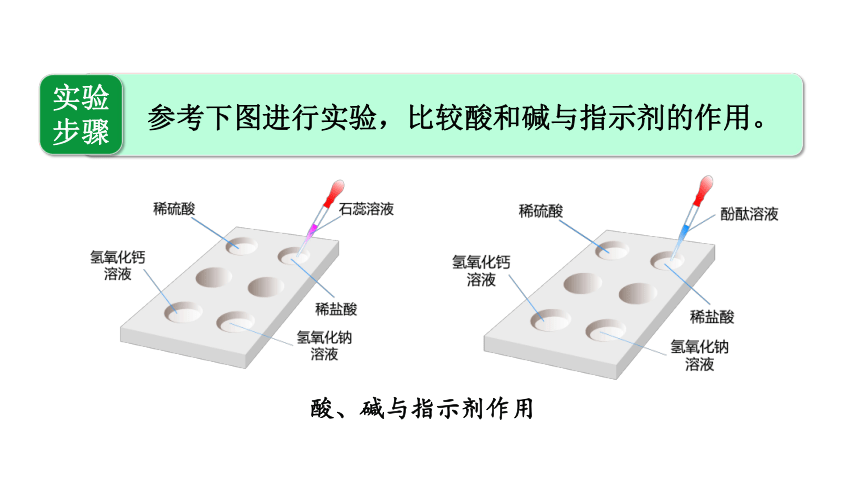
实验步骤
参考下图进行实验,比较酸和碱与指示剂的作用。
酸、碱与指示剂作用
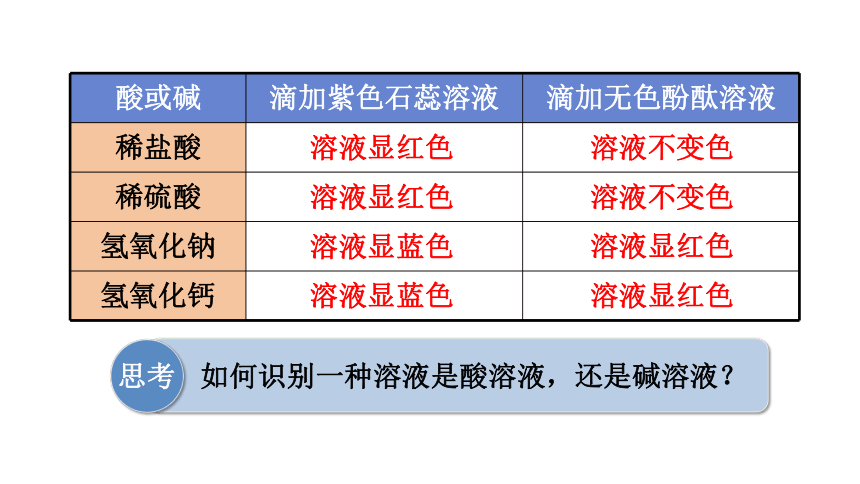
酸或碱 滴加紫色石蕊溶液 滴加无色酚酞溶液
稀盐酸
稀硫酸
氢氧化钠
氢氧化钙
溶液显红色
溶液显红色
溶液显蓝色
溶液显蓝色
溶液不变色
溶液不变色
溶液显红色
溶液显红色
思考
如何识别一种溶液是酸溶液,还是碱溶液?
知识二
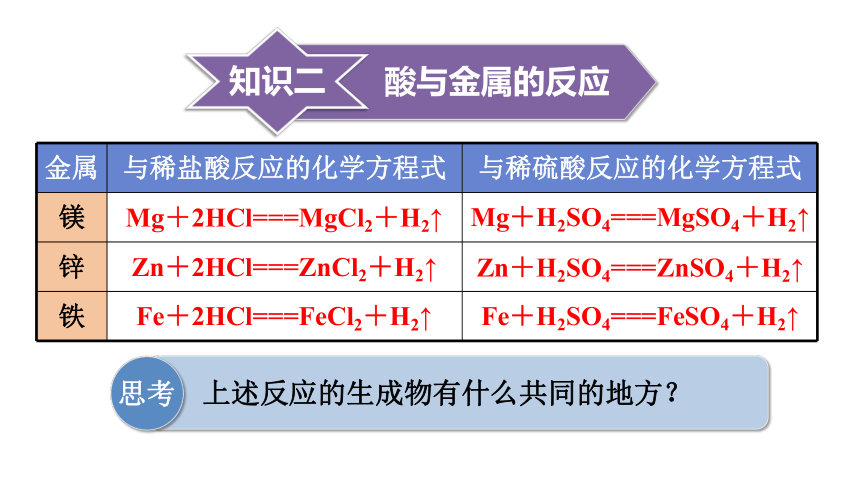
酸与金属的反应
金属 与稀盐酸反应的化学方程式 与稀硫酸反应的化学方程式
镁
锌
铁
Mg+2HCl===MgCl2+H2↑
Zn+2HCl===ZnCl2+H2↑
Fe+2HCl===FeCl2+H2↑
Mg+H2SO4===MgSO4+H2↑
Zn+H2SO4===ZnSO4+H2↑
Fe+H2SO4===FeSO4+H2↑
思考
上述反应的生成物有什么共同的地方?
知识三
酸与金属氧化物的反应
实验步骤
将生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管里,过一会儿将铁钉取出后,观察铁钉表面和溶液颜色有什么变化?
实验 现象 化学方程式
铁锈+稀盐酸
铁锈+稀硫酸
铁锈逐渐溶解,溶液由无色变为黄色
Fe2O3+6HCl===2FeCl3+3H2O
铁锈逐渐溶解,溶液由无色变为黄色
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
思考
根据以上实验和讨论,归纳出盐酸、硫酸等具有哪些相似的化学性质?
知识四
碱与非金属氧化物的反应
将气体通入澄清石灰水,观察石灰水是否变浑浊;Ca(OH)2+CO2===CaCO3↓+H2O。
1.实验室如何检验二氧化碳气体?反应的化学方程式是什么?
2NaOH+CO2===Na2CO3+H2O
2.氢氧化钠与氢氧化钙具有相似的化学性质,请写出相应的化学方程式。
知识五
酸与碱发生中和反应
实验步骤
1.按要求完成实验:在烧杯中加入10 mL氢氧化钠溶液,滴入几滴无色酚酞溶液,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变为无色为止。这是什么反应?写出化学反应的方程式。
中和反应;
HCl+NaOH===NaCl+H2O。
实验步骤
2.向两支试管中各加入相同质量(约1~2 g)的氢氧化钙粉末,然后各加入10 mL水,振荡;
①氢氧化钙不易溶于水,即微溶于水。
②无色酚酞溶液显示红色。
③氢氧化钙粉末逐渐溶解形成无色溶液。
再各加入几滴无色酚酞溶液,观察现象;
再用滴管向其中一支试管滴入1 mL水,向另一支试管慢慢滴入稀盐酸并不断振荡,比较两支试管中的现象。
实验步骤
3.完成下列两个反应的化学方程式:
2HCl+Ca(OH)2===________________。
H2SO4+2NaOH===________________。
CaCl2+2H2O
Na2SO4+2H2O
第十单元 酸和碱
实验活动6 酸、碱的化学性质
情景导入
复习:盐酸、硫酸、氢氧化钠、氢氧化钙的主要化学性质有哪些?通过实验再具体认识。
自学互研
知识一
酸、碱与指示剂的作用
实验用品
试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴。
稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
实验步骤
参考下图进行实验,比较酸和碱与指示剂的作用。
酸、碱与指示剂作用
酸或碱 滴加紫色石蕊溶液 滴加无色酚酞溶液
稀盐酸
稀硫酸
氢氧化钠
氢氧化钙
溶液显红色
溶液显红色
溶液显蓝色
溶液显蓝色
溶液不变色
溶液不变色
溶液显红色
溶液显红色
思考
如何识别一种溶液是酸溶液,还是碱溶液?
知识二
酸与金属的反应
金属 与稀盐酸反应的化学方程式 与稀硫酸反应的化学方程式
镁
锌
铁
Mg+2HCl===MgCl2+H2↑
Zn+2HCl===ZnCl2+H2↑
Fe+2HCl===FeCl2+H2↑
Mg+H2SO4===MgSO4+H2↑
Zn+H2SO4===ZnSO4+H2↑
Fe+H2SO4===FeSO4+H2↑
思考
上述反应的生成物有什么共同的地方?
知识三
酸与金属氧化物的反应
实验步骤
将生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管里,过一会儿将铁钉取出后,观察铁钉表面和溶液颜色有什么变化?
实验 现象 化学方程式
铁锈+稀盐酸
铁锈+稀硫酸
铁锈逐渐溶解,溶液由无色变为黄色
Fe2O3+6HCl===2FeCl3+3H2O
铁锈逐渐溶解,溶液由无色变为黄色
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
思考
根据以上实验和讨论,归纳出盐酸、硫酸等具有哪些相似的化学性质?
知识四
碱与非金属氧化物的反应
将气体通入澄清石灰水,观察石灰水是否变浑浊;Ca(OH)2+CO2===CaCO3↓+H2O。
1.实验室如何检验二氧化碳气体?反应的化学方程式是什么?
2NaOH+CO2===Na2CO3+H2O
2.氢氧化钠与氢氧化钙具有相似的化学性质,请写出相应的化学方程式。
知识五
酸与碱发生中和反应
实验步骤
1.按要求完成实验:在烧杯中加入10 mL氢氧化钠溶液,滴入几滴无色酚酞溶液,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变为无色为止。这是什么反应?写出化学反应的方程式。
中和反应;
HCl+NaOH===NaCl+H2O。
实验步骤
2.向两支试管中各加入相同质量(约1~2 g)的氢氧化钙粉末,然后各加入10 mL水,振荡;
①氢氧化钙不易溶于水,即微溶于水。
②无色酚酞溶液显示红色。
③氢氧化钙粉末逐渐溶解形成无色溶液。
再各加入几滴无色酚酞溶液,观察现象;
再用滴管向其中一支试管滴入1 mL水,向另一支试管慢慢滴入稀盐酸并不断振荡,比较两支试管中的现象。
实验步骤
3.完成下列两个反应的化学方程式:
2HCl+Ca(OH)2===________________。
H2SO4+2NaOH===________________。
CaCl2+2H2O
Na2SO4+2H2O
同课章节目录
