2022年人教版九年级化学下册第九单元溶液测试题(word版有答案)
文档属性
| 名称 | 2022年人教版九年级化学下册第九单元溶液测试题(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 262.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-09 18:21:11 | ||
图片预览



文档简介
第九单元《溶液》测试题
一、单选题
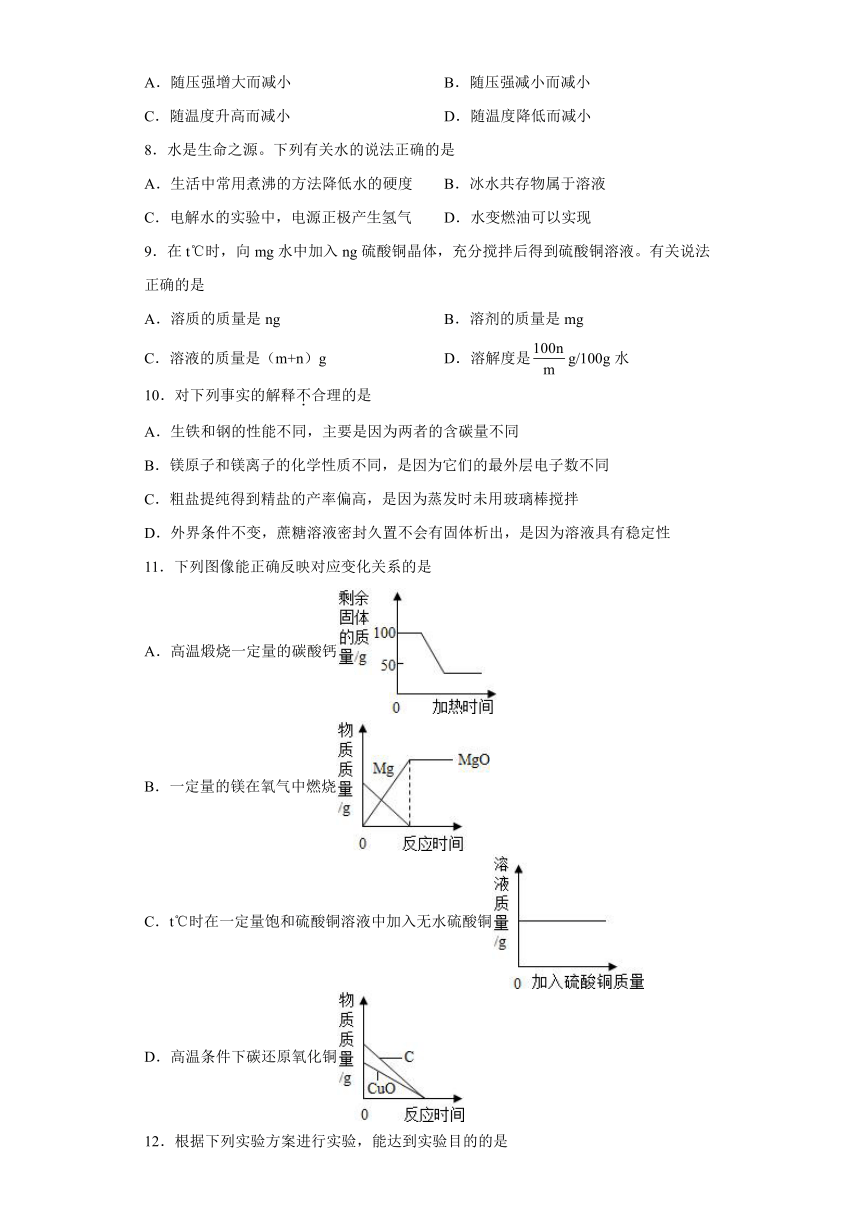
1.推理是化学学习中常用的思维方法,“证据推理与模型认知”是化学学科核心素养的重要组成部分,下列推理正确的是
A.离子是带电的粒子,所以带电的粒子一定是离子
B.根据质量守恒定律,1g氢气与9g氧气反应一定生成10g水
C.溶液具有均一性和稳定性,因此具有均一性和稳定性的液体一定是溶液
D.化合物含有不同种元素,所以由不同种元素组成的纯净物一定是化合物
2.下列物质不属于溶液的是
A.可矿泉水 B.冰水混合物 C.碘酒 D.生理盐水
3.下列因素不影响固体物质溶解度的是
a.固体的种类;b.固体颗粒的大小;c.溶剂的种类;d.溶剂的多少;e.温度
A.abed B.abe C.bd D.b
4.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是
A.实验操作顺序为④②①⑤③ B.选用100mL量筒量取所需水的体积
C.需称量NaCl的质量为16.0g D.②中游码在6g处,则食盐实际质量为16g
5.把少量下列物质分别放入水中,充分搅拌,可得到溶液的是
A.牛奶 B.面粉 C.植物油 D.葡萄糖
6.下列说法正确的是
A.饱和石灰水溶液放置较长时间后表面形成了一层白膜 (若水没有减少),该溶液仍是氢氧化钙的饱和溶液。
B.饱和溶液析出晶体后就变成不饱和溶液。
C.相同温度下,同一物质的饱和溶液比不饱和溶液含的溶质多。
D.一定温度下,向某蔗糖溶液中加入少量蔗糖,蔗糖逐渐消失,说明原溶液是不饱和溶液。
7.打开汽水瓶盖时,汽水会自动喷出,原因是气体在水中的溶解度
A.随压强增大而减小 B.随压强减小而减小
C.随温度升高而减小 D.随温度降低而减小
8.水是生命之源。下列有关水的说法正确的是
A.生活中常用煮沸的方法降低水的硬度 B.冰水共存物属于溶液
C.电解水的实验中,电源正极产生氢气 D.水变燃油可以实现
9.在t℃时,向mg水中加入ng硫酸铜晶体,充分搅拌后得到硫酸铜溶液。有关说法正确的是
A.溶质的质量是ng B.溶剂的质量是mg
C.溶液的质量是(m+n)g D.溶解度是g/100g水
10.对下列事实的解释不合理的是
A.生铁和钢的性能不同,主要是因为两者的含碳量不同
B.镁原子和镁离子的化学性质不同,是因为它们的最外层电子数不同
C.粗盐提纯得到精盐的产率偏高,是因为蒸发时未用玻璃棒搅拌
D.外界条件不变,蔗糖溶液密封久置不会有固体析出,是因为溶液具有稳定性
11.下列图像能正确反映对应变化关系的是
A.高温煅烧一定量的碳酸钙
B.一定量的镁在氧气中燃烧
C.t℃时在一定量饱和硫酸铜溶液中加入无水硫酸铜
D.高温条件下碳还原氧化铜
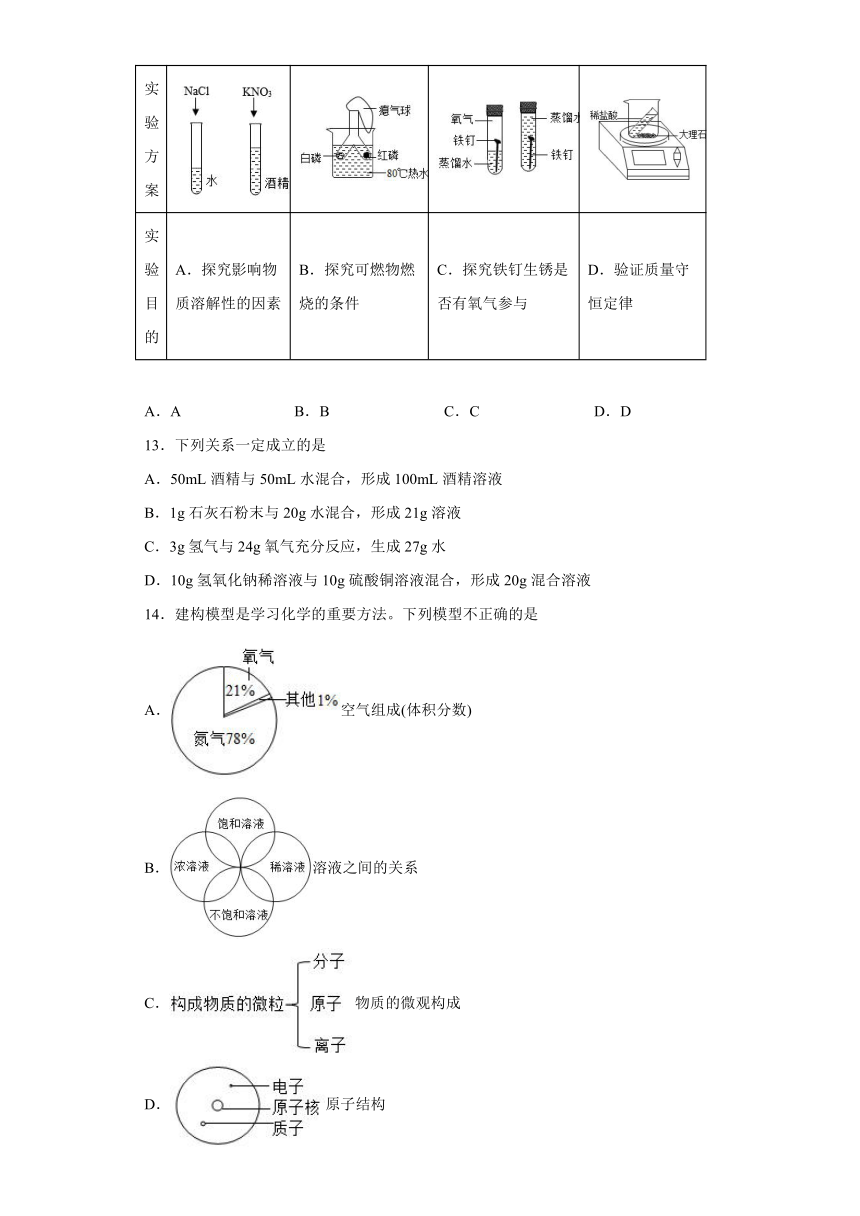
12.根据下列实验方案进行实验,能达到实验目的的是
实验 方案
实验 目的 A.探究影响物质溶解性的因素 B.探究可燃物燃烧的条件 C.探究铁钉生锈是否有氧气参与 D.验证质量守恒定律
A.A B.B C.C D.D
13.下列关系一定成立的是
A.50mL酒精与50mL水混合,形成100mL酒精溶液
B.1g石灰石粉末与20g水混合,形成21g溶液
C.3g氢气与24g氧气充分反应,生成27g水
D.10g氢氧化钠稀溶液与10g硫酸铜溶液混合,形成20g混合溶液
14.建构模型是学习化学的重要方法。下列模型不正确的是
A.空气组成(体积分数)
B.溶液之间的关系
C.物质的微观构成
D.原子结构
15.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时,a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时,向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
二、填空题
16.溶液的特征为___________、___________、混合物。一定温度下的不饱和石灰水,使它变为该温度下的饱和溶液的方法①___________,②___________。
17.生活与化学密切相关,请用你学到的知识回答:
(1)日前使用的煤、石油、天然气均为___________(填“可再生”或“不可再生”)能源。
(2)石油的综合利用是利用石油中各成分的___________不同,将它们分离,得到不同的产品。
(3)通常所说的煤气中毒是指____________(填化学式)引起的中毒。
(4)为保证安全,凡是可燃性气体,点燃前都要检验气体的________。
(5)煤发电时,将煤块粉碎成煤粉,其目的是_______。
(6)炭雕以活性炭为原料,对甲醛等有害气体有很强的__________作用,能净化室内空气。
(7)洗涤灵能洗去盘子上的油渍,原理是洗涤灵对食用油有____作用,它能增强乳浊液的___性。
18.结合水和溶液的相关知识,回答下列问题:
(1)矿泉水属于_________(填“纯净物”或“混合物”);
(2)生活中要降低水的硬度,可采用的方法是_________ ;
(3)如图是电解水的装置图,点燃负极气体前要先___________,防止爆炸; 正极与负极产生气体的体积比为:_________。
(4)如图是A、B两种固体物质的溶解度曲线。
①_______℃时,A、B 溶解度相等;
②若A中含少量 B,要提纯 A,宜采用的结晶方法是________;
③50 ℃时,若 50gA 加入 100g 水中得到的溶液是________(填“饱和”或“不饱和”)溶液;
④40 ℃时,将 100g 溶质质量分数为 28.6%的 B 的饱和溶液稀释为溶质质量分数为 10%的溶液,需加水的质量为________g。
19.在农业生产上,常采用质量分数为16%的氯化钠溶液来选种。
(1)若用氯化钠固体和水(水的密度为1g)配制100g这种溶液,需水______mL;
(2)若称取的氯化钠固体中含有水分,则所配制的溶液的溶质质量分数将会如何变化______。
三、推断题
20.A~F是初中化学常见的物质,A是空气的主要成分,B常温下是液体,C是年产量最多的金属。它们之间的存在如图的转化关系。
(1)B的化学式为__________。
(2)E的一种用途是__________。
(3)反应①的基本反应类型为______________。
(4)反应①的化学方程式为______________。
21.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
22.为了研究物质的溶解现象,进行如下探究活动。
(1)探究 I:探究氢氧化钠固体溶于水后液体的温度变化。图1中的操作存在一处错误,应该改正为______。
(2)探究II如下表:
实验序号 ① ② ③
现象 固体溶解,形成紫红色溶液 固体溶解,形成紫色溶液 固体几乎不溶解
对探究 II中实验现象进行分析,需要做的对比是______,分析得出的结论之一是______。
(3)探究III过程如图2所示。
所得溶液一定属于饱和溶液的是______。通过该探究得出的结论是______(答一点即可)。
(4)在上述探究的基础上,同学们想通过探究,比较食盐和氯化铵在水中的溶解度大小,探究方案应该是______。
23.某实验小组利用图1所示仪器配制一定溶质质量分数的氯化钠溶液。
(1)图1中还缺少的一种玻璃仪器是________,它的作用主要是_________。
(2)图2的操作错误是______;图中实际称得的氯化钠的质量为________g。
(3)量取蒸馏水的体积读数如图3所示,则该实验小组实际配制的氯化钠溶液的溶质质量分数为(水的密度为1g/cm3)______(精确至0.1%),比计划配制的溶质质量分数偏______(填写“高”或“低”)。
(4)将制得的氯化钠溶液装瓶保存时,试剂瓶的标签上应注明_____、____等信息。
(5)取上述实验得到的氯化钠溶液100g,加入100g水进行稀释,稀释后的溶液的溶质质量分数是________。
五、计算题
24.小路向容器中加入85g过氧化氢溶液在一定条件下分解产生气体的质量变化如图所示。已知每68份质量的过氧化氢完全分解可产生36份质量的水和32份质量的氧气。
(1)最终产生氧气的总质量为_______g。
(2)求原过氧化氢溶液中过氧化氢的质量分数是多少 (质量分数是指混合物中某种物质质量占总质量的百分比)。
25.实验室制取二氧化碳结束后,17中学化学兴趣小组的同学对锥形瓶内剩余的固液混合物(以下简称废液)做了如下实验:
请回答下列问题:
(1)实验中发生反应的化学方程式为___________。
(2)根据已知条件列出求解12.5g大理石中碳酸钙质量(x)的比例式___________。
(3)根据实验可知废液中含有的可溶性物质有___________(填化学式);
(4)所用废液中盐酸的质量分数为___________。
(5)操作A的名称为___________。
(6)下图中可以表示H+变化的是___________(填序号)。
参考答案
1.D 2.B 3.C 4.D 5.D 6.D 7.B 8.A 9.C 10.C 11.B 12.C 13.C 14.D 15.C
16.均一性 稳定性 增加溶质 恒温蒸发溶剂
17.(1)不可再生(2)沸点(3)CO(4)纯度(5)增大与空气的接触面积
(6)吸附(7) 乳化 稳定
18.(1)混合物
(2)煮沸(或加热煮沸)
(3) 验纯(或检验纯度) 1:2
(4) 40 冷却热饱和溶液(或降温结晶、冷却结晶) 不饱和 186
19.(1)84(2)减小
20.H2O 灭火等 置换反应 Fe+2HCl=FeCl2+H2↑
21.CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
22.应该用玻璃棒搅拌 将②③对比(或①③对比,答出一组即可) 其他条件相同时,高锰酸钾在水中的溶解能力比在汽油中强(或碘在汽油中的溶解能力比高锰酸钾在汽油中溶解能力强等其它合理答案均可) BDE 硝酸钾的溶解能力随温度升高而增大 20℃时,各取100g水于两只烧杯中,分别逐渐加入氯化铵/食盐,至不再溶解,称量两溶液的质量,溶液质量越大,该物质的溶解度越大(其它合理答案均可)
23.(1) 玻璃棒 搅拌,加速溶解
(2) 称量物和砝码放颠倒了 12
(3) 12.8% 低
(4) 溶质质量分数 溶液名称
(5)6.4%
24.(1)6.4
(2)16%
解:设原过氧化氢溶液中过氧化氢的质量为x,则有
所以原过氧化氢溶液中过氧化氢的质量分数为×100%=16%;
答:原过氧化氢溶液中过氧化氢的质量分数是16%。
25.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)
(3)HCl、CaCl2
(4)设废液中HCl质量为x
x=7.3g
所用废液中盐酸的质量分数为:
(5)过滤
(6)②
一、单选题
1.推理是化学学习中常用的思维方法,“证据推理与模型认知”是化学学科核心素养的重要组成部分,下列推理正确的是
A.离子是带电的粒子,所以带电的粒子一定是离子
B.根据质量守恒定律,1g氢气与9g氧气反应一定生成10g水
C.溶液具有均一性和稳定性,因此具有均一性和稳定性的液体一定是溶液
D.化合物含有不同种元素,所以由不同种元素组成的纯净物一定是化合物
2.下列物质不属于溶液的是
A.可矿泉水 B.冰水混合物 C.碘酒 D.生理盐水
3.下列因素不影响固体物质溶解度的是
a.固体的种类;b.固体颗粒的大小;c.溶剂的种类;d.溶剂的多少;e.温度
A.abed B.abe C.bd D.b
4.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是
A.实验操作顺序为④②①⑤③ B.选用100mL量筒量取所需水的体积
C.需称量NaCl的质量为16.0g D.②中游码在6g处,则食盐实际质量为16g
5.把少量下列物质分别放入水中,充分搅拌,可得到溶液的是
A.牛奶 B.面粉 C.植物油 D.葡萄糖
6.下列说法正确的是
A.饱和石灰水溶液放置较长时间后表面形成了一层白膜 (若水没有减少),该溶液仍是氢氧化钙的饱和溶液。
B.饱和溶液析出晶体后就变成不饱和溶液。
C.相同温度下,同一物质的饱和溶液比不饱和溶液含的溶质多。
D.一定温度下,向某蔗糖溶液中加入少量蔗糖,蔗糖逐渐消失,说明原溶液是不饱和溶液。
7.打开汽水瓶盖时,汽水会自动喷出,原因是气体在水中的溶解度
A.随压强增大而减小 B.随压强减小而减小
C.随温度升高而减小 D.随温度降低而减小
8.水是生命之源。下列有关水的说法正确的是
A.生活中常用煮沸的方法降低水的硬度 B.冰水共存物属于溶液
C.电解水的实验中,电源正极产生氢气 D.水变燃油可以实现
9.在t℃时,向mg水中加入ng硫酸铜晶体,充分搅拌后得到硫酸铜溶液。有关说法正确的是
A.溶质的质量是ng B.溶剂的质量是mg
C.溶液的质量是(m+n)g D.溶解度是g/100g水
10.对下列事实的解释不合理的是
A.生铁和钢的性能不同,主要是因为两者的含碳量不同
B.镁原子和镁离子的化学性质不同,是因为它们的最外层电子数不同
C.粗盐提纯得到精盐的产率偏高,是因为蒸发时未用玻璃棒搅拌
D.外界条件不变,蔗糖溶液密封久置不会有固体析出,是因为溶液具有稳定性
11.下列图像能正确反映对应变化关系的是
A.高温煅烧一定量的碳酸钙
B.一定量的镁在氧气中燃烧
C.t℃时在一定量饱和硫酸铜溶液中加入无水硫酸铜
D.高温条件下碳还原氧化铜
12.根据下列实验方案进行实验,能达到实验目的的是
实验 方案
实验 目的 A.探究影响物质溶解性的因素 B.探究可燃物燃烧的条件 C.探究铁钉生锈是否有氧气参与 D.验证质量守恒定律
A.A B.B C.C D.D
13.下列关系一定成立的是
A.50mL酒精与50mL水混合,形成100mL酒精溶液
B.1g石灰石粉末与20g水混合,形成21g溶液
C.3g氢气与24g氧气充分反应,生成27g水
D.10g氢氧化钠稀溶液与10g硫酸铜溶液混合,形成20g混合溶液
14.建构模型是学习化学的重要方法。下列模型不正确的是
A.空气组成(体积分数)
B.溶液之间的关系
C.物质的微观构成
D.原子结构
15.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时,a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时,向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
二、填空题
16.溶液的特征为___________、___________、混合物。一定温度下的不饱和石灰水,使它变为该温度下的饱和溶液的方法①___________,②___________。
17.生活与化学密切相关,请用你学到的知识回答:
(1)日前使用的煤、石油、天然气均为___________(填“可再生”或“不可再生”)能源。
(2)石油的综合利用是利用石油中各成分的___________不同,将它们分离,得到不同的产品。
(3)通常所说的煤气中毒是指____________(填化学式)引起的中毒。
(4)为保证安全,凡是可燃性气体,点燃前都要检验气体的________。
(5)煤发电时,将煤块粉碎成煤粉,其目的是_______。
(6)炭雕以活性炭为原料,对甲醛等有害气体有很强的__________作用,能净化室内空气。
(7)洗涤灵能洗去盘子上的油渍,原理是洗涤灵对食用油有____作用,它能增强乳浊液的___性。
18.结合水和溶液的相关知识,回答下列问题:
(1)矿泉水属于_________(填“纯净物”或“混合物”);
(2)生活中要降低水的硬度,可采用的方法是_________ ;
(3)如图是电解水的装置图,点燃负极气体前要先___________,防止爆炸; 正极与负极产生气体的体积比为:_________。
(4)如图是A、B两种固体物质的溶解度曲线。
①_______℃时,A、B 溶解度相等;
②若A中含少量 B,要提纯 A,宜采用的结晶方法是________;
③50 ℃时,若 50gA 加入 100g 水中得到的溶液是________(填“饱和”或“不饱和”)溶液;
④40 ℃时,将 100g 溶质质量分数为 28.6%的 B 的饱和溶液稀释为溶质质量分数为 10%的溶液,需加水的质量为________g。
19.在农业生产上,常采用质量分数为16%的氯化钠溶液来选种。
(1)若用氯化钠固体和水(水的密度为1g)配制100g这种溶液,需水______mL;
(2)若称取的氯化钠固体中含有水分,则所配制的溶液的溶质质量分数将会如何变化______。
三、推断题
20.A~F是初中化学常见的物质,A是空气的主要成分,B常温下是液体,C是年产量最多的金属。它们之间的存在如图的转化关系。
(1)B的化学式为__________。
(2)E的一种用途是__________。
(3)反应①的基本反应类型为______________。
(4)反应①的化学方程式为______________。
21.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
22.为了研究物质的溶解现象,进行如下探究活动。
(1)探究 I:探究氢氧化钠固体溶于水后液体的温度变化。图1中的操作存在一处错误,应该改正为______。
(2)探究II如下表:
实验序号 ① ② ③
现象 固体溶解,形成紫红色溶液 固体溶解,形成紫色溶液 固体几乎不溶解
对探究 II中实验现象进行分析,需要做的对比是______,分析得出的结论之一是______。
(3)探究III过程如图2所示。
所得溶液一定属于饱和溶液的是______。通过该探究得出的结论是______(答一点即可)。
(4)在上述探究的基础上,同学们想通过探究,比较食盐和氯化铵在水中的溶解度大小,探究方案应该是______。
23.某实验小组利用图1所示仪器配制一定溶质质量分数的氯化钠溶液。
(1)图1中还缺少的一种玻璃仪器是________,它的作用主要是_________。
(2)图2的操作错误是______;图中实际称得的氯化钠的质量为________g。
(3)量取蒸馏水的体积读数如图3所示,则该实验小组实际配制的氯化钠溶液的溶质质量分数为(水的密度为1g/cm3)______(精确至0.1%),比计划配制的溶质质量分数偏______(填写“高”或“低”)。
(4)将制得的氯化钠溶液装瓶保存时,试剂瓶的标签上应注明_____、____等信息。
(5)取上述实验得到的氯化钠溶液100g,加入100g水进行稀释,稀释后的溶液的溶质质量分数是________。
五、计算题
24.小路向容器中加入85g过氧化氢溶液在一定条件下分解产生气体的质量变化如图所示。已知每68份质量的过氧化氢完全分解可产生36份质量的水和32份质量的氧气。
(1)最终产生氧气的总质量为_______g。
(2)求原过氧化氢溶液中过氧化氢的质量分数是多少 (质量分数是指混合物中某种物质质量占总质量的百分比)。
25.实验室制取二氧化碳结束后,17中学化学兴趣小组的同学对锥形瓶内剩余的固液混合物(以下简称废液)做了如下实验:
请回答下列问题:
(1)实验中发生反应的化学方程式为___________。
(2)根据已知条件列出求解12.5g大理石中碳酸钙质量(x)的比例式___________。
(3)根据实验可知废液中含有的可溶性物质有___________(填化学式);
(4)所用废液中盐酸的质量分数为___________。
(5)操作A的名称为___________。
(6)下图中可以表示H+变化的是___________(填序号)。
参考答案
1.D 2.B 3.C 4.D 5.D 6.D 7.B 8.A 9.C 10.C 11.B 12.C 13.C 14.D 15.C
16.均一性 稳定性 增加溶质 恒温蒸发溶剂
17.(1)不可再生(2)沸点(3)CO(4)纯度(5)增大与空气的接触面积
(6)吸附(7) 乳化 稳定
18.(1)混合物
(2)煮沸(或加热煮沸)
(3) 验纯(或检验纯度) 1:2
(4) 40 冷却热饱和溶液(或降温结晶、冷却结晶) 不饱和 186
19.(1)84(2)减小
20.H2O 灭火等 置换反应 Fe+2HCl=FeCl2+H2↑
21.CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
22.应该用玻璃棒搅拌 将②③对比(或①③对比,答出一组即可) 其他条件相同时,高锰酸钾在水中的溶解能力比在汽油中强(或碘在汽油中的溶解能力比高锰酸钾在汽油中溶解能力强等其它合理答案均可) BDE 硝酸钾的溶解能力随温度升高而增大 20℃时,各取100g水于两只烧杯中,分别逐渐加入氯化铵/食盐,至不再溶解,称量两溶液的质量,溶液质量越大,该物质的溶解度越大(其它合理答案均可)
23.(1) 玻璃棒 搅拌,加速溶解
(2) 称量物和砝码放颠倒了 12
(3) 12.8% 低
(4) 溶质质量分数 溶液名称
(5)6.4%
24.(1)6.4
(2)16%
解:设原过氧化氢溶液中过氧化氢的质量为x,则有
所以原过氧化氢溶液中过氧化氢的质量分数为×100%=16%;
答:原过氧化氢溶液中过氧化氢的质量分数是16%。
25.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)
(3)HCl、CaCl2
(4)设废液中HCl质量为x
x=7.3g
所用废液中盐酸的质量分数为:
(5)过滤
(6)②
同课章节目录
