2022年仁爱版九年级化学下册7.1酸性溶液和碱性溶液同步课时卷(word版含解析)
文档属性
| 名称 | 2022年仁爱版九年级化学下册7.1酸性溶液和碱性溶液同步课时卷(word版含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 181.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-09 22:53:55 | ||
图片预览



文档简介
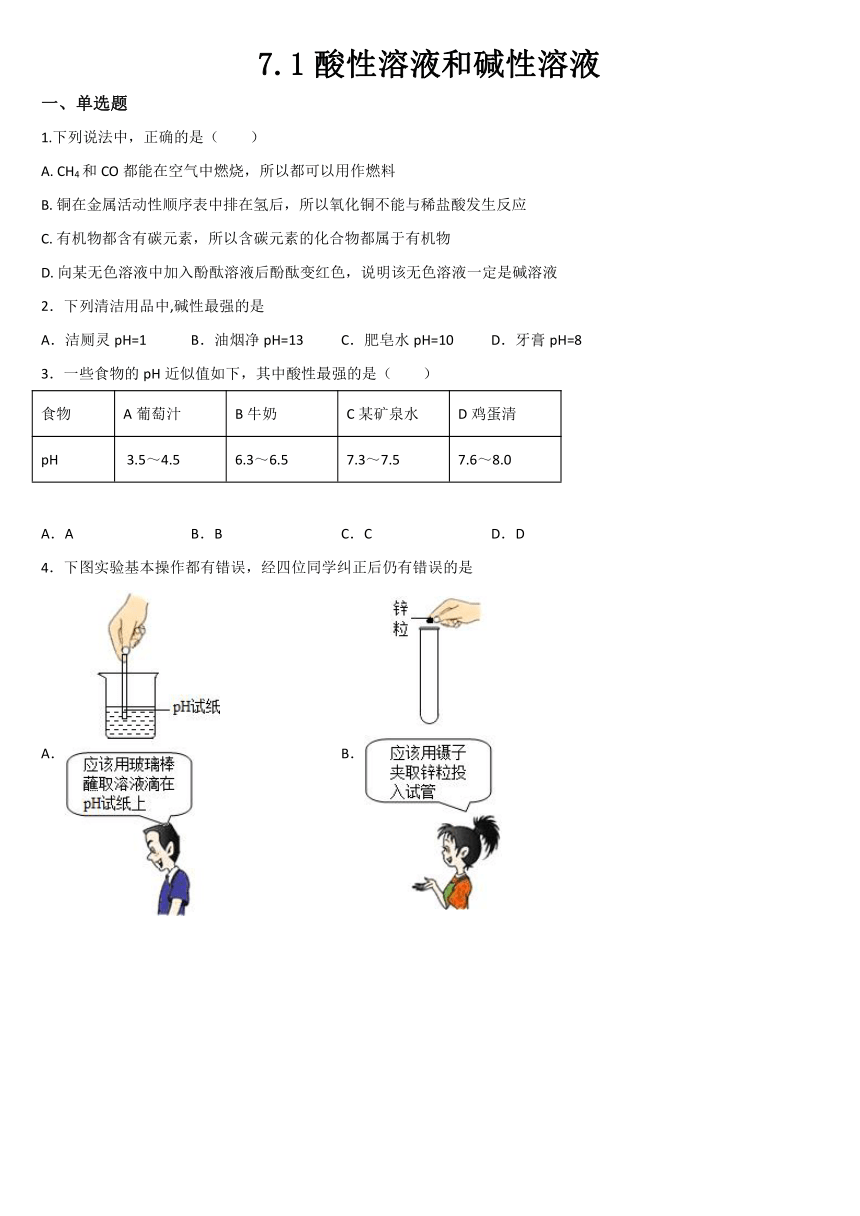
7.1酸性溶液和碱性溶液
一、单选题
1.下列说法中,正确的是( )
A. CH4和CO都能在空气中燃烧,所以都可以用作燃料
B. 铜在金属活动性顺序表中排在氢后,所以氧化铜不能与稀盐酸发生反应
C. 有机物都含有碳元素,所以含碳元素的化合物都属于有机物
D. 向某无色溶液中加入酚酞溶液后酚酞变红色,说明该无色溶液一定是碱溶液
2.下列清洁用品中,碱性最强的是
A.洁厕灵pH=1 B.油烟净pH=13 C.肥皂水pH=10 D.牙膏pH=8
3.一些食物的pH近似值如下,其中酸性最强的是( )
食物 A葡萄汁 B牛奶 C某矿泉水 D鸡蛋清
pH 3.5~4.5 6.3~6.5 7.3~7.5 7.6~8.0
A.A B.B C.C D.D
4.下图实验基本操作都有错误,经四位同学纠正后仍有错误的是
A. B.
C. D.
5.下列叙述正确的是( )
A. 用托盘天平称取5.26g氧化铜 B. 用药匙搅拌加速氢氧化钠溶解
C. 溶液的pH越大酸性越强 D. 少量浓硫酸沾到皮肤上应立即用大量水冲洗
6.下列说法中正确的是( )
A. 凡是生成盐和水的反应都是中和反应 B. 与酸反应生成盐和水的物质一定是碱
C. 凡是有盐参加的反应都是复分解反应 D. 当溶液pH=7时,溶液呈中性
7.如图是X、Y、Z、W四种溶液的近似pH.下列判断正确的是( )
A. X一定是酸 B. Y不一定是水 C. Z可能显碱性 D. W中含有的阴离子全部为OH﹣
8.现有①稀盐酸 ②碳酸钠溶液 ③食盐水,其pH由小到大的是( )
A. ①②③ B. ③②① C. ①③② D. ②③①
9.在氢氧化钠溶液中加入一定量的稀盐酸后,下列能证明两者恰好完全中和的是( )
A. 滴入适量 FeCl3 溶液,溶液变黄,但无沉淀生成
B. 滴入几滴酚酞试液,酚酞试液不变色
C. 测得反应后溶液中 Na+与 Cl﹣的个数比为 1:1
D. 滴入适量 AgNO3溶液和稀硝酸,观察到有白色沉淀
10.下列有关汽水的说法正确的是( )
A. 胃酸过多的人要多喝汽水
B. 汽水的pH为3~4,它显碱性
C. CO2易溶于水,所以用来制汽水
D. 打开汽水瓶盖时,有大量气泡冒出,说明气体的溶解度随压强减小而减小
二、填空题
11.酸雨对我们生产、生活危害较大,主要是工业生产和化石燃料燃烧产生的二氧化硫、二氧化氮排放不恰当所引起。酸雨pH________5.6(填“>”、“<”或“=”),二氧化硫与二氧化碳的某些化学性质相似,请完成化学方程式:SO2+2NaOH=________+H2O。
12. 有A、B、C、D四种元素,其原子结构示意图如图:
(1)D元素的名称为________ ,D元素与图中________ (填写字母序号)元素的化学性质相似,D元素的离子符号为________ .
(2)A、B、C三种元素能形成一种化合物,其水溶液的pH________ 7(填>、<、=)
(3)A、B两种元素的原子以1:1的比例形成的化合物为(写化学式)________ ,其中B元素化合价为________ .
13.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料.它们既有相似之处,又有不同之点.
(1)它们水溶液的pH都________ 7(填“大于”、“小于”或“等于”).
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式________ .
(3)它们都能与碱反应生成盐和水,该类反应叫________ 反应.
(4)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是________ .
14.测定pH值最简单的方法是使用________ ,测定时,用玻璃棒蘸取待测溶液,滴在________ 上,然后再与________ 对照,便可测出溶液的pH值。若用此法测得土壤的pH值小于5,可以施用适量的 ________来改良土壤。
三、解答题
15.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”包含着许多化学内容:
(1)家庭厨房中的“柴”趋向洁净,有煤气、液化石油气、天然气等。其中天然气的主要成分为______。(填化学式)
(2)米、面的主要成分是淀粉,化学式为(C6H10O5)n,淀粉中氢原子、氧原子的最简个数比为______。
(3)炒菜时油锅着火,可以用盖上锅盖的方法来灭火,利用的主要灭火原理是______。
(4)厨房中的食盐有加碘盐、锌盐、硒盐等。加碘盐中含有碘酸钾(KIO3),碘酸钾中碘元素的化合价为______价。
(5)卫生部推广使用“铁强化酱油”,这里的铁是指______(填:单质、原子或元素)
(6)在试管中加入少量白醋,再加入紫色石蕊溶液,观察到的现象为______。
(7)白糖与红糖主要成分都是蔗糖。利用活性炭的______性,可将红糖脱色成白糖。
四、综合题
16. 溶液的酸碱度常用pH来表示,请回答下列与pH相关的问题:
(1)请分别指出酸性溶液与碱性溶液的pH范围.
(2)用酚酞溶液检测NaOH溶液,将看到什么颜色?用pH试纸呢?
(3)电解pH=4的稀硫酸(实质是电解水),随着电解的进行,溶液的pH将发生怎样的变化?并请总结出溶液的pH变化与溶液中H+浓度变化的关系.
17.盐酸、硫酸、氢氧化钠是重要的化工原料.
(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有________性.
(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为它们的溶液中都含有________.
(3)氢氧化钠暴露在空气中,容易潮解,同时吸收空气中的________而变质,所以氢氧化钠固体必须________保存.
一、单选题
1.【答案】A
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】C
9.【答案】C
10.【答案】D
二、填空题
11.【答案】 <;Na2SO3
12.【答案】硫;B;S2﹣;>;H2O2;﹣1
【解析】【解答】(1)D元素的原子核内质子数为16,为硫元素;决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质,D元素的原子最外层电子数为6,B元素最外层电子数也为6,故具有相似的化学性质.D原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成带2个单位负电荷的硫离子,其离子符号为:S2﹣ .
(2)A、B、C三种元素分别是氢元素、氧元素、钠元素,据形成的化合物为氢氧化钠,显碱性,其水溶液的pH>7.
(3)A、B元素分别是氢元素、氧元素,A、B两种元素的原子以1:1的比例形成的化合物为过氧化氢,其化学式为H2O2;氢元素显+1价,设氧元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x=0,则x=﹣1价.
故答案为:(1)硫;B;S2﹣;(2)>;(3)H2O2;﹣1.
【分析】(1)D元素的原子核内质子数为16,元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,据此进行分析解答.
(2)A、B、C三种元素分别是氢元素、氧元素、钠元素,据形成的化合物为氢氧化钠,据此进行分析解答.
(3)A、B元素分别是氢元素、氧元素,A、B两种元素的原子以1:1的比例形成的化合物为过氧化氢,据此结合在化合物中正负化合价代数和为零,进行分析解答.
13.【答案】 小于 ;Fe2O3+6HCl=2FeCl3+3H2O ;中和 ;浓盐酸
【解析】【解答】(1)酸溶液都是酸性溶液,故答案为:小于;
(2)由于酸溶液都能和某些金属氧化物发生复分解反应生成盐和水,故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)酸和碱之间的反应叫中和反应,是复分解反应的一种,故答案为:中和;
(4)由于浓盐酸具有强烈的挥发性,故答案为:浓盐酸;
故答案为:(1)小于;(2)Fe2O3+6HCl=2FeCl3+3H2O;(3)中和;(4)浓盐酸.
【分析】酸的通性有:①都能使紫色石蕊试液变红,不能使无色酚酞变色,②能够和活泼金属反应生成氢气,③能够和金属氧化物反应生成盐和水,④能够和碱反应生成盐和水,⑤能够和某些盐反应生成新酸和新盐;酸溶液都是酸性溶液,它们的PH都小于7.
14.【答案】pH试纸;pH试纸;标准比色卡; 熟石灰或消石灰Ca(OH)2
三、解答题
15.CH4 2:1 隔绝氧气 +5 元素 紫色石蕊变红色 吸附
【解析】
【详解】
(1)天然气的主要成分为甲烷,其化学式为:CH4;
(2)1个淀粉分子中含有10n个氢原子、5n个氧原子,则淀粉中氢原子、氧原子的最简个数比为10n:5n=2:1;
(3)炒菜时油锅着火,可以用盖上锅盖的方法来灭火,利用的主要灭火原理是:隔绝氧气;
(4)钾元素显+1价,氧元素显-2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价;
(5)卫生部推广使用“铁强化酱油”,这里的铁不是以单质、分子、原子等形式存在,这里所指的“铁”是强调存在的元素,与具体形态无关;
(6)在试管中加入少量白醋,再加入紫色石蕊溶液,白醋显酸性,能使紫色石蕊变红色,观察到的现象为:紫色石蕊变红色;
(7)活性炭具有吸附性,能吸附异味和色素,可将红糖脱色成白糖。
【点睛】
掌握酸的化学性质、灭火的原理、活性炭具有吸附性、化合物中正负化合价代数和为零等是正确解答本题的关键。
四、综合题
16.【答案】(1)解:当溶液的pH<7时显酸性;当溶液的pH>7时显碱性
(2)解:氢氧化钠溶液显碱性,能使酚酞试液变红色,能使PH试纸显蓝色(从绿色到蓝紫色均可)
(3)解:随着电解的进行,水不断减少,氢离子的浓度越来越大,酸性越来越强,溶液的pH越来越小.
【解析】【分析】当溶液的PH等于7时,呈中性.当溶液的PH大于7时,呈碱性.当溶液的PH小于7时,呈酸性.酚酞试液遇酸性溶液不变色,遇碱性溶液变红,遇中性溶液不变色.显酸性的溶液,氢离子浓度越大,酸性越强,PH越小.
17.【答案】 (1)吸水
(2)H+
(3)CO2 ;密封
【解析】【解答】浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有吸水性.稀盐酸和稀硫酸都可以用于金属除锈,是因为它们的溶液中都含有氢离子. 氢氧化钠暴露在空气中,容易潮解,同时吸收空气中的二氧化碳而变质,所以氢氧化钠固体必须密封保存。
故答案为:吸水;H+;CO2;密封。【分析】本题主要考查酸碱的性质,酸具有很多共性是由于含有氢离子,碱具有共性是由于含有氢氧根离子。
一、单选题
1.下列说法中,正确的是( )
A. CH4和CO都能在空气中燃烧,所以都可以用作燃料
B. 铜在金属活动性顺序表中排在氢后,所以氧化铜不能与稀盐酸发生反应
C. 有机物都含有碳元素,所以含碳元素的化合物都属于有机物
D. 向某无色溶液中加入酚酞溶液后酚酞变红色,说明该无色溶液一定是碱溶液
2.下列清洁用品中,碱性最强的是
A.洁厕灵pH=1 B.油烟净pH=13 C.肥皂水pH=10 D.牙膏pH=8
3.一些食物的pH近似值如下,其中酸性最强的是( )
食物 A葡萄汁 B牛奶 C某矿泉水 D鸡蛋清
pH 3.5~4.5 6.3~6.5 7.3~7.5 7.6~8.0
A.A B.B C.C D.D
4.下图实验基本操作都有错误,经四位同学纠正后仍有错误的是
A. B.
C. D.
5.下列叙述正确的是( )
A. 用托盘天平称取5.26g氧化铜 B. 用药匙搅拌加速氢氧化钠溶解
C. 溶液的pH越大酸性越强 D. 少量浓硫酸沾到皮肤上应立即用大量水冲洗
6.下列说法中正确的是( )
A. 凡是生成盐和水的反应都是中和反应 B. 与酸反应生成盐和水的物质一定是碱
C. 凡是有盐参加的反应都是复分解反应 D. 当溶液pH=7时,溶液呈中性
7.如图是X、Y、Z、W四种溶液的近似pH.下列判断正确的是( )
A. X一定是酸 B. Y不一定是水 C. Z可能显碱性 D. W中含有的阴离子全部为OH﹣
8.现有①稀盐酸 ②碳酸钠溶液 ③食盐水,其pH由小到大的是( )
A. ①②③ B. ③②① C. ①③② D. ②③①
9.在氢氧化钠溶液中加入一定量的稀盐酸后,下列能证明两者恰好完全中和的是( )
A. 滴入适量 FeCl3 溶液,溶液变黄,但无沉淀生成
B. 滴入几滴酚酞试液,酚酞试液不变色
C. 测得反应后溶液中 Na+与 Cl﹣的个数比为 1:1
D. 滴入适量 AgNO3溶液和稀硝酸,观察到有白色沉淀
10.下列有关汽水的说法正确的是( )
A. 胃酸过多的人要多喝汽水
B. 汽水的pH为3~4,它显碱性
C. CO2易溶于水,所以用来制汽水
D. 打开汽水瓶盖时,有大量气泡冒出,说明气体的溶解度随压强减小而减小
二、填空题
11.酸雨对我们生产、生活危害较大,主要是工业生产和化石燃料燃烧产生的二氧化硫、二氧化氮排放不恰当所引起。酸雨pH________5.6(填“>”、“<”或“=”),二氧化硫与二氧化碳的某些化学性质相似,请完成化学方程式:SO2+2NaOH=________+H2O。
12. 有A、B、C、D四种元素,其原子结构示意图如图:
(1)D元素的名称为________ ,D元素与图中________ (填写字母序号)元素的化学性质相似,D元素的离子符号为________ .
(2)A、B、C三种元素能形成一种化合物,其水溶液的pH________ 7(填>、<、=)
(3)A、B两种元素的原子以1:1的比例形成的化合物为(写化学式)________ ,其中B元素化合价为________ .
13.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料.它们既有相似之处,又有不同之点.
(1)它们水溶液的pH都________ 7(填“大于”、“小于”或“等于”).
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式________ .
(3)它们都能与碱反应生成盐和水,该类反应叫________ 反应.
(4)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是________ .
14.测定pH值最简单的方法是使用________ ,测定时,用玻璃棒蘸取待测溶液,滴在________ 上,然后再与________ 对照,便可测出溶液的pH值。若用此法测得土壤的pH值小于5,可以施用适量的 ________来改良土壤。
三、解答题
15.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”包含着许多化学内容:
(1)家庭厨房中的“柴”趋向洁净,有煤气、液化石油气、天然气等。其中天然气的主要成分为______。(填化学式)
(2)米、面的主要成分是淀粉,化学式为(C6H10O5)n,淀粉中氢原子、氧原子的最简个数比为______。
(3)炒菜时油锅着火,可以用盖上锅盖的方法来灭火,利用的主要灭火原理是______。
(4)厨房中的食盐有加碘盐、锌盐、硒盐等。加碘盐中含有碘酸钾(KIO3),碘酸钾中碘元素的化合价为______价。
(5)卫生部推广使用“铁强化酱油”,这里的铁是指______(填:单质、原子或元素)
(6)在试管中加入少量白醋,再加入紫色石蕊溶液,观察到的现象为______。
(7)白糖与红糖主要成分都是蔗糖。利用活性炭的______性,可将红糖脱色成白糖。
四、综合题
16. 溶液的酸碱度常用pH来表示,请回答下列与pH相关的问题:
(1)请分别指出酸性溶液与碱性溶液的pH范围.
(2)用酚酞溶液检测NaOH溶液,将看到什么颜色?用pH试纸呢?
(3)电解pH=4的稀硫酸(实质是电解水),随着电解的进行,溶液的pH将发生怎样的变化?并请总结出溶液的pH变化与溶液中H+浓度变化的关系.
17.盐酸、硫酸、氢氧化钠是重要的化工原料.
(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有________性.
(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为它们的溶液中都含有________.
(3)氢氧化钠暴露在空气中,容易潮解,同时吸收空气中的________而变质,所以氢氧化钠固体必须________保存.
一、单选题
1.【答案】A
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】C
9.【答案】C
10.【答案】D
二、填空题
11.【答案】 <;Na2SO3
12.【答案】硫;B;S2﹣;>;H2O2;﹣1
【解析】【解答】(1)D元素的原子核内质子数为16,为硫元素;决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质,D元素的原子最外层电子数为6,B元素最外层电子数也为6,故具有相似的化学性质.D原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成带2个单位负电荷的硫离子,其离子符号为:S2﹣ .
(2)A、B、C三种元素分别是氢元素、氧元素、钠元素,据形成的化合物为氢氧化钠,显碱性,其水溶液的pH>7.
(3)A、B元素分别是氢元素、氧元素,A、B两种元素的原子以1:1的比例形成的化合物为过氧化氢,其化学式为H2O2;氢元素显+1价,设氧元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x=0,则x=﹣1价.
故答案为:(1)硫;B;S2﹣;(2)>;(3)H2O2;﹣1.
【分析】(1)D元素的原子核内质子数为16,元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,据此进行分析解答.
(2)A、B、C三种元素分别是氢元素、氧元素、钠元素,据形成的化合物为氢氧化钠,据此进行分析解答.
(3)A、B元素分别是氢元素、氧元素,A、B两种元素的原子以1:1的比例形成的化合物为过氧化氢,据此结合在化合物中正负化合价代数和为零,进行分析解答.
13.【答案】 小于 ;Fe2O3+6HCl=2FeCl3+3H2O ;中和 ;浓盐酸
【解析】【解答】(1)酸溶液都是酸性溶液,故答案为:小于;
(2)由于酸溶液都能和某些金属氧化物发生复分解反应生成盐和水,故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)酸和碱之间的反应叫中和反应,是复分解反应的一种,故答案为:中和;
(4)由于浓盐酸具有强烈的挥发性,故答案为:浓盐酸;
故答案为:(1)小于;(2)Fe2O3+6HCl=2FeCl3+3H2O;(3)中和;(4)浓盐酸.
【分析】酸的通性有:①都能使紫色石蕊试液变红,不能使无色酚酞变色,②能够和活泼金属反应生成氢气,③能够和金属氧化物反应生成盐和水,④能够和碱反应生成盐和水,⑤能够和某些盐反应生成新酸和新盐;酸溶液都是酸性溶液,它们的PH都小于7.
14.【答案】pH试纸;pH试纸;标准比色卡; 熟石灰或消石灰Ca(OH)2
三、解答题
15.CH4 2:1 隔绝氧气 +5 元素 紫色石蕊变红色 吸附
【解析】
【详解】
(1)天然气的主要成分为甲烷,其化学式为:CH4;
(2)1个淀粉分子中含有10n个氢原子、5n个氧原子,则淀粉中氢原子、氧原子的最简个数比为10n:5n=2:1;
(3)炒菜时油锅着火,可以用盖上锅盖的方法来灭火,利用的主要灭火原理是:隔绝氧气;
(4)钾元素显+1价,氧元素显-2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价;
(5)卫生部推广使用“铁强化酱油”,这里的铁不是以单质、分子、原子等形式存在,这里所指的“铁”是强调存在的元素,与具体形态无关;
(6)在试管中加入少量白醋,再加入紫色石蕊溶液,白醋显酸性,能使紫色石蕊变红色,观察到的现象为:紫色石蕊变红色;
(7)活性炭具有吸附性,能吸附异味和色素,可将红糖脱色成白糖。
【点睛】
掌握酸的化学性质、灭火的原理、活性炭具有吸附性、化合物中正负化合价代数和为零等是正确解答本题的关键。
四、综合题
16.【答案】(1)解:当溶液的pH<7时显酸性;当溶液的pH>7时显碱性
(2)解:氢氧化钠溶液显碱性,能使酚酞试液变红色,能使PH试纸显蓝色(从绿色到蓝紫色均可)
(3)解:随着电解的进行,水不断减少,氢离子的浓度越来越大,酸性越来越强,溶液的pH越来越小.
【解析】【分析】当溶液的PH等于7时,呈中性.当溶液的PH大于7时,呈碱性.当溶液的PH小于7时,呈酸性.酚酞试液遇酸性溶液不变色,遇碱性溶液变红,遇中性溶液不变色.显酸性的溶液,氢离子浓度越大,酸性越强,PH越小.
17.【答案】 (1)吸水
(2)H+
(3)CO2 ;密封
【解析】【解答】浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有吸水性.稀盐酸和稀硫酸都可以用于金属除锈,是因为它们的溶液中都含有氢离子. 氢氧化钠暴露在空气中,容易潮解,同时吸收空气中的二氧化碳而变质,所以氢氧化钠固体必须密封保存。
故答案为:吸水;H+;CO2;密封。【分析】本题主要考查酸碱的性质,酸具有很多共性是由于含有氢离子,碱具有共性是由于含有氢氧根离子。
