第3章《不同聚集状态的物质与性质》测试题(含答案)2021-2022学年高二下学期鲁科版(2019)化学选择性必修2有答案
文档属性
| 名称 | 第3章《不同聚集状态的物质与性质》测试题(含答案)2021-2022学年高二下学期鲁科版(2019)化学选择性必修2有答案 |  | |
| 格式 | zip | ||
| 文件大小 | 385.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-09 09:36:12 | ||
图片预览


文档简介
第3章《不同聚集状态的物质与性质》测试题
一、单选题(共15题)
1.干冰熔点很低是由于
A.CO2分子间以氢键结合 B.C=O键的键能小
C.CO2的化学性质不活泼 D.CO2分子间的作用力较弱
2.下列有关氯化钠晶体的叙述中,正确的是
A.氯化钠晶体是由钠离子和氯离子构成的,所以氯化钠晶体能导电
B.钠离子和氯离子之间因静电吸引而形成氯化钠晶体
C.氯化钠的分子式为NaCl
D.每个钠离子周围吸引6个氯离子,每个氯离子周围同样吸引6个钠离子
3.下列晶体中熔点最低的是
A.干冰 B.NaOH C.金刚石 D.铝
4.NA为阿伏加德罗常数的值。下列叙述正确的是
A.20gD2O中含有的中子数为8NA
B.12g 石墨中含有2 molC—C键
C.标准状况下,1.12 L乙烯中所含σ键数目为2NA
D.0.1 mol石英晶体中,硅氧键数目为0.4NA
5.磷酸亚铁锂(LiFePO4)可作锂离子电池的正极材料。工业上以FeCl3、NH4H2PO4、LiCl和苯胺()等为原料制备磷酸亚铁锂。下列说法错误的是
A.苯胺中氮原子的杂化方式是sp3
B.NH和PO的空间结构相同
C.1mol苯胺分子中含有9molσ键
D.LiC1、苯胺和甲苯的熔点由高到低的顺序是LiCl>苯胺>甲苯
6.侯氏制碱法主要反应原理:。下列有关说法正确的是
A.CO2的电子式为
B.NH3形成的配合物中含有8molσ键
C.NH4Cl固体为分子晶体
D.NaHCO3的水解方程式为:
7.下列有关晶体的叙述中,错误的是
A.干冰晶体中,每个CO2周围紧邻12个CO2
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
8.已知NO能被FeSO4溶液吸收生成配合物。下列有关说法不正确的是
A.该配合物中阴离子空间构型为正四面体形
B.配离子为,配位数为6
C.如图所示γ-Fe的晶胞中,铁原子的配位数为12
D.H2O分子是含有极性键的非极性分子
9.下列说法中正确的是
A.离子化合物的熔点一定比共价化合物的高
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.共价晶体的熔点一定比金属晶体高
10.关于晶体的下列说法中,正确的是
A.共价晶体中可能含有离子键
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键,不含有共价键
D.任何晶体中,若含有阳离子就一定有阴离子
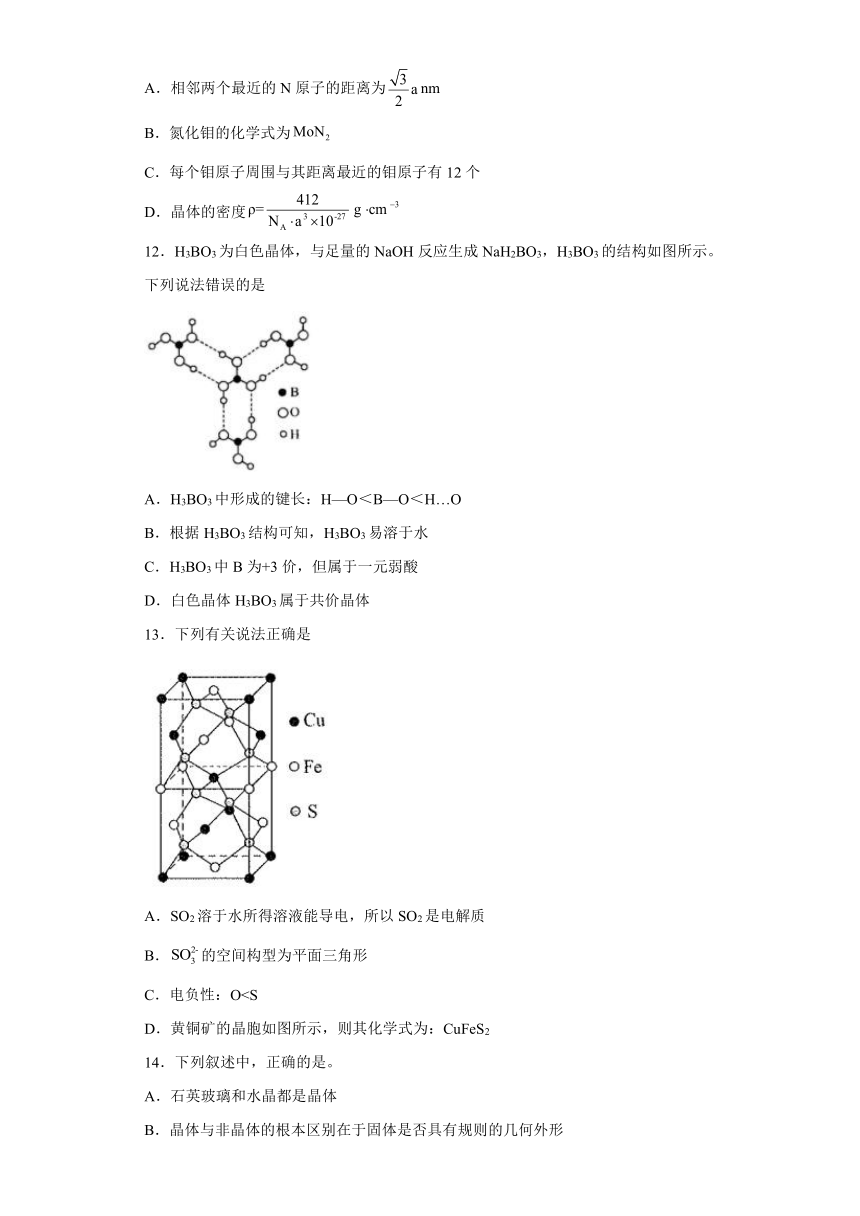
11.氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm,下列说法正确的是
A.相邻两个最近的N原子的距离为nm
B.氮化钼的化学式为
C.每个钼原子周围与其距离最近的钼原子有12个
D.晶体的密度
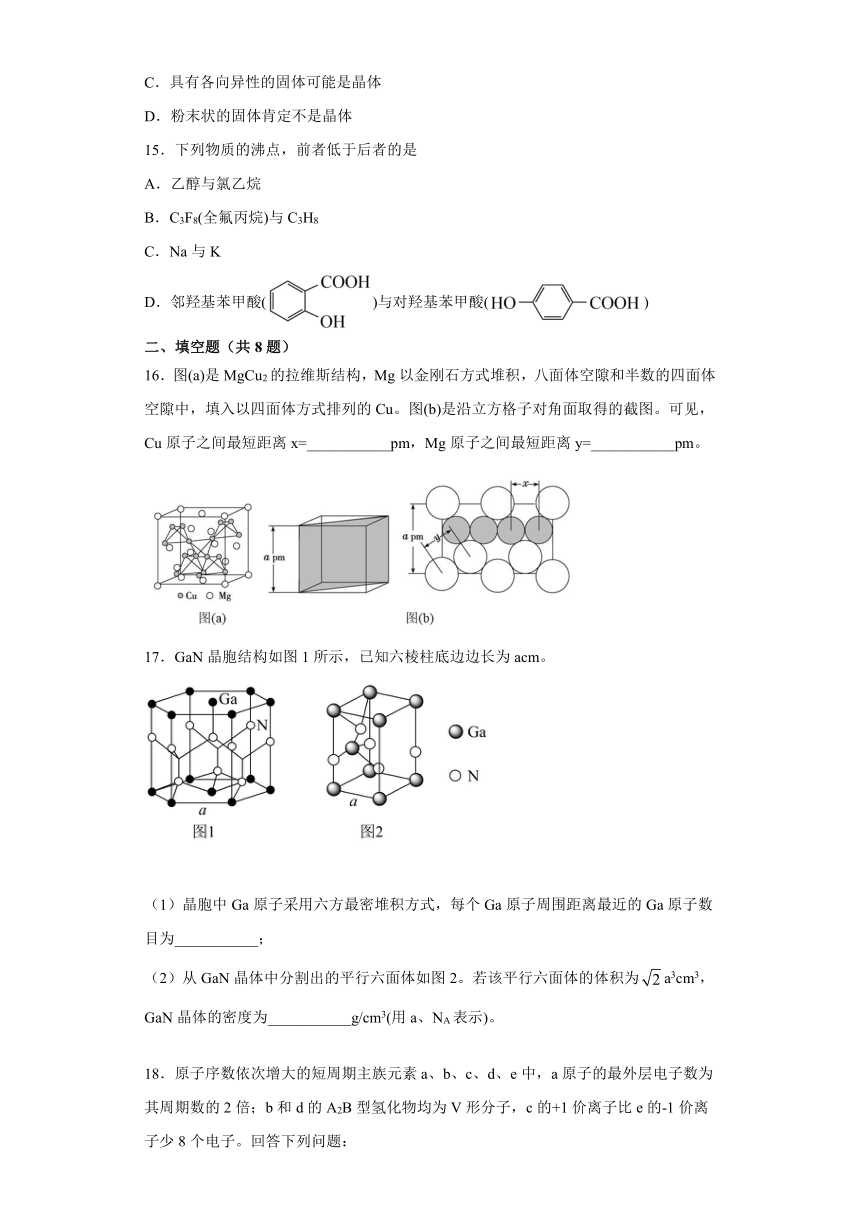
12.H3BO3为白色晶体,与足量的NaOH反应生成NaH2BO3,H3BO3的结构如图所示。下列说法错误的是
A.H3BO3中形成的键长:H—O<B—O<H…O
B.根据H3BO3结构可知,H3BO3易溶于水
C.H3BO3中B为+3价,但属于一元弱酸
D.白色晶体H3BO3属于共价晶体
13.下列有关说法正确是
A.SO2溶于水所得溶液能导电,所以SO2是电解质
B.的空间构型为平面三角形
C.电负性:OD.黄铜矿的晶胞如图所示,则其化学式为:CuFeS2
14.下列叙述中,正确的是。
A.石英玻璃和水晶都是晶体
B.晶体与非晶体的根本区别在于固体是否具有规则的几何外形
C.具有各向异性的固体可能是晶体
D.粉末状的固体肯定不是晶体
15.下列物质的沸点,前者低于后者的是
A.乙醇与氯乙烷
B.C3F8(全氟丙烷)与C3H8
C.Na与K
D.邻羟基苯甲酸()与对羟基苯甲酸()
二、填空题(共8题)
16.图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=___________pm,Mg原子之间最短距离y=___________pm。
17.GaN晶胞结构如图1所示,已知六棱柱底边边长为acm。
(1)晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为___________;
(2)从GaN晶体中分割出的平行六面体如图2。若该平行六面体的体积为a3cm3,GaN晶体的密度为___________g/cm3(用a、NA表示)。
18.原子序数依次增大的短周期主族元素a、b、c、d、e中,a原子的最外层电子数为其周期数的2倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。回答下列问题:
(1)元素a为_______(填元素符号,下同),c为_________。
(2)由这些元素形成的双原子分子有________。
(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于共价晶体的是________(填化学名称),属于离子晶体的是________(填化学式,下同),属于金属晶体的是________,属于分子晶体的是_______。(每空填一种即可)
19.同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列)。该周期部分元素氟化物的熔点见下表。
氟化物 AF BF2 DF4
熔点/K 1266 1534 183
(1)A原子核外共有_______种不同运动状态的电子、_______种不同能级的电子;
(2)元素C的最高价氧化物对应水化物的电离方程式为__________;
(3)解释上表中氟化物熔点差异的原因:_______;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是_______(填化学式)。A、B、C三种原子形成的简单离子的半径由大到小的顺序为______(填离子符号)。
20.已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
21.分析下图所示的甲、乙、丙三种晶体并回答有关问题:
(1)甲晶体化学式(X为阳离子)为______。
(2)乙晶体中A、B、C三种微粒的个数比是________。
(3)丙晶体中每个D周围结合E的个数是______个。
22.如图所示,为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+的周围与它最接近且距离相等的Na+共有_______个。
(2)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于_______,并列出计算式_______;Na+的个数等于_______,并列出计算式_______
(3)设NaCl的摩尔质量为M g/mol,食盐晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,食盐晶体中两个距离最近的钠离子间的距离为_______cm
23.随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒B.烧杯C.容量瓶D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿伏加德常数NA的表达式为___。
参考答案
1.D 2.D 3.A 4.D 5.C 6.B 7.B 8.D 9.B 10.B 11.C 12.D 13.D 14.A 15.D
16.
17.(1)12(2)
18.C Na CO、O2、Cl2 金刚石 NaCl Na CO(合理即可)
19.11 4 AlO2-+H++H2OAl(OH)3Al3++3OH- NaF与 MgF2为离子晶体,离子之间以离子键结合,离子键是强烈的作用力,所以熔点高;Mg2+的半径比Na+的半径小,离子电荷比Na+多,故MgF2的熔点比NaF高;SiF4为分子晶体,分子之间以微弱的分子间作用力结合,故SiF4的熔点低 HCl Na+>Mg2+>Al3+
20. 极性共价键 分子晶体 2NH4Cl + Ca(OH)2 2NH3↑+ CaCl2 + 2H2O CO32- + H2OHCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
21.X2Y 1:3:1 8
22.12 4 8×+6× 4 12×+1
23.C 酸式滴定管 碱式滴定管的橡胶管会溶于苯而变形 否 水会溶解NaCl,无法准确测出NaCl固体的体积
一、单选题(共15题)
1.干冰熔点很低是由于
A.CO2分子间以氢键结合 B.C=O键的键能小
C.CO2的化学性质不活泼 D.CO2分子间的作用力较弱
2.下列有关氯化钠晶体的叙述中,正确的是
A.氯化钠晶体是由钠离子和氯离子构成的,所以氯化钠晶体能导电
B.钠离子和氯离子之间因静电吸引而形成氯化钠晶体
C.氯化钠的分子式为NaCl
D.每个钠离子周围吸引6个氯离子,每个氯离子周围同样吸引6个钠离子
3.下列晶体中熔点最低的是
A.干冰 B.NaOH C.金刚石 D.铝
4.NA为阿伏加德罗常数的值。下列叙述正确的是
A.20gD2O中含有的中子数为8NA
B.12g 石墨中含有2 molC—C键
C.标准状况下,1.12 L乙烯中所含σ键数目为2NA
D.0.1 mol石英晶体中,硅氧键数目为0.4NA
5.磷酸亚铁锂(LiFePO4)可作锂离子电池的正极材料。工业上以FeCl3、NH4H2PO4、LiCl和苯胺()等为原料制备磷酸亚铁锂。下列说法错误的是
A.苯胺中氮原子的杂化方式是sp3
B.NH和PO的空间结构相同
C.1mol苯胺分子中含有9molσ键
D.LiC1、苯胺和甲苯的熔点由高到低的顺序是LiCl>苯胺>甲苯
6.侯氏制碱法主要反应原理:。下列有关说法正确的是
A.CO2的电子式为
B.NH3形成的配合物中含有8molσ键
C.NH4Cl固体为分子晶体
D.NaHCO3的水解方程式为:
7.下列有关晶体的叙述中,错误的是
A.干冰晶体中,每个CO2周围紧邻12个CO2
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
8.已知NO能被FeSO4溶液吸收生成配合物。下列有关说法不正确的是
A.该配合物中阴离子空间构型为正四面体形
B.配离子为,配位数为6
C.如图所示γ-Fe的晶胞中,铁原子的配位数为12
D.H2O分子是含有极性键的非极性分子
9.下列说法中正确的是
A.离子化合物的熔点一定比共价化合物的高
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.共价晶体的熔点一定比金属晶体高
10.关于晶体的下列说法中,正确的是
A.共价晶体中可能含有离子键
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键,不含有共价键
D.任何晶体中,若含有阳离子就一定有阴离子
11.氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm,下列说法正确的是
A.相邻两个最近的N原子的距离为nm
B.氮化钼的化学式为
C.每个钼原子周围与其距离最近的钼原子有12个
D.晶体的密度
12.H3BO3为白色晶体,与足量的NaOH反应生成NaH2BO3,H3BO3的结构如图所示。下列说法错误的是
A.H3BO3中形成的键长:H—O<B—O<H…O
B.根据H3BO3结构可知,H3BO3易溶于水
C.H3BO3中B为+3价,但属于一元弱酸
D.白色晶体H3BO3属于共价晶体
13.下列有关说法正确是
A.SO2溶于水所得溶液能导电,所以SO2是电解质
B.的空间构型为平面三角形
C.电负性:O
14.下列叙述中,正确的是。
A.石英玻璃和水晶都是晶体
B.晶体与非晶体的根本区别在于固体是否具有规则的几何外形
C.具有各向异性的固体可能是晶体
D.粉末状的固体肯定不是晶体
15.下列物质的沸点,前者低于后者的是
A.乙醇与氯乙烷
B.C3F8(全氟丙烷)与C3H8
C.Na与K
D.邻羟基苯甲酸()与对羟基苯甲酸()
二、填空题(共8题)
16.图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=___________pm,Mg原子之间最短距离y=___________pm。
17.GaN晶胞结构如图1所示,已知六棱柱底边边长为acm。
(1)晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为___________;
(2)从GaN晶体中分割出的平行六面体如图2。若该平行六面体的体积为a3cm3,GaN晶体的密度为___________g/cm3(用a、NA表示)。
18.原子序数依次增大的短周期主族元素a、b、c、d、e中,a原子的最外层电子数为其周期数的2倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。回答下列问题:
(1)元素a为_______(填元素符号,下同),c为_________。
(2)由这些元素形成的双原子分子有________。
(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于共价晶体的是________(填化学名称),属于离子晶体的是________(填化学式,下同),属于金属晶体的是________,属于分子晶体的是_______。(每空填一种即可)
19.同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列)。该周期部分元素氟化物的熔点见下表。
氟化物 AF BF2 DF4
熔点/K 1266 1534 183
(1)A原子核外共有_______种不同运动状态的电子、_______种不同能级的电子;
(2)元素C的最高价氧化物对应水化物的电离方程式为__________;
(3)解释上表中氟化物熔点差异的原因:_______;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是_______(填化学式)。A、B、C三种原子形成的简单离子的半径由大到小的顺序为______(填离子符号)。
20.已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
21.分析下图所示的甲、乙、丙三种晶体并回答有关问题:
(1)甲晶体化学式(X为阳离子)为______。
(2)乙晶体中A、B、C三种微粒的个数比是________。
(3)丙晶体中每个D周围结合E的个数是______个。
22.如图所示,为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+的周围与它最接近且距离相等的Na+共有_______个。
(2)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于_______,并列出计算式_______;Na+的个数等于_______,并列出计算式_______
(3)设NaCl的摩尔质量为M g/mol,食盐晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,食盐晶体中两个距离最近的钠离子间的距离为_______cm
23.随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒B.烧杯C.容量瓶D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿伏加德常数NA的表达式为___。
参考答案
1.D 2.D 3.A 4.D 5.C 6.B 7.B 8.D 9.B 10.B 11.C 12.D 13.D 14.A 15.D
16.
17.(1)12(2)
18.C Na CO、O2、Cl2 金刚石 NaCl Na CO(合理即可)
19.11 4 AlO2-+H++H2OAl(OH)3Al3++3OH- NaF与 MgF2为离子晶体,离子之间以离子键结合,离子键是强烈的作用力,所以熔点高;Mg2+的半径比Na+的半径小,离子电荷比Na+多,故MgF2的熔点比NaF高;SiF4为分子晶体,分子之间以微弱的分子间作用力结合,故SiF4的熔点低 HCl Na+>Mg2+>Al3+
20. 极性共价键 分子晶体 2NH4Cl + Ca(OH)2 2NH3↑+ CaCl2 + 2H2O CO32- + H2OHCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
21.X2Y 1:3:1 8
22.12 4 8×+6× 4 12×+1
23.C 酸式滴定管 碱式滴定管的橡胶管会溶于苯而变形 否 水会溶解NaCl,无法准确测出NaCl固体的体积
