10.1.5碱的化学性质)课件(14页)
文档属性
| 名称 | 10.1.5碱的化学性质)课件(14页) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-08 16:43:14 | ||
图片预览


文档简介
(共14张PPT)
第十单元 酸和碱
课题1 碱的化学性质
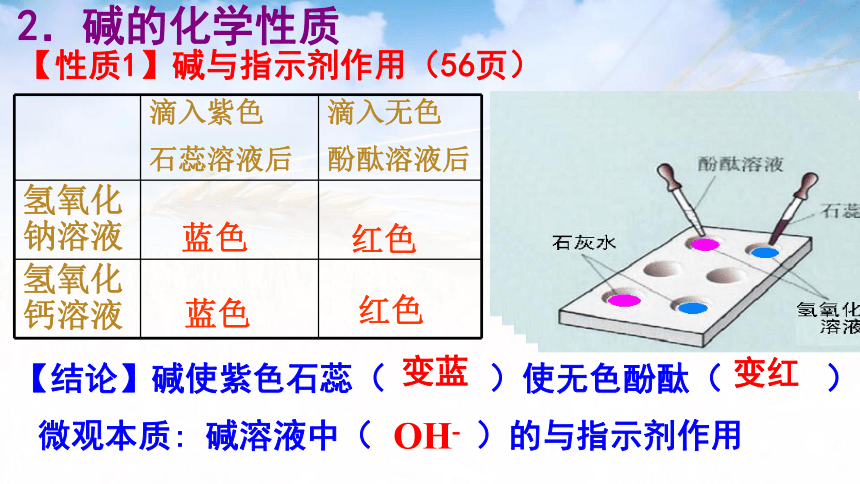
蓝色
蓝色
红色
红色
2.碱的化学性质
滴入紫色 石蕊溶液后 滴入无色
酚酞溶液后
氢氧化钠溶液
氢氧化钙溶液
【性质1】碱与指示剂作用(56页)
【结论】碱使紫色石蕊( )使无色酚酞( )
变蓝
变红
微观本质: 碱溶液中( )的与指示剂作用
OH-
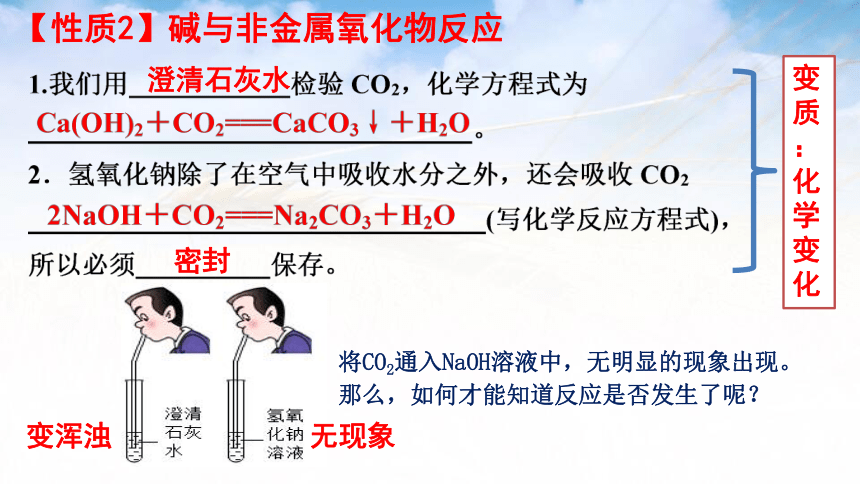
澄清石灰水
密封
【性质2】碱与非金属氧化物反应
变质:化学变化
变浑浊
无现象
将CO2通入NaOH溶液中,无明显的现象出现。那么,如何才能知道反应是否发生了呢?
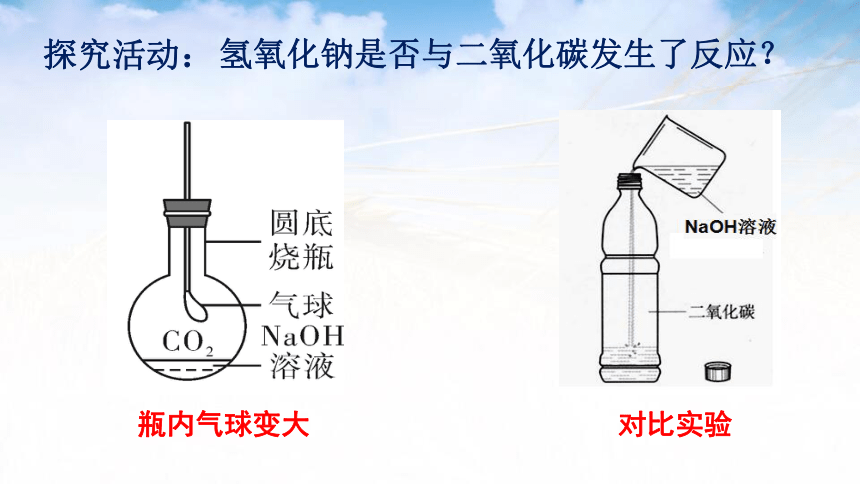
探究活动:
对比实验
瓶内气球变大
氢氧化钠是否与二氧化碳发生了反应?
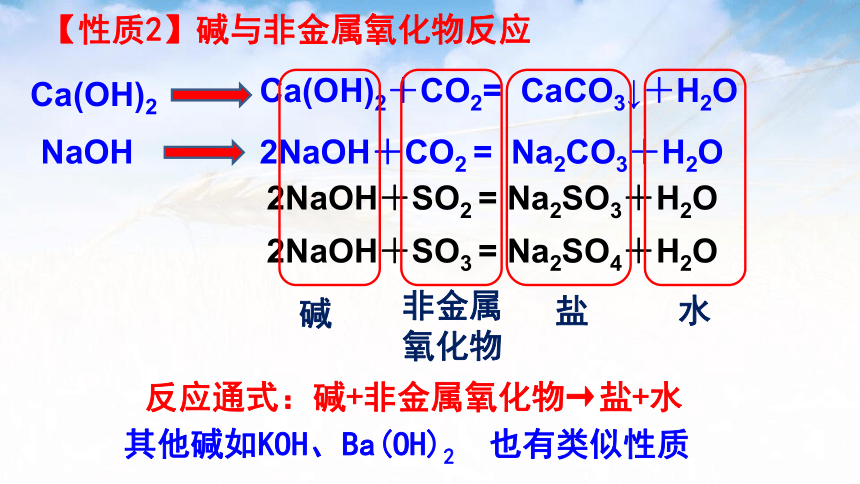
反应通式:碱+非金属氧化物→盐+水
【性质2】碱与非金属氧化物反应
Ca(OH)2+CO2= CaCO3↓+H2O
Ca(OH)2
2NaOH+CO2 = Na2CO3+H2O
NaOH
2NaOH+SO3 = Na2SO4+H2O
2NaOH+SO2 = Na2SO3+H2O
其他碱如KOH、Ba(OH)2 也有类似性质
碱
非金属
氧化物
盐
水
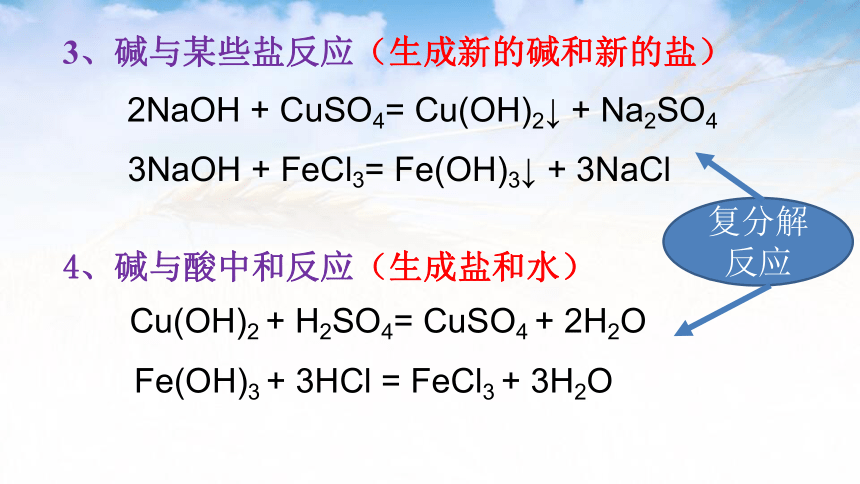
3、碱与某些盐反应(生成新的碱和新的盐)
4、碱与酸中和反应(生成盐和水)
2NaOH + CuSO4= Cu(OH)2↓ + Na2SO4
Cu(OH)2 + H2SO4= CuSO4 + 2H2O
3NaOH + FeCl3= Fe(OH)3↓ + 3NaCl
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
复分解反应
红
变蓝
盐
水
C
B
B
B
酸
放出
某些非金属氧化物
如图是喷淋塔吸收二氧化硫的图示:
表示的微粒是 (填符号)。
①吸收过程用氢氧化钠溶液喷淋SO2,而不是将SO2直接通入氢氧化钠溶液是为了:
②写出NaOH溶液吸收SO2的化学方程式:
③图中小球分别表示NaOH溶液及吸收SO2后所得溶液中溶质的微粒,“ ”
增大气液接触面积,提高SO2吸收效果
Na+
Na+ OH-
Na+ SO32-
第十单元 酸和碱
课题1 碱的化学性质
蓝色
蓝色
红色
红色
2.碱的化学性质
滴入紫色 石蕊溶液后 滴入无色
酚酞溶液后
氢氧化钠溶液
氢氧化钙溶液
【性质1】碱与指示剂作用(56页)
【结论】碱使紫色石蕊( )使无色酚酞( )
变蓝
变红
微观本质: 碱溶液中( )的与指示剂作用
OH-
澄清石灰水
密封
【性质2】碱与非金属氧化物反应
变质:化学变化
变浑浊
无现象
将CO2通入NaOH溶液中,无明显的现象出现。那么,如何才能知道反应是否发生了呢?
探究活动:
对比实验
瓶内气球变大
氢氧化钠是否与二氧化碳发生了反应?
反应通式:碱+非金属氧化物→盐+水
【性质2】碱与非金属氧化物反应
Ca(OH)2+CO2= CaCO3↓+H2O
Ca(OH)2
2NaOH+CO2 = Na2CO3+H2O
NaOH
2NaOH+SO3 = Na2SO4+H2O
2NaOH+SO2 = Na2SO3+H2O
其他碱如KOH、Ba(OH)2 也有类似性质
碱
非金属
氧化物
盐
水
3、碱与某些盐反应(生成新的碱和新的盐)
4、碱与酸中和反应(生成盐和水)
2NaOH + CuSO4= Cu(OH)2↓ + Na2SO4
Cu(OH)2 + H2SO4= CuSO4 + 2H2O
3NaOH + FeCl3= Fe(OH)3↓ + 3NaCl
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
复分解反应
红
变蓝
盐
水
C
B
B
B
酸
放出
某些非金属氧化物
如图是喷淋塔吸收二氧化硫的图示:
表示的微粒是 (填符号)。
①吸收过程用氢氧化钠溶液喷淋SO2,而不是将SO2直接通入氢氧化钠溶液是为了:
②写出NaOH溶液吸收SO2的化学方程式:
③图中小球分别表示NaOH溶液及吸收SO2后所得溶液中溶质的微粒,“ ”
增大气液接触面积,提高SO2吸收效果
Na+
Na+ OH-
Na+ SO32-
同课章节目录
