10.1.1常见的酸课件(70页)
图片预览









文档简介
常见的酸和碱
第一课时 常见的酸
CONTENTS
01
常见的酸
02
酸的化学性质
内容提要
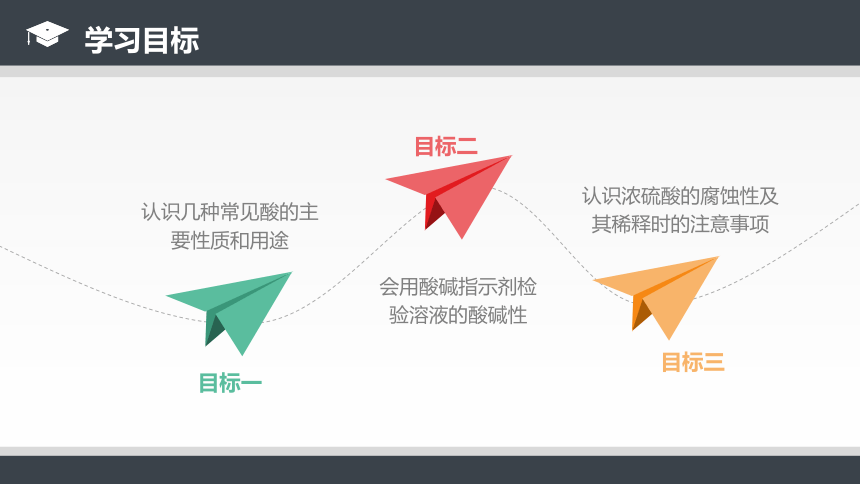
认识几种常见酸的主要性质和用途
认识浓硫酸的腐蚀性及其稀释时的注意事项
会用酸碱指示剂检验溶液的酸碱性
目标一
目标三
目标二
学习目标
你知道生活中哪些物质有酸味吗?
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
导入新课
PART 1
01 常见的酸
常见的酸
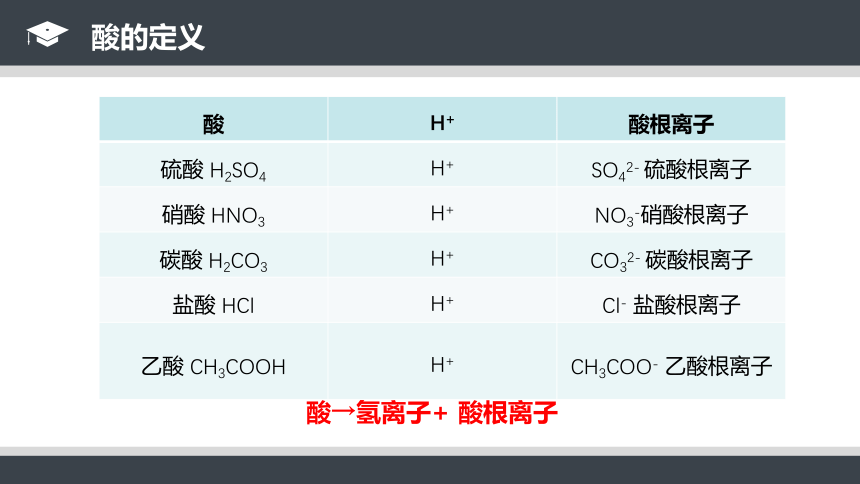
常见的酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、磷酸(H3PO4)、碳酸(H2CO3)、醋酸(CH3COOH)等。
观察这几种酸,从名称和组成上看你能发现什么?
酸→氢离子+ 酸根离子
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}酸
H+
酸根离子
硫酸 H2SO4
H+
SO42- 硫酸根离子
硝酸 HNO3
H+
NO3-硝酸根离子
碳酸 H2CO3
H+
CO32- 碳酸根离子
盐酸 HCl
H+
Cl- 盐酸根离子
乙酸 CH3COOH
H+
CH3COO- 乙酸根离子
酸的定义
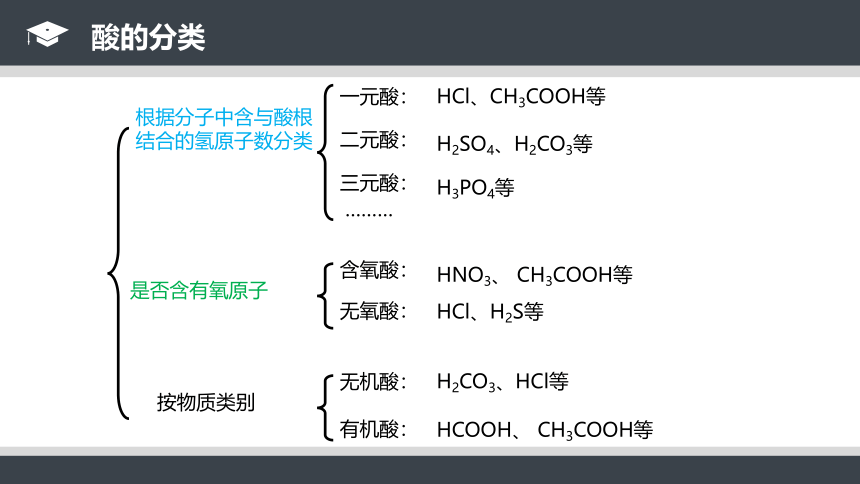
是否含有氧原子
含氧酸:
无氧酸:
HNO3、 CH3COOH等
HCl、H2S等
按物质类别
有机酸:
无机酸:
HCOOH、 CH3COOH等
H2CO3、HCl等
根据分子中含与酸根结合的氢原子数分类
一元酸:
二元酸:
三元酸:
………
HCl、CH3COOH等
H2SO4、H2CO3等
H3PO4等
酸的分类
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
根据分子中含与酸根离子结合的氢原子数分类
根据分子中是否含有氧原子分类
含1个H原子一元酸
含2个H原子二元酸
含O原子含氧酸
不含O原子无氧酸
HCl
H2S
H2SO4
HNO3
酸的分类
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
根据分子中含与酸根离子结合的氢原子数分类
根据分子中是否含有氧原子分类
含1个H原子一元酸
含2个H原子二元酸
含O原子含氧酸
不含O原子无氧酸
HCl
√
H2S
√
H2SO4
√
HNO3
√
酸的分类
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
根据分子中含与酸根离子结合的氢原子数分类
根据分子中是否含有氧原子分类
含1个H原子一元酸
含2个H原子二元酸
含O原子含氧酸
不含O原子无氧酸
HCl
√
√
H2S
√
√
H2SO4
√
√
HNO3
√
√
酸的分类
认识常见的酸
浓硫酸
浓盐酸
认识常见的酸
浓盐酸(HCl)
颜色、状态:无色的液体;工业用盐酸:黄色(Fe3+)
气味性:有刺激性气味
特性:挥发性(敞口至于空气中,瓶口有白雾)
用途:重要化工产品。用于除锈、制药、人体胃液中有盐酸帮助消化。
浓盐酸
盐酸的制取方法:
浓盐酸(HCl)
颜色、状态:无色的液体;工业用盐酸:黄色(Fe3+)
气味性:有刺激性气味
特性:挥发性(敞口至于空气中,瓶口有白雾)
用途:重要化工产品。用于除锈、制药、人体胃液中有盐酸帮助消化。
浓盐酸
盐酸的制取方法:
先发生反应:H2+Cl2 === 2HCl,再将HCl气体溶于水即得盐酸。
点燃
浓盐酸(HCl)
颜色、状态:无色的液体;工业用盐酸:黄色(Fe3+)
气味性:有刺激性气味
特性:挥发性(敞口至于空气中,瓶口有白雾)
用途:重要化工产品。用于除锈、制药、人体胃液中有盐酸帮助消化。
浓盐酸
盐酸的制取方法:
先发生反应:H2+Cl2 === 2HCl,再将HCl气体溶于水即得盐酸。
点燃
为什么为什么会有白雾? ?
1.盐酸具有挥发性,浓度越大、温度越高,挥发性越强。
2.浓盐酸易挥发,打开瓶盖,瓶口出现白雾,这是由于挥发出来的氯化氢气体与空气中的水蒸气结合,又形成了盐酸小液滴。
拓展延伸
你们在实验室如何嗅药品的气味?
浓硫酸(H2SO4)
颜色、状态:浓硫酸无色、粘稠的油状液体(稀硫酸是无色的液体)
气味性:无
特性:吸水性、脱水性(脱水性)、强氧化性
用途:重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。在实验室中常用它做干燥剂。
浓硫酸
硫酸的制取方法:
浓硫酸(H2SO4)
颜色、状态:浓硫酸无色、粘稠的油状液体(稀硫酸是无色的液体)
气味性:无
特性:吸水性、脱水性(脱水性)、强氧化性
用途:重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。在实验室中常用它做干燥剂。
浓硫酸
硫酸的制取方法:
2SO2+O2=== 2SO3 SO3+ H2O =H2SO4
高温
浓硫酸(H2SO4)
颜色、状态:浓硫酸无色、粘稠的油状液体(稀硫酸是无色的液体)
气味性:无
特性:吸水性、脱水性(脱水性)、强氧化性
用途:重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。在实验室中常用它做干燥剂。
浓硫酸
硫酸的制取方法:
2SO2+O2=== 2SO3 SO3+ H2O =H2SO4
高温
为什么可以用它做干燥剂?
浓硫酸的吸水性
因为浓硫酸有很强的吸水性,溶于水放出大量的热量,所以可以将其作为干燥剂。
那么做干燥剂的时候,装置图是怎么样的?需要注意的点在哪?
1、浓硫酸的吸水性
浓硫酸的吸水性
干燥装置图如右所示。
浓硫酸
浓硫酸的吸水性
干燥装置图如右所示。浓硫酸做干燥剂时,需要干燥的气体一定从长导管通入,从短导管出,可归纳为:长进短出。
稀硫酸无吸水性,不能用作干燥剂。
浓硫酸不能干燥氨气(NH3),可以用来干燥O2、H2、CO2。
浓硫酸
气体
浓硫酸的脱水性
实验: 浓硫酸的脱水性
2、浓硫酸的脱水性(腐蚀性)
实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到一小块布上
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
布条逐渐变黄
浓硫酸的脱水性
实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到一小块布上
因为浓硫酸的脱水性(浓硫酸能使由碳、氢、氧等元素组成的化合物炭化),显示浓硫酸具有强腐蚀性。
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
布条逐渐变黄
浓硫酸的脱水性
拓展延伸
1.浓硫酸有强烈的腐蚀性,实验应在玻璃片上进行,如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
2.浓硫酸将皮肤、纸张、木材等物质中的氢、氧元素按水的组成比脱去,生成黑色的炭,这种作用通常叫做脱水作用。脱水性属于化学性质。
浓硫酸的吸水性属于物理性质
浓硫酸的稀释
怎样稀释浓硫酸?
实验: 浓硫酸的稀释
浓硫酸的稀释
怎样稀释浓硫酸?
口诀:稀释浓硫酸,应防酸飞溅,硫酸慢入水,及时来搅拌
浓硫酸的稀释
你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着容器壁慢慢注入水中,而且还要不断搅拌吗?
浓硫酸的稀释
水的密度较小,浮在浓硫酸上面,且溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅
你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着容器壁慢慢注入水中,而且还要不断搅拌吗?
浓硫酸的稀释
1.稀释浓硫酸应在烧杯中进行,不可以在量筒中直接稀释浓硫酸。
2.若是稀硫酸沾到皮肤或衣服上,也应立即用大量水冲洗,因为时间一长,水分蒸发后,稀硫酸也会变成浓硫酸,仍会有很强的腐蚀性。
特别提醒!
浓硫酸的稀释
1.下列有关溶质质量分数为98%的浓硫酸的说法错误的是( )
A.浓硫酸的密度大于水的密度
B.浓硫酸腐蚀衣物和皮肤是物理变化
C.浓硫酸与水混合时溶液温度迅速升高
D.浓硫酸具有很强的吸水性,常用作干燥剂
课堂达标
2. (2019·北京中考)用如图装置进行实验,挤出浓盐酸。
(1)实验现象是________________________。
(2)该实验说明分子具有的性质是____________________。
1.下列有关溶质质量分数为98%的浓硫酸的说法错误的是( )
A.浓硫酸的密度大于水的密度
B.浓硫酸腐蚀衣物和皮肤是物理变化
C.浓硫酸与水混合时溶液温度迅速升高
D.浓硫酸具有很强的吸水性,常用作干燥剂
B
强腐蚀性→化学变化
课堂达标
2. (2019·北京中考)用如图装置进行实验,挤出浓盐酸。
(1)实验现象是________________________。
(2)该实验说明分子具有的性质是____________________。
小纸花由紫色变为红色
分子在不停地运动
3.实验室为了收集干燥的二氧化碳气体,将制取的气体先后通过甲、乙两装置。下列关于甲、乙两装置导管的连接方式正确的是( )
A. a接c B. a接d
C. b接c D. b接d
课堂达标
3.实验室为了收集干燥的二氧化碳气体,将制取的气体先后通过甲、乙两装置。下列关于甲、乙两装置导管的连接方式正确的是( )
A. a接c B. a接d
C. b接c D. b接d
A
课堂达标
在学习盐酸、硫酸之后我们发现它们存在一些相似的性质。
现在对它们的化学性质你有什么想法呢?
酸的化学性质
PART 2
02 酸的化学性质
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
酸碱指示剂:能跟酸或碱的溶液起反应而显不同颜色的物质,通常简称指示剂。
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
酸碱指示剂:能跟酸或碱的溶液起反应而显不同颜色的物质,通常简称指示剂。
常见的酸碱指示剂:
紫色石蕊溶液(紫色)
酚酞溶液(无色)
指示剂的作用
实验 : 指示剂的作用
操作:向溶液中加入酸碱指示剂
指示剂的作用
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
加入紫色石蕊溶液
加入无色酚酞溶液
溶液性质
白醋
苹果汁
石灰水
氢氧化钠
氯化钠
实验记录
指示剂的作用
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
加入紫色石蕊溶液
加入无色酚酞溶液
溶液性质
白醋
变红色
不变色
酸性
苹果汁
变红色
不变色
酸性
石灰水
变蓝色
变红色
碱性
氢氧化钠
变蓝色
变红色
碱性
氯化钠
紫色
不变色
中性
实验记录
【实验结论】
酸或碱能与指示剂反应,使指示剂显示不同的颜色。
酸能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色;
碱能使紫色石蕊溶液变成蓝色,使无色酚酞溶液变成红色。
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
酸性溶液
碱性溶液
中性溶液
紫色石蕊溶液
无色酚酞溶液
指示剂的作用
【实验结论】
酸或碱能与指示剂反应,使指示剂显示不同的颜色。
酸能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色;
碱能使紫色石蕊溶液变成蓝色,使无色酚酞溶液变成红色。
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
酸性溶液
碱性溶液
中性溶液
紫色石蕊溶液
变红
变蓝
不变色(显紫色)
无色酚酞溶液
不变色(显无色)
变红
不变色(显无色)
指示剂的作用
石蕊遇酸紫变红,酚酞遇酸仍无色;
石蕊遇碱紫变蓝,酚酞遇碱红艳艳;
无论石蕊与酚酞,中性溶液色不变。
指示剂变色巧记
酸
碱
指示剂的作用
1.酸碱指示剂遇到酸碱性不同的溶液时,颜色改变为化学变化,变色的是指示剂。
2.不溶于水的酸或碱不能使指示剂变色。例如,氢氧化铜、氢氧化铁。
3.某溶液滴入无色酚酞溶液不变色,该溶液不一定是酸性溶液,也可能是中性溶液
4. 酸碱指示剂只能证明溶液显酸性或碱性。
指示剂的作用
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
稀盐酸
稀硫酸
紫色石蕊溶液
无色酚酞溶液
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
稀盐酸
稀硫酸
紫色石蕊溶液
变红
变红
无色酚酞溶液
不变色
不变色
【结论】紫色石蕊溶液遇酸变红,无色酚酞溶液遇酸不变色。
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
(2)酸与活泼金属的反应
酸的化学性质
回忆第八单元所学的几种金属分别与稀盐酸或稀硫酸的反应,写出化学方程式。
{08FB837D-C827-4EFA-A057-4D05807E0F7C}
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
Mg +2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = Fe SO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
酸的化学性质
注意!因硝酸、浓硫酸的氧化性很强,它们与金属反应不生成氢气。
{08FB837D-C827-4EFA-A057-4D05807E0F7C}
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
【结论】:酸能与较活泼的金属反应生成金属离子和酸根离子构成化合物
(盐)和氢气。
Mg +2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = Fe SO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
酸的化学性质
为什么不可将醋放在铁锅中长时间烹调,不可用铝制品调拌要放醋的凉菜?
思考
为什么不可将醋放在铁锅中长时间烹调,不可用铝制品调拌要放醋的凉菜?
因为食醋中含有醋酸,能与铁、铝发生化学反应。
思考
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因。
思考
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因。
用水冲洗铁罐车时,浓硫酸被稀释成稀硫酸,稀硫酸与铁发生化学反应生成了氢气,氢气在爆炸极限内遇火发生爆炸。
思考
(3)酸与金属的碱性氧化物反应
酸的化学性质
用酸处理生锈铁钉
用酸处理生锈铁钉,观察现象。
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
现象
化学方程式
铁锈+
稀盐酸
铁锈+
稀硫酸
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
Fe2O3 + 3H2SO4 Fe2(SO4) 3 + 3H2O
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
酸的化学性质
Fe2O3 + 6HCl 2FeCl3 + 3H2O
+3
+3
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
现象
化学方程式
铁锈+
稀盐酸
铁锈+
稀硫酸
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
Fe2O3 + 3H2SO4 Fe2(SO4) 3 + 3H2O
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
酸的化学性质
Fe2O3 + 6HCl 2FeCl3 + 3H2O
+3
+3
【结论】:
酸能与金属的碱性氧化物反应生成金属离子和酸根离子构成的化合物(盐)和水。
(4)酸与碱的反应
酸的化学性质(拓展延伸)
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}酸与碱的反应
酸 + 碱 → 盐 + 水
NaOH+HCl=NaCl+H2O
?
2NaOH+H2SO4=Na2SO4+2H2O
?
酸的化学性质(拓展延伸)
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}酸与盐的反应
酸 + 盐 → 新盐 + 新酸
HCl+AgNO3=AgCl↓+HNO3
?
H2SO4+BaCl2=BaSO4↓+2HCl
?
(5)酸与盐的反应
酸有一些相似的化学性质
1、酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色。
2、酸能跟多种活泼金属反应,生成该金属的化合物和氢气。
3、酸可以与某些金属的碱性氧化物反应生成该金属的化合物(盐)和水。
4、酸可以与碱反应生成该金属的化合物(盐)和水。
5、酸可以与盐反应生成新酸和新盐。
归纳总结
浓盐酸:挥发性
物理性质
几种常
见的酸
浓硫酸:吸水性,脱水性(化学性质)
化学性质
用途
酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色
阶段小结
酸+活泼金属 金属化合物+氢气
酸+金属的碱性氧化物 盐+水
酸+碱 盐+水
酸+盐 新盐+新酸
1.(2019·上海中考)能使紫色石蕊试液变蓝的是( )
A.水 B.石灰水 C.稀硫酸 D.稀盐酸
课堂达标
2.向一瓶无色透明的溶液中滴两滴紫色石蕊试液,溶液使石蕊变红,说明该溶液是( )
A.酸的水溶液 B.碱的水溶液
C.碱性溶液 D.酸性溶液
1.(2019·上海中考)能使紫色石蕊试液变蓝的是( )
B
A.水 B.石灰水 C.稀硫酸 D.稀盐酸
课堂达标
2.向一瓶无色透明的溶液中滴两滴紫色石蕊试液,溶液使石蕊变红,说明该溶液是( )
A.酸的水溶液 B.碱的水溶液
C.碱性溶液 D.酸性溶液
D
3.社会上的一些不法分子常常用黄铜(铜锌合金)假冒黄金进行诈骗。为了区别黄铜和真金,以下方法简便可行的是( )
A.观察颜色 B.放入水中
C.滴加稀硫酸 D.用磁铁吸引
4.下列关于H2SO4性质的描述中,不属于酸的通性的是( )
A.使紫色石蕊溶液变红
B.与氧化铁发生反应
C.浓硫酸滴到白纸上使纸变黑
D.与镁反应放出氢气
课堂达标
3.社会上的一些不法分子常常用黄铜(铜锌合金)假冒黄金进行诈骗。为了区别黄铜和真金,以下方法简便可行的是( )
A.观察颜色 B.放入水中
C.滴加稀硫酸 D.用磁铁吸引
C
4.下列关于H2SO4性质的描述中,不属于酸的通性的是( )
A.使紫色石蕊溶液变红
B.与氧化铁发生反应
C.浓硫酸滴到白纸上使纸变黑
D.与镁反应放出氢气
C
课堂达标
5.学习完酸的化学性质,小凯构建了如图所示的知识网络图。请回答:
(1)溶液X是一种酸,试剂A的名称是 。
(2)若X是稀硫酸、B是氧化物,则B的化学式为 。
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为__________________________________________。
课堂达标
5.学习完酸的化学性质,小凯构建了如图所示的知识网络图。请回答:
(1)溶液X是一种酸,试剂A的名称是 。
(2)若X是稀硫酸、B是氧化物,则B的化学式为 。
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为__________________________________________。
紫色石蕊溶液
Fe2O3
铁
2HCl+CaCO3 CaCl2+H2O+CO2↑
课堂达标
第一课时 常见的酸
CONTENTS
01
常见的酸
02
酸的化学性质
内容提要
认识几种常见酸的主要性质和用途
认识浓硫酸的腐蚀性及其稀释时的注意事项
会用酸碱指示剂检验溶液的酸碱性
目标一
目标三
目标二
学习目标
你知道生活中哪些物质有酸味吗?
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
导入新课
PART 1
01 常见的酸
常见的酸
常见的酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、磷酸(H3PO4)、碳酸(H2CO3)、醋酸(CH3COOH)等。
观察这几种酸,从名称和组成上看你能发现什么?
酸→氢离子+ 酸根离子
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}酸
H+
酸根离子
硫酸 H2SO4
H+
SO42- 硫酸根离子
硝酸 HNO3
H+
NO3-硝酸根离子
碳酸 H2CO3
H+
CO32- 碳酸根离子
盐酸 HCl
H+
Cl- 盐酸根离子
乙酸 CH3COOH
H+
CH3COO- 乙酸根离子
酸的定义
是否含有氧原子
含氧酸:
无氧酸:
HNO3、 CH3COOH等
HCl、H2S等
按物质类别
有机酸:
无机酸:
HCOOH、 CH3COOH等
H2CO3、HCl等
根据分子中含与酸根结合的氢原子数分类
一元酸:
二元酸:
三元酸:
………
HCl、CH3COOH等
H2SO4、H2CO3等
H3PO4等
酸的分类
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
根据分子中含与酸根离子结合的氢原子数分类
根据分子中是否含有氧原子分类
含1个H原子一元酸
含2个H原子二元酸
含O原子含氧酸
不含O原子无氧酸
HCl
H2S
H2SO4
HNO3
酸的分类
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
根据分子中含与酸根离子结合的氢原子数分类
根据分子中是否含有氧原子分类
含1个H原子一元酸
含2个H原子二元酸
含O原子含氧酸
不含O原子无氧酸
HCl
√
H2S
√
H2SO4
√
HNO3
√
酸的分类
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
根据分子中含与酸根离子结合的氢原子数分类
根据分子中是否含有氧原子分类
含1个H原子一元酸
含2个H原子二元酸
含O原子含氧酸
不含O原子无氧酸
HCl
√
√
H2S
√
√
H2SO4
√
√
HNO3
√
√
酸的分类
认识常见的酸
浓硫酸
浓盐酸
认识常见的酸
浓盐酸(HCl)
颜色、状态:无色的液体;工业用盐酸:黄色(Fe3+)
气味性:有刺激性气味
特性:挥发性(敞口至于空气中,瓶口有白雾)
用途:重要化工产品。用于除锈、制药、人体胃液中有盐酸帮助消化。
浓盐酸
盐酸的制取方法:
浓盐酸(HCl)
颜色、状态:无色的液体;工业用盐酸:黄色(Fe3+)
气味性:有刺激性气味
特性:挥发性(敞口至于空气中,瓶口有白雾)
用途:重要化工产品。用于除锈、制药、人体胃液中有盐酸帮助消化。
浓盐酸
盐酸的制取方法:
先发生反应:H2+Cl2 === 2HCl,再将HCl气体溶于水即得盐酸。
点燃
浓盐酸(HCl)
颜色、状态:无色的液体;工业用盐酸:黄色(Fe3+)
气味性:有刺激性气味
特性:挥发性(敞口至于空气中,瓶口有白雾)
用途:重要化工产品。用于除锈、制药、人体胃液中有盐酸帮助消化。
浓盐酸
盐酸的制取方法:
先发生反应:H2+Cl2 === 2HCl,再将HCl气体溶于水即得盐酸。
点燃
为什么为什么会有白雾? ?
1.盐酸具有挥发性,浓度越大、温度越高,挥发性越强。
2.浓盐酸易挥发,打开瓶盖,瓶口出现白雾,这是由于挥发出来的氯化氢气体与空气中的水蒸气结合,又形成了盐酸小液滴。
拓展延伸
你们在实验室如何嗅药品的气味?
浓硫酸(H2SO4)
颜色、状态:浓硫酸无色、粘稠的油状液体(稀硫酸是无色的液体)
气味性:无
特性:吸水性、脱水性(脱水性)、强氧化性
用途:重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。在实验室中常用它做干燥剂。
浓硫酸
硫酸的制取方法:
浓硫酸(H2SO4)
颜色、状态:浓硫酸无色、粘稠的油状液体(稀硫酸是无色的液体)
气味性:无
特性:吸水性、脱水性(脱水性)、强氧化性
用途:重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。在实验室中常用它做干燥剂。
浓硫酸
硫酸的制取方法:
2SO2+O2=== 2SO3 SO3+ H2O =H2SO4
高温
浓硫酸(H2SO4)
颜色、状态:浓硫酸无色、粘稠的油状液体(稀硫酸是无色的液体)
气味性:无
特性:吸水性、脱水性(脱水性)、强氧化性
用途:重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。在实验室中常用它做干燥剂。
浓硫酸
硫酸的制取方法:
2SO2+O2=== 2SO3 SO3+ H2O =H2SO4
高温
为什么可以用它做干燥剂?
浓硫酸的吸水性
因为浓硫酸有很强的吸水性,溶于水放出大量的热量,所以可以将其作为干燥剂。
那么做干燥剂的时候,装置图是怎么样的?需要注意的点在哪?
1、浓硫酸的吸水性
浓硫酸的吸水性
干燥装置图如右所示。
浓硫酸
浓硫酸的吸水性
干燥装置图如右所示。浓硫酸做干燥剂时,需要干燥的气体一定从长导管通入,从短导管出,可归纳为:长进短出。
稀硫酸无吸水性,不能用作干燥剂。
浓硫酸不能干燥氨气(NH3),可以用来干燥O2、H2、CO2。
浓硫酸
气体
浓硫酸的脱水性
实验: 浓硫酸的脱水性
2、浓硫酸的脱水性(腐蚀性)
实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到一小块布上
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
布条逐渐变黄
浓硫酸的脱水性
实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到一小块布上
因为浓硫酸的脱水性(浓硫酸能使由碳、氢、氧等元素组成的化合物炭化),显示浓硫酸具有强腐蚀性。
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
布条逐渐变黄
浓硫酸的脱水性
拓展延伸
1.浓硫酸有强烈的腐蚀性,实验应在玻璃片上进行,如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
2.浓硫酸将皮肤、纸张、木材等物质中的氢、氧元素按水的组成比脱去,生成黑色的炭,这种作用通常叫做脱水作用。脱水性属于化学性质。
浓硫酸的吸水性属于物理性质
浓硫酸的稀释
怎样稀释浓硫酸?
实验: 浓硫酸的稀释
浓硫酸的稀释
怎样稀释浓硫酸?
口诀:稀释浓硫酸,应防酸飞溅,硫酸慢入水,及时来搅拌
浓硫酸的稀释
你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着容器壁慢慢注入水中,而且还要不断搅拌吗?
浓硫酸的稀释
水的密度较小,浮在浓硫酸上面,且溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅
你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着容器壁慢慢注入水中,而且还要不断搅拌吗?
浓硫酸的稀释
1.稀释浓硫酸应在烧杯中进行,不可以在量筒中直接稀释浓硫酸。
2.若是稀硫酸沾到皮肤或衣服上,也应立即用大量水冲洗,因为时间一长,水分蒸发后,稀硫酸也会变成浓硫酸,仍会有很强的腐蚀性。
特别提醒!
浓硫酸的稀释
1.下列有关溶质质量分数为98%的浓硫酸的说法错误的是( )
A.浓硫酸的密度大于水的密度
B.浓硫酸腐蚀衣物和皮肤是物理变化
C.浓硫酸与水混合时溶液温度迅速升高
D.浓硫酸具有很强的吸水性,常用作干燥剂
课堂达标
2. (2019·北京中考)用如图装置进行实验,挤出浓盐酸。
(1)实验现象是________________________。
(2)该实验说明分子具有的性质是____________________。
1.下列有关溶质质量分数为98%的浓硫酸的说法错误的是( )
A.浓硫酸的密度大于水的密度
B.浓硫酸腐蚀衣物和皮肤是物理变化
C.浓硫酸与水混合时溶液温度迅速升高
D.浓硫酸具有很强的吸水性,常用作干燥剂
B
强腐蚀性→化学变化
课堂达标
2. (2019·北京中考)用如图装置进行实验,挤出浓盐酸。
(1)实验现象是________________________。
(2)该实验说明分子具有的性质是____________________。
小纸花由紫色变为红色
分子在不停地运动
3.实验室为了收集干燥的二氧化碳气体,将制取的气体先后通过甲、乙两装置。下列关于甲、乙两装置导管的连接方式正确的是( )
A. a接c B. a接d
C. b接c D. b接d
课堂达标
3.实验室为了收集干燥的二氧化碳气体,将制取的气体先后通过甲、乙两装置。下列关于甲、乙两装置导管的连接方式正确的是( )
A. a接c B. a接d
C. b接c D. b接d
A
课堂达标
在学习盐酸、硫酸之后我们发现它们存在一些相似的性质。
现在对它们的化学性质你有什么想法呢?
酸的化学性质
PART 2
02 酸的化学性质
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
酸碱指示剂:能跟酸或碱的溶液起反应而显不同颜色的物质,通常简称指示剂。
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
酸碱指示剂:能跟酸或碱的溶液起反应而显不同颜色的物质,通常简称指示剂。
常见的酸碱指示剂:
紫色石蕊溶液(紫色)
酚酞溶液(无色)
指示剂的作用
实验 : 指示剂的作用
操作:向溶液中加入酸碱指示剂
指示剂的作用
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
加入紫色石蕊溶液
加入无色酚酞溶液
溶液性质
白醋
苹果汁
石灰水
氢氧化钠
氯化钠
实验记录
指示剂的作用
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
加入紫色石蕊溶液
加入无色酚酞溶液
溶液性质
白醋
变红色
不变色
酸性
苹果汁
变红色
不变色
酸性
石灰水
变蓝色
变红色
碱性
氢氧化钠
变蓝色
变红色
碱性
氯化钠
紫色
不变色
中性
实验记录
【实验结论】
酸或碱能与指示剂反应,使指示剂显示不同的颜色。
酸能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色;
碱能使紫色石蕊溶液变成蓝色,使无色酚酞溶液变成红色。
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
酸性溶液
碱性溶液
中性溶液
紫色石蕊溶液
无色酚酞溶液
指示剂的作用
【实验结论】
酸或碱能与指示剂反应,使指示剂显示不同的颜色。
酸能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色;
碱能使紫色石蕊溶液变成蓝色,使无色酚酞溶液变成红色。
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
酸性溶液
碱性溶液
中性溶液
紫色石蕊溶液
变红
变蓝
不变色(显紫色)
无色酚酞溶液
不变色(显无色)
变红
不变色(显无色)
指示剂的作用
石蕊遇酸紫变红,酚酞遇酸仍无色;
石蕊遇碱紫变蓝,酚酞遇碱红艳艳;
无论石蕊与酚酞,中性溶液色不变。
指示剂变色巧记
酸
碱
指示剂的作用
1.酸碱指示剂遇到酸碱性不同的溶液时,颜色改变为化学变化,变色的是指示剂。
2.不溶于水的酸或碱不能使指示剂变色。例如,氢氧化铜、氢氧化铁。
3.某溶液滴入无色酚酞溶液不变色,该溶液不一定是酸性溶液,也可能是中性溶液
4. 酸碱指示剂只能证明溶液显酸性或碱性。
指示剂的作用
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
稀盐酸
稀硫酸
紫色石蕊溶液
无色酚酞溶液
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
稀盐酸
稀硫酸
紫色石蕊溶液
变红
变红
无色酚酞溶液
不变色
不变色
【结论】紫色石蕊溶液遇酸变红,无色酚酞溶液遇酸不变色。
1、酸的化学性质
(1)酸与指示剂作用
酸的化学性质
(2)酸与活泼金属的反应
酸的化学性质
回忆第八单元所学的几种金属分别与稀盐酸或稀硫酸的反应,写出化学方程式。
{08FB837D-C827-4EFA-A057-4D05807E0F7C}
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
Mg +2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = Fe SO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
酸的化学性质
注意!因硝酸、浓硫酸的氧化性很强,它们与金属反应不生成氢气。
{08FB837D-C827-4EFA-A057-4D05807E0F7C}
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
【结论】:酸能与较活泼的金属反应生成金属离子和酸根离子构成化合物
(盐)和氢气。
Mg +2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = Fe SO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
酸的化学性质
为什么不可将醋放在铁锅中长时间烹调,不可用铝制品调拌要放醋的凉菜?
思考
为什么不可将醋放在铁锅中长时间烹调,不可用铝制品调拌要放醋的凉菜?
因为食醋中含有醋酸,能与铁、铝发生化学反应。
思考
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因。
思考
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因。
用水冲洗铁罐车时,浓硫酸被稀释成稀硫酸,稀硫酸与铁发生化学反应生成了氢气,氢气在爆炸极限内遇火发生爆炸。
思考
(3)酸与金属的碱性氧化物反应
酸的化学性质
用酸处理生锈铁钉
用酸处理生锈铁钉,观察现象。
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
现象
化学方程式
铁锈+
稀盐酸
铁锈+
稀硫酸
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
Fe2O3 + 3H2SO4 Fe2(SO4) 3 + 3H2O
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
酸的化学性质
Fe2O3 + 6HCl 2FeCl3 + 3H2O
+3
+3
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
现象
化学方程式
铁锈+
稀盐酸
铁锈+
稀硫酸
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
Fe2O3 + 3H2SO4 Fe2(SO4) 3 + 3H2O
铁锈逐渐消失,铁钉变得光亮,溶液由无色变为黄色
酸的化学性质
Fe2O3 + 6HCl 2FeCl3 + 3H2O
+3
+3
【结论】:
酸能与金属的碱性氧化物反应生成金属离子和酸根离子构成的化合物(盐)和水。
(4)酸与碱的反应
酸的化学性质(拓展延伸)
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}酸与碱的反应
酸 + 碱 → 盐 + 水
NaOH+HCl=NaCl+H2O
?
2NaOH+H2SO4=Na2SO4+2H2O
?
酸的化学性质(拓展延伸)
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}酸与盐的反应
酸 + 盐 → 新盐 + 新酸
HCl+AgNO3=AgCl↓+HNO3
?
H2SO4+BaCl2=BaSO4↓+2HCl
?
(5)酸与盐的反应
酸有一些相似的化学性质
1、酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色。
2、酸能跟多种活泼金属反应,生成该金属的化合物和氢气。
3、酸可以与某些金属的碱性氧化物反应生成该金属的化合物(盐)和水。
4、酸可以与碱反应生成该金属的化合物(盐)和水。
5、酸可以与盐反应生成新酸和新盐。
归纳总结
浓盐酸:挥发性
物理性质
几种常
见的酸
浓硫酸:吸水性,脱水性(化学性质)
化学性质
用途
酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色
阶段小结
酸+活泼金属 金属化合物+氢气
酸+金属的碱性氧化物 盐+水
酸+碱 盐+水
酸+盐 新盐+新酸
1.(2019·上海中考)能使紫色石蕊试液变蓝的是( )
A.水 B.石灰水 C.稀硫酸 D.稀盐酸
课堂达标
2.向一瓶无色透明的溶液中滴两滴紫色石蕊试液,溶液使石蕊变红,说明该溶液是( )
A.酸的水溶液 B.碱的水溶液
C.碱性溶液 D.酸性溶液
1.(2019·上海中考)能使紫色石蕊试液变蓝的是( )
B
A.水 B.石灰水 C.稀硫酸 D.稀盐酸
课堂达标
2.向一瓶无色透明的溶液中滴两滴紫色石蕊试液,溶液使石蕊变红,说明该溶液是( )
A.酸的水溶液 B.碱的水溶液
C.碱性溶液 D.酸性溶液
D
3.社会上的一些不法分子常常用黄铜(铜锌合金)假冒黄金进行诈骗。为了区别黄铜和真金,以下方法简便可行的是( )
A.观察颜色 B.放入水中
C.滴加稀硫酸 D.用磁铁吸引
4.下列关于H2SO4性质的描述中,不属于酸的通性的是( )
A.使紫色石蕊溶液变红
B.与氧化铁发生反应
C.浓硫酸滴到白纸上使纸变黑
D.与镁反应放出氢气
课堂达标
3.社会上的一些不法分子常常用黄铜(铜锌合金)假冒黄金进行诈骗。为了区别黄铜和真金,以下方法简便可行的是( )
A.观察颜色 B.放入水中
C.滴加稀硫酸 D.用磁铁吸引
C
4.下列关于H2SO4性质的描述中,不属于酸的通性的是( )
A.使紫色石蕊溶液变红
B.与氧化铁发生反应
C.浓硫酸滴到白纸上使纸变黑
D.与镁反应放出氢气
C
课堂达标
5.学习完酸的化学性质,小凯构建了如图所示的知识网络图。请回答:
(1)溶液X是一种酸,试剂A的名称是 。
(2)若X是稀硫酸、B是氧化物,则B的化学式为 。
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为__________________________________________。
课堂达标
5.学习完酸的化学性质,小凯构建了如图所示的知识网络图。请回答:
(1)溶液X是一种酸,试剂A的名称是 。
(2)若X是稀硫酸、B是氧化物,则B的化学式为 。
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为__________________________________________。
紫色石蕊溶液
Fe2O3
铁
2HCl+CaCO3 CaCl2+H2O+CO2↑
课堂达标
同课章节目录
