13.1食物中的营养物质课后练习—2021_2022学年九年级化学京改版(2013)版下册(word版 含解析)
文档属性
| 名称 | 13.1食物中的营养物质课后练习—2021_2022学年九年级化学京改版(2013)版下册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 394.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-10 14:57:22 | ||
图片预览



文档简介
13.1食物中的营养物质
一、选择题(共16题)
1.下列食品中富含维生素的是
A.米饭 B.牛肉 C.菜油 D.橙子
2.工业酒精中常含有甲醇,甲醇有剧毒,不能食用,其分子结构可用如图所示的模型表示。下列有关甲醇的叙述中,错误的是( )
A.甲醇的化学式为CH3OH
B.甲醇属于有机物
C.甲醇中C、H、O三种元素的质量比为1:4:1
D.甲醇中氧元素的质量分数为50%
3.分类法是化学学习的重要方法,下列关于物质分类正确的是
A.氧化物 :氧气、五氧化二磷、生石灰
B.混合物 :洁净的空气、石油、冰水混合物
C.有机物:甲烷、乙醇、乙酸
D.合成材料:合金、塑料、合成纤维
4.下列衣物中所使用的主要材料属于合成纤维的是( )
A.丝绸睡衣 B.亚麻长裤 C.涤纶T恤 D.羊绒大衣
5.健康的生活离不开化学,下列有关方法不合理的是
A.用碳酸氢钠做膨松剂制作蛋糕
B.在酱油里加适量的“铁”预防缺铁性贫血
C.在食品包装里充氮气防腐
D.用汽油除去餐具上的油污
6.下列属于人体必需的微量元素且对人体健康作用的叙述正确的是( )
A.人体缺钙易患佝偻病 B.人体缺铁影响智力发育
C.人体缺锌易得贫血症 D.人体缺碘会导致甲状腺肿大
7.下列是某同学记录的实验现象,其中错误的是
A.向澄清石灰水中滴入碳酸钠溶液,有白色沉淀出现
B.CO在高温条件下还原氧化铁时,红棕色固体逐渐变为黑色
C.将草木灰的浸出液滴到pH试纸上,试纸会由黄色变为浅红色
D.灼烧棉线会产生烧纸的气味,灼烧羊毛线则产生烧焦羽毛的气味
8.为保障“舌尖上的安全”,下列做法合理的是( )
A.霉变大米燕煮后食用
B.为保障腊肠肉质鲜美,添加过量的亚硝酸钠
C.做蛋糕时加入少量的小苏打,使它更松软
D.用甲醛溶液浸泡荔枝,以保鲜防腐
9.“绿水青山就是金山银山”,已成为国家意志和全民共识,建设天蓝、地绿、水清的美丽中国,我们任重而道远。下列做法与我国绿色发展理念不相符的是( )
A.参与植树造林,扩大植被面积
B.改进污水处理技术,减少水体污染
C.使用一些新型可降解的塑料,减少“白色污染”
D.将校园散落的塑料袋、树叶集中焚烧,保持整洁的环境
10.下列说法正确的是
A.天然淡水经过沉降、过滤、吸附、灭菌、蒸馏等净化操作后,可供人们生活用水
B.活性炭用于消毒面具,是利用它化学性质稳定的特点
C.CO2 含量增多会引起温室效应,属于空气污染物
D.废弃塑料产生的白色污染会带来严重的环境问题,因此,回收废弃塑料非常重要
11.化学与我们的生活息息相关,下列物质的用途中不正确的是( )
A.用甲醛溶液保鲜食品 B.小苏打制发酵粉
C.金刚石裁玻璃 D.补碘剂可预防甲状腺肿大
12.1989年世界卫生组织正式将“铝确定为食品污染源之一”而加以控制.在下列使用场合必须加以控制的是
①制电器 ②制易拉罐 ③制铝锭 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾及小苏打作食物膨化剂 ⑧用氢氧化铝制胃药 ⑨制防锈漆 ⑩制桌椅.
A.①②④⑤⑧⑩ B.②④⑤⑥⑦⑧
C.②⑤⑥⑦⑧⑩ D.③④⑤⑥⑦⑧⑨
13.下列有关生产生活中的化学知识整理有错误的一组是 ( )
A ①制糖工业中利用活性炭来脱色 ②硬水经过滤后可以转化为软水 C ①缺乏维生素 C 易引起坏血病 ②工业炼铁的主要原料包括铁矿石、焦炭和石灰石
B ①金刚石和石墨中都含有碳元素 ②氢氧化钠能与油脂反应,在生活中可以用来去除油污 D ①灯泡中充氮气以延长使用寿命 ②食品袋中放一小包铁粉,既防潮又防止食品腐败变质
A.A B.B C.C D.D
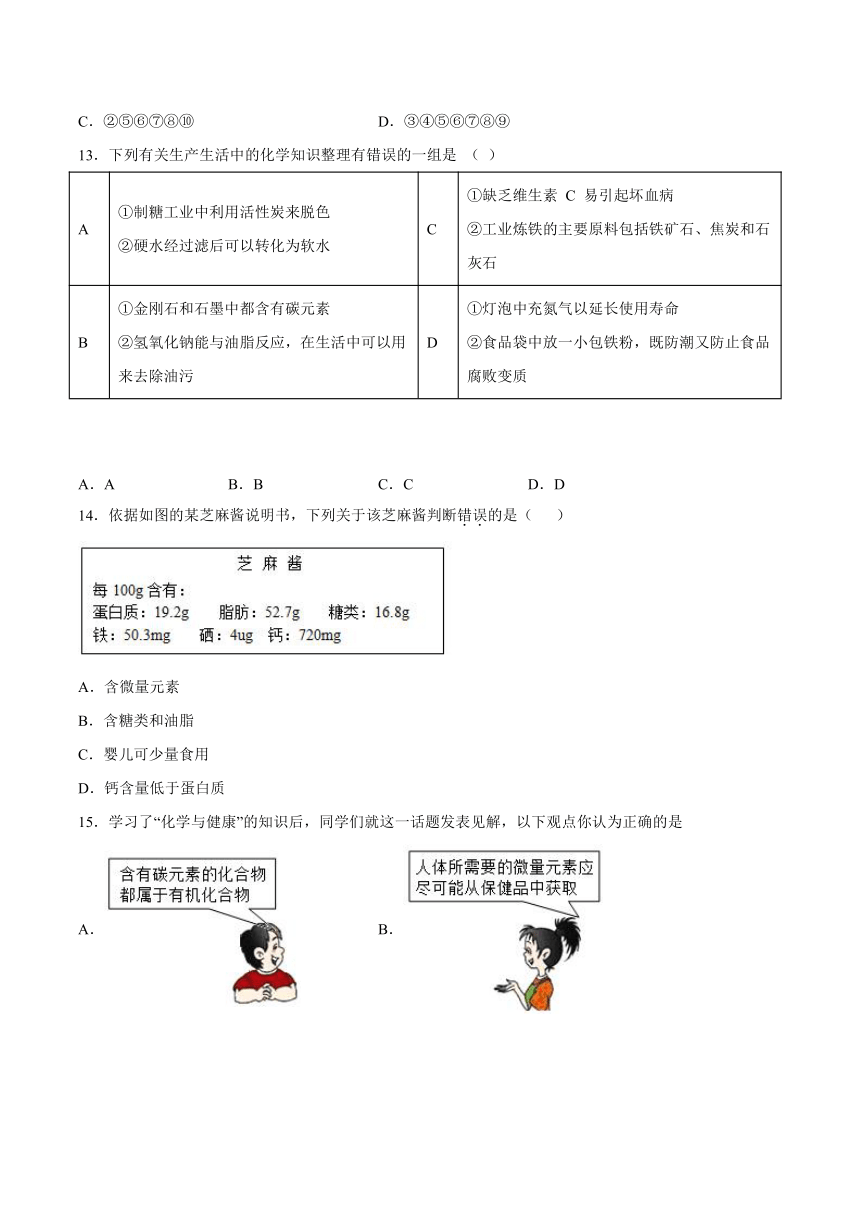
14.依据如图的某芝麻酱说明书,下列关于该芝麻酱判断错误的是( )
A.含微量元素
B.含糖类和油脂
C.婴儿可少量食用
D.钙含量低于蛋白质
15.学习了“化学与健康”的知识后,同学们就这一话题发表见解,以下观点你认为正确的是
A. B.
C. D.
16.南宁是我家, 保护环境靠大家。下列因果关系错误的是
选项 原因 结果
A 废纸、废金属制品的随意丟弃 白色污染
B SO2 和 NO2 气体大量排放 酸雨
C 化石燃料的大量使用 温室效应加剧
D 工业、农业和生活废水未经处理就排放 水体污染
A.A B.B C.C D.D
二、综合题(共6题)
17.常见金属铁的认识:
(1)如图为铁元素在元素周期表中的信息,铁元素的原子序数为_____,亚铁离子(Fe2+)的核外电子数为_____。
(2)健康人体内,总量4~5g的铁元素主要以_____(选填“单质”、“化合物”)形式存在,缺铁会患上_____(填字母)。
a.骨质疏松 b.甲状腺疾病 c.贫血症 d.侏儒症
(3)兴趣小组通过如图实验研究铁的冶炼
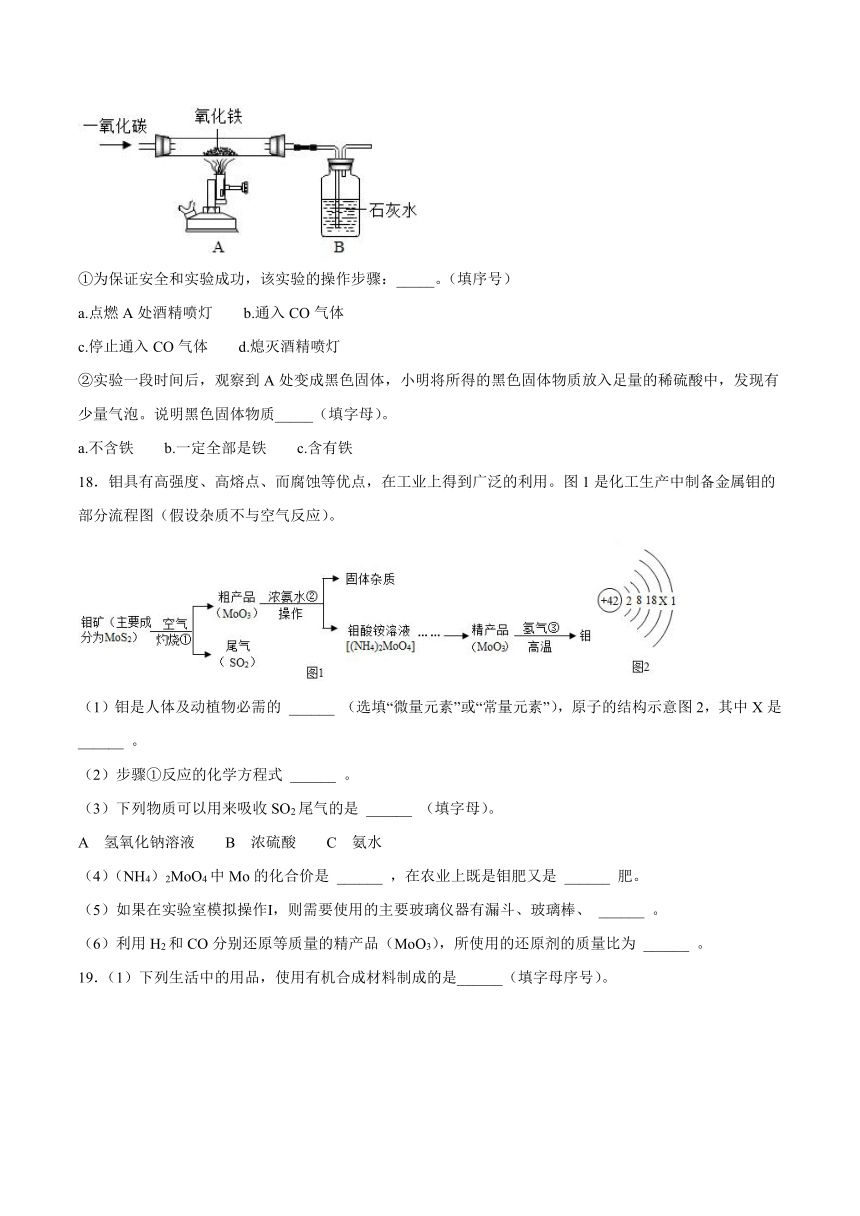
①为保证安全和实验成功,该实验的操作步骤:_____。(填序号)
a.点燃A处酒精喷灯 b.通入CO气体
c.停止通入CO气体 d.熄灭酒精喷灯
②实验一段时间后,观察到A处变成黑色固体,小明将所得的黑色固体物质放入足量的稀硫酸中,发现有少量气泡。说明黑色固体物质_____(填字母)。
a.不含铁 b.一定全部是铁 c.含有铁
18.钼具有高强度、高熔点、而腐蚀等优点,在工业上得到广泛的利用。图1是化工生产中制备金属钼的部分流程图(假设杂质不与空气反应)。
(1)钼是人体及动植物必需的 ______ (选填“微量元素”或“常量元素”),原子的结构示意图2,其中X是 ______ 。
(2)步骤①反应的化学方程式 ______ 。
(3)下列物质可以用来吸收SO2尾气的是 ______ (填字母)。
A 氢氧化钠溶液 B 浓硫酸 C 氨水
(4)(NH4)2MoO4中Mo的化合价是 ______ ,在农业上既是钼肥又是 ______ 肥。
(5)如果在实验室模拟操作Ⅰ,则需要使用的主要玻璃仪器有漏斗、玻璃棒、 ______ 。
(6)利用H2和CO分别还原等质量的精产品(MoO3),所使用的还原剂的质量比为 ______ 。
19.(1)下列生活中的用品,使用有机合成材料制成的是______(填字母序号)。
A、塑料桶 B、橡胶篮球
C、棉布围裙 D、陶瓷餐具
(2)洗洁精去除油污的原因是洗洁精具有______作用。
(3)生活中常用______来区分硬水和软水。
(4)石灰石用途非常广泛。可用来吸收火力发电厂煤燃烧时产生的二氧化硫废气,反应的化学方程式为:2CaCO3+2SO2+O22CaSO4+2X,X的化学式为______。
(5)如图为某一化学反应的微观示意图(X,Y,Z、W分别表示四种不同的物质),以下说法正确的是(____)
A.该反应的生成物有三种
B.参加反应的X、Y两种粒子的个数比是1:1
C.反应前后原子的种类发生了变化
D.X不可能是氧化物
20.(1)水是宝贵的自然资源,我国南海海域海洋资源极其丰富。
①2017年5月18日,南海可燃冰试采成功,可燃冰主要含有甲烷水合物。甲烷中碳元素的化合价是______价,甲烷充分燃烧的化学方程式是__________________。
②渔民常在这一带从事捕鱼作业,鱼肉中含量最多的营养素是_____(填序号)。
A.糖类 B.油脂 C.蛋白质 D.维生素
③科学研究证明,水在光照和TiO2作催化剂的条件下,能分解为氢气和氧气,反应的化学方程式是____________________。
④河水和海水一样都是混合物。自来水厂利用河水生产饮用水的过程中常用活性炭的_____性来除去水中的色素和异味。检验饮用水是软水还是硬水,可用___来检验。
(2)能源利用和环境保护是人类共同关注的问题。
①下列说法中正确的是______(填字母)。
A.煤、石油和天然气都属于可再生能源 B.氢气是理想的“绿色能源”
C.人类使用的能源绝大部分来自太阳能 D.废弃电池可以填埋在土壤里
②煤燃烧时排放出的二氧化硫等污染物,有可能会导致降雨的酸性增强。我们把pH_____5.6(填“>”“=”或“<”)的降雨称为酸雨。某电厂为防止环境污染,用石灰石浆来吸收二氧化硫,其反应的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2x,则x的化学式为______。
③研究发现,二氧化碳和氢气在催化剂作用下转化为甲醇(CH3OH)和水。该反应的化学方程式为______________________。
④将一定质量的甲醇与8.8g氧气混合于密闭容器内,在一定条件下,发生如下反应:8CH3OH+xO2 一定条件 mCO2+nCO+16H2O。当反应物完全耗尽且全部转化为生成物时,有7.2g水生成,同时生成二氧化碳的质量为______g。
21.盐城的城市建设可谓是日新月异,在城市建设、生产、生活中材料有着广泛的应用。
(1)下列生活用品,主要利用金属具有良好导热性的是________(填序号),一般铜导线外面包有聚乙烯绝缘层,聚乙烯属于________材料。
(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的___________共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是_____________(要求一种方法即可)。
(3)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
根据实验一判断出镁的金属活动性比铁强,依据的现象是___________;根据实验二的现象应得出的结论是__________。
(4)苗苗同学向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,充分反应后过滤,滤液呈浅绿色,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化。根据此现象作出了下列判断,你认为正确的是_____________(填序号)。
A.滤纸上一定有Fe,可能有Mg、Cu
B.滤纸上一定有Cu,可能有Fe,一定没有Mg
C.滤液中一定有FeSO4,可能有MgSO4 、CuSO4
D.滤液中一定有MgSO4、FeSO4,一定没有CuSO4
(5)为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
第I组 第Ⅱ组 第Ⅲ组
稀硫酸的质量/g 50 100 150
溶解固体的质量/g 10.0 16.0 16.0
根据实验及有关数据进行分析与计算:
①第I组实验中反应物___________(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完。
②20g样品中含氧化铜的质量分数分别为____________。
③计算所用的稀硫酸溶质的质量分数为____________(写出计算过程)
④将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
___________________
22.铝、镁等金属在生产生活中有广泛的应用。
(一)铝制品的应用。
(1)Cu、Fe、Al三种金属的活动性由强到弱的顺序是 ____ 。
(2)用玻璃钢、铝合金等材料可制成某火箭整流罩,以上叙述中不涉及到 __ (选填序号)。
A 无机材料 B 合成材料 C 复合材料
(3)焊接铁轨时,铝与氧化铁在高温下生成铁和氧化铝,该反应的化学方程式 ____ 。
(4)铝制成铝箔作食品包装,是利用它的 _____ 。
A 导热性 B 延展性 C 导电性
(二)活性氧化铝可用作化学反应的催化剂。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
(1)将工业废渣研磨成粉末的目的是 ____ 。
(2)气体X的化学式 ______ 。
(3)碱浸过程中,烧结生成的NaFeO2可与水反应生成NaOH和一种含铁的化合物,该含铁的化合物是 ____ 。
(三)铝碳酸镁[AlxMgy(OH)zCO3·aH2O]可用于治疗胃酸过多。某兴趣小组取一定量该药片用下图装置探究其组成。
(资料)Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O。Mg(OH)2不溶于NaOH, NaAlO2极易溶于水。
(1)装配好实验装置后,先要 ______ 。
(2)铝碳酸镁加热分解为Al2O3、MgO、CO2和水,装置B和C中盛放的药品应选择: ____ 。
A 浓H2SO4、浓NaOH溶液
B 浓NaOH溶液、浓H2SO4
(3)实验开始前通入一定量氮气,目的是 _______ 。
(4)充分加热后,测得装置B增重2.16g,装置C增重0.44g。另取等质量的样品加入一定量稀硫酸充分反应后滤去不溶物,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。
①图中NaOH加入0.80g,仍没有沉淀,说明滤液中含 _______ 。
②X值为 ______ 。③x:y:z= ______ 。
④写出铝碳酸镁治疗胃酸过多的化学方程式 _____________ 。
参考答案
1.D
【详解】
A、米饭中富含淀粉,淀粉属于糖类,故选项错误;
B、牛肉中富含蛋白质,故选项错误;
C、菜油中富含油脂,故选项错误;
D、橙子等水果中富含维生素,故选项正确。
故选D。
2.C
【详解】
A、由甲醇的分子结构模型可知,每个甲醇分子是由1个碳原子、4个氢原子和1个氧原子构成的,所以其化学式为CH3OH,故A正确;
B、甲醇是含碳元素的化合物,属于有机物,故B正确;
C、C甲醇中,碳、氢、氧三种元素的质量比等于(12×1):(1×4):(16×1)=3:1:4,故C错误;
D、甲醇中氧元素的质量分数=,故D正确。故选C。
3.C
【详解】
A、氧化物是由两种元素组成的化合物中,其中一种元素是氧元素,五氧化二磷、生石灰属于氧化物,而氧气是由同种元素组成的纯净物,属于单质,故选项分类不正确;
B、洁净的空气、石油中都含有多种物质,属于混合物,而冰是水的固体,冰水混合物只含有水一种物质,属于纯净物,故选项分类不正确;
C、甲烷、乙醇、乙酸都是含碳元素的化合物,属于有机物,故选项分类正确;
D、合金属于金属材料,塑料、合成纤维属于有机合成材料,故选项分类不正确。
故选C。
4.C
【详解】
A、丝绸睡衣是由蚕丝制成的,蚕丝属天然纤维,故A错误。
B、亚麻长裤是麻制成的,麻属于天然纤维,故B错误。
C、涤纶上衣是由涤纶制成的,涤纶是聚丙烯腈纤维,属于合成纤维,故C正确。
D、羊绒大衣是有羊毛制成的,羊毛属于天然纤维,故D错误。
故选:C。
5.D
【详解】
A、碳酸氢钠受热分解生成二氧化碳,可用碳酸氢钠做膨松剂制作蛋糕,不符合题意;
B、在酱油里加适量的“铁”,可以预防缺铁性贫血,不符合题意;
C、氮气化学性质稳定,且无毒,可在食品包装里充氮气防腐,不符合题意;
D、汽油能溶解油污,但是不能用汽油除去餐具上的油污,对健康不利,可用洗涤剂除去油污,符合题意。
故选D。
6.D
【详解】
A、人体缺钙易患佝偻病,但是钙元素属于人体必需的常量元素,故A错误;
B、人体缺铁易患贫血,故B错误;
C、人体缺锌会影响智力发育,故C错误;
D、人体缺碘易患甲状肿大,碘元素属于人体必需的微量元素,故D正确。故选D。
7.C
【详解】
A、碳酸钠能与氢氧化钙反应生产碳酸钙沉淀,溶液中出现白色浑浊,故选项说法正确;
B、将CO通过高温的氧化铁,生成铁和二氧化碳,会观察到,红棕色固体逐渐变为黑色,故选项说法正确;
C、草木灰水显碱性,用玻璃棒将草木灰水滴到pH试纸上,试纸由黄色变为蓝色,故选项说法错误;
D、羊毛线的主要成分是蛋白质,燃烧时有烧焦羽毛的气味,灼烧棉线会产生烧纸的气味,故选项说法正确。
故选C。
8.C
【详解】
A、霉变的食物中含有毒的黄曲霉素,黄曲霉素十分耐热,蒸煮不能将其破坏,所以不能食用,故A错误;
B、亚硝酸钠是一种常用的防腐剂,它虽可保持肉类鲜美,但食用过量会使人中毒,故B错误;
C、面粉发酵时可产生酸,碳酸氢钠与酸反应能生成二氧化碳气体,气体膨胀使蛋糕疏松多孔,故该做法不会危害人体健康,故C正确;
D、甲醛有毒,能破坏人体蛋白质的结构,使蛋白质变质,不能用甲醛水溶液浸泡荔枝,故D错误。
故选:C。
9.D
【详解】
A、参与植树造林,扩大植被面积有利于改善环境质量,故A不正确;
B、改进污水处理技术,减少水体污染,故B不正确;
C、使用一些新型可降解的塑料,减少“白色污染”,故C不正确;
D、将校园散落的塑料袋、树叶集中焚烧会产生大量的有害气体与烟尘造成环境污染,故D正确。故选D。
10.D
【详解】
A、由自来水的净化过程可知,天然淡水经沉降、过滤、吸附、灭菌等净化操作后,可供人们生活用水,故A说法正确;B、活性炭用于消毒面具,是利用它具有吸附性的特点,故B说法错误;C、CO2含量增多会引起温室效应,不属于空气污染物,故C说法错误;D、废弃塑料产生的白色污染会带来严重的环境问题,因此,回收废弃塑料非常重要,故D说法正确。故选D。
11.A
【详解】
A、甲醛有毒,不能保鲜食品,A错。
B、小苏打受热分解生成二氧化碳,可以制发酵粉,B正确。
C、金刚石硬度大,可以切割玻璃,C正确。
D、缺碘容易得甲状腺肿大,补碘可预防甲状腺肿大,D正确。
故选:A。
12.B
【详解】
①制电器、③制铝锭、⑨制防锈漆、⑩制桌椅与人的消化系统不直接接触,铝不会因使用进入人体,与人体健康无关,无需控制.②制易拉罐、④制牙膏皮、⑤用明矾净水、⑥制炊具、⑦用明矾及小苏打作食物膨化剂、⑧用氢氧化铝制胃药其中的铝元素能通过消化系统进入人体,需要加以控制.故选B.
13.A
【详解】
A、活性炭具有吸附性,①制糖工业中利用活性炭来脱色。正确;②硬水经过滤后,依然含有大量的可溶性钙、镁离子,不能转化为软水,错误。化学知识整理有错误,符合题意;
B、①金刚石和石墨中都只由碳元素组成的单质,都含有碳元素,正确;②氢氧化钠能与油脂反应,在生活中可以用来去除油污,正确,化学知识整理正确,不符合题意;
C、①缺乏维生素 C 易引起坏血病,正确;②工业炼铁的主要原料包括铁矿石、焦炭和石灰石,正确。化学知识整理正确,不符合题意;
D、①氮气的化学性质稳定,灯泡中充氮气以延长使用寿命,正确;②铁生锈时既能消耗氧气又能消耗水,食品袋中放一小包铁粉做干燥剂,既防潮又防止食品腐败变质,正确。化学知识整理正确,不符合题意;
故选:A。
14.C
【详解】
A、由图表信息可知:芝麻酱中含有微量元素:铁、硒;故选项正确,但不符合题意。
B、由图表信息可知:芝麻酱中含有脂肪(油脂)和糖类;故选项正确,但不符合题意。
C、婴儿应该谨慎使用;故选项错误,符合题意。
D、由图表信息可知:含钙量(720mg)<含蛋白质(19.2g);故选项正确,但不符合题意。
故选C。
15.D
【详解】
有机化合物一定含有碳元素,但含有碳元素的化合物不一定是有机物,如CO、CO2、H2CO3等属于无机物,A错;人体需要的微量元素应尽可能从食物中获取,不能盲目乱补,B错;食品防腐剂可以延长食品的保质期,不能禁止使用,应该合理使用,C错;霉变的食品和超过保质期的食品,会产生一些有毒物质,不能食用,D对.
16.A
【详解】
A、白色污染是指废弃塑料造成的污染,因果关系不正确,故A错误;
B、二氧化硫、二氧化氮排入空气中,和水反应会产生酸雨,因果关系正确,故B正确;
C、化石燃料燃烧会生成大量的二氧化碳,空气中二氧化碳含量的增加,会导致温室效应,因果关系正确,故C正确;
D、水资源污染的途径主要是工业、农业和工业废水的大量排放,因果关系正确,故D正确。
故选:A。
17.26 24 化合物 c badc c
【详解】
(1)在元素周期表中,元素名称左上角的数字表示原子序数,故铁元素的原子序数为26,原子序数=质子数=原子的核外电子数,铁原子失去2个电子变成亚铁离子,故亚铁离子的核外电子数为24;
(2)健康人体内,总量4~5g的铁元素主要以化合物式存在,缺铁会患上贫血,故选c;
(3)①该实验的操作步骤为:先通一氧化碳气体,将装置内的空气排尽,因为一氧化碳属于可燃性气体,混有一定量的空气,遇明火会发生爆炸,然后点燃A处酒精喷灯,反应结束后,先熄灭酒精喷灯,待冷却至室温后,再停止通一氧化碳气体,防止液体倒流炸裂试管故顺序为:badc;
②氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,将黑色固体放入足量的稀硫酸中,有气泡产生,铁能与稀硫酸反应生成硫酸亚铁和氢气,有气泡产生,说明黑色固体物质含有铁。故选c。
18.微量元素 13 2MoS2+7O22MoO3+4SO2 AC +6 氮 烧杯 1:14
【详解】
(1)钼是人体及动植物必需的微量元素;在原子中,核电荷数=核外电子数,原子的结构示意图2,其中X=42-2-8-18-1=13;
(2)根据流程图可知,步骤①反应是MoS2和O2在高温条件下反应生成SO2和MoO3,反应的化学方程式为:2MoS2+7O22MoO3+4SO2;
(3)二氧化硫,能与氢氧化钠、氨水反应,不能与浓硫酸反应,可用来吸收SO2尾气的是氢氧化钠溶液和氨水,故选AC;
(4)在(NH4)2MoO4中,铵根子、氧元素的化合价分别为+1和-2,设:(NH4)2MoO4中钼的化合价为x,根据化合物中元素的化合价的代数和为零,则有:(+1)×2+x+(-2)×4=0
解得x=+6,(NH4)2MoO4中Mo的化合价是+6,(NH4)2MoO4中含有氮元素,在农业上既是钼肥又是氮肥;
(5)操作Ⅰ是将固体与液体分离。如果在实验室模拟操作Ⅰ,则需要使用的主要玻璃仪器有漏斗、玻璃棒、烧杯;
(6)利用H2和CO分别还原等质量的精产品(MoO3),所需的还原剂分别为H2和CO。
设:MoO3的质量为m,所需的还原剂分别为H2和CO质量分别为x、y。
;
;。利用H2和CO分别还原等质量的精产品(MoO3),所需的还原剂的质量比为1:14。
19.AB 乳化 肥皂水 CO2 B
【详解】
(1)有机合成材料包括塑料、合成纤维、合成橡胶,塑料桶、橡胶篮球是使用有机合成材料制成,故选AB。
(2)洗洁精去除油污的原因是洗洁精具有乳化作用。
(3)生活中常用肥皂水来区分硬水和软水,产生泡沫多的是软水,产生泡沫少的是硬水。
(4)反应前有2Ca、2C、12O、2S,反应后(X除外有)2Ca、8O、2S,根据化学反应前后各种原子个数相等, X的化学式为CO2。
(5)根据反应的微观示意图,反应的化学方程式为:2X+2YZ+2W
A、该反应的生成物有二种,此选项错误;
B、参加反应的X、Y两种粒子的个数比是1:1,此选项正确;
C、反应前后原子的种类不变,此选项错误;
D、X含有两种元素,可能是氧化物,此选项错误。
故选B。
20.-4 CH4+2O2 CO2+2H2O C 2H2O2H2↑+O2↑ 吸附 肥皂水 BC < CO2 CO2+3H2 CH3OH+H2O 6.6
【解析】
(1) ①根据根据化合物中各元素正负化合价代数和为0及甲烷燃烧生成二氧化碳和水解答;②根据肉类主要富含蛋白质解答;③根据水在光照和TiO2作催化剂的条件下,能分解为氢气和氧气解答;④根据活性炭有吸附性及用肥皂水检验软水和硬水解答;(2)①根据能源的分类及其对环境的影响来分析;②根据酸雨的形成与质量守恒定律来分析;③根据反应物和生成物书写有关反应的化学方程式;④依据质量守恒定律的有关应用解答即可;依据已知的化学方程式利用水的质量可以求出生成的二氧化碳质量。(1) ①甲烷中氢元素显+1价,碳元素的化合价是[0-(+1×4)]=-4;甲烷和氧气在点燃条件下生成二氧化碳和水,的化学方程式是CH4+2O2 点燃 2H2O+CO2;②肉、蛋、奶、大豆类食品给人提供丰富的蛋白质,故选C;(3)水在光照和TiO2作催化剂的条件下,能分解为氢气和氧气,反应的化学方程式是2H2O2H2↑+O2↑ ;(4)活性炭结构疏松多孔,有吸附性,常用活性炭除去水中的色素和异味;检验饮用水是软水还是硬水,可用肥皂水来检验;加肥皂水后,泡沫少、浮渣多的为硬水,反之,为软水;(2)①A、煤、石油和天然气都属于不可再生能源,错误;B、氢气燃烧的错误是水,是理想的“绿色能源”,正确;C、人类使用的能源绝大部分来自太阳能,正确;D、废弃电池填埋在土壤里会造成土壤污染,错误。故选BC。②我们把pH<5.6的雨水称为酸雨;由反应的化学方程式2CaCO3+2SO2+O2=2CaSO4+2x,可知反应前后各原子的个数为反应前Ca原子2个、C原子 2个、O原子12个、S原子2个;反应后Ca原子2个、C原子0个、O原子8个、S原子2个。根据化学变化前后原子的种类、数目不变,可判断生成物x的2个分子中含有2个C原子和4个O原子,则每个x分子由1个C原子和2个O原子构成,物质x的化学式为CO2;③氢气和二氧化碳在催化剂和一定温度下反应生成甲醇和水,反应的化学方程式为CO2+3H2 CH3OH+H2O;④依据化学反应前后各原子的个数不会变化对x、m进行计算;反应前碳原子的个数是8,故反应后碳原子个数也是8,则有m+n=8;由题意可知:
8CH3OH+xO2mCO2+nCO+16H2O
32x 288
8.8g 7.2g
x=11
该化学方程式为8CH3OH+11O26CO2+2CO+16H2O
设生成的二氧化碳质量是y
8CH3OH+11O26CO2+2CO+16H2O
264 288
y 7.2g
y=6.6g
21.A 合成 O2\H2O 洗净擦干(合理即可) 镁与稀硫酸反应产生气泡的速率快 Cu的活动性比Hg强 B D 稀硫酸 80% 24.5%
【详解】
(1)铁锅主要利用金属具有良好导热性;铜导线主要利用了金属的延性和导电性;铝箔主要利用了金属的展性;铁锤主要利用金属的硬度、强度大的性质;聚乙烯属于塑料的一类,属于有机高分子合成材料;(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的氧气、水共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是用完后及时擦干;(3) 金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。判断出镁的金属活动性比铁强,依据的现象是镁与稀硫酸反应产生气泡的速率比铁快;实验二的现象是铜的表面有银白色固体生成,溶液由无色变成蓝色,说明铜能与硝酸汞反应,应得出的结论是Cu的活动性比Hg强;(4)向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,镁先与硫酸铜反应,然后再与硫酸亚铁反应。充分反应后过滤,滤液呈浅绿色,说明硫酸亚铁有剩余、镁粉一定完全反应;再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化,说明硝酸铜完全反应。故反应后溶液中的溶质有剩余的硫酸亚铁和生成的硫酸镁;固体中一定有铜,可能有铁;选BD;(1)由题中的数据分析可知,20g样品中含氧化铜的质量16g,样品中氧化铜的质量分数:16g÷20g×10%=80%;由题中数据分析知,10g氧化铜一定能将50稀硫酸中的溶质完全反应。
(2)设:稀硫酸的溶质质量分数为x
CuO+H2SO4═CuSO4+H2O
80 98
10g 50g x
80/10g=98/50g x
x=24.5%
答:所用稀硫酸的溶质质量分数为24.5%.
(3)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z.
CuO + H2SO4 ═ CuSO4+H2O
80 98 160
16g 24.5%y z
80/98=16g/24.5%y y=80g
80/160=16g/z z=32g z=32g
设和(100g-80g)稀硫酸反应的氢氧化钠溶液的质量为m.
H2SO4 + 2NaOH=Na2SO4+2 H2O
98 80
(100g-80g)×24.5% 10%m
解得m=40g因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应,再和硫酸铜反应,所以我们得到起点坐标(40,0).
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w.
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
160 80 98
32g 10%n w
解得n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如下图.
22.Al Fe Cu AB 2Al+Fe2O3 2Fe+ Al2O3 B 加快反应速率(合理答案均给分) CO2 Fe(OH)3 检查装置气密性 A 除去装置内的H2O和CO2 H2SO4(或硫酸) 8 2:6:16 Al2Mg6(OH)16CO3·4H2O +18HCl=2AlCl3+6MgCl2+21H2O+CO2↑
【详解】
(一)(1)Cu、Fe、Al三种金属的活动性由强到弱的顺序是Al、Fe、Cu。
(2)玻璃钢是由玻璃纤维与塑料复合而成的,属于复合材料,铝合金属于合金材料,以上叙述中不涉及的是A、无机材料,B、合成材料,故选AB。
(3)焊接铁轨时,铝与氧化铁在高温下生成铁和氧化铝,该反应的化学方程式2Al+Fe2O3 2Fe+ Al2O3。
(4)铝制成铝箔作食品包装,是利用它的延展性,故选B。
(二)(1)由于反应物之间接触面积越大,反应越快,转化率越高,所以将工业废渣研磨成粉末的目的是加快反应速率。
(2)石灰石在烧结过程中分解为氧化钙和二氧化碳,所以气体X的化学式 CO2。
(3)碱浸过程中,烧结生成的NaFeO2可与水反应生成NaOH和一种含铁的化合物,由于在碱性溶液中同时生成且铁为正三价,所以该含铁的化合物 Fe(OH)3。
(三)(1)装配好实验装置后,先要检查装置气密性。
(2)铝碳酸镁片在加热条件下分解生成Al2O3、MgO、CO2 、H2O,装置B中应放入能吸水的物质,但不能吸收二氧化碳气体,否则无法确定生成的水和二氧化碳各自的质量进行分析,装置C中应放入吸收二氧化碳的物质,装置B中盛放浓H2SO4,装置C中盛放浓NaOH溶液,故填A。
(3)为减小误差,实验开始前通入一定量氮气,目的是除去装置内的H2O和CO2。
(4)①图中NaOH加入0.80g,仍没有沉淀,说明滤液中含未反应完的稀硫酸。
②由图象分析,NaOH加入0.80g,仍没有沉淀,说明滤液含硫酸,当加入NaOH的质量到x时,生成的沉淀有氢氧化镁和氢氧化铝;图象分析沉淀3.48g为Mg(OH)2,Al(OH)3的质量量为5.04-3.48g=1.56g;设与硫酸镁反应的氢氧化钠的质量为x,与硫酸铝反应的氢氧化钠的质量为y,
x=4.8g,y=2.4g
故X=4.8g+2.4g+0.8g=8g
③根据质量守恒定律,反应前后元素的质量不变,根据以上数据,3.48gMg(OH)2中镁元素的质量为1.44g,Al(OH)3的质量量1.56g,铝元素的质量为0.54g,原子个数比为 ,根据元素化合价代数和为零的原则,可知的个数为16,所以铝碳酸镁的化学式为Al2Mg6(OH)16 CO3 4H2O, x:y:z=2:6:16。
④写出铝碳酸镁治疗胃酸过多的化学方程式为Al2Mg6(OH)16CO3·4H2O +18HCl=2AlCl3+6MgCl2+21H2O+CO2↑。
一、选择题(共16题)
1.下列食品中富含维生素的是
A.米饭 B.牛肉 C.菜油 D.橙子
2.工业酒精中常含有甲醇,甲醇有剧毒,不能食用,其分子结构可用如图所示的模型表示。下列有关甲醇的叙述中,错误的是( )
A.甲醇的化学式为CH3OH
B.甲醇属于有机物
C.甲醇中C、H、O三种元素的质量比为1:4:1
D.甲醇中氧元素的质量分数为50%
3.分类法是化学学习的重要方法,下列关于物质分类正确的是
A.氧化物 :氧气、五氧化二磷、生石灰
B.混合物 :洁净的空气、石油、冰水混合物
C.有机物:甲烷、乙醇、乙酸
D.合成材料:合金、塑料、合成纤维
4.下列衣物中所使用的主要材料属于合成纤维的是( )
A.丝绸睡衣 B.亚麻长裤 C.涤纶T恤 D.羊绒大衣
5.健康的生活离不开化学,下列有关方法不合理的是
A.用碳酸氢钠做膨松剂制作蛋糕
B.在酱油里加适量的“铁”预防缺铁性贫血
C.在食品包装里充氮气防腐
D.用汽油除去餐具上的油污
6.下列属于人体必需的微量元素且对人体健康作用的叙述正确的是( )
A.人体缺钙易患佝偻病 B.人体缺铁影响智力发育
C.人体缺锌易得贫血症 D.人体缺碘会导致甲状腺肿大
7.下列是某同学记录的实验现象,其中错误的是
A.向澄清石灰水中滴入碳酸钠溶液,有白色沉淀出现
B.CO在高温条件下还原氧化铁时,红棕色固体逐渐变为黑色
C.将草木灰的浸出液滴到pH试纸上,试纸会由黄色变为浅红色
D.灼烧棉线会产生烧纸的气味,灼烧羊毛线则产生烧焦羽毛的气味
8.为保障“舌尖上的安全”,下列做法合理的是( )
A.霉变大米燕煮后食用
B.为保障腊肠肉质鲜美,添加过量的亚硝酸钠
C.做蛋糕时加入少量的小苏打,使它更松软
D.用甲醛溶液浸泡荔枝,以保鲜防腐
9.“绿水青山就是金山银山”,已成为国家意志和全民共识,建设天蓝、地绿、水清的美丽中国,我们任重而道远。下列做法与我国绿色发展理念不相符的是( )
A.参与植树造林,扩大植被面积
B.改进污水处理技术,减少水体污染
C.使用一些新型可降解的塑料,减少“白色污染”
D.将校园散落的塑料袋、树叶集中焚烧,保持整洁的环境
10.下列说法正确的是
A.天然淡水经过沉降、过滤、吸附、灭菌、蒸馏等净化操作后,可供人们生活用水
B.活性炭用于消毒面具,是利用它化学性质稳定的特点
C.CO2 含量增多会引起温室效应,属于空气污染物
D.废弃塑料产生的白色污染会带来严重的环境问题,因此,回收废弃塑料非常重要
11.化学与我们的生活息息相关,下列物质的用途中不正确的是( )
A.用甲醛溶液保鲜食品 B.小苏打制发酵粉
C.金刚石裁玻璃 D.补碘剂可预防甲状腺肿大
12.1989年世界卫生组织正式将“铝确定为食品污染源之一”而加以控制.在下列使用场合必须加以控制的是
①制电器 ②制易拉罐 ③制铝锭 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾及小苏打作食物膨化剂 ⑧用氢氧化铝制胃药 ⑨制防锈漆 ⑩制桌椅.
A.①②④⑤⑧⑩ B.②④⑤⑥⑦⑧
C.②⑤⑥⑦⑧⑩ D.③④⑤⑥⑦⑧⑨
13.下列有关生产生活中的化学知识整理有错误的一组是 ( )
A ①制糖工业中利用活性炭来脱色 ②硬水经过滤后可以转化为软水 C ①缺乏维生素 C 易引起坏血病 ②工业炼铁的主要原料包括铁矿石、焦炭和石灰石
B ①金刚石和石墨中都含有碳元素 ②氢氧化钠能与油脂反应,在生活中可以用来去除油污 D ①灯泡中充氮气以延长使用寿命 ②食品袋中放一小包铁粉,既防潮又防止食品腐败变质
A.A B.B C.C D.D
14.依据如图的某芝麻酱说明书,下列关于该芝麻酱判断错误的是( )
A.含微量元素
B.含糖类和油脂
C.婴儿可少量食用
D.钙含量低于蛋白质
15.学习了“化学与健康”的知识后,同学们就这一话题发表见解,以下观点你认为正确的是
A. B.
C. D.
16.南宁是我家, 保护环境靠大家。下列因果关系错误的是
选项 原因 结果
A 废纸、废金属制品的随意丟弃 白色污染
B SO2 和 NO2 气体大量排放 酸雨
C 化石燃料的大量使用 温室效应加剧
D 工业、农业和生活废水未经处理就排放 水体污染
A.A B.B C.C D.D
二、综合题(共6题)
17.常见金属铁的认识:
(1)如图为铁元素在元素周期表中的信息,铁元素的原子序数为_____,亚铁离子(Fe2+)的核外电子数为_____。
(2)健康人体内,总量4~5g的铁元素主要以_____(选填“单质”、“化合物”)形式存在,缺铁会患上_____(填字母)。
a.骨质疏松 b.甲状腺疾病 c.贫血症 d.侏儒症
(3)兴趣小组通过如图实验研究铁的冶炼
①为保证安全和实验成功,该实验的操作步骤:_____。(填序号)
a.点燃A处酒精喷灯 b.通入CO气体
c.停止通入CO气体 d.熄灭酒精喷灯
②实验一段时间后,观察到A处变成黑色固体,小明将所得的黑色固体物质放入足量的稀硫酸中,发现有少量气泡。说明黑色固体物质_____(填字母)。
a.不含铁 b.一定全部是铁 c.含有铁
18.钼具有高强度、高熔点、而腐蚀等优点,在工业上得到广泛的利用。图1是化工生产中制备金属钼的部分流程图(假设杂质不与空气反应)。
(1)钼是人体及动植物必需的 ______ (选填“微量元素”或“常量元素”),原子的结构示意图2,其中X是 ______ 。
(2)步骤①反应的化学方程式 ______ 。
(3)下列物质可以用来吸收SO2尾气的是 ______ (填字母)。
A 氢氧化钠溶液 B 浓硫酸 C 氨水
(4)(NH4)2MoO4中Mo的化合价是 ______ ,在农业上既是钼肥又是 ______ 肥。
(5)如果在实验室模拟操作Ⅰ,则需要使用的主要玻璃仪器有漏斗、玻璃棒、 ______ 。
(6)利用H2和CO分别还原等质量的精产品(MoO3),所使用的还原剂的质量比为 ______ 。
19.(1)下列生活中的用品,使用有机合成材料制成的是______(填字母序号)。
A、塑料桶 B、橡胶篮球
C、棉布围裙 D、陶瓷餐具
(2)洗洁精去除油污的原因是洗洁精具有______作用。
(3)生活中常用______来区分硬水和软水。
(4)石灰石用途非常广泛。可用来吸收火力发电厂煤燃烧时产生的二氧化硫废气,反应的化学方程式为:2CaCO3+2SO2+O22CaSO4+2X,X的化学式为______。
(5)如图为某一化学反应的微观示意图(X,Y,Z、W分别表示四种不同的物质),以下说法正确的是(____)
A.该反应的生成物有三种
B.参加反应的X、Y两种粒子的个数比是1:1
C.反应前后原子的种类发生了变化
D.X不可能是氧化物
20.(1)水是宝贵的自然资源,我国南海海域海洋资源极其丰富。
①2017年5月18日,南海可燃冰试采成功,可燃冰主要含有甲烷水合物。甲烷中碳元素的化合价是______价,甲烷充分燃烧的化学方程式是__________________。
②渔民常在这一带从事捕鱼作业,鱼肉中含量最多的营养素是_____(填序号)。
A.糖类 B.油脂 C.蛋白质 D.维生素
③科学研究证明,水在光照和TiO2作催化剂的条件下,能分解为氢气和氧气,反应的化学方程式是____________________。
④河水和海水一样都是混合物。自来水厂利用河水生产饮用水的过程中常用活性炭的_____性来除去水中的色素和异味。检验饮用水是软水还是硬水,可用___来检验。
(2)能源利用和环境保护是人类共同关注的问题。
①下列说法中正确的是______(填字母)。
A.煤、石油和天然气都属于可再生能源 B.氢气是理想的“绿色能源”
C.人类使用的能源绝大部分来自太阳能 D.废弃电池可以填埋在土壤里
②煤燃烧时排放出的二氧化硫等污染物,有可能会导致降雨的酸性增强。我们把pH_____5.6(填“>”“=”或“<”)的降雨称为酸雨。某电厂为防止环境污染,用石灰石浆来吸收二氧化硫,其反应的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2x,则x的化学式为______。
③研究发现,二氧化碳和氢气在催化剂作用下转化为甲醇(CH3OH)和水。该反应的化学方程式为______________________。
④将一定质量的甲醇与8.8g氧气混合于密闭容器内,在一定条件下,发生如下反应:8CH3OH+xO2 一定条件 mCO2+nCO+16H2O。当反应物完全耗尽且全部转化为生成物时,有7.2g水生成,同时生成二氧化碳的质量为______g。
21.盐城的城市建设可谓是日新月异,在城市建设、生产、生活中材料有着广泛的应用。
(1)下列生活用品,主要利用金属具有良好导热性的是________(填序号),一般铜导线外面包有聚乙烯绝缘层,聚乙烯属于________材料。
(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的___________共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是_____________(要求一种方法即可)。
(3)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
根据实验一判断出镁的金属活动性比铁强,依据的现象是___________;根据实验二的现象应得出的结论是__________。
(4)苗苗同学向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,充分反应后过滤,滤液呈浅绿色,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化。根据此现象作出了下列判断,你认为正确的是_____________(填序号)。
A.滤纸上一定有Fe,可能有Mg、Cu
B.滤纸上一定有Cu,可能有Fe,一定没有Mg
C.滤液中一定有FeSO4,可能有MgSO4 、CuSO4
D.滤液中一定有MgSO4、FeSO4,一定没有CuSO4
(5)为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
第I组 第Ⅱ组 第Ⅲ组
稀硫酸的质量/g 50 100 150
溶解固体的质量/g 10.0 16.0 16.0
根据实验及有关数据进行分析与计算:
①第I组实验中反应物___________(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完。
②20g样品中含氧化铜的质量分数分别为____________。
③计算所用的稀硫酸溶质的质量分数为____________(写出计算过程)
④将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
___________________
22.铝、镁等金属在生产生活中有广泛的应用。
(一)铝制品的应用。
(1)Cu、Fe、Al三种金属的活动性由强到弱的顺序是 ____ 。
(2)用玻璃钢、铝合金等材料可制成某火箭整流罩,以上叙述中不涉及到 __ (选填序号)。
A 无机材料 B 合成材料 C 复合材料
(3)焊接铁轨时,铝与氧化铁在高温下生成铁和氧化铝,该反应的化学方程式 ____ 。
(4)铝制成铝箔作食品包装,是利用它的 _____ 。
A 导热性 B 延展性 C 导电性
(二)活性氧化铝可用作化学反应的催化剂。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
(1)将工业废渣研磨成粉末的目的是 ____ 。
(2)气体X的化学式 ______ 。
(3)碱浸过程中,烧结生成的NaFeO2可与水反应生成NaOH和一种含铁的化合物,该含铁的化合物是 ____ 。
(三)铝碳酸镁[AlxMgy(OH)zCO3·aH2O]可用于治疗胃酸过多。某兴趣小组取一定量该药片用下图装置探究其组成。
(资料)Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O。Mg(OH)2不溶于NaOH, NaAlO2极易溶于水。
(1)装配好实验装置后,先要 ______ 。
(2)铝碳酸镁加热分解为Al2O3、MgO、CO2和水,装置B和C中盛放的药品应选择: ____ 。
A 浓H2SO4、浓NaOH溶液
B 浓NaOH溶液、浓H2SO4
(3)实验开始前通入一定量氮气,目的是 _______ 。
(4)充分加热后,测得装置B增重2.16g,装置C增重0.44g。另取等质量的样品加入一定量稀硫酸充分反应后滤去不溶物,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。
①图中NaOH加入0.80g,仍没有沉淀,说明滤液中含 _______ 。
②X值为 ______ 。③x:y:z= ______ 。
④写出铝碳酸镁治疗胃酸过多的化学方程式 _____________ 。
参考答案
1.D
【详解】
A、米饭中富含淀粉,淀粉属于糖类,故选项错误;
B、牛肉中富含蛋白质,故选项错误;
C、菜油中富含油脂,故选项错误;
D、橙子等水果中富含维生素,故选项正确。
故选D。
2.C
【详解】
A、由甲醇的分子结构模型可知,每个甲醇分子是由1个碳原子、4个氢原子和1个氧原子构成的,所以其化学式为CH3OH,故A正确;
B、甲醇是含碳元素的化合物,属于有机物,故B正确;
C、C甲醇中,碳、氢、氧三种元素的质量比等于(12×1):(1×4):(16×1)=3:1:4,故C错误;
D、甲醇中氧元素的质量分数=,故D正确。故选C。
3.C
【详解】
A、氧化物是由两种元素组成的化合物中,其中一种元素是氧元素,五氧化二磷、生石灰属于氧化物,而氧气是由同种元素组成的纯净物,属于单质,故选项分类不正确;
B、洁净的空气、石油中都含有多种物质,属于混合物,而冰是水的固体,冰水混合物只含有水一种物质,属于纯净物,故选项分类不正确;
C、甲烷、乙醇、乙酸都是含碳元素的化合物,属于有机物,故选项分类正确;
D、合金属于金属材料,塑料、合成纤维属于有机合成材料,故选项分类不正确。
故选C。
4.C
【详解】
A、丝绸睡衣是由蚕丝制成的,蚕丝属天然纤维,故A错误。
B、亚麻长裤是麻制成的,麻属于天然纤维,故B错误。
C、涤纶上衣是由涤纶制成的,涤纶是聚丙烯腈纤维,属于合成纤维,故C正确。
D、羊绒大衣是有羊毛制成的,羊毛属于天然纤维,故D错误。
故选:C。
5.D
【详解】
A、碳酸氢钠受热分解生成二氧化碳,可用碳酸氢钠做膨松剂制作蛋糕,不符合题意;
B、在酱油里加适量的“铁”,可以预防缺铁性贫血,不符合题意;
C、氮气化学性质稳定,且无毒,可在食品包装里充氮气防腐,不符合题意;
D、汽油能溶解油污,但是不能用汽油除去餐具上的油污,对健康不利,可用洗涤剂除去油污,符合题意。
故选D。
6.D
【详解】
A、人体缺钙易患佝偻病,但是钙元素属于人体必需的常量元素,故A错误;
B、人体缺铁易患贫血,故B错误;
C、人体缺锌会影响智力发育,故C错误;
D、人体缺碘易患甲状肿大,碘元素属于人体必需的微量元素,故D正确。故选D。
7.C
【详解】
A、碳酸钠能与氢氧化钙反应生产碳酸钙沉淀,溶液中出现白色浑浊,故选项说法正确;
B、将CO通过高温的氧化铁,生成铁和二氧化碳,会观察到,红棕色固体逐渐变为黑色,故选项说法正确;
C、草木灰水显碱性,用玻璃棒将草木灰水滴到pH试纸上,试纸由黄色变为蓝色,故选项说法错误;
D、羊毛线的主要成分是蛋白质,燃烧时有烧焦羽毛的气味,灼烧棉线会产生烧纸的气味,故选项说法正确。
故选C。
8.C
【详解】
A、霉变的食物中含有毒的黄曲霉素,黄曲霉素十分耐热,蒸煮不能将其破坏,所以不能食用,故A错误;
B、亚硝酸钠是一种常用的防腐剂,它虽可保持肉类鲜美,但食用过量会使人中毒,故B错误;
C、面粉发酵时可产生酸,碳酸氢钠与酸反应能生成二氧化碳气体,气体膨胀使蛋糕疏松多孔,故该做法不会危害人体健康,故C正确;
D、甲醛有毒,能破坏人体蛋白质的结构,使蛋白质变质,不能用甲醛水溶液浸泡荔枝,故D错误。
故选:C。
9.D
【详解】
A、参与植树造林,扩大植被面积有利于改善环境质量,故A不正确;
B、改进污水处理技术,减少水体污染,故B不正确;
C、使用一些新型可降解的塑料,减少“白色污染”,故C不正确;
D、将校园散落的塑料袋、树叶集中焚烧会产生大量的有害气体与烟尘造成环境污染,故D正确。故选D。
10.D
【详解】
A、由自来水的净化过程可知,天然淡水经沉降、过滤、吸附、灭菌等净化操作后,可供人们生活用水,故A说法正确;B、活性炭用于消毒面具,是利用它具有吸附性的特点,故B说法错误;C、CO2含量增多会引起温室效应,不属于空气污染物,故C说法错误;D、废弃塑料产生的白色污染会带来严重的环境问题,因此,回收废弃塑料非常重要,故D说法正确。故选D。
11.A
【详解】
A、甲醛有毒,不能保鲜食品,A错。
B、小苏打受热分解生成二氧化碳,可以制发酵粉,B正确。
C、金刚石硬度大,可以切割玻璃,C正确。
D、缺碘容易得甲状腺肿大,补碘可预防甲状腺肿大,D正确。
故选:A。
12.B
【详解】
①制电器、③制铝锭、⑨制防锈漆、⑩制桌椅与人的消化系统不直接接触,铝不会因使用进入人体,与人体健康无关,无需控制.②制易拉罐、④制牙膏皮、⑤用明矾净水、⑥制炊具、⑦用明矾及小苏打作食物膨化剂、⑧用氢氧化铝制胃药其中的铝元素能通过消化系统进入人体,需要加以控制.故选B.
13.A
【详解】
A、活性炭具有吸附性,①制糖工业中利用活性炭来脱色。正确;②硬水经过滤后,依然含有大量的可溶性钙、镁离子,不能转化为软水,错误。化学知识整理有错误,符合题意;
B、①金刚石和石墨中都只由碳元素组成的单质,都含有碳元素,正确;②氢氧化钠能与油脂反应,在生活中可以用来去除油污,正确,化学知识整理正确,不符合题意;
C、①缺乏维生素 C 易引起坏血病,正确;②工业炼铁的主要原料包括铁矿石、焦炭和石灰石,正确。化学知识整理正确,不符合题意;
D、①氮气的化学性质稳定,灯泡中充氮气以延长使用寿命,正确;②铁生锈时既能消耗氧气又能消耗水,食品袋中放一小包铁粉做干燥剂,既防潮又防止食品腐败变质,正确。化学知识整理正确,不符合题意;
故选:A。
14.C
【详解】
A、由图表信息可知:芝麻酱中含有微量元素:铁、硒;故选项正确,但不符合题意。
B、由图表信息可知:芝麻酱中含有脂肪(油脂)和糖类;故选项正确,但不符合题意。
C、婴儿应该谨慎使用;故选项错误,符合题意。
D、由图表信息可知:含钙量(720mg)<含蛋白质(19.2g);故选项正确,但不符合题意。
故选C。
15.D
【详解】
有机化合物一定含有碳元素,但含有碳元素的化合物不一定是有机物,如CO、CO2、H2CO3等属于无机物,A错;人体需要的微量元素应尽可能从食物中获取,不能盲目乱补,B错;食品防腐剂可以延长食品的保质期,不能禁止使用,应该合理使用,C错;霉变的食品和超过保质期的食品,会产生一些有毒物质,不能食用,D对.
16.A
【详解】
A、白色污染是指废弃塑料造成的污染,因果关系不正确,故A错误;
B、二氧化硫、二氧化氮排入空气中,和水反应会产生酸雨,因果关系正确,故B正确;
C、化石燃料燃烧会生成大量的二氧化碳,空气中二氧化碳含量的增加,会导致温室效应,因果关系正确,故C正确;
D、水资源污染的途径主要是工业、农业和工业废水的大量排放,因果关系正确,故D正确。
故选:A。
17.26 24 化合物 c badc c
【详解】
(1)在元素周期表中,元素名称左上角的数字表示原子序数,故铁元素的原子序数为26,原子序数=质子数=原子的核外电子数,铁原子失去2个电子变成亚铁离子,故亚铁离子的核外电子数为24;
(2)健康人体内,总量4~5g的铁元素主要以化合物式存在,缺铁会患上贫血,故选c;
(3)①该实验的操作步骤为:先通一氧化碳气体,将装置内的空气排尽,因为一氧化碳属于可燃性气体,混有一定量的空气,遇明火会发生爆炸,然后点燃A处酒精喷灯,反应结束后,先熄灭酒精喷灯,待冷却至室温后,再停止通一氧化碳气体,防止液体倒流炸裂试管故顺序为:badc;
②氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,将黑色固体放入足量的稀硫酸中,有气泡产生,铁能与稀硫酸反应生成硫酸亚铁和氢气,有气泡产生,说明黑色固体物质含有铁。故选c。
18.微量元素 13 2MoS2+7O22MoO3+4SO2 AC +6 氮 烧杯 1:14
【详解】
(1)钼是人体及动植物必需的微量元素;在原子中,核电荷数=核外电子数,原子的结构示意图2,其中X=42-2-8-18-1=13;
(2)根据流程图可知,步骤①反应是MoS2和O2在高温条件下反应生成SO2和MoO3,反应的化学方程式为:2MoS2+7O22MoO3+4SO2;
(3)二氧化硫,能与氢氧化钠、氨水反应,不能与浓硫酸反应,可用来吸收SO2尾气的是氢氧化钠溶液和氨水,故选AC;
(4)在(NH4)2MoO4中,铵根子、氧元素的化合价分别为+1和-2,设:(NH4)2MoO4中钼的化合价为x,根据化合物中元素的化合价的代数和为零,则有:(+1)×2+x+(-2)×4=0
解得x=+6,(NH4)2MoO4中Mo的化合价是+6,(NH4)2MoO4中含有氮元素,在农业上既是钼肥又是氮肥;
(5)操作Ⅰ是将固体与液体分离。如果在实验室模拟操作Ⅰ,则需要使用的主要玻璃仪器有漏斗、玻璃棒、烧杯;
(6)利用H2和CO分别还原等质量的精产品(MoO3),所需的还原剂分别为H2和CO。
设:MoO3的质量为m,所需的还原剂分别为H2和CO质量分别为x、y。
;
;。利用H2和CO分别还原等质量的精产品(MoO3),所需的还原剂的质量比为1:14。
19.AB 乳化 肥皂水 CO2 B
【详解】
(1)有机合成材料包括塑料、合成纤维、合成橡胶,塑料桶、橡胶篮球是使用有机合成材料制成,故选AB。
(2)洗洁精去除油污的原因是洗洁精具有乳化作用。
(3)生活中常用肥皂水来区分硬水和软水,产生泡沫多的是软水,产生泡沫少的是硬水。
(4)反应前有2Ca、2C、12O、2S,反应后(X除外有)2Ca、8O、2S,根据化学反应前后各种原子个数相等, X的化学式为CO2。
(5)根据反应的微观示意图,反应的化学方程式为:2X+2YZ+2W
A、该反应的生成物有二种,此选项错误;
B、参加反应的X、Y两种粒子的个数比是1:1,此选项正确;
C、反应前后原子的种类不变,此选项错误;
D、X含有两种元素,可能是氧化物,此选项错误。
故选B。
20.-4 CH4+2O2 CO2+2H2O C 2H2O2H2↑+O2↑ 吸附 肥皂水 BC < CO2 CO2+3H2 CH3OH+H2O 6.6
【解析】
(1) ①根据根据化合物中各元素正负化合价代数和为0及甲烷燃烧生成二氧化碳和水解答;②根据肉类主要富含蛋白质解答;③根据水在光照和TiO2作催化剂的条件下,能分解为氢气和氧气解答;④根据活性炭有吸附性及用肥皂水检验软水和硬水解答;(2)①根据能源的分类及其对环境的影响来分析;②根据酸雨的形成与质量守恒定律来分析;③根据反应物和生成物书写有关反应的化学方程式;④依据质量守恒定律的有关应用解答即可;依据已知的化学方程式利用水的质量可以求出生成的二氧化碳质量。(1) ①甲烷中氢元素显+1价,碳元素的化合价是[0-(+1×4)]=-4;甲烷和氧气在点燃条件下生成二氧化碳和水,的化学方程式是CH4+2O2 点燃 2H2O+CO2;②肉、蛋、奶、大豆类食品给人提供丰富的蛋白质,故选C;(3)水在光照和TiO2作催化剂的条件下,能分解为氢气和氧气,反应的化学方程式是2H2O2H2↑+O2↑ ;(4)活性炭结构疏松多孔,有吸附性,常用活性炭除去水中的色素和异味;检验饮用水是软水还是硬水,可用肥皂水来检验;加肥皂水后,泡沫少、浮渣多的为硬水,反之,为软水;(2)①A、煤、石油和天然气都属于不可再生能源,错误;B、氢气燃烧的错误是水,是理想的“绿色能源”,正确;C、人类使用的能源绝大部分来自太阳能,正确;D、废弃电池填埋在土壤里会造成土壤污染,错误。故选BC。②我们把pH<5.6的雨水称为酸雨;由反应的化学方程式2CaCO3+2SO2+O2=2CaSO4+2x,可知反应前后各原子的个数为反应前Ca原子2个、C原子 2个、O原子12个、S原子2个;反应后Ca原子2个、C原子0个、O原子8个、S原子2个。根据化学变化前后原子的种类、数目不变,可判断生成物x的2个分子中含有2个C原子和4个O原子,则每个x分子由1个C原子和2个O原子构成,物质x的化学式为CO2;③氢气和二氧化碳在催化剂和一定温度下反应生成甲醇和水,反应的化学方程式为CO2+3H2 CH3OH+H2O;④依据化学反应前后各原子的个数不会变化对x、m进行计算;反应前碳原子的个数是8,故反应后碳原子个数也是8,则有m+n=8;由题意可知:
8CH3OH+xO2mCO2+nCO+16H2O
32x 288
8.8g 7.2g
x=11
该化学方程式为8CH3OH+11O26CO2+2CO+16H2O
设生成的二氧化碳质量是y
8CH3OH+11O26CO2+2CO+16H2O
264 288
y 7.2g
y=6.6g
21.A 合成 O2\H2O 洗净擦干(合理即可) 镁与稀硫酸反应产生气泡的速率快 Cu的活动性比Hg强 B D 稀硫酸 80% 24.5%
【详解】
(1)铁锅主要利用金属具有良好导热性;铜导线主要利用了金属的延性和导电性;铝箔主要利用了金属的展性;铁锤主要利用金属的硬度、强度大的性质;聚乙烯属于塑料的一类,属于有机高分子合成材料;(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的氧气、水共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是用完后及时擦干;(3) 金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。判断出镁的金属活动性比铁强,依据的现象是镁与稀硫酸反应产生气泡的速率比铁快;实验二的现象是铜的表面有银白色固体生成,溶液由无色变成蓝色,说明铜能与硝酸汞反应,应得出的结论是Cu的活动性比Hg强;(4)向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,镁先与硫酸铜反应,然后再与硫酸亚铁反应。充分反应后过滤,滤液呈浅绿色,说明硫酸亚铁有剩余、镁粉一定完全反应;再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化,说明硝酸铜完全反应。故反应后溶液中的溶质有剩余的硫酸亚铁和生成的硫酸镁;固体中一定有铜,可能有铁;选BD;(1)由题中的数据分析可知,20g样品中含氧化铜的质量16g,样品中氧化铜的质量分数:16g÷20g×10%=80%;由题中数据分析知,10g氧化铜一定能将50稀硫酸中的溶质完全反应。
(2)设:稀硫酸的溶质质量分数为x
CuO+H2SO4═CuSO4+H2O
80 98
10g 50g x
80/10g=98/50g x
x=24.5%
答:所用稀硫酸的溶质质量分数为24.5%.
(3)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z.
CuO + H2SO4 ═ CuSO4+H2O
80 98 160
16g 24.5%y z
80/98=16g/24.5%y y=80g
80/160=16g/z z=32g z=32g
设和(100g-80g)稀硫酸反应的氢氧化钠溶液的质量为m.
H2SO4 + 2NaOH=Na2SO4+2 H2O
98 80
(100g-80g)×24.5% 10%m
解得m=40g因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应,再和硫酸铜反应,所以我们得到起点坐标(40,0).
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w.
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
160 80 98
32g 10%n w
解得n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如下图.
22.Al Fe Cu AB 2Al+Fe2O3 2Fe+ Al2O3 B 加快反应速率(合理答案均给分) CO2 Fe(OH)3 检查装置气密性 A 除去装置内的H2O和CO2 H2SO4(或硫酸) 8 2:6:16 Al2Mg6(OH)16CO3·4H2O +18HCl=2AlCl3+6MgCl2+21H2O+CO2↑
【详解】
(一)(1)Cu、Fe、Al三种金属的活动性由强到弱的顺序是Al、Fe、Cu。
(2)玻璃钢是由玻璃纤维与塑料复合而成的,属于复合材料,铝合金属于合金材料,以上叙述中不涉及的是A、无机材料,B、合成材料,故选AB。
(3)焊接铁轨时,铝与氧化铁在高温下生成铁和氧化铝,该反应的化学方程式2Al+Fe2O3 2Fe+ Al2O3。
(4)铝制成铝箔作食品包装,是利用它的延展性,故选B。
(二)(1)由于反应物之间接触面积越大,反应越快,转化率越高,所以将工业废渣研磨成粉末的目的是加快反应速率。
(2)石灰石在烧结过程中分解为氧化钙和二氧化碳,所以气体X的化学式 CO2。
(3)碱浸过程中,烧结生成的NaFeO2可与水反应生成NaOH和一种含铁的化合物,由于在碱性溶液中同时生成且铁为正三价,所以该含铁的化合物 Fe(OH)3。
(三)(1)装配好实验装置后,先要检查装置气密性。
(2)铝碳酸镁片在加热条件下分解生成Al2O3、MgO、CO2 、H2O,装置B中应放入能吸水的物质,但不能吸收二氧化碳气体,否则无法确定生成的水和二氧化碳各自的质量进行分析,装置C中应放入吸收二氧化碳的物质,装置B中盛放浓H2SO4,装置C中盛放浓NaOH溶液,故填A。
(3)为减小误差,实验开始前通入一定量氮气,目的是除去装置内的H2O和CO2。
(4)①图中NaOH加入0.80g,仍没有沉淀,说明滤液中含未反应完的稀硫酸。
②由图象分析,NaOH加入0.80g,仍没有沉淀,说明滤液含硫酸,当加入NaOH的质量到x时,生成的沉淀有氢氧化镁和氢氧化铝;图象分析沉淀3.48g为Mg(OH)2,Al(OH)3的质量量为5.04-3.48g=1.56g;设与硫酸镁反应的氢氧化钠的质量为x,与硫酸铝反应的氢氧化钠的质量为y,
x=4.8g,y=2.4g
故X=4.8g+2.4g+0.8g=8g
③根据质量守恒定律,反应前后元素的质量不变,根据以上数据,3.48gMg(OH)2中镁元素的质量为1.44g,Al(OH)3的质量量1.56g,铝元素的质量为0.54g,原子个数比为 ,根据元素化合价代数和为零的原则,可知的个数为16,所以铝碳酸镁的化学式为Al2Mg6(OH)16 CO3 4H2O, x:y:z=2:6:16。
④写出铝碳酸镁治疗胃酸过多的化学方程式为Al2Mg6(OH)16CO3·4H2O +18HCl=2AlCl3+6MgCl2+21H2O+CO2↑。
